锂离子电池正极材料磷酸钒锂制备方法研究进展
2022-03-11张鑫意狄玉丽陈星宇张正冬
张鑫意,狄玉丽,2,董 琦,陈星宇,张正冬
(1.成都理工大学材料与化学化工学院,四川成都 610059;2.西昌学院理学院)
可充电锂离子电池(LIB)在移动电子、(混合)电动汽车和大规模电网储能等应用中发挥着重要作用。为满足这些应用,LIB应具有高能量、高功率密度以及优良的安全性能[1]。电能以化学能的形式存在于可充电电极上,电极材料的成本、安全性、储能量以及电池的寿命和电池的功率输出是影响电池商业应用的重要因素[2]。所以,为满足各行业对锂离子电池的性能要求,先进电极材料的寻找和制造是一项重要且紧迫的任务[3]。在当前所研究的正极材料中,金属磷酸盐已被广泛认可为新一代材料,可以提供安全的动力和能源以满足这些快速增长的行业应用,所以过渡金属磷酸盐作为可充电锂离子电池正极材料有着极大的研究前景。其中,LiFePO4被认为是电动汽车动力电池应用较为广泛的正极材料,其优点包括较高的比容量(170 mA·h/g)、较低的成本、环境兼容性和安全性能高等,但是由于其自身结构的不足导致离子和电子导电率较低[4-5]。在这一方面,单斜Li3V2(PO4)3(LVP)因具有较高的工作电压(3.0~4.8 V)、良好的离子迁移率和优良的热稳定性,是一种具有竞争优势和发展前景的大功率锂离子电池正极材料,成为近年来研究的热点[6-7]。但是,LVP的电子导电性和锂离子扩散系数较低,成为了磷酸钒锂材料实际应用的主要障碍[8-9]。笔者简要介绍了LVP的结构特征和充放电原理,主要概述了LVP正极材料的制备方法,并对不同合成方法及材料性能进行了简单的比较分析。
1 锂离子电池工作原理及LVP结构特征
锂离子电池通常由正极、负极、隔膜和电解质等组成。图1为锂离子电池工作原理示意图。充电时正极部分的Li+脱出,离开含锂化合物通过隔膜向负极移动,并嵌入到负极的层状结构中,同时为保证电荷守恒电子通过外部电路由正极传输到负极;反之,放电时Li+从负极脱出,经过电解质和隔膜回到正极,电子从外电路返回正极。锂离子的嵌入/脱出带动电荷分布的变化,导致外部电路电子的传输,从而产生电流[10]。

图1 锂离子电池充放电原理示意图[10]Fig.1 Schematic diagramof charging and discharging principle of lithiumion battery[10]
聚阴离子型锂离子电池正极材料与其他锂离子电池正极材料相比具有不同的晶体结构,正是由于这种不同的结构特征使其对正极材料的电化学性能有着极大的影响。橄榄石结构和NASICON结构的聚阴离子型化合物在锂离子电池正极材料中研究较多[11-12]。Li3V2(PO4)3具有单斜和菱方两种晶体结构,菱方结构的Li3V2(PO4)3热力学不稳定导致其合成困难,而单斜晶相比菱方晶相具有高容量和易于合成的优点,因此单斜结构的Li3V2(PO4)3正极材料成为研究的热点[13]。单斜晶相的Li3V2(PO4)3空间群为P21/n,晶格参数分别为a=0.859 8 nm、b=0.859 3 nm、c=0.120 32 nm、α=90.0°、β=90.496°、γ=90.0°[14]。Li3V2(PO4)3晶体结构见图2。单斜晶相的Li3V2(PO4)3由八面体结构的VO6和四面体结构的PO4共用氧原子顶点而形成三维框架,每个VO6八面体通过顶点与6个PO4四面体连接,每个PO4四面体通过顶点与4个VO6八面体连接,形成一个三维网状的V2(PO4)5单元结构。其具有特殊的三维离子通道,为锂离子提供了更大的扩散通道[15-16]。
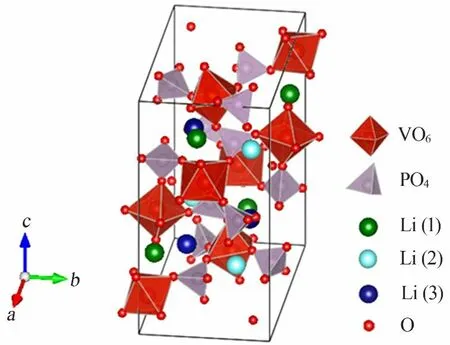
图2 磷酸钒锂晶体结构示意图Fig.2 Schematic diagramof crystal structure of lithiumvanadiumphosphate
单斜结构的Li3V2(PO4)3在3.0~4.3 V出现了3对明确的电压平台,分别出现在3.596/3.571、3.679/3.652、4.050/4.082 V,对应LixV2(PO4)3的一系列相变过程。3个可逆的相变方程:

此时对应2个Li+的嵌脱过程,理论比容量可达133 mA·h/g;当充电电压提高至4.8 V时能够脱出第3个Li+,理论比容量可达197 mA·h/g[17-18]。
2 LVP制备方法
Li3V2(PO4)3的合成一直以来都是一个很有研究意义的课题,不同的制备方法通常导致最终产品在结构、形貌、粒度分布、比表面积、结晶度等方面存在差异,这些差异对其电化学性能有着显著的影响。所以,选择一种简易安全的制备方法对于制备高性能锂离子电池正极材料具有重要意义[19]。Li3V2(PO4)3常见的合成方法有碳热还原法、水热法、溶胶-凝胶法和流变相法等。
2.1 碳热还原法
碳热还原法属于高温固相反应法[20-22]。高温固相法是先使反应物混合均匀生成一种前体物或非晶态产物然后再进行高温焙烧使反应完全并使产物晶化的方法。对于固相反应,参加反应各组分的原子和离子受到晶体内聚力的限制,不能像在液相或气相反应中那样自由地迁移运动,粉体细度和均匀程度对固相反应的进行非常重要。碳热还原法是在一定温度下以碳或碳的有机物作为碳源与还原剂进行的氧化还原反应方法[20,23-24]。图3为将丙烯酸树脂(PAA)和葡萄糖一起作为碳源与还原剂采用球磨法和碳热还原法合成LVP/C的流程示意图。

图3 核壳结构LVP/C的合成示意图[25]Fig.3 Schematic diagramof synthesisof core-shell structure LVP/C[25]
姜霖琳等[23]研究了碳热还原法合成磷酸钒锂及过量的碳加入对材料性能的影响,对所制备的材料进行了X射线衍射(XRD)、循环伏安和恒电流充放电测试。结果表明,所得样品的XRD峰型尖锐,表明晶体的结晶性好;循环伏安曲线对称性好,表明可逆性良好;过量碳的加入提高了材料的充放电比容量,循环性能有所改善。SAÏDI等[26]采用碳热还原法以NH4H2PO4、V2O5和Li2CO3按化学计量比混合成功制备出具有良好稳定性的磷酸钒锂材料。通过对比LiCoO2与LVP的放电特性得知,在23℃时磷酸钒锂的能量密度比钴酸锂高10%左右。为测试材料对环境(电解质)的反应性,他们还进行了差示扫描量热分析(DSC)。结果表明,在220~250℃时Li0.5NiO2、Li0.5CoO2、λ-MnO2的热流率分别为890、570、340 J/g,与LiCoO2等正极材料相比磷酸钒锂具有良好的稳定性。LIU等[27]采用改进的碳热还原法结合球磨技术合成了5LiFePO4·Li3V2(PO4)3复合材料。通过测试电化学性能发现,该材料在2C和5C倍率下初始放电比容量分别为145.2 mA·h/g和133.9 mA·h/g,并且循环50次后容量衰减很小,与LiFePO4/C相比其倍率性能和循环稳定性有较大提高。HUANG等[28]利用球磨碳热法制备出具有球形结构的LVP/C复合材料。该材料具有较好的电化学性能(见图4),在3.0~4.3 V时0.2C和20C倍率放电比容量分别为130、100 mA·h/g,表明此实验方法制备的LVP/C材料具有良好的倍率性能。LVP/C样品的扫描电镜(SEM)与透射电镜(TEM)照片见图5。由图5a看出,实验获得的样品颗粒直径在几微米至几十微米之间,形貌为球形。从图5b看出,Li3V2(PO4)3粒子为纳米级,并且包裹了一层碳层,碳层近似厚度为4~5 nm。
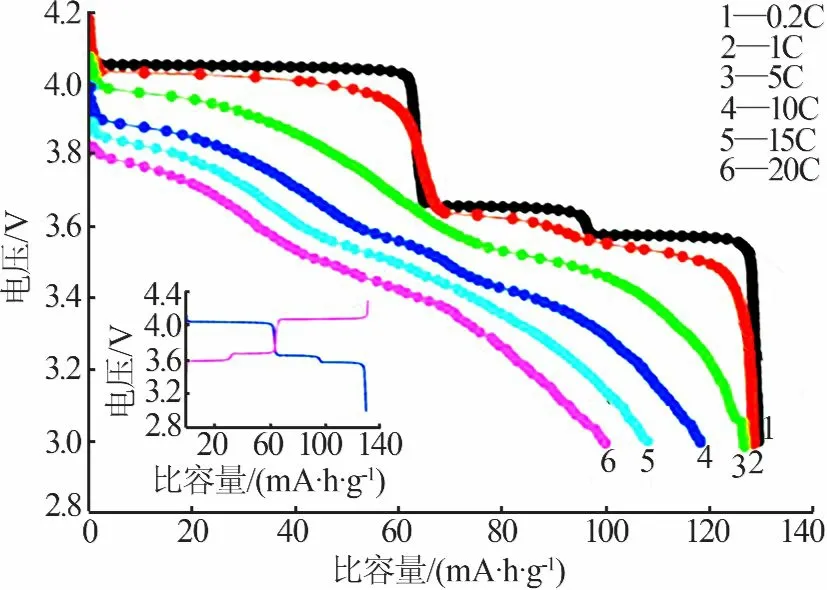
图4 LVP/C在不同倍率下的初始放电曲线[28]Fig.4 Initial dischargecurvesof the LVP/Cat different rates[28]

图5 LVP/C的SEM(a)与TEM(b)照片[28]Fig.5 SEM(a)and TEM(b)imagesof the LVP/C[28]
碳热还原法存在反应时间较长、反应温度较高、原料混合不均匀等缺陷。但是碳热还原法能够有效地降低材料粒径,提高材料的电化学性能并具有良好的稳定性,因此该制备方法比较适合工业化。
2.2 水热法
水热法属于液相化学法,是指在密封的压力容器中用水作为溶剂在高温高压下进行的化学反应。DUAN等[29]为控制纳米颗粒的尺寸、形貌和均匀性,采用水热法辅助溶胶-凝胶法制备了LVP/C。图6为LVP/C的制备过程示意图。其采用抗坏血酸和聚乙二醇400作为碳源和还原剂,利用水热处理工艺形成部分碳化层,限制了煅烧过程中LVP粒径的增加。

图6 水热法辅助溶胶-凝胶法制备纳米LVP/C复合材料示意图[29]Fig.6 Schematic diagramof hydrothermal-assisted sol-gel approach for preparing nanosized LVP/Ccomposites[29]
CHANG等[30]以LiOH·H2O、NH4VO3、NH4H2PO4和葡萄糖为原料分别使用水热法和传统固相法制成磷酸钒锂,采用XRD、热重分析(TG)、SEM和恒流充放电循环等方法对材料的结构、形貌和电化学性能进行了研究。结果表明,两种方法制备的样品XRD峰均为单相,具有单斜结构,没有检测到杂质相;与传统固相法合成LVP相比[31],水热法极大地缩短了制备时间,而且制备的材料具有更好的放电容量,并且在高倍率下具有稳定的循环性能。TENG等[32]采用水热法制备了一种由纳米板组成的片状碳包覆LVP/C粉末。图7为水热法制备LVP/C的SEM照片。由图7看出,中间产物具有片状形貌,煅烧后颗粒仍保持板状形态,但变得更厚。对材料的电化学性能进行了表征,该材料在3.0~4.3V和3.0~4.8V以6C倍率进行充放电,其比容量分别为113.8、128.8 mA·h/g;以1C倍率循环20次样品的容量保持率分别为91.4%、85.0%。测试结果表明,该材料在室温下表现出良好的倍率性能。LIU等[33]采用水热法成功制备出Li3V2(PO4)3纳米棒,测试了纳米棒LVP材料在3.0~4.6 V不同倍率下的循环性能,结果见图8。从图8看出,在0.5C、1C、2C、5C、10C时初始放电比容量分别为141.6、136.1、134.6、124.8、101.1 mA·h/g。经过多次循环过程,该材料与传统方法制备的材料相比在不同倍率下的放电比容量保持良好[31,34]。

图7 水热法制备LVP/C的SEM照片[32]Fig.7 SEMimagesof LVP/Cprepared byhydrothermalmethod[32]
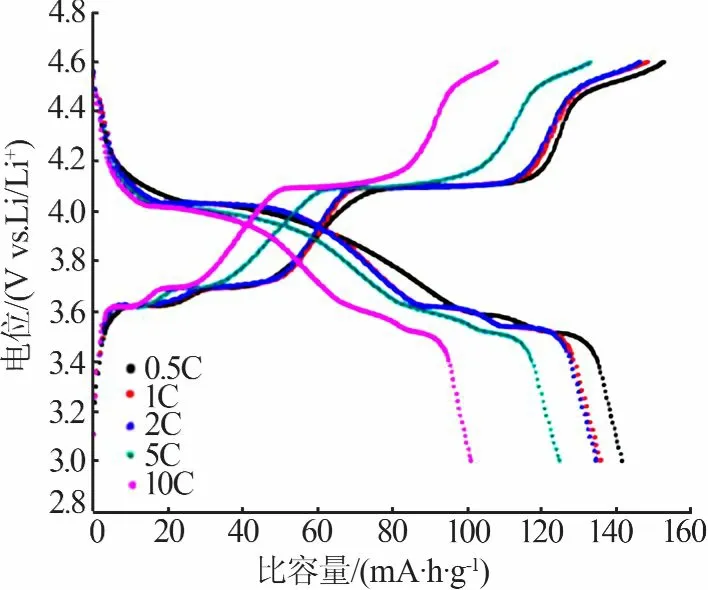
图8 LVP/C在不同倍率下的充放电曲线[33]Fig.8 Initial chargeand discharge curves of the LVP/Cat different rates[33]
水热法可以制备出晶粒细小的材料,而且制备方法较为简易,制备过程所需时间较短。但是利用水热法制备材料对仪器的要求较高,这也是影响水热法走向工业化的主要因素。
2.3 溶胶-凝胶法
溶胶-凝胶法[35-36]是用含高化学活性组分的化合物作前驱体,在液相下将这些原料均匀混合并进行水解、缩合反应在溶液中形成稳定的透明溶胶体系,溶胶经陈化胶粒间缓慢聚合形成三维网络结构的凝胶,凝胶网络间充满了失去流动性的溶剂形成凝胶,凝胶经过干燥、烧结固化制备出材料。图9为溶胶-凝胶法制备LVP/C的形成机理图。将一定量草酸溶于去离子水中,再加入V2O5,通过磁力搅拌溶液变为蓝色,再依次加入Li2CO3和NH4H2PO4并不断搅拌,最后经过干燥、煅烧得到LVP/C材料。

图9 LVP/C形成机理示意图[37]Fig.9 Schematic diagramof the formation mechanismfor the LVP/C[37]
LI等[38]利用溶胶-凝胶法制备出高性能的LVP正极材料。按化学计量比将混合物NH4H2PO4、Li2CO3和过量的高比表面积的碳添加到V2O5·nH2O水凝胶中,在室温下强烈搅拌,再放入80℃烘箱中干燥,最后在管式炉中于300℃煅烧4 h,再升温至750℃并保温4 h。与传统的固态反应相比,溶胶-凝胶之后的热处理是在比较低的温度下进行并在较短的时间内完成。ZHANG等[39]用溶胶-凝胶法与固相法两种方法制备了Li3V2(PO4)3材料,材料的SEM照片见图10。从图10看出,固相法制备的LVP材料粒径较大且不均匀,溶胶-胶法制备的LVP材料颗粒均匀性良好、粒径较小。RUI等[40]以草酸为螯合剂、麦芽糖为碳源采用溶胶-凝胶法制备了碳包覆LVP/C正极材料,通过测试材料的电化学性能表明该材料具有优良的倍率性能,倍率性能是高功率应用所需的锂离子电池的重要电化学特性之一。图11为不同碳含量的LVP/C材料在3.0~4.3V的倍率性能。从图11看出,碳质量分数为11.6%的样品具有最佳的倍率性能,在0.5C倍率时其放电比容量为125 mA·h/g,在5C倍率时其放电比容量为116 mA·h/g,在10C倍率时仍可获得82 mA·h/g的比容量。

图10 Li3V2(PO4)3材料SEM照片[39]Fig.10 SEMimages of Li3V2(PO4)3 materials[39]
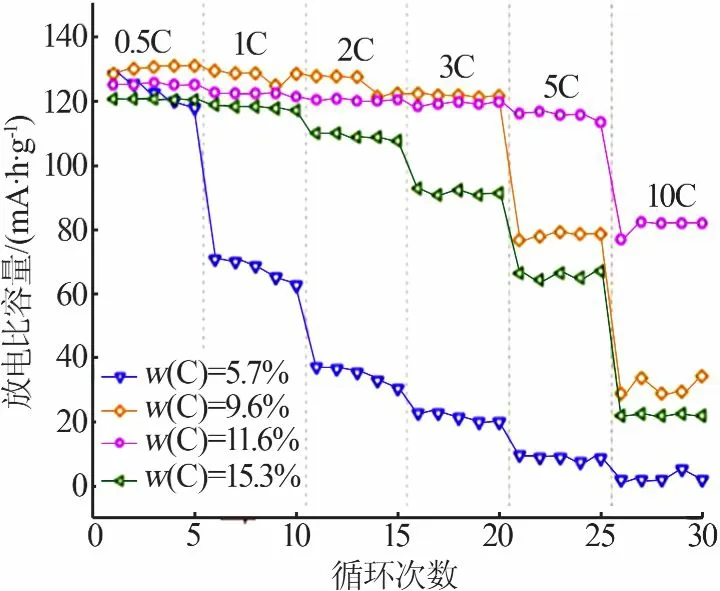
图11 不同碳含量的LVP/C样品在3.0~4.3 V的倍率性能[40]Fig.11 Rate performanceof LVP/Csamples with various carbon contentsin 3.0~4.3 V[40]
利用溶胶-凝胶法制备的正极材料能够有效地减小晶粒尺寸并且能够让碳分散得更加均匀,意味着采用该制备方法能够提高材料的电化学性能,使材料拥有良好的倍率性能和循环性能。但是此制备方法过程较为复杂,影响因素较多且不易控制,不适用于工业化生产。
2.4 流变相法
流变相法是指在较低的温度下将混合物处于流变状态下,从而增强固体粒子间的有效接触,是一种新型的软化学合成方法[41-43]。图12为流变相法制备Li4Ti5O12工艺流程示意图。先将LiOH·H2O浸入TiO2的颗粒间隙涂覆在颗粒表面,在热处理条件下LiOH·H2O逐渐失去结晶水成为LiOH,随着煅烧温度的升高,LiOH和TiO2发生反应失去羟基转化为Li4Ti5O12。

图12 流变相法制备Li4Ti5O12工艺流程示意图[42]Fig.12 Processflow diagramof Li4Ti5O12 prepared by rheological phase method[42]
CHANG等[44]以Li2CO3、V2O5、NH4H2PO4和高比表面积的碳为原料,利用流变相法成功制备出LVP正极材料,用XRD、SEM和电化学测试等方法对材料进行了表征。结果表明,该材料具有良好的电化学性能、较高的可逆容量和较稳定的循环性能,在循环过程中结构保持良好。图13为LVP/C的SEM照片,可观察到通过流变相法制备的LVP/C为块状,LVP颗粒表面被纳米级碳颗粒包覆,LVP粒子可以通过这些纳米级碳层很好地连接,大大提高了材料的电子导电性和电化学性能。该材料在3.0~4.8V以0.1C和0.2C倍率充放电表现出189 mA·h/g和177 mA·h/g的高初始放电比容量;测试了不同电流密度下LVP材料在3.0~4.8V的循环性能,循环100次后在0.5C、1C、2C、5C倍率下放电比容量分别为140、133、129、124 mA·h/g,具有良好的容量保持率。李丽等[45]以LiOH·H2O、NH4VO3、NH4H2PO4和柠檬酸为原始材料采用流变相法制备出LVP/C复合材料,对材料的电化学性能进行了表征。结果表明,样品在3.0~4.2 V以0.1C和1C倍率首次充放电比容量分别为122.8 mA·h/g和107 mA·h/g,循环性能良好。CAO等[46]以LiOH·H2O、V2O5、NH4H2PO4为原料,通过流变相法成功制备了LVP/C复合材料,对材料的电化学性能进行了表征。图14为LVP/C-3(800℃,10 h)在不同电流密度下的循环稳定性。结果表明,在800℃条件下LVP/C复合材料在15 mA/g电流下初始放电比容量高达132.422 mA·h/g,循环60次仍保持129.149 mA·h/g的比容量;甚至在90 mA/g电流下循环60次,其比容量还能达到112.101mA·h/g。

图13 LVP/C的SEM照片[44]Fig.13 SEMimagesof LVP/C[44]

图14 LVP/C-3(800℃,10 h)在不同电流密度下的循环稳定性[46]Fig.14 Cycling stability of as-synthesized LVP/C-3(800℃,10 h)at different current rates[46]
流变相法是一种新颖、简单、有效的由固液混合物制备化合物或材料的方法。与传统的固态处理技术相比,此制备方法较为简单和经济,没有太多麻烦的过程,如洗涤、搅拌和重复热处理等。而且该方法的关键是固体颗粒与液体物质均匀分散为液固流变体,由于固体颗粒与流体紧密而均匀地接触,可以有效地利用固体颗粒的表面积。但是此制备方法的反应温度过高,安全性较低。
3 结果与展望
单斜结构的LVP正极材料具有良好的离子迁移率、高的工作电压、高的理论容量和良好的热稳定性,是锂离子电池的理想正极材料,但是也存在Li+扩散速率低、高低温循环性能差、电子导电率低等缺陷。磷酸钒锂的制备方法比较多,不同的方法需要不同的制备条件,使得最终产品在结构形貌上存在着差异,也对材料的电化学性能有着重要的影响。在制备磷酸钒锂正极材料的方法中,碳热还原法虽然反应时间较长、所需温度较高,但是该制备方法较为简单,比较适合工业化生产;水热法虽然合成的材料颗粒较为均匀、粒径较小,具有优良的电化学性能,但是该方法较为繁杂、对实验仪器要求较高,不适合工业化生产;溶胶-凝胶法常用于实验室制备磷酸钒锂正极材料,条件较为严苛,材料合成过程容易被外界因素所影响,进而会使材料的形貌与电化学性能受到不好的影响,因此该方法不适合工业化生产。流变相法与传统的固态相法相比更为经济,且固体颗粒与液体物质均匀分散为液固流变体,由于固体颗粒与流体紧密而均匀地接触,可以有效地利用固体颗粒的表面积提高材料的电化学性能,但是此制备方法的反应温度过高,安全性较低。为进一步推动磷酸钒锂的商业化发展,需要优化材料的制备方法以改善材料的颗粒形貌、提高电子导电率和扩散系数等,进而改善材料的循环性能、倍率性能和充放电性能等;需要改进制备流程、提高实验的安全性、简化反应流程和减少制备成本等,以实现磷酸钒锂正极材料的工业化应用。
