‘章姬’草莓茎尖脱毒及快繁技术研究
2022-03-11陈甘牛陆兆军孙晓慧王世伟乔艳辉柴传平
陈甘牛,苗 杰,陆兆军,赵 莹,孙晓慧,宋 黎,王世伟,乔艳辉,柴传平
(1.烟台市森林资源监测保护服务中心,山东烟台264000;2.沂南县国有林场总场,山东沂南276300;3.山东省林业科学研究院,山东济南250014)
草莓(Fragaria×ananassa Duch.)是蔷薇科草莓属植物,植物学分类为多年生草本植物,果树学分类为小浆果植物,是世界七大水果之一,素有“水果皇后”的美称。‘章姬’草莓是日本静冈县农民育种家章弘先生于1992年选育的品种,为日本主栽品种之一,其特点是果实大,长圆形,味浓甜,畸形少,可溶性固形物含量9%~14%,丰产,休眠期浅,适宜鲜食和加工。1996年辽宁东港市草莓研究所引入试栽成功,2000年后在胶东地区大面积推广栽培。
草莓适应性强,在全球分布广泛。美、日、韩等发达国家早已根据本国市场需求建立了自己的草莓脱毒快繁体系,广泛应用于生产实践中,草莓产量和质量有了较大提高。我国草莓种苗生产方式一直沿用传统的无性繁殖方式,品质退化严重,大面积感染病毒。目前国内感染病毒种类主要有4 种:斑驳病毒、皱缩病毒、轻型黄边病毒和镶脉病毒,这些病毒大部分为潜隐性病毒,含有病毒的草莓早期无明显表现特征,不进行专业性的检测无法分辨其是否存在病毒[1-2]。感染的病毒易造成复合感染,导致果实品质及产量下降,严重时可致草莓减产75%,田间无特效药和有效防治手段[3]。已有的研究报道,许多学者认为茎尖培养与热处理结合脱毒是草莓较好的脱毒方法,但脱毒效果与热处理方式、茎尖的大小和草莓的品种密切相关[4]。本研究采用生长健壮的‘章姬’草莓为材料,通过热处理脱毒后剥离茎尖,利用正交试验设计方法,建立茎尖脱毒及快繁技术体系,为实现草莓脱毒苗的产业化发展提供技术支撑。
1 材料和方法
1.1 材料
试验材料‘章姬’草莓由烟台绿食农林科技草莓研究所苗圃提供。2019年3月初选取生长健壮、匍匐茎充实、无病虫斑、具典型‘章姬’性状的优良单株为试验材料。
1.2 方法
1.2.1 外植体灭菌和无菌苗的建立
以草莓匍匐茎的茎尖端2~3 cm 为外植体材料,去除形态学末端。3%洗洁精溶液浸泡15 min,期间用毛刷轻微搅动,流水冲洗1~2 h,无菌水冲洗1~2 次,移入超净工作台。用75%酒精处理时间分别为30 s、60 s和90 s,用无菌水冲洗2~3 次后,再用2%次氯酸钠处理时间分别为4 min、8 min 和12min,再用无菌水冲洗4~5 次后无菌吸水纸吸干表面水分,切取长度为0.8~1.0 cm 顶芽茎段接种到MS 培养基中。每个处理20 瓶,每瓶接种3 个茎段,3 个重复。培养7 d 后,剔除霉菌细菌污染苗,统计污染率,建立草莓无菌苗体系。
1.2.2 高温处理
将草莓无菌苗置于工智能气候箱中,参考聂园军[5]的做法,采用逐步升温的方式(每小时升温1℃)对无菌苗进行高温处理培养,起始温度25 ℃,终止温度38 ℃,分别处理28 d、38 d、48 d。人工气候箱光照时间14 h,光照强度3000~5000 lx,相对湿度70%。每个处理20 瓶,每瓶接种2 棵无菌苗,3 个重复。28~48 d 后统计存活率。
1.2.3 病毒检测
脱毒效果检验参考顾地周[6]电子显微镜检测法,利用负染色法,对脱毒处理的叶片进行染色,再将染色的叶片制成60 nm 的超薄叶片,每棵成活苗取3 个叶片,在电子显微镜下观察叶片中的病毒颗粒,如果没有则证明已脱毒。
1.2.4 愈伤组织诱导
试验按照正交设计L9(34),采用3 因素3 水平设计,共9 个组合。分别是培养基(MS、1/2MS 和white)、6-BA(0.5 mg·L-1、1 mg·L-1、1.5 mg·L-1)和IBA(0.25 mg·L-1、0.5 mg·L-1、0.75mg·L-1),将剥离高温处理后成活苗的0.5~0.8 mm 茎尖接种,每个组合20 瓶,每瓶接种3 个茎尖。30d 后统计诱导率,并记录愈伤组织生长情况。
1.2.5 不定芽诱导
把质地致密、颜色淡黄的愈伤组织接种到含不同浓度的6-BA 和IBA 的MS 培养基上,每个处理接种20 瓶,每瓶3 块。定期观察愈伤组织的再分化状态,30 d 后统计不定芽诱导率。
1.2.6 生根培养
丛生芽高度2.5 cm 时,切成单株转至生根培养基。基础培养基选用1/2MS 培养基,NAA 浓度设0 mg·L-1、0.25 mg·L-1、0.5 mg·L-1、0.75 mg·L-14 个梯度,每个处理接种20 瓶,每瓶接种3 棵生根苗,28 d 后统计生根情况。
培养基中含蔗糖25 g·L-1、琼脂粉8 g·L-1、pH 为5.8~6.2。将组培材料置于光照强度2000 lx,光照时间14 h·d-1,培养温度(25±2) ℃的生化培养箱中培养[7]。
1.2.7 数据处理及分析
(1)污染率(%) = 污染外植体数/接种外植体总数×100%
(2)存活率(%) = 存活外植体数/接种外植总体数×100%
(3)脱毒率(%) = 脱除病毒的叶片数/检测叶片数×100%
(4)愈伤组织诱导率(%) = 愈伤组织的外植体数/接种外植体数×100%
(5)不定芽诱导率(%) = 愈伤组织出芽数/接种愈伤组织总数×100%
(6)生根率(%) = 生根苗数/接种苗数×100%
2 结果与分析
2.1 不同消毒处理对外植体染菌率的影响
外植体无菌苗体系的建立是直接影响组织培养成败的重要因素,单独使用一种消毒剂,污染率较高,效果差[8]。本试验采用75%酒精和2%次氯酸钠联合处理草莓外植体,消毒效果较好。
不同灭菌时间对外植体的影响由表1 看出,污染率随着灭菌处理时间的延长而降低,75%酒精处理无茎段死亡现象,2%次氯酸钠随处理时间的延长,对外植体的损伤越大,主要表现为褐化严重、植株枯萎,消毒时间为12 min 时,编号3 和6 均死亡1 株、编号9 死亡2 株。编号9 即75% 酒精处理90 s、2%次氯酸钠处理12 min,污染率最低0%,存活率93.33%,但是芽基部表面褐化,切口枯萎;编号8 即75%酒精处理90 s、2%次氯酸钠处理8 min,污染率最低0%,存活率最高100%,茎段生长正常,无褐化枯萎现象发生。综合分析试验结果表明‘章姬’草莓最佳的灭菌处理为75%酒精90 s、2%次氯酸钠8 min。
2.2 病毒检测
用电子显微镜检测法检验无菌苗存活率及脱毒率。由表2 可知,无菌苗在38℃恒温条件下培养10 d后,植株生长开始减慢,培养28 d 后,叶片开始变黄,植株部分枯死。培养38 d 后,无菌苗成活率大大降低,脱毒率大幅提升,植株几乎停止生长;培养48 d 后,成活率低至30.00%,脱毒率达最大值85.19%,存活的植株萎蔫,生长不良。因此在温度一定的条件下,存活率随培养时间的延长而降低,脱毒率则与培养时间成正比,培养时间越长,脱毒率越高。为取得更高的脱毒率,培养时间应越长越好,但是,成活率则相反,且植株长势差,不利于后期的愈伤组织诱导。综合存活率、脱毒率及植株生长情况的考虑,确定‘章姬’草莓38 ℃恒温条件下培养时间38 d 为宜。
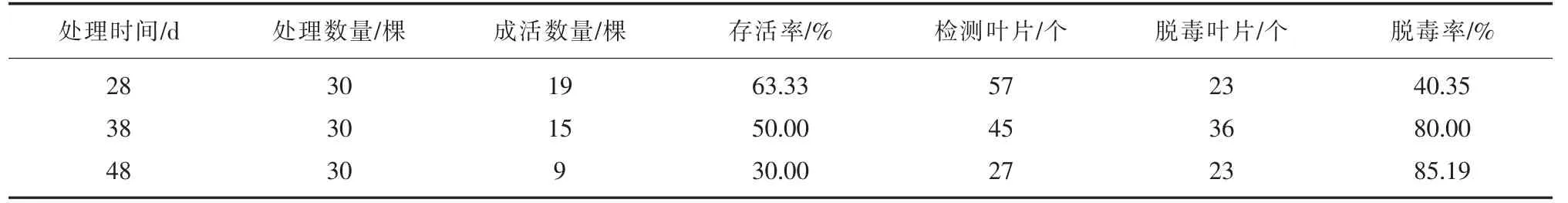
表2 38 ℃条件下不同处理时间对无菌苗存活率和脱毒率的影响
2.3 不同因素对愈伤组织诱导的影响
脱毒草莓茎尖接种到诱导培养基上7 d 左右,紧贴培养基茎尖切口处开始膨大,颜色变淡,14 d 后切口处膨大的愈伤组织颜色淡绿,30 d 后变为淡黄色、颗粒状愈伤组织,体积增大。不同植物生长调节剂组合对草莓茎尖愈伤组织的产生和生长状态影响不同。愈伤组织诱导率统计结果见表3。
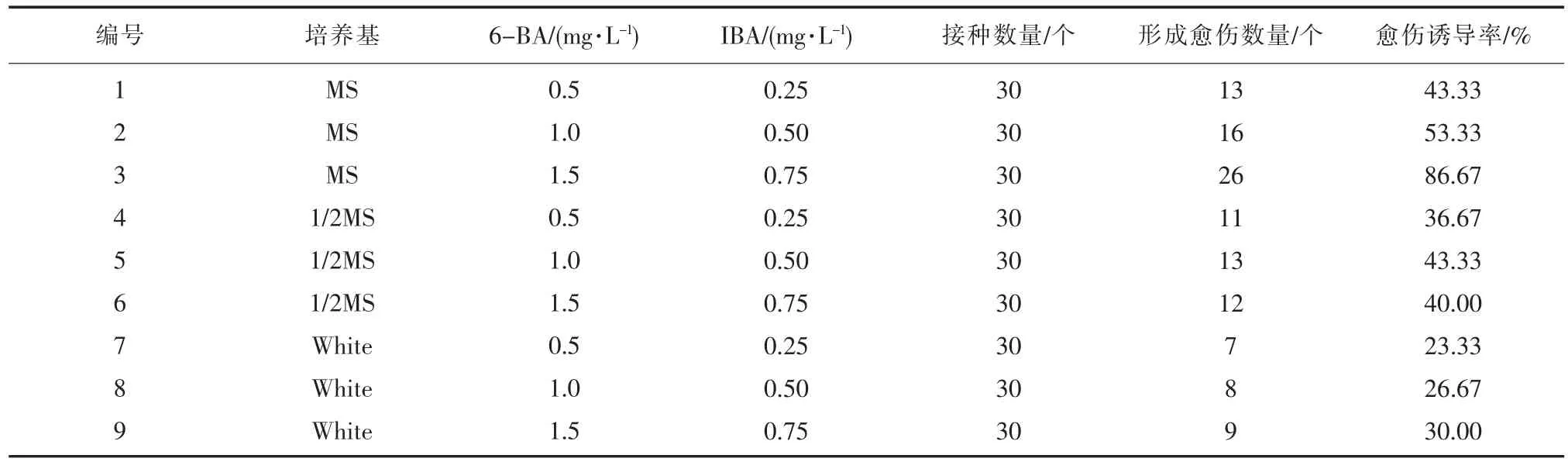
表3 不同因素对愈伤组织诱导的影响
激素浓度一定的情况下,MS、1/2MS、White 对愈伤组织的诱导率总体趋势为MS>1/2MS>White。在MS 培养基愈伤组织的诱导率随激素的增高而增大,其中,以编号3 诱导率最高,达86.67%。由此确定,‘章姬’草莓茎尖愈伤组织最佳诱导培养基为MS + 6BA1.5 mg·L-1+ IBA0.75 mg·L-1。
2.4 植物生长调节剂对不定芽诱导的影响
愈伤组织接种到不定芽诱导培养基上7 d,颜色由淡黄色转为黄绿色,体积增大。14 d 时,愈伤组织突起明显,出现绿色芽点。随着时间的延长芽点数量增多,逐渐分化为芽丛,28 d 左右形成丛生芽,苗高2~3 cm,叶片2~3 片。
由表4 可知,培养基中无添加植物生长调节物质时,愈伤组织未见再分化。附加0.25 mg·L-1NAA 时,不定芽诱导率较低,仅3.33%,添加1.50 mg·L-16-BA 时,不定芽诱导率43.33%;随着NAA 和6-BA 浓度的升高,不定芽诱导率都分别升高。
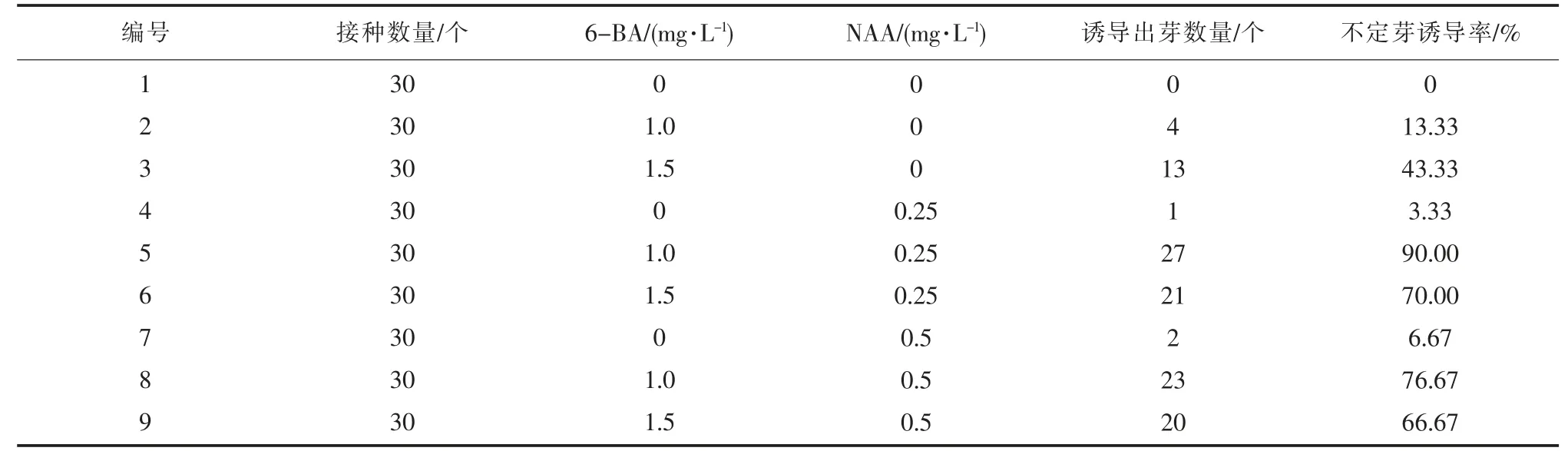
表4 不同植物生长调节物质对不定芽诱导率的影响
同时添加6-BA 与NAA,在NAA 浓度一定时,诱导率随6-BA 浓度的递增而呈抛物线状变化,6-BA 浓度在1.0 mg·L-1时分化率达到最高,由此可见细胞分裂素与生长素配比使用更有利于再分化[9]。综合试验结果可知,适宜‘章姬’草莓不定芽诱导的培养基为MS + 6-BA1.0 mg·L-1+ NAA0.25 mg·L-1,不定芽诱导率最高90.00%,产生大量丛生芽。
2.5 IBA 对草莓生根的影响
把丛生芽切成单株接种到含有不同浓度IBA 的生根培养基中,15d 后部分小苗基部开始膨大,20 d 开始出现白色不定根,35 d 根长2~3 cm,发根数条,小苗长势良好。
由表5 可知,在培养基中未添加IBA 时,小苗无生根现象,只看到茎段及叶片增大。当IBA 的浓度范围为0.25~0.75 mg·L-1时,生根率明显提高,IBA 浓度0.75 mg·L-1时,生根率最高93.33%;而IBA 浓度>1.0 mg·L-1时,生根率逐渐下降。由此得出‘章姬’草莓最佳生根培养基为1/2 MS + IBA 0.75 mg·L-1,主根明显,植株生长健壮。

表5 不同浓度IBA 对草莓植株生根的影响
3 结论和讨论
外植体消毒是快繁体系建立的重要环节,由于外植体来源于田间,不可避免的附有大量的病毒和细菌,因此,消毒剂的种类、浓度、消毒时间的选择尤为重要。本试验采用75%酒精消毒90 s,再用2%次氯酸钠处理8 min,结果表明二者联合比单独使用消毒效果好,污染率0%,存活率100%。
茎尖培养是最常见的草莓组培快繁方法。利用茎尖的快速分生能力不仅能在组培条件下获得大量的优质种苗,还可以结合脱毒技术生产脱毒种苗[10]。当前,草莓茎尖脱毒研究多集中在茎尖大小的选择、生长调节剂的种类和剂量、高温处理等方面。陈婕[11]采用热-化结合处理(热处理结合病毒醚处理)的方法获得生根能力更强的优质脱毒草莓苗。茎尖脱毒通常茎尖长度越小越好,但是实际操作中,茎尖越小,脱毒率增高的同时,死亡率也随之增加。笔者在长期的工作实践中,发现0.5~0.8 mm 的茎尖长度适合愈伤组织诱导,还方便操作,因此,本研究采用38 ℃高温处理后无毒的无菌苗,剥离0.5~0.8 mm 的茎尖进行培养,获得了生长健壮的优质脱毒‘章姬’草莓苗。
在愈伤组织诱导中,不同植物对各类营养成分的需求也有差异[12]。本试验选用了3 种(MS、1/2 MS 和white)基本培养基,附加不同浓度的6-BA 和IBA,采用正交试验,发现适宜草莓愈伤组织诱导的基本培养基为MS,可能是MS 培养基中钾盐、铵盐、硝酸盐等无机盐更适宜草莓茎尖诱导形成愈伤组织,其诱导率主要受到6-BA 浓度的影响,在一定范围内,诱导率随6-BA 浓度的升高而升高,诱导的愈伤组织在再分化过程中更容易分化成苗。最适愈伤组织诱导的培养基配比MS+6BA1.5 mg·L-1+IBA0.75 mg·L-1,诱导率86.67%。
植物所需生长调节物质的种类和浓度,在不同培养阶段是不同的,二者以适宜浓度配比使用,有利于形成完整植株,浓度过高或过低,会影响再生植株发生及长势[13]。本研究发现,草莓愈伤组织再分化过程中细胞分裂素和生长素联合使用更利于愈伤组织再分化,较高浓度的6-BA 与适宜浓度IBA 也有助于草莓愈伤组织再分化,但IBA 浓度过高对再分化不利。因此最适宜不定芽诱导的培养基配比MS + 6-BA1.0 mg·L-1+NAA0.25 mg·L-1,不定芽诱导率达90%。本试验建立的‘章姬’草莓茎尖脱毒快繁体系对其他品种草莓的脱毒和工厂化育苗具有一定的参考意义。
