化脓隐秘杆菌肝素结合蛋白的提取及铁结合蛋白的黏附特性分析
2022-03-08沈克飞许国洋付利芝张素辉
沈克飞,许国洋,付利芝,杨 柳,牟 豪,张素辉*
(1. 重庆市畜牧科学院, 重庆 402460; 2. 重庆市兽用生物制品工程技术研究中心,重庆 402460)
化脓隐秘杆菌(Trueperellapyogenes)是家养和野生动物化脓性感染的常见病原菌,感染造成组织器官脓肿、化脓性炎症、纤维化、坏死及流产、死胎等[1]。近年来,化脓隐秘杆菌相关疾病在猪、牛、羊等动物上的发病率逐渐增加,给养殖业带来较大经济损失[2-8]。化脓隐秘杆菌是一种革兰阳性菌,常见于动物上呼吸道、胃肠道和泌尿生殖道黏膜,是动物和人的条件性致病菌[1, 9]。
病原体与宿主硫酸乙酰肝素蛋白多糖(heparan sulfate proteoglycans, HSPGs)的相互作用能增进微生物黏附和侵入宿主细胞,进而促进发病[10-12]。HSPGs是广泛分布于宿主细胞表面和细胞外基质的一类黏多糖,由与核心蛋白连接的硫酸乙酰氨基葡聚糖(glycosaminoglycans, GAGs)组成。GAGs是一种阴离子线性多糖,由重复的二糖组成,包括肝素、硫酸乙酰肝素等。研究发现,肝素可剂量依赖性地抑制化脓隐秘杆菌黏附HeLa细胞[13],提示化脓隐秘杆菌能利用自身的肝素结合蛋白黏附宿主细胞。最近,利用肝素琼脂糖凝胶从化脓隐秘杆菌菌体蛋白中提取到包含铁结合蛋白(iron-binding protein, IBP)在内的多种ATP结合盒(ATP binding cassette, ABC)转运体的底物结合蛋白(substrate binding proteins, SBPs)。IBP是化脓隐秘杆菌的1种抗原[14],在化脓隐秘杆菌自然感染的山羊血清中能检测到针对IBP的抗体,提示其在感染中会表达。目前尚无关于IBP参与化脓隐秘杆菌黏附宿主细胞的研究报道。因此,本研究在IBP黏附肝素、宿主细胞及IBP抗血清抑制黏附方面进行了分析,为化脓隐秘杆菌与宿主细胞的相互作用提供了新认识。
1 材料与方法
1.1 材料
1.1.1 细胞、菌株、抗血清 MDBK细胞、山羊源化脓隐秘杆菌、含pGEX-4T-1-IBP重组质粒的BL21(DE3)重组菌株及小鼠抗rIBP血清[14]、GST及其小鼠抗血清、自然感染化脓隐秘杆菌山羊血清[15]由重庆畜牧科学院兽医研究所保存和提供。
1.1.2 主要试剂 新生胎牛血清、Roswell Park Memoria Institute-1640(RPMI-1640)培养基、胰蛋白酶均购自Hyclone公司;小鼠抗GST单克隆抗体、碱性磷酸酶标记的驴抗山羊IgG抗体或山羊抗小鼠IgG抗体购自EarthOx公司;Gluthathione-Sepharose 4B购自Pharmacia公司;肝素、还原性谷胱甘肽购自Sigma-Alorich公司;BCTP/NBT购自上海生工;肝素琼脂糖珠购自索莱宝公司;Quick Start Bradford购自BioRad公司。
1.2 肝素结合蛋白的提取与质谱鉴定
化脓隐秘杆菌单菌落接种于含8%小牛血清的TSB培养基,37 ℃振摇培养48 h。7 000 ×g离心10 min,菌体沉淀用 Tris-HCl (0.02 mol·L-1,pH8.0)悬浮,洗3次。每300 mL培养物所得菌体沉淀用20 mL Tris-HCl 悬浮,加入蛋白酶抑制剂。冰水浴中超声裂解菌悬液(超声功率为300 W,工作4 s间歇5 s,超声裂解15 min)。12 000 ×g离心30 min,上清用0.22 μm滤膜过滤,即为菌体蛋白。吸取200 μL充分混悬的肝素琼脂糖凝胶,用Tris-HCl 洗3次,加入1.2 mL菌体蛋白,4 ℃下摇动孵育2 h,用含0.15 mol·L-1NaCl的Tris-HCl 洗3次, 用含0.5 mol·L-1NaCl的Tris-HCl洗脱。采用SDS-PAGE检测提取的蛋白质。采用LC-MS/MS方法对肝素琼脂糖凝胶提取的样品进行质谱鉴定。
1.3 重组蛋白的制备
质谱鉴定结果显示所提取的蛋白中存在IBP,按参考文献[14]所描述的方法制备重组蛋白rIBP。简单步骤如下:37 ℃下振摇培养至菌体浓度达OD600 nm约为1时,加入终浓度0.1 mmol·L-1IPTG,37 ℃下诱导表达3 h。培养物4 ℃5 000 ×g离心30 min,每100 mL培养液加20 mL PBS以悬浮菌体沉淀,冰水浴中超声裂解菌悬液(超声功率为300 W,工作4 s间歇5 s,超声裂解15 min)。裂解物12 000 ×g离心10 min,向裂解物中加入终浓度1% Trition X-100,4 ℃振摇孵育30 min,5 000 ×g离心30 min,收集上清。每20 mL上清加入300 μL Gluthathione-Sepharose 4B,4 ℃搅动孵育1 h。PBS洗涤3次后用10 mmol·L-1还原性谷胱甘肽洗脱。采用SDS-PAGE分析纯化效果,采用透析法去除其中的还原性谷胱甘肽,使用Bradford法定量蛋白质浓度。
1.4 免疫印迹检测IBP
纯化的rIBP经SDS-PAGE后转印至硝酸纤维素膜上,采用5%脱脂奶粉封闭2 h,TBST洗3次后与自然感染化脓隐秘杆菌山羊血清或rIBP免疫小鼠血清(1∶1 00稀释)孵育,TBST洗3次后与碱性磷酸酶标记的驴抗山羊IgG抗体或山羊抗小鼠IgG抗体(1∶2 000稀释)孵育,最后置于BCTP/NBT显色,以检测血清中存在抗IBP抗体。
将化脓隐秘杆菌菌体蛋白及肝素琼脂糖凝胶提取的菌体蛋白经SDS-PAGE后转印至硝酸纤维素膜上,采用5%脱脂奶粉封闭2 h,TBST洗3次后与自然感染化脓隐秘杆菌山羊血清或小鼠抗rIBP血清(1∶100稀释)孵育,TBST洗3次后与碱性磷酸酶标记的驴抗山羊IgG抗体或山羊抗小鼠IgG抗体(1∶2 000稀释)孵育,最后置于BCTP/NBT显色,以验证化脓隐秘杆菌菌体蛋白及肝素琼脂糖凝胶提取的蛋白中存在IBP。
1.5 rIBP肝素结合与结合抑制分析
充分混匀肝素琼脂糖凝胶,吸取悬浮液30 μL加入离心管中,用预冷的100 μL PBS洗涤3次。向洗好的肝素琼脂糖凝胶加入30 μL 0.3 mg·mL-1rIBP,颠倒混匀,4 ℃下缓慢摇动孵育1 h。4 ℃下3 000 ×g离心5 min,肝素琼脂糖凝胶沉淀用200 μL 预冷NaCl溶液洗3次,NaCl浓度依次为0.025、0.05、0.1、0.2、0.3、0.4、0.5 mol·L-1。向凝胶加入40 μL SDS-PAGE上样缓冲液,沸水浴10 min,采用SDS-PAGE分析rIBP与肝素的结合情况。
用PBS溶液溶解肝素配制肝素溶液。按表1加入各组分,按肝素浓度分为4个处理组、肝素浓度依次为0、10、30、90 mg·mL-1。混匀,4 ℃下缓慢摇动孵育1 h。4 ℃下3 000×g离心10 min,保留沉淀。按上述方法进行免疫印迹分析,一抗为小鼠抗GST单克隆抗体(1∶2 000稀释),二抗为碱性磷酸酶标记的山羊抗小鼠IgG抗体(1∶2 000稀释)。

表1 肝素结合抑制分析
rIBP和GST抗血清用PBS进行1∶10稀释。将肝素琼脂糖凝胶、rIBP(0.3 mg·mL-1)、稀释的rIBP或GST抗血清加入1.5 mL离心管中,各组分均为60 μL,混匀,4 ℃下缓慢摇动孵育1 h。4 ℃下3 000 ×g离心10 min,凝胶用0.1 mL 预冷0.9%NaCl洗3次。向凝胶加入40 μL SDS-PAGE上样缓冲液,沸水浴10 min,采用免疫印迹分析抗血清对rIBP结合肝素的抑制作用,一抗为小鼠抗GST单克隆抗体(1∶2 000稀释),二抗为碱性磷酸酶标记的山羊抗小鼠IgG抗体(1∶2 000稀释)。
1.6 rIBP细胞黏附分析
用胰酶(0.05%胰酶,0.02% EDTA)消化长满单层的MDBK细胞,用RPMI-1640洗3次,将细胞制备成1010个·mL-1备用。将蛋白质(GST、rIBP)的浓度调整为0.3 mg·mL-1。按表2加入各组分,按蛋白质浓度分为4个处理组,蛋白质浓度依次为0、0.015、0.045 和0.135 mg·mL-1。颠倒混匀各组分,4 ℃下缓慢摇动孵育1 h。4 ℃下800 r·min-1离心10 min, 沉淀用1 mL 预冷PBS洗3次。样本经SDS-PAGE后转印至硝酸纤维素膜上,用5%脱脂奶粉封闭2 h,TBST洗3次后与小鼠抗GST单克隆抗体(1∶2 000稀释)孵育,TBST洗3次后与碱性磷酸酶标记的山羊抗小鼠IgG(1∶2 000稀释)孵育,最后置于BCTP/NBT显色。

表2 rIBP细胞黏附分析
1.7 rIBP抗血清抑制细菌黏附细胞分析

2 结 果
2.1 肝素结合蛋白的提取与质谱鉴定
SDS-PAGE显示,利用肝素琼脂糖凝胶从化脓隐秘杆菌菌体蛋白中提取到蛋白,提取后蛋白质条带数量明显减少,部分条带得到明显富集(图1A、B)。蛋白质质谱鉴定得出,所提取的蛋白包含IBP等多种ABC转运体SBP(表3)。
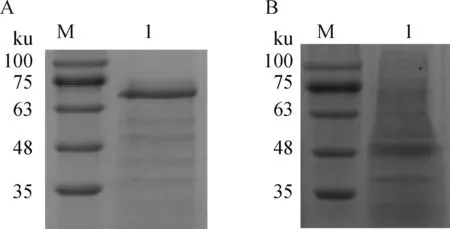
A.肝素琼脂糖凝胶提取的蛋白;B. 菌体蛋白;M. 蛋白质相对分子质量标准;1. 蛋白质样品A. Proteins extracted by heparin agarose gel; B. Bacterial proteins; M. Protein marker; 1. Protein sample图1 SDS-PAGE分析肝素琼脂糖凝胶提取的化脓隐秘杆菌蛋白质Fig.1 SDS-PAGE analysis of the proteins extracted from Trueperella pyogenes by heparin agarose gel
2.2 rIBP的制备
采用Gluthathione-Sepharose 4B从37 ℃下0.1 mmol·mL-1IPTG诱导表达3 h的重组菌株中纯化得到rIBP(图2)。

M.蛋白质相对分子质量标准;1. rIBPM.Protein marker; 1. rIBP图2 rIBP的纯化结果Fig.2 Purification of rIBP
2.3 免疫印迹检测IBP
采自自然感染化脓隐秘杆菌山羊血清或免疫rIBP后的小鼠血清,在免疫印迹中能识别rIBP(图3A),表明血清中含有抗rIBP抗体。自然感染山羊血清识别rIBP也表明在感染过程中化脓隐秘杆菌表达IBP。
免疫印迹显示,肝素琼脂糖凝胶提取的蛋白能被自然感染化脓隐秘杆菌的山羊血清识别出2条带(图3B),能被 rIBP小鼠抗血清识别1条带(图3C)。 rIBP小鼠抗血清所识别的条带和自然感染的山羊血清所识别的其中1条带的大小一致,表明化脓隐秘杆菌在含8%小牛血清的TSB培养基中37 ℃振摇培养有IBP表达,且IBP能用肝素琼脂糖凝胶从化脓隐秘杆菌培养物中提取。

A.抗血清与rIBP的反应性;B. 自然感染化脓隐秘杆菌山羊血清识别的化脓隐秘杆菌蛋白;C. 小鼠抗rIBP血清识别的化脓隐秘杆菌蛋白;M. 蛋白质相对分子质量标准;1. 自然感染化脓隐秘杆菌山羊血清;2.小鼠抗 rIBP血清;3. 肝素琼脂糖凝胶提取的蛋白;4.菌体蛋白A.The reaction between antiserum and rIBP; B. Proteins of T. pyogenes recognized by serum of goat infected naturally with T. pyogene; C. Proteins of T. pyogenes recognized by mice anti-rIBP serum; M. Protein marker; 1. Serum of goat naturally infected with T. pyogenes; 2. Anti-rIBP serum from mice; 3.Proteins extracted by heparin agarose gel; 4.Bacterial proteins图3 抗血清识别的化脓隐秘杆菌蛋白(免疫印迹)Fig.3 Proteins of T. pyogenes recognized by the antiserum (immunoblotting)
2.4 肝素结合与结合抑制分析
SDS-PAGE显示,随着洗液中NaCl浓度从0.025 mol·L-1逐渐提高,肝素琼脂糖珠结合的rIBP的量逐渐下降,至NaCl达到0.5 mol·L-1时,基本不可见rIBP;同时,GST没有结合肝素琼脂糖珠(图4A)。这表明rIBP结合肝素琼脂糖珠与标签GST无关,且结合能被生理浓度的NaCl部分解离下来。
肝素与肝素琼脂糖凝胶、rIBP共孵育后,免疫印迹中的特异条带亮度随肝素浓度升高而降低,表现出剂量依赖关系(图4B),表明游离肝素与琼脂糖凝胶中固相肝素竞争结合rIBP,对结合的抑制作用是特异的。
免疫印迹显示,与PBS相比,rIBP、GST抗血清都能抑制rIBP结合肝素琼脂糖凝胶,且与两者孵育后肝素琼脂糖凝胶结合的rIBP量无明显差异(图4C),表明针对rIBP的抗体不能抑制rIBP结合肝素,抗血清对结合的抑制作用是由血清中的其他物质造成的。
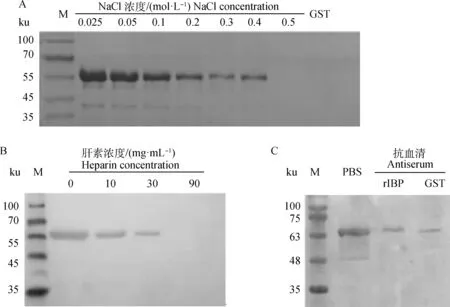
A. rIBP结合肝素琼脂糖凝胶分析;B. 肝素抑制rIBP结合肝素琼脂糖凝胶;C. 抗血清抑制 rIBP结合肝素琼脂糖凝胶(rIBP. 小鼠抗 rIBP血清;GST. GST抗血清);M. 蛋白质相对分子质量标准A. Binding assay of rIBP to heparin agarose gel; B. Heparin inhibits rIBP binding to heparin agarose gel; C. Antiserum inhibits rIBP binding to heparin agarose gel (rIBP. Anti-rIBP serum from mice; GST. Anti-GST serum); M. Protein marker图4 rIBP肝素结合与结合抑制分析Fig.4 Analysis of rIBP binding heparin and the binding inhibition
2.5 细胞黏附分析
免疫印迹显示,rIBP与MDBK细胞孵育后,出现特异条带,且条带亮度随rIBP剂量的增加而增量,表现出良好的剂量依赖关系;GST与MDBK细胞孵育后未出现明显条带(图5),表明rIBP黏附MDBK细胞与GST标签无关,能特异性黏附MDBK细胞。
2.6 rIBP抗血清抑制细菌黏附细胞分析
抗血清抑制细胞黏附试验结果显示,与rIBP或GST抗血清(1∶10稀释)预孵育的化脓隐秘杆菌和与PBS预孵育的化脓隐秘杆菌相比,黏附到MDBK细胞上的数量下降极显著(P<0.05);与rIBP抗血清预孵育的化脓隐秘杆菌和与GST抗血清预孵育的化脓隐秘杆菌黏附到MDBK细胞上的数量下降极显著(P<0.05)(图6)。这表明rIBP抗血清能抑制化脓隐秘杆菌黏附到MDBK细胞,进一步证实rIBP能黏附MDBK细胞。

M.蛋白质相对分子质量标准M. Protein marker图5 rIBP黏附MDBK细胞分析(免疫印迹)Fig.5 Adhesion assay of rIBP to MDBK cells (Western blotting)
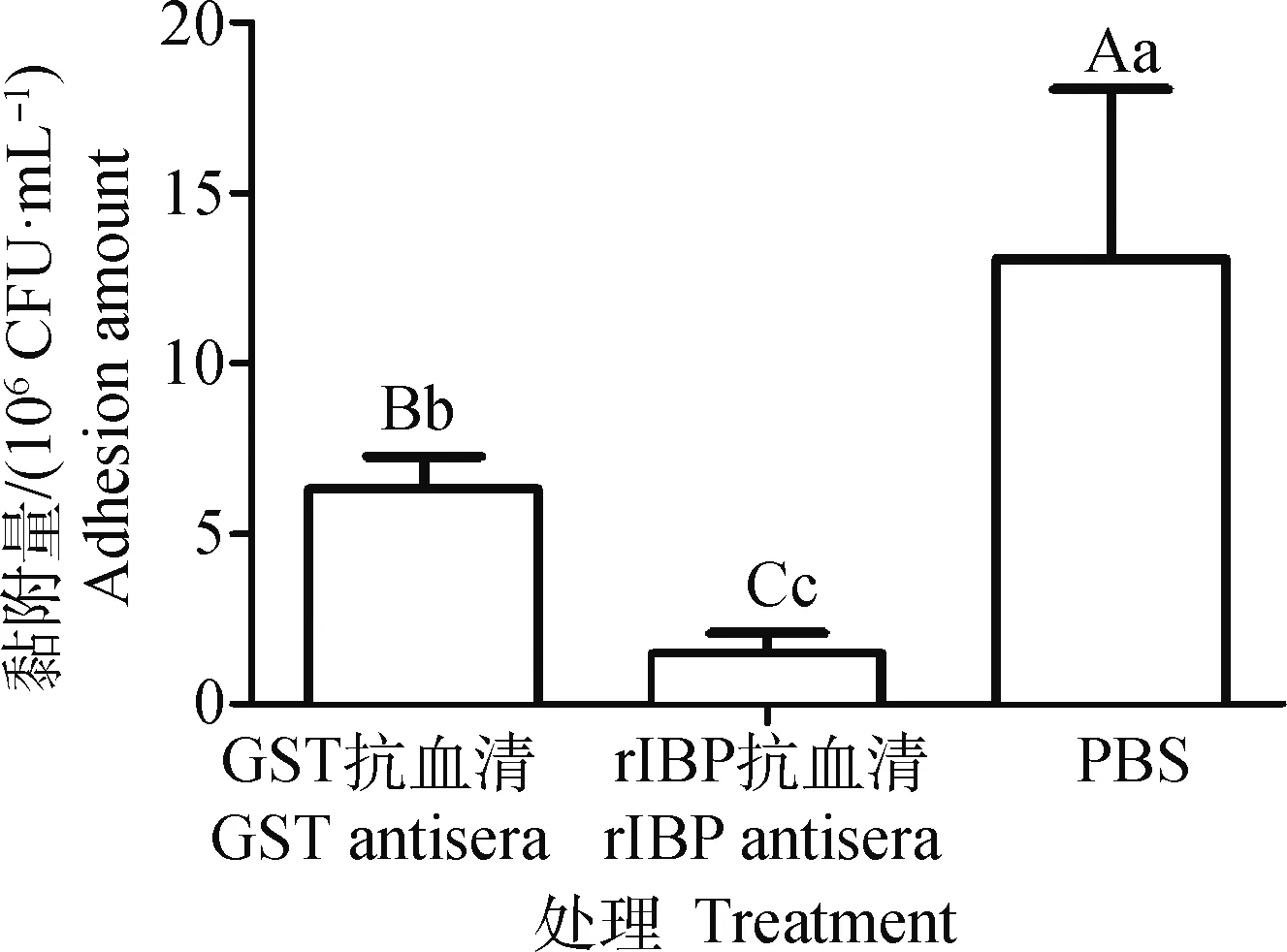
图中不同大写字母(A、B、C)表示差异极显著(P<0.01),不同小写字母(a、b、c)表示差异显著(P<0.05)Different capital letters (A, B or C) mean P<0.01, different lower letters (a, b or c) mean P<0.05 in the column chart图6 rIBP抗血清抑制化脓隐秘杆菌黏附细胞的作用分析Fig.6 Inhibitory effect of anti-rIBP serum on cell adhesion of T. pyogenes
3 讨 论
肝素、硫酸乙酰肝素是结构类似的GAGs[16]。硫酸乙酰肝素在多细胞生物进化的早期出现,与核心蛋白共价结合,是所有多细胞生物细胞膜结构的基本成分[17]。据计算人肝细胞表面表达4×105个硫酸乙酰肝素分子[18]。在感染中,很多病原体利用自身的表面蛋白黏附宿主HSPGs,以使自身附着靶细胞并侵入组织[10-12]。这些研究结果指出很多病原在进化中适应了以HSPGs作为受体的一般策略。
病原体表面蛋白与HSPGs黏附的分子基础是,这些表面蛋白结构域柔性环中的富含Arg、Lys区域负责与HSPGs结合,蛋白质上带正电荷的氨基酸簇与HSPGs上带负电荷的GAGs形成离子键,在黏附基序上要求带正电荷的氨基酸簇与疏水性氨基酸相靠近,疏水性氨基酸侧链和糖链非极性基团间的相互作用稳定了蛋白质和聚糖的结合[19-20]。与HSPGs结合的病原体表面蛋白能通过肝素琼脂糖凝胶层析从膜蛋白中提取[20]。之前用商品化细菌膜蛋白提取试剂盒提取的化脓隐秘杆菌膜蛋白是高盐溶液[14],高浓度盐会降低蛋白质与肝素琼脂糖凝胶的结合力。本研究利用肝素琼脂糖凝胶从化脓隐秘杆菌裂解物上清提取蛋白,从SDS-PAGE和免疫印迹分析结果来看,提取后蛋白质条带数量明显减少,部分条带得到明显富集。经蛋白质质谱和免疫印迹鉴定,提取到包含IBP在内的10种ABC转运体的SBPs,表明化脓隐秘杆菌的这些蛋白质在含8%小牛血清的TSB培养基中37 ℃振摇培养有大量表达。
ABC转运体负责细胞内外物质摄取、转运,由ABC型膜透酶(permease)、ATP结合蛋白质(或称ATP酶,ATPase)和底物结合蛋白(substrate binding protein, SBP)组成,不同类型的ABC转运体转运不同的底物。SBPs是一类脂蛋白(lipoproteins)[21]。细菌脂蛋白含有N-末端脂质修饰,即N-酰基-S-二酰基-甘油基-半胱氨酸(N-acyl-S-diacyl-glyceryl-cysteine)。脂蛋白在原核生物中含量丰富。Stoll等[22]利用脂蛋白搜索程序ParSeq[23]对金黄色葡萄球菌N315基因组进行了分析,鉴定出70多个推测的脂蛋白,但只有55个含有正确长度的信号肽,35个脂蛋白可被注释为铁、锌、氨基酸、寡肽、甘氨酸甜菜碱、糖和磷壁酸的转运蛋白。
在革兰阳性细菌中,脂蛋白锚定在细胞质膜的外表面上,并可延伸到细胞壁内外,与外部成分(如营养素和宿主蛋白质)结合[21],是一类保守的细菌黏附蛋白家族[24-25]。在免疫印迹中,自然感染化脓隐秘杆菌的山羊血清能识别出rIBP,这表明IBP能在感染过程中表达,可能在感染过程中发挥黏附宿主细胞的作用。IBP(rIBP)能结合肝素和宿主细胞,表明IBP可能通过与宿主HSPGs结合而促进化脓隐秘杆菌黏附宿主细胞。另外,与肝素琼脂糖凝胶结合的rIBP能被生理浓度的NaCl部分解离下来,提示IBP与HSPGs结合可能涉及化脓隐秘杆菌在黏膜定植和感染部位上与宿主细胞的动态相互作用,而与宿主细胞的动态相互作用对病原菌的体内存活和疾病的发展至关重要[24]。rIBP能结合肝素和宿主细胞,但rIBP抗血清不能明显抑制其结合肝素而能抑制其黏附宿主细胞,表明IBP还有其他宿主受体。
4 结 论
采用肝素琼脂糖凝胶从化脓隐秘杆菌裂解物中提取到IBP等多种蛋白,证实在自然感染中化脓隐秘杆菌表达IBP,IBP特异性结合肝素、黏附MDBK细胞,rIBP抗血清不能明显抑制rIBP结合肝素,但能抑制化脓隐秘杆菌黏附MDBK细胞。
