薄荷醇、苏合香挥发油对川芎嗪纳米粒跨血脑屏障模型转运行为的影响
2022-03-07张翼杨凯丽毕嘉谣王迪磊郭子硕杜守颖李鹏跃
张翼 杨凯丽 毕嘉谣 王迪磊 郭子硕 杜守颖 李鹏跃
缺血性脑血管病(ischemic cerebrovascular disease, ICVD)是指因脑部血液供应障碍而导致的相应供血区脑组织缺血、缺氧、坏死或软化[1]。ICVD是导致人类死亡的三大主要疾病之一,占全部脑血管疾病的70%左右[2]。在治疗ICVD的中药方剂中常配伍使用各类芳香开窍药以取其通关利窍之效。挥发油是芳香类中药中的一类重要成分,现代研究显示,多种挥发油能够提高药物入脑药量,提高药物的脑组织分布[3-4]。但同时应注意的是,大量的经皮递药实验显示挥发油具有一定的刺激性,在研究及应用时应予以重视。
川芎嗪(tetramethylpyrazine,TMP)是从伞形科藁本属植物川芎(LigusticumchuanxiongHort.)中提取的活性生物碱单体成分,主要用于治疗ICVD。但药动力学研究显示,川芎嗪在体内代谢迅速,排泄快,生物利用率低[5],导致其在脑组织分布较低。目前研究显示纳米制剂能够在一定程度上提高药物的脑靶向性,如孙德清[6]制备了聚乳酸—羟基乙酸共聚物[poly(lactic-co-glycolic acid),PLGA]纳米粒(nanoparticles,NPs),经静脉注射途径给药,提高了乙酰葛根素在脑组织中的分布。
基于上述认识,本研究拟采用bEnd.3细胞构建体外细胞模型,对薄荷醇、苏合香挥发油对血脑屏障(blood-brain barrier, BBB)的生物相容性进行研究;同时构建川芎嗪纳米粒(TMP-PLGA-NPs),在生物相容性良好的前提下配伍薄荷醇、苏合香挥发油,探索二者对TMP-PLGA-NPs跨膜转运的影响。
1 材料与方法
1.1 细胞株
小鼠脑微血管内皮细胞(bEnd.3 细胞,资源编号:ATCC CRL-2299)购于美国模式培养物集存库(American type culture collection, ATCC)。
1.2 主要仪器
电子分析天平[赛多利斯科学仪器(北京)有限公司,BSA 224S];高效液相色谱仪(安捷伦科技有限公司,Agilent 1100);电热恒温水浴锅(北京科伟永兴仪器有限公司,HH-6);超声波细胞粉碎仪(宁波新芝生物科技股份有限公司,SCIENTZ-ⅡD);超声波清洗机(宁波新苓生物科技股份有限公司,SB25-12DTD);循环水式多用真空泵(郑州长城科工贸有限公司,SHB-III);二氧化碳培养箱(德国Binder公司,C170);倒置显微镜(日本Olympus公司,CKX41-A22PHP);台式离心机(上海安亭科学仪器厂,TDL80-2B); -80℃超低温冰箱(美国Thermo公司,Revco PLUS);细胞电阻仪(美国Merck公司,Millcell®ERS-2);12 孔Transwell细胞培养板(美国Corning公司,配有0.4 μm孔径聚酯膜)。
1.3 主要试剂与试药
磷酸川芎嗪对照品(中国食品药品检定研究院,批号100845-201603);2,3,5,6-四甲基吡嗪(北京华威锐科化工有限公司);酯封端聚乳酸乙醇酸共聚物(PLGA 75/25 COOR,山东济南岱罡生物有限公司);L-薄荷醇(货号01002845)、苏合香挥发油(货号01028128)均购于北京偶合科技有限公司;二氯甲烷(分析纯)、乙酸乙酯(分析纯)、冰乙酸(色谱纯),均购于天津市大茂化学试剂厂;聚乙烯醇1788(上海麦克林生化科技有限公司);甲醇(Fisher公司,色谱级);娃哈哈纯净水(杭州娃哈哈集团有限公司);DMEM 高糖培养基(美国 Gibco 公司,货号C11995500BT);胎牛血清FBS(美国Gemini公司,货号100-700);PBS缓冲液(Solarbio公司,货号P1020);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(噻唑兰,MTT)(北京拜尔迪生物技术有限公司,货号bn30793);二甲基亚砜DMSO(美国 Sigma-Aldrich 公司,货号D2438);无血清细胞冻存液(苏州新赛美生物科技有限公司,货号C40100)。
1.4 细胞培养
将bEnd.3细胞置于含10% FBS、1%双抗(青霉素/链霉素)的DMEM高糖培养基的25 cm2细胞培养瓶中,在37℃、5% CO2恒温培养箱环境下培养,隔天换液。当培养瓶中bEnd.3细胞的覆盖率达到70~80%时,以胰蛋白酶消化并传代。
1.5 薄荷醇、苏合香挥发油细胞相容性实验研究
本研究拟采用MTT实验对薄荷醇、苏合香挥发油与bEnd.3细胞的生物相容性进行研究。将处于对数生长期的bEnd.3细胞以5×104/mL密度接种于96孔板,每孔终体积100 μL。细胞培养24小时后弃去原培养基,加入配制好的含药培养基,组别设置有TMP-PLGA-NPs 100~1000倍稀释液、TMP-PLGA-NPs 100~1000倍稀释液+25 μg/mL促透剂(薄荷醇/苏合香油)、TMP-PLGA-NPs 100~500倍稀释液+50 μg/mL促透剂(薄荷醇/苏合香油)、TMP-PLGA-NPs 100~1000倍稀释液+75 μg/mL促透剂(薄荷醇/苏合香油),此外,对照组仅加入新鲜的DMEM高糖培养基。按照“1.4”项下条件培养6小时后,每孔加入质量浓度为5 mg/mL的MTT溶液10 μL,37℃下继续孵育4小时。终止培养后小心吸弃药液,每孔添加150 μL DMSO,振荡使结晶物充分溶解,酶标仪检测490 nm处的吸光度(A),计算细胞存活率。选取细胞存活率≥95%且与对照组采用独立样本t检验无统计学差异(P>0.05)组的稀释倍数作为非细胞毒剂量,即安全给药剂量。

1.6 TMP-PLGA-NPs的制备及药剂学性质评价
1.6.1 TMP-PLGA-NPs的制备 采用乳化-溶剂挥发法制备TMP-PLGA-NPs。精密称取10 mg TMP、150 mg PLGA溶于0.7 g 二氯甲烷中,待完全溶解后加入0.3 g乙酸乙酯,构成有机相;另取一定量的聚乙烯醇溶于娃哈哈水中,制备质量分数为2%、0.5%的聚乙烯醇水溶液,作为水相;精密称取2% 聚乙烯醇水溶液5 g置于上述混合有机相中,于冰浴条件下细胞破碎仪超声10分钟(200 W,超声2秒,停顿2秒),加入0.5% 聚乙烯醇水溶液5 g,以相同条件再次超声10分钟后,置于磁力搅拌器上,室温下搅拌6小时,静置24小时挥去有机溶剂,即得TMP-PLGA-NPs混悬液。
1.6.2 TMP-PLGA-NPs的形态观察 通过透射电子显微镜对TMP-PLGA-NPs的形态结构进行观测。将TMP-PLGA-NPs稀释至合适的浓度,滴加在覆盖碳膜的铜网上,30秒后用滤纸从边缘吸除水分,滴加1% 醋酸铀水溶液,染色10秒,用滤纸吸去染液,将铜网置滤纸上自然干燥,置透射电镜下观察并拍照。
1.6.3 TMP-PLGA-NPs的粒径测定 取TMP-PLGA-NPs 100 μL,娃哈哈纯净水稀释至1 mL,混匀,用马尔文粒度电位仪测定样品的粒径分布情况。
1.6.4 TMP-PLGA-NPs存放稳定性的初步考察 将依照处方制备的TMP-PLGA-NPs混悬液置于室温下保存,于1、2、3、4、5、6、7天分别取样,观察制剂外观,并测定粒径及载药量,考察各指标的变化。
1.7 转运样品中TMP含量测定方法的建立
1.7.1 色谱条件 色谱柱为Waters Xselect®HSS T3 Column(250 mm×4.6 mm,5 μm);流动相为甲醇-0.5%醋酸(70∶30);体积流量为0.5 mL/min;检测波长为282 nm;柱温30℃。
1.7.2 对照品溶液的制备 取磷酸川芎嗪对照品适量,精密称定,加甲醇制成含120 μg/mL的磷酸川芎嗪对照品储备液。
1.7.3 转运实验供试品溶液的制备 于接收池内取样600 μL,添加一倍量50%甲醇,涡旋2 分钟,超声5分钟,4℃ 10 000 r/min离心10分钟,取1 mL上清液,即得。
1.8 转运样品中TMP含量测定方法学考察
1.8.1 专属性试验 分别吸取空白DMEM培养液、TMP对照品溶液以及转运后样品溶液进行高效液相色谱分析,分析上述各实验组出峰位置,确保样品溶液出峰位置无干扰以测定方法专属性。
1.8.2 精密度试验 取浓度为2.4200 μg/mL的磷酸川芎嗪对照品溶液,连续进样6次,记录峰面积并计算相对标准偏差(relative standard deviation,RSD)。
1.8.3 重复性试验 取空白DMEM培养基配制的浓度为2.4200 μg/mL的磷酸川芎嗪溶液600 μL,添加一倍量50%甲醇,涡旋2分钟,超声5分钟,4℃ 10 000 r/min离心10分钟,取1 mL上清液,按照1.7.1项下色谱条件进样,平行操作6份,记录峰面积并计算RSD。
1.8.4 稳定性试验 取空白DMEM培养基配制的浓度为1.0020 μg/mL的磷酸川芎嗪溶液600 μL,添加一倍量50%甲醇,涡旋2分钟,超声5分钟,4℃ 10 000 r/min离心10分钟,取1 mL上清液,分别于 0、2、4、8、12、24小时进样记录峰面积并计算RSD。
1.8.5 加样回收率试验 取空白DMEM培养基配制的低、中、高浓度分别为0.1002、0.5010、1.0080 μg/mL磷酸川芎嗪对照品溶液600 μL,添加一倍量50%甲醇,涡旋2分钟,超声5分钟,4℃ 10 000 r/min离心10分钟,取1 mL上清液,高效液相色谱测定TMP含量,计算回收率RSD值。
1.9 TMP-PLGA-NPs跨细胞单层转运研究
1.9.1 bEnd.3细胞单层模型的构建 将处于对数生长期的细胞以2.5×105/mL的密度、0.5 mL的体积接种于配有聚碳酸酯膜(孔径0.4 μm,面积1.12 cm2)的12孔Transwell细胞培养板顶侧(AP)细胞培养池中,底侧(BL)加入1.5 mL相应培养基,移入培养箱中进行培养。培养过程中,隔天更换Transwell细胞培养板中培养基,观察细胞生长状态,并使用电阻仪测定细胞跨膜电阻值(trans-epithelial electrical resistance,TEER)。bEnd.3细胞TEER值生长到55~70 Ω·cm2时,在AP侧新添一定量的培养基,使AP侧液面上升至明显高于BL侧液面,培养4小时后测定液面差有无变化。若bEnd.3细胞TEER值生长到55~70 Ω·cm2,且液面差无变化(如图1所示),表明其细胞单层具有足够的紧密连接和完整性,可用以进行药物转运实验[7]。
1.9.2 TMP-PLGA-NPs跨BBB模型转运实验研究 取符合1.9.1项下条件的转运孔,在实验前用预热的PBS清洗3次,加入DMEM基础培养基(不含10% FBS),在37 ℃培养箱中温孵20分钟,弃掉培养基。用DMEM基础培养基配制TMP-PLGA-NPs 100倍稀释液、TMP-PLGA-NPs 100倍稀释液+薄荷醇(50 μg/mL)、TMP-PLGA-NPs 100倍稀释液+苏合香油(50 μg/mL)。在AP侧至BL侧的转运中,AP侧加上述药液0.5 mL,作为供给池;同时取空白DMEM基础培养基1.5 mL,加于BL侧,作为接收池。给药后,在30、60、120、180、240、300、360分钟时,从接收池中取样600 μL,随即补充相同温度和体积的空白DMEM基础培养基,按照1.7.1项下色谱条件,高效液相色谱法检测TMP的含量,绘制TMP的累积透过量-时间曲线,计算表观渗透系数(Papp)。
式中Papp为表观渗透系数(cm/s);dQ/dt为TMP转运速率;A为聚碳酸酯膜面积;C0为TMP在供给池中的初始浓度。

图1 bEND.3细胞单层的试漏实验
1.9.3 跨膜转运TEER值检测 TEER与细胞间紧密连接的完整性相关,细胞生长越紧密,TEER值越大,因而常通过TEER值表征细胞单层膜结构的完整性及药物转运的阻力大小。取符合1.9.1项下条件的转运孔,给药后分别于0、30、60、120、180、240、300、360分钟,使用Millcell®ERS-2细胞电阻仪测定各孔细胞的TEER值,计算TEER百分率并绘制TEER百分率-时间曲线。
式中TEER(%)为电阻值百分率,TEERt为各时间点的电阻值,TEER0为0时间点的电阻值。
1.10 统计学处理

2 结果
2.1 薄荷醇、苏合香挥发油的细胞相容性
如表1~3所示,无论是否添加不同浓度凉性促透剂薄荷醇,TMP-PLGA-NPs稀释100倍~1000倍,bEnd.3细胞的存活率均≥95%;TMP-PLGA-NPs稀释100~500倍后分别配伍25、50、75 μg/mL的薄荷醇均未显示细胞毒性;而TMP-PLGA-NPs稀释100~500倍后配伍75 μg/mL的苏合香挥发油,具有显著的细胞毒性(P<0.05),配伍25、50 μg/mL的苏合香挥发油则不具有细胞毒性。
为了在保障细胞生物相容性的条件下对比薄荷醇、苏合香挥发油对TMP-PLGA-NPs跨膜转运的影响,故统一采用50 μg/mL的浓度进行后续实验。

表1 TMP-PLGA-NPs不同稀释倍数下bEnd.3细胞存活率

表2 TMP-PLGA-NPs配伍不同浓度薄荷醇的bEnd.3细胞存活率

表3 TMP-PLGA-NPs配伍不同浓度苏合香挥发油的bEnd.3细胞存活率
2.2 TMP-PLGA-NPs药剂学性质评价结果
2.2.1 形态观察 透射电子显微镜结果显示,TMP-PLGA-NPs为实心球结构,表面光滑圆整,分散性好,无粘连,见图2。

图2 TMP-PLGA-NPs透射电镜图
2.2.2 粒径测定 由粒径分析结果可知,平均粒径为(152.9±2.6)nm,聚合物分散性指数(polymer dispersity index,PDI)为(0.101±0.017),粒径分布见图3。
2.2.3 稳定性初步研究 由图4可知,TMP-PLGA-NPs在室温下保存7天粒径、PDI、载药量无显著变化,基本保持稳定。
2.3 标准曲线的制备
精密量取1.7.2项下对照品储备液适量,加空白DMEM培养基配制成系列质量浓度分别为0.1002、0.5010、1.0020、1.5030、2.0040、2.5050 μg/mL的磷酸川芎嗪对照品溶液。按照1.7.1项下色谱条件进样,记录峰面积,并以峰面积(Y)对质量浓度(X)进行线性回归。结果显示川芎嗪质量浓度的回归方程为Y=187.9X+4.0444,r=0.9997,表明川芎嗪在0.1002~2.5050 μg/mL范围内线性关系良好。
2.4 转运样品中TMP含量测定方法学实验结果
2.4.1 专属性试验 由图5可见,TMP的保留时间约为8.75分钟,TMP色谱峰与相邻色谱峰分离度大于 1.5,且空白对照在相应位置上未见色谱峰,方法专属性良好。
2.4.2 精密度、重复性、稳定性、加样回收率试验结果 将1.8中各组样品按照相应方法条件检测后,得出实验结果,见表4。

表4 转运样品中TMP含量测定方法学实验结果
2.5 TMP-PLGA-NPs跨细胞单层转运结果
2.5.1 不同促透剂对TMP-PLGA-NPs跨细胞单层转运的影响 随时间延长各组累积转运量呈增长趋势。TMP-PLGA-NPs的Papp值为15.9199×10-6cm/s,配伍薄荷醇组、苏合香油组Papp值分别为15.5661×10-6cm/s、15.1416×10-6cm/s,均无显著性差异。提示在当前配伍浓度(50 μg/mL)下薄荷醇、苏合香油对TMP-PLGA-NPs跨细胞单层转运并无影响。见图6。
2.5.2 不同促透剂对转运过程中细胞TEER值的影响 由图7可见,在给予不同浓度薄荷醇、苏合香油后,细胞单层TEER值的变化趋势与单独给予TMP-PLGA-NPs组相近,整体均呈现下降趋势。

图3 TMP-PLGA-NPs粒径分布图

图4 TMP-PLGA-NPs稳定性考察

图5 空白DMEM培养液(A)、TMP对照品溶液(B)和TMP-PLGA-NPs样品溶液(C)的高效液相色谱图

图6 TMP-PLGA-NPs配伍薄荷醇、苏合香挥发油的
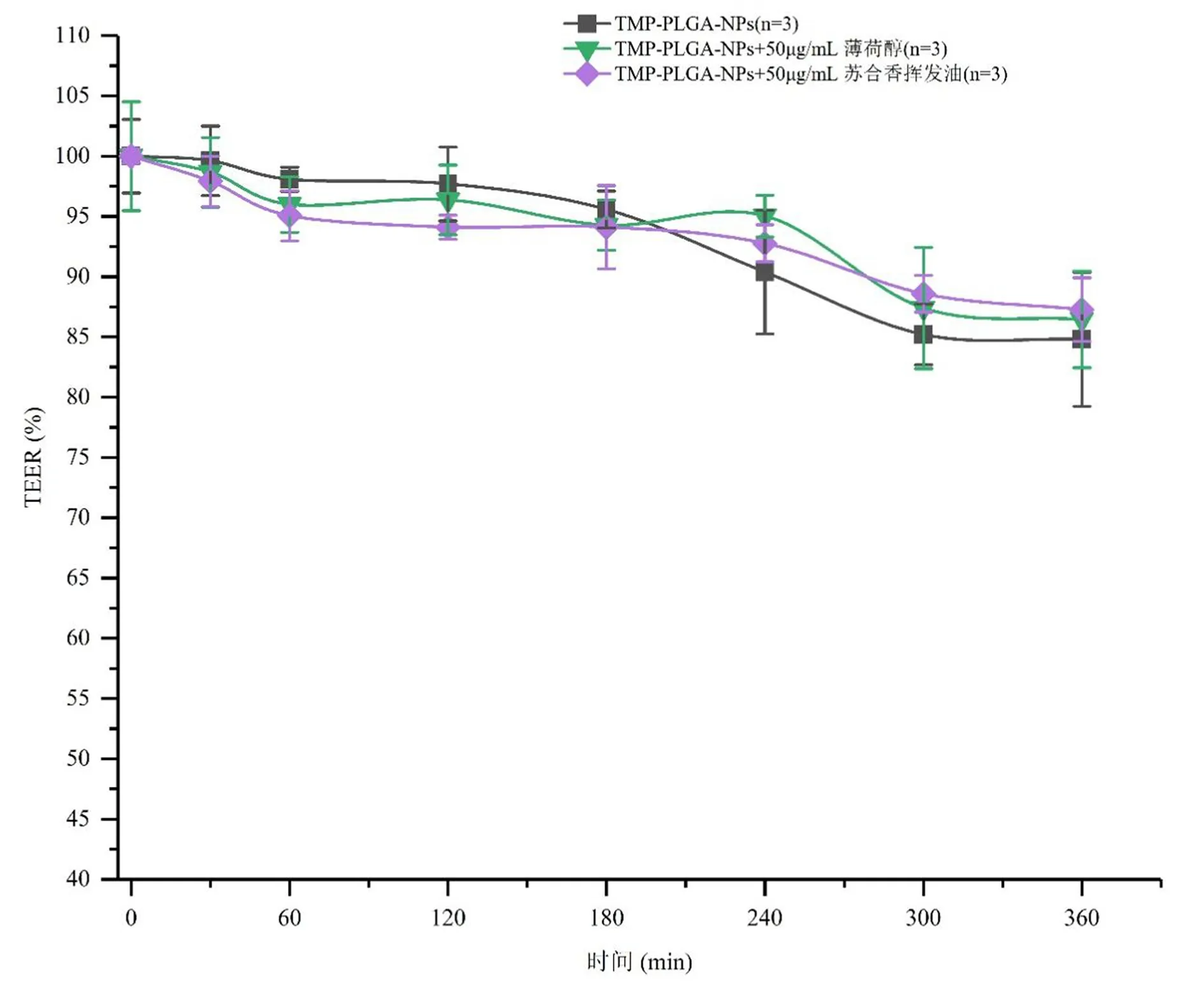
图7 不同促透剂对bEnd.3细胞单层TEER值的影响
3 讨论
现代研究表明,芳香开窍成分可通过提高细胞膜的流动性,影响细胞骨架结构等发挥促透作用,是良好的化学促透剂。当前,促透技术常应用于经皮递药研究,而对于其对药物跨BBB转运的研究相对较少,且促透剂的促透作用与刺激性通常相伴存在,为此本研究初步构建“纳米制剂+芳香开窍成分”联用系统,能够在降低促透剂刺激性的同时提高药物渗透性,为化学、药剂学的联用提供了一定的实验依据。
脑微血管内皮细胞(brain microvascular endothelial cells,BMECs)是BBB的主要结构。小鼠脑微血管内皮细胞(bEnd.3)是目前国际公认的一种血管内皮细胞株,其生长迅速并高水平表达紧密连接蛋白,是体外模拟BBB的常用细胞模型。
在对TMP-PLGA-NPs进行跨膜转运研究前,为了保障薄荷醇、苏合香挥发油对模型细胞无损伤作用,首先以细胞存活率为指标,采用MTT法对薄荷醇、苏合香挥发油对bEnd.3细胞的生物相容性进
行了研究。实验结果显示,相对于薄荷醇而言,苏合香挥发油毒性更大,为了保障试验的对照性和均衡性原则,故统一设计薄荷醇、苏合香挥发油的浓度为50 μg/mL。
本研究采用乳化—溶剂挥发法制备了TMP-PLGA-NPs,纳米粒表面光滑圆整,分散性好,无黏连,粒径均匀,平均粒径为(152.9±2.6)nm,PDI为(0.101±0.017)。对稳定性的初步研究显示,纳米粒在室温下密封贮存7天其粒径、PDI、载药量无显著变化,基本能够保持稳定。
在课题组前期对葛根素微乳的转运实验研究中[8],配伍薄荷脑后在Calu-3细胞模型中转运Papp值与葛根素微乳组相比并无显著性差异,这与本研究中跨膜转运实验结果相一致。结果显示在当前配伍浓度下,薄荷醇、苏合香挥发油对TMP-PLGA-NPs的跨膜转运并无影响。然而,这一现象与部分在体研究的文献存在一定程度的矛盾,如LIANG等[9]研究显示,薄荷醇能够显著增加负载阿苯达唑的薄荷醇—牛血清白蛋白—银纳米粒的BBB通透性,进而增加在脑胶质瘤中的积累;李东娜等[10]研究发现苏合香(0.4 g/kg)可增加伊文思蓝的渗透,对生理状态BBB具有一定开放作用。
这种不一致可能是由于薄荷醇、苏合香挥发油配伍浓度较低所造成的。受体外细胞模型实验的局限,为了不使细胞在实验过程中受到损伤,选择了较低的配伍浓度。但在绝大多数体内药动学研究中,并未考虑促透剂对实验动物BBB(或其他生物屏障)细胞的损伤作用,促透剂的配伍浓度往往较高,故而表现出更好的促透效果。以目前报道最多的中药促透剂冰片为例,张琪[11]对山奈酚经静脉递药后脑药药时曲线下面积(area under curve, AUC)进行了考察,25 mg/kg山奈酚脑药AUC为13.06 μg/(mL·min),若配伍15 mg/kg的冰片静注则脑药AUC增加到24.00 μg/(mL·min),若大鼠血液体积以12 mL计(6 mL/100 g)[12],则冰片的血药浓度可达250 μg/mL。研究发现,冰片可能通过影响神经内分泌功能以改善伊立替康的药动学,配伍冰片(0.125 g/kg)后抗肿瘤药物伊立替康静注脑药AUC 由760.91 ng/(L·h)增加至974.19 ng/(L·h),此时冰片的血药浓度高达2.08 mg/mL[13]。
对于实际应用而言,只要能够保障BBB具有可恢复性,以一定程度的损伤来提高药物制剂的脑靶向性亦具有一定的可行性,故而除上述体外细胞模型实验外,后续需要更多的在体动物实验以筛选芳香开窍药的配伍剂量,挖掘更高的指导价值。
对于细胞单层TEER值的监测显示,随着转运时间的延长TEER值表现出降低的趋势,但薄荷醇、苏合香挥发油组与对照品组并无差异,在一定程度上作证了上述推论,正是由于薄荷醇、苏合香挥发油配伍浓度较低,未能体现出对TMP-PLGA-NPs的促透作用。
从中医药理论的角度出发,本研究选择了温、凉两种药性药物的挥发性成分,分别是薄荷(性凉)中的薄荷醇、苏合香(性温)中的苏合香挥发油。MTT实验结果显示,二者细胞毒性存在较大的差异,苏合香挥发油对bEnd.3细胞的刺激性更大。姚俊宏等[14]研究了21 种辛味中药挥发油的透皮促渗效果,并对其药性规律进行分析,虽然研究中挥发油的浓度较高[丙二醇—异丙醇(3∶7)复合溶媒中含有3%的挥发油],但结果亦显示四气与挥发油透皮促渗效果具有一定的相关性。上述结果均提示在后续研究或应用过程中应当对于不同类型(或药性)促透剂的安全性予以关注。
