敲低BCLAF1对肝癌SMMC-7221细胞增殖、侵袭及耐药性的影响
2022-03-05朱朝玉范长儒张玉良
朱朝玉,范长儒,张玉良
(临沂市肿瘤医院普通外科二病区,山东 临沂 276034)
在全球范围内,肝癌的发病率在所有癌症中排名第六位,在癌症相关死亡中排名第二位[1]。肝细胞癌(hepatocellular carcinoma,HCC)占原发性肝恶性肿瘤的75%~90%,是肝癌相关死亡的主要原因[2]。早期HCC的症状通常不明显,当症状出现时,大多数HCC已经发展至晚期。HCC外科治疗选择主要是肝移植和手术切除,然而,有相当数量的中晚期患者已不适合手术治疗,导致预后很差[3]。因此,探寻可用于HCC治疗的新靶标尤为重要。Bcl-2相关转录因子1(bcl-2-associated transcription factor 1,BCLAF1)最初发现是作为一种能与Bcl-2家族发生作用的蛋白质。多年来,据报道BCLAF1参与多种生物过程,包括T细胞活化、肺发育、溶菌感染程序的控制、DNA损伤和修复[4-5],甚至转录后事件,例如mRNA的剪接加工[6]。此外,BCLAF1基因的突变或异常表达也与人类癌症密切相关。尽管大多数研究表明BCLAF1通过抑制Bcl-2家族的抗凋亡蛋白发挥肿瘤抑制因子作用,但最近的一项研究报道BCLAF1调节结肠癌细胞的肿瘤发生,其敲除能抑制结肠癌细胞增殖,过表达增强致瘤潜力[7]。本研究通过敲低BCLAF1,借以探讨其对肝癌SMMC-7221细胞增殖、侵袭及耐药性的影响。
1 材料与方法
1.1 材料
肝癌SMMC-7221细胞(目录号:TCHu52)购买自中国上海中科院细胞库;RNA提取试剂盒(货号:ZP401)、反转录试剂盒(货号:ZR102)、qPCR试剂盒(货号:ZF201)购买自北京庄盟国际生物基因科技有限公司;引物合成及shRNA-BCLAF1载体构建由自上海吉凯基因技术有限公司完成;转染试剂Lipofectamine 2000(货号:11668019)购买自赛默飞世尔科技(中国)有限公司;RPMI 1640 细胞培养基(货号:31800022 )、胰蛋白酶(货号:25200056)购买自美国 Gibco 公司;胎牛血清(货号:04-001-1ACS)购买自以色列 BI 公司;BCA蛋白浓度测定试剂盒(货号:20201ES76)购买自上海翊圣生物科技有限公司;兔抗人BCLAF1(货号:26809-1-AP)、PI3K(货号:67071-1-Ig)、p-PI3K(货号:60225-1-Ig)、Akt(货号:60203-2-Ig)、p-Akt(货号:66444-1-Ig)、β-actin(货号:66009-1-Ig)单抗,辣根过氧化酶(HRP)标记羊抗兔IgG二抗(货号:10285-1-AP)购买自美国Proteintech Group公司;MTT检测试剂盒(货号:ZY2050-500T)购买自上海泽叶生物技术公司;Transwell小室(货号:3421)购买自美国Corning公司;索拉非尼(货号:Y0002098)购买自美国sigma公司。
1.2 方法
1.2.1 细胞培养与脂质体转染 取出冻存的SMMC-7221细胞,置于37 ℃水浴条件下融化,冻存液部分溶解时取出,在无菌操作台下吸取冻存液加入完全培养基混匀后离心去上清液,加入适量添加有10%胎牛血清的RPMI 1640完全培养基重悬细胞,于37 ℃、5%CO2浓度条件下恒温培养。观察培养细胞生长到合适状态后,按照空白对照组、shRNA-NC(阴性对照)组、shRNA-BCLAF1组分别进行转染,在聚苯乙稀管中制备A液:0.8 μg DNA(空白对照组无DNA;shRNA-NC组为shRNA-NC载体:F∶5′-GAAACACAGACGGAGGGAA-3′,R∶5′-TTCCCTCCGTCTGTGTTTC-3′; shRNA-BCLAF1组为shRNA-BCLAF1载体:F∶5′-GAAGGACAGACGCAAGGAA-3′,R∶5′-TTCCTTGCGTCTGTCCTTC-3′,靶向BCLAF1基因编码序列2733-2751bp)稀释于50 μL无血清无抗生素的培养液中,B液:2 μL Lipofectamine 2 000稀释于50 μL无血清无抗生素的培养液中,轻轻混合A、B液,室温中置10~15 min;吸去SMMC-7221细胞培养孔的培养基,用无血清培养基清洗细胞两次;将混合后的A、B液加入培养孔,前后摇动培养板使其分布均匀;将细胞放入培养箱孵育4~6 h后,可以更换含血清培养基,培养24~48 h后可以观察转入基因表达情况。
1.2.2 qPCR鉴定干扰效果 按照RNA提取试剂盒说明书提取各组SMMC-7221细胞RNA,使用反转录试剂盒进行反转录获得cDNA,按照qPCR试剂盒说明书配置反应体系进行qPCR,采用2-ΔΔCt法以β-actin作为内参计算BCLAF1 mRNA的相对表达量。BCLAF1:F∶5′-AAGGTCTGGGTCTGGTrCTG-3′,R∶5′-GAGCATTCTGTGGTGCGATT-3′,扩增片段大小122bp;β-actin:F∶5′-TGGCACCCAGCACAATGAA-3′,R∶5′-CTAAGTCATAGTCCGCCTAGAA-3′,扩增片段大小185 bp。每组SMMC-7221细胞重复3次。
1.2.3 Western blot 鉴定干扰效果 提取各组SMMC-7221细胞蛋白,使用PBS冲洗细胞,加入0.25%胰蛋白酶进行消化处理3~5 min,用完全培养基终止消化反应,重悬细胞后用PBS清洗两次,离心弃上清。加入50 μL细胞裂解液,冰浴条件下超声粉碎细胞10 s,重复3次,离心收集上清液。按照BCA法使用试剂盒测定蛋白质浓度;根据测量浓度加入相应体积的待测样品于SDS-PAGE凝胶中,以25 mA恒定电流电泳1~2 h ;将凝胶转印到PVDF膜上,浸入封闭液中2 h,用TBST清洗膜3次,3 min/次;加入适当比例稀释的BCLAF1蛋白一抗,4 ℃孵育过夜,TBST清洗膜3次;加入对应浓度二抗,室温孵育2 h,TBST清洗膜3次;避光加入ECL发光染色,使用凝胶成像仪进行成像分析。采用TotalLab2.0 进行灰度分析,以β-actin作为内参,计算蛋白的相对表达量,其相对表达水平用目的蛋白条带灰度与内参蛋白条带灰度的比率表示。每组SMMC-7221细胞重复3次。
1.2.4 MTT法检测细胞增殖活性 取对数生长期且生长状态良好的上述各组SMMC-7221细胞进行传代培养,计数后以5×103个细胞每孔接种100 μL于96孔板,培养48 h后取出培养细胞,每孔加入20 μL MTT溶液培养4 h,去除培养基加入150 μL DMSO溶液,摇床震荡10 min,置于酶标仪(美国Molecular Devices,SpectraMax iD)在570 nm波长下测量各孔吸光度值,增殖率=各组吸光度值/空白对照组吸光度值。每组SMMC-7221细胞重复3次。
1.2.5 Transwell检测细胞侵袭能力 分别将各组SMMC-7221细胞以1×105个细胞每孔接种200 μL于Transwell上腔中,同时加入500 μL含有10%胎牛血清的RPMI 1 640培养基,培养24 h。24 h后,吸取Transwell上腔多余液体,PBS清洗3次。棉棒在上腔内轻轻旋转以吸去残留水分,加入结晶紫染料。5 min后,用自来水缓慢缓冲去除染料溶液。显微镜下观察透膜细胞数,随机取400×显微镜视野5个,侵袭率=各组透膜细胞数/空白对照组透膜细胞数×100%。每组SMMC-7221细胞重复3次。
1.2.6 划痕实验检测细胞迁移能力 取对数生长期且生长状态良好的上述各组SMMC-7221细胞以1×106个细胞每孔接种100 μL于6孔板中,培养至融合率达到95%后,使用无菌枪头尖端垂直于培养皿表面进行划痕,PBS冲洗悬浮细胞,更换新鲜培养基。分别于划痕即刻及划痕培养48 h后置于显微镜下观察拍照,采用Image J 2.1.4.7对图片进行分析,根据公式:细胞迁移率=(划痕即刻划痕宽度-培养48 h后划痕宽度)/划痕即刻划痕宽度×100% 进行计算。每组SMMC-7221细胞重复3次。
1.2.7 耐药性检测实验 取对数生长期且生长状态良好的各组SMMC-7221细胞进行传代培养,计数后以5×103个细胞每孔接种于96孔板,分别加入添加有浓度分别为0、4、8、12、16 μmol/L的索拉非尼的新鲜培养基。培养48 h后,采用MTT法检测细胞增殖活性,方法同1.2.4,在570 nm波长下测量各孔吸光度值,根据公式:细胞活性(%)=各组各浓度索拉非尼培养条件下吸光度值/各组0 μmol/L的索拉非尼培养条件下吸光度值×100% 计算细胞活性。每组SMMC-7221细胞重复3次。
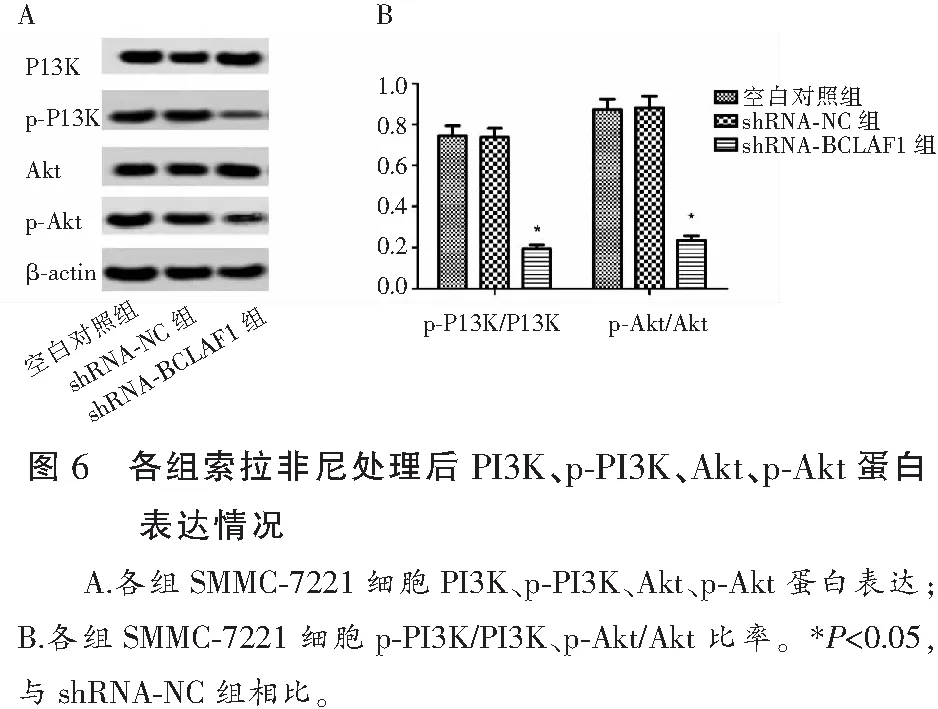
1.2.8 Western blot 法检测PI3K、p-PI3K、Akt、p-Akt蛋白表达水平 取1.2.7中16 μmol/L索拉非尼处理各组SMMC-7221细胞,抽提蛋白,按照1.2.3种方法测定各组PI3K、p-PI3K、Akt、p-Akt蛋白表达水平。每组SMMC-7221细胞重复3次。
1.3 统计学分析

2 结果
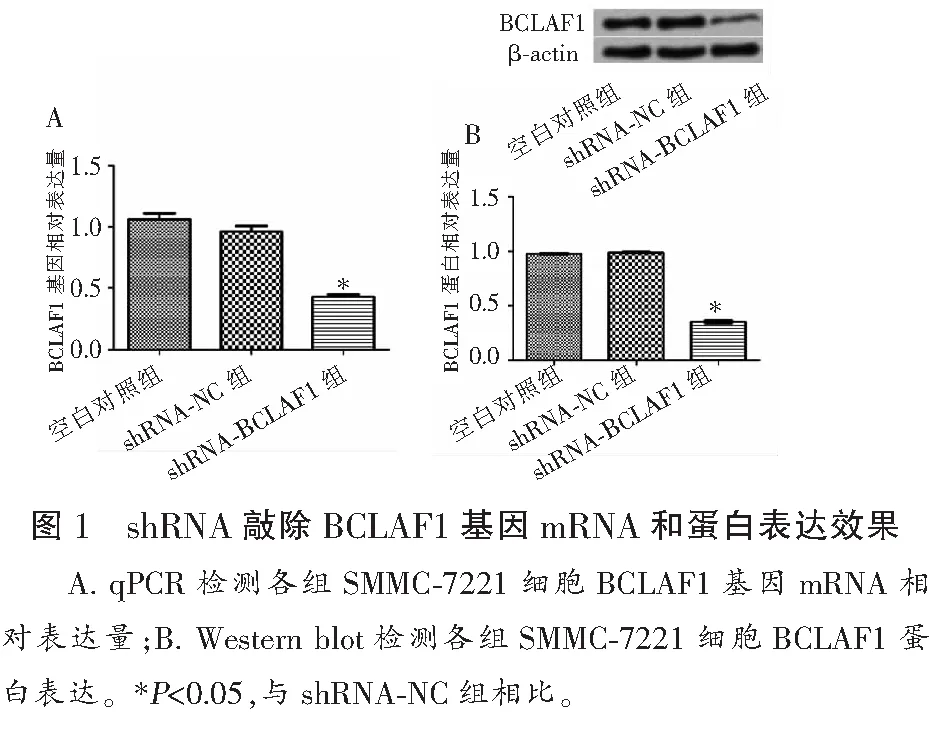
2.1 shRNA敲除BCLAF1基因表达效果比较
qPCR结果显示,空白对照组BCLAF1基因相对表达量为(1.061±0.042)与shRNA-NC组(0.982±0.034)比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组BCLAF1基因相对表达量为(0.428±0.038)低于空白对照组及shRNA-NC组(P<0.05)。Western blot结果显示,空白对照组BCLAF1蛋白相对表达量(0.978±0.061)与shRNA-NC组(0.991±0.032)比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组BCLAF1蛋白相对表达量(0.346±0.045)低于空白对照组及shRNA-NC组(P<0.05)。见图1。
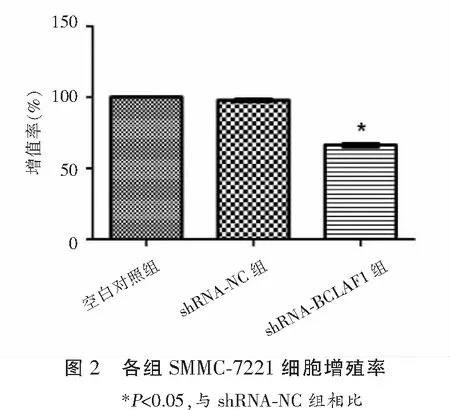
2.2 各组SMMC-7221细胞增殖活性比较
MTT法检测结果显示,空白对照组SMMC-7221细胞增殖率为(100.0±0.00)%,与shRNA-NC组(98.26±0.71)%比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组SMMC-7221细胞增殖率为(64.48±1.34)%,低于空白对照组及shRNA-NC组(P<0.05)。见图2。
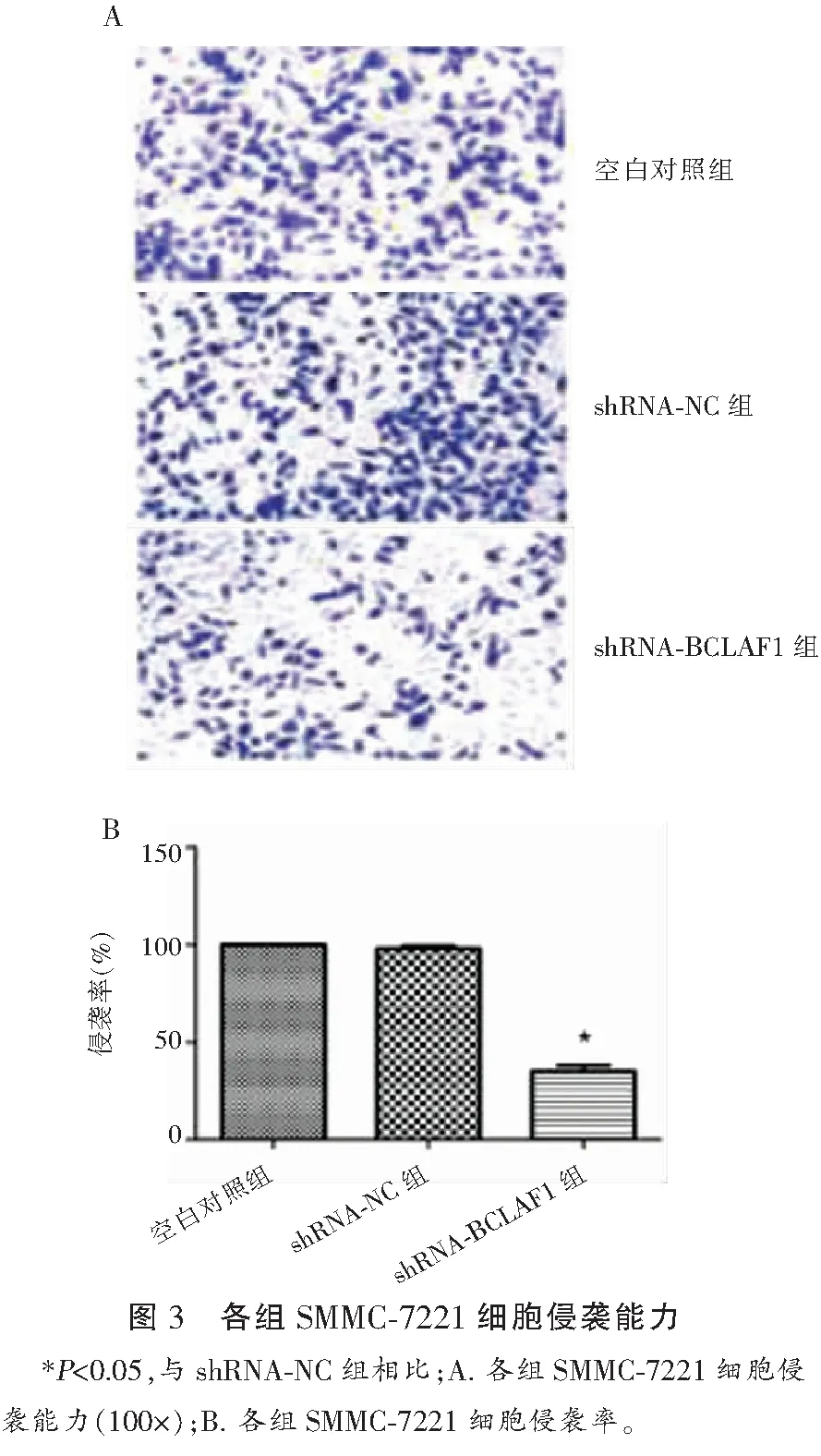
2.3 各组SMMC-7221细胞侵袭能力比较
Transwell检测结果显示,空白对照组SMMC-7221细胞侵袭率为(100.0±0.00)%,与shRNA-NC组(98.25±2.51)%比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组SMMC-7221细胞侵袭率为(34.59±2.27)%,低于空白对照组及shRNA-NC组(P<0.05)。见图3。
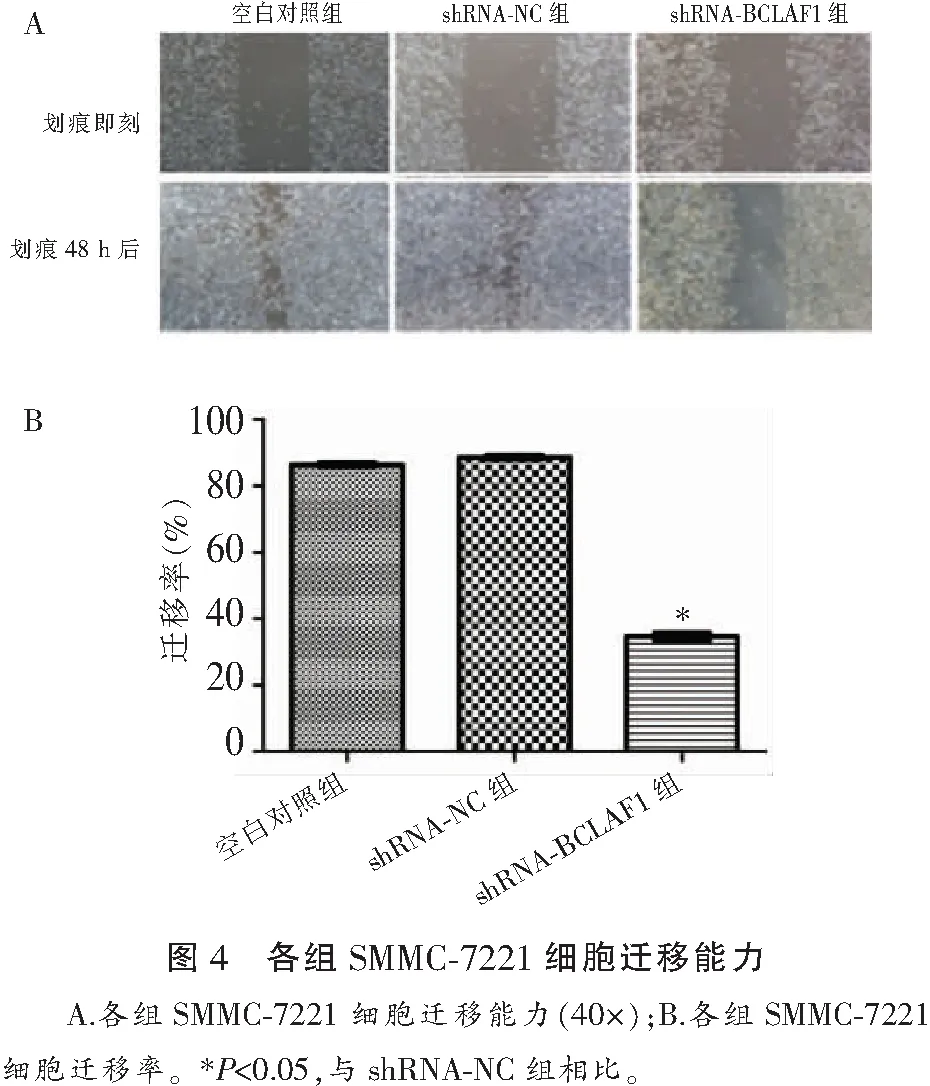
2.4 各组SMMC-7221细胞迁移能力比较
划痕实验结果显示,空白对照组SMMC-7221细胞迁移率为(84.61±2.12)%与shRNA-NC组(86.22±1.41)%比较,差异无统计学意义(P>0.05),shRNA-BCLAF1组SMMC-7221细胞迁移率(34.59±1.62)%,低于空白对照组及shRNA-NC组(P<0.05)。见图4。
2.5 各组SMMC-7221细胞耐药性比较
MTT法检测结果显示,空白对照组各浓度索拉非尼处理条件下SMMC-7221细胞活性与shRNA-NC组比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组各浓度索拉非尼处理条件下SMMC-7221细胞活性低于空白对照组及shRNA-NC组(P<0.05)。见图5。

2.6 各组索拉非尼处理后PI3K、p-PI3K、Akt、p-Akt蛋白表达情况比较
Western blot结果显示,各组PI3K、Akt蛋白相对表达量比较,差异无统计学意义(P>0.05);空白对照组p-PI3K/PI3K、p-Akt/Akt比率与shRNA-NC组比较,差异无统计学意义(P>0.05);shRNA-BCLAF1组p-PI3K/PI3K、p-Akt/Akt比率低于空白对照组及shRNA-NC组(P<0.05)。见图6。
3 讨论
HCC预后持续不良的原因之一是大部分病例诊断已到晚期,缺乏有效的治疗方案。尽管对多种化疗和靶向治疗药物进行了评估,但对晚期HCC疾病唯一被证实的治疗方法是索拉非尼,而且总体生存益处不大。因此,探索HCC发展机制、寻找可能的治疗靶点有助于改善HCC预后。
BCLAF1最初被鉴定为腺病毒E1B19K(BCL-2的同系物)的蛋白质伴侣。BCLAF1参与对BCL-2的调控,通过与抗凋亡蛋白(如BCL-2)结合而引起凋亡。然而,其功能仍然令人迷惑,因为在缺乏BCLAF1的小鼠细胞中未观察到明显的细胞凋亡缺陷。此外,BCLAF1可通过拮抗fbeclin-1和BCL-2的相互作用诱导自噬[8]。最近发现BCLAF1与几种人类恶性肿瘤有关。BCLAF1在胰腺导管腺癌、结肠直肠癌和膀胱癌中上调,并促进肿瘤进展[9-10]。BCLAF1在HCC中的临床意义和功能尚不清楚。Zhou等[11]证明BCLAF1在HCC中经常上调,BCLAF1的上调与Edmondson分级、较低的总生存率和不良预后有关,表明BCLAF1作为癌基因可能参与HCC发展。为明确BCLAF1对HCC的作用,本研究通过观察敲低BCLAF1后对肝癌SMMC-7221细胞的影响,探讨BCLAF1在HCC中的功能。qPCR和Western blot结果显示,shRNA-BCLAF1组BCLAF1基因、蛋白相对表达量降低(P<0.05),证明干扰因素明显抑制BCLAF1表达。MTT法检测结果表明,shRNA-BCLAF1组SMMC-7221细胞增殖能力低于空白对照组及shRNA-NC组(P<0.05);Transwell检测结果表明,shRNA-BCLAF1组SMMC-7221细胞侵袭能力低于空白对照组及shRNA-NC组(P<0.05);划痕实验结果表明,shRNA-BCLAF1组SMMC-7221细胞迁移能力低于空白对照组及shRNA-NC组(P<0.05),与既往研究一致,表明SMMC-7221细胞在敲低BCLAF1基因表达后,增殖、侵袭及迁移能力受到抑制,提示BCLAF1在HCC中能促进细胞增殖、侵袭及迁移。Mou等[12]报道,BCLAF1可与lncNEAT1启动子直接相互作用并促进lncNEAT1(一种转录调节因子,有助于形成易于癌变的转录组,促进肿瘤发生和发展)表达,证明BCLAF1通过靶向lncRNA NEAT1促进肝癌细胞增殖和侵袭;Shao等[4]报道BCLAF1可在缺氧条件下结合HIF-1α,维持长期缺氧条件下HIF-1α活性,促进肿瘤进展。恶性肿瘤较强的增殖及侵袭能力是其发展与转移的关键,提示BCLAF1可作为抑制HCC发展与转移的靶点在HCC治疗中起作用。
索拉非尼是一种口服多激酶抑制剂,通过抑制丝氨酸-苏氨酸激酶BRAF和CRAF、受体酪氨酸激酶、血管内皮生长因子受体(VEGFRs)和血小板源性生长因子受体(PDGFR- β),表现出促凋亡和抑制血管生成作用进而抑制HCC增殖发展[13]。迄今为止,索拉非尼仍是FDA批准的唯一治疗不能切除的晚期HCC的全身药物。然而,肝癌患者对索拉非尼的获得性耐药是一种普遍现象,限制了其临床应用[14]。Yu等[15]采用Kaplan-Meier生存法分析HCC中BCLAF1与索拉非尼耐药的相关性,表明高表达水平BCLAF1可能导致HCC患者对索拉非尼耐药。在本研究中,shRNA-BCLAF1组各浓度索拉非尼处理条件下SMMC-7221细胞活性降低(P<0.05),提示敲低BCLAF1能增强HCC细胞对索拉非尼的敏感性,BCLAF1能介导HCC对索拉非尼耐药,与前人研究一致。
PI3K / Akt通路是人体内至关重要的信号转导途径之一,参与正常的细胞过程,例如细胞存活、增殖和凋亡以及许多生理过程[16]。然而,这种信号的异常激活已在包括HCC在内的人类癌症中广泛报道[17]。此外,许多研究报告称,PI3K/Akt信号的异常激活在对索拉非尼的耐药性发展中起关键作用,抑制该途径可提高索拉非尼在多种人类恶性肿瘤中的功效[18]。最近的研究还发现,PI3K/Akt通路抑制剂联合索拉非尼表现出强大的抗HCC效应,并与抑制PI3K及Akt磷酸化有关[19]。在本研究中,索拉非尼处理后,shRNA-BCLAF1组p-PI3K、p-Akt水平降低(P<0.05),表明敲低BCLAF1能通过抑制PI3K / Akt通路降低HCC对索拉非尼耐药性,提示BCLAF1可能通过激活PI3K/Akt通路介导索拉非尼耐药,可将BCLAF1作为纠正HCC索拉非尼耐药的靶点进一步研究以为临床服务。
综上,敲低BCLAF1能抑制肝癌SMMC-7221细胞增殖、侵袭及迁移能力,并降低对索拉非尼的耐药性,机制可能与抑制PI3K/Akt通路有关,但BCLAF1在HCC发展中的具体机制有待进一步研究。
