乳酸菌对苏尼特羊肠道菌群组成及肉品质的影响
2022-03-04王柏辉田建军素布达
刘 婷, 王柏辉, 刘 畅, 段 艳, 苏 琳, 田建军, 素布达, 靳 烨*
(1 内蒙古农业大学 呼和浩特010018 2 乌拉特中旗农牧和科技局 内蒙古巴彦淖尔015300)
反刍动物具有较为特殊的消化器官, 除了瘤胃,肠道也是重要的微生物发酵消化场所,起到营养物质补偿、参与机体的消化代谢的作用[1]。 胃和小肠消化后未被利用的淀粉、 纤维物质以及一些不溶性蛋白等都能继续进入大肠中发酵, 随后产生葡萄糖、 挥发性脂肪酸等能为机体提供营养的能量物质[2]。 Malmuthuge 等[3]发现饲喂不同饲粮会改变奶牛胃肠道菌群的组成及结构, 断奶前小奶牛大肠内的细菌丰富度显著高于小肠内的细菌丰富度[4]。
有研究表明饲粮的营养结构对羊肉中氨基酸、脂肪酸的结构和含量都有显著影响[5]。 刘传发等[6]发现牦牛后肠道内有大量促进短链脂肪酸生成的益生微生物群, 进一步提高了食物中营养成分的转化率。赵方舟等[7]发现乳铁蛋白的干预能够提高仔猪盲肠菌群的多样性, 改变短链脂肪酸的含量并改善盲肠菌群结构。 乳酸菌能增强动物机体免疫能力并起到抗氧化的功效[8]。 郭春燕等[9]在研究乳酸菌对反刍动物胃肠道中活菌比例、 挥发性脂肪酸含量的影响中发现: 瘤胃中外源乳酸菌能提高胃中总活菌比例。 本试验采用高通量测序技术检测肠道菌群菌落中的物种, 比较饲粮中添加乳酸菌对苏尼特羊肠道细菌多样性、 肉的理化感官指标及营养品质的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物饲养及样本采集 从乌拉特中旗农区畜牧业育种园区内随机选取12 只3~4月龄苏尼特羊并将其分为2 组,每组6 只【公母各半,体质量均为(16.94±1.29)kg】。
对照组:10 kg 精饲粮、8 kg 青贮饲粮和5 kg葵花饼;乳酸菌组:乳酸菌添加量为对照组总饲粮(精饲粮+青贮饲粮+葵花饼)的0.50%。 乳酸菌为乳安邦复合微生态制剂 (活菌数≥1.5×109CFU/g),其成分主要包括干酪乳杆菌HM-09、植物乳杆菌HM-10 (Lactobacillus casei HM-09、Lactobacillus plantarum HM-10)。
在90 d 饲喂后宰杀放血并采集500 g 苏尼特羊背最长肌用于羊肉品质分析; 苏尼特羊盲肠粪便样品用50 mL 无酶无菌离心管进行采集, 采集后直接贮存在干冰中, 盲肠样品用作后期肠道微生物分析,所用样品采集带回后均保存在-80 ℃冰箱。
1.1.2 仪器与设备 5424R 高速台式冷冻离心机,Eppendorf 公司; 气相色谱GC-质谱联用仪MS、NanoDrop2000 超微量分光光度计,Thermo Fisher Scientific 公司;DYY-6C 电泳仪,北京市六一仪器厂;GeneAmp700 型PCR 仪,ABI 公司;Illumina Miseq MISEQ 测序仪,Illumina 公司;固相微萃取头,Supelco 公司;RE-52AA 旋转蒸发器,上海亚荣生化仪器厂。
1.1.3 主要试剂及其来源 精饲粮, 恒牧饲粮科技有限公司;青贮饲粮、葵花饼为蒙古牧民自制;乳安邦,内蒙古和美科盛生物技术有限公司;DNA抽提试剂盒,Omega Bio-Tek 公司;FastPfu 聚合酶,TransGen 公司;DNA 凝胶提取试剂盒,Axygen公司;土壤基因组DNA 提取试剂,MP 公司;37 种脂肪酸甲酯的混标,Sigma 公司;正己烷、甲醇为色谱纯级,其余试剂如无水硫酸钠、氢氧化钠、三氟化硼-乙醚络合物、乙醚、氢氧化钠、硫酸铜、硫酸钾和盐酸均为国产分析纯级, 国药集团化学试剂有限公司。
1.2 试验方法
1.2.1 肠道微生物菌群的测定 按照DNA 提取试剂盒说明书提取微生物群落总DNA, 利用1%的琼脂糖凝胶电泳检测DNA 提取的质量,利用超微量分光光度计进行样品DNA 浓度及纯度测定;使用 (515F 和926R,515F:5’-GTGCCAGCMGCCGCGGTAA-3’;926 R:5’-CCGTCAATTCMTTTRAGTTT-3’) 对16S rDNA 基因V4-V5 可变区进行PCR 扩增。
Illumina Miseq 测序及后期优化数据处理参照王柏辉[5]的方法。
1.2.2 营养品质的测定 肉中脂肪酸的测定参照袁倩等[10]的方法;氨基酸的测定参照GB 5009.124-2016 《食品安全国家标准 食品中氨基酸的测定》的方法。
1.2.3 感官品质测定 挥发性风味物质的测定参照李文博等[11]的方法;肉品质基础感官指标及理化指标(色差、pH 值、剪切力和熟肉率)的测定参照罗玉龙等[12]的方法。 在肉羊在屠宰后,用胴体直插式pH 计分别在45 min 和24 h 测定背最长肌的pH 值,记作pH45min和pH24h。 测定肉样色泽时肌肉切成3 cm×3 cm×1 cm 的立方体,其中L*表示亮度值;a*表示红度值;b*表示黄度值。 取50 g 左右的肉样,在肉样中心插入温度计,在水浴锅中85℃煮制40 min,待肉样中心温度达到75 ℃后吸去表面水分,按照下式计算熟肉率。
熟肉率(%)=m1/m2×100
式中,m1——煮前质量,g;m2——煮后质量,g。
1.3 数据处理
运用SPSS 22.0 版本软件进行单因素方差分析及样本t 检验。 饲喂乳酸菌后胃肠道菌群的Alpha 多样性及Beta 多样性利用FastTree 软件进行统计分析[13]。
2 结果与分析
2.1 肠道菌群多样性分析
由于反刍动物饲粮组成和机体能量代谢的不同, 肠道菌群及其代谢产物的变化和肉中化学组成变化紧密相关[14]。 具有益生作用的饲粮能在反刍动物消化系统中建立有利于自身生长发育的优势菌群[15]。 同一品种的反刍动物在不同肠段的微生物群落组成和结构中均具有显著差异性[16],可能造成各个胃肠段的微生物群落丰度以及组成不同。
通过微生物物种丰富度和均匀度来表示肠道微生物多样性,Shannon 指数越大细菌多样性越高[17],Ace 和Chao 1 指数越大,微生物群落丰富度越高[18]。 由表1 数据得出对照组与乳酸菌组的Shannon、Chao 1、Ace 指数具有显著差异性(P<0.05),试验表明通过在饲粮中添加乳酸菌可以增加苏尼特羊肠道微生物丰富度。 两组样品覆盖深度约达到99%, 当前测序量能够覆盖样本中的绝大部分物种信息, 乳酸菌组微生物丰富度显著高于对照组, 本研究基因序列质量满足后续生物信息学分析的要求。

表1 乳酸菌对苏尼特羊瘤胃菌群α-多样性的影响Table 1 Effect of lactic acid bacteria on the α-diversity of rumen microbe in Sunit sheep
2.2 肠道菌群群落组成分析
Beta 多样性分析表示不同分组条件下样本之间微生物结构的相似性或差异性。 基于样本属水平分类,由共享菌群绘制的聚类热图1 可知,乳酸菌组和对照组的菌落能明显区分开, 乳酸菌组主要以拟杆菌门、疣微菌门为主,根据两组样本部分有聚类的趋势, 说明这两组从肠道区系划分都为盲肠,有一定的同源性和相似性。
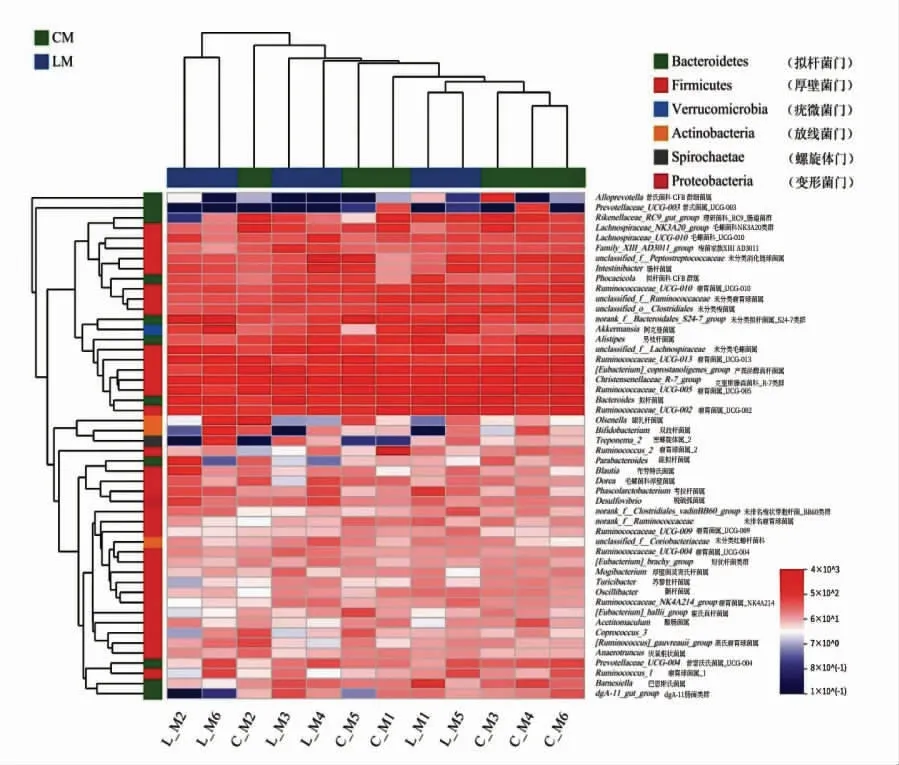
图1 两组间共享属聚类热图Fig.1 Shared genus cluster heatmap between two groups
2.3 肠道菌群结构分析
2.3.1 菌群门水平分布 在门水平肠道主要物种组成丰度依次为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia)、放线菌 门(Actinobacteria)、变 形 菌 门(Proteobacteria),从表2 中可以看出12 个样品的优势菌群均以厚壁菌门和拟杆菌门为主,这与杜瑞等[19]在研究盲肠微生物多样性中的结果相同。 其中乳酸菌组的拟杆菌门及疣微菌门均显著高于对照组(P<0.05),厚壁菌门、放线菌门、变形菌门在两组中无显著差异。
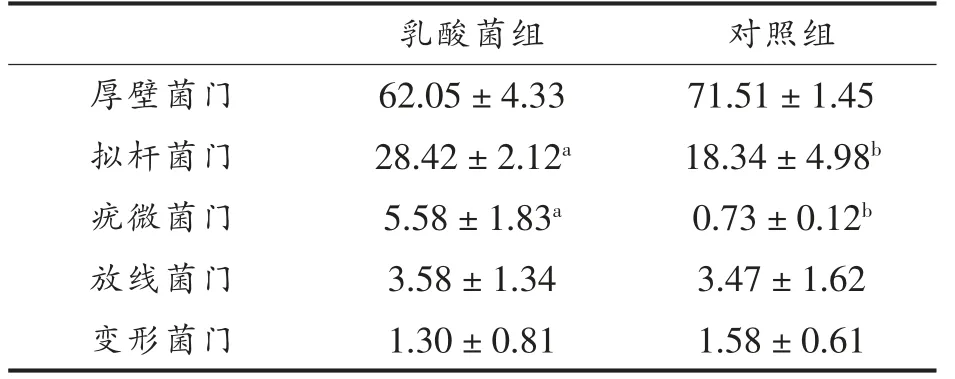
表2 乳酸菌对苏尼特羊盲肠菌群的影响(门水平,%)Table 2 Effect of lactic acid bacteria on the cecal flora of Sunit sheep (phylum level,%)
反刍动物胃肠道中拟杆菌门升高能够减轻宿主食源性肥胖的症状, 因为拟杆菌门可以提高动物对碳水化合物的利用增加宿主体内脂肪的降解速率[20]。 有研究表明在动物肠道菌群多样性分析试验中, 无论单胃还是多胃动物的胃肠道菌群内都存在共性[21]。 苏尼特羊肠道菌群内容物中瘤胃菌属占比大, 而一些瘤胃球菌属能够产生许多种碳水化合物降解酶, 具有降解碳水化合物的活性物质[22]。 疣微菌门存在于不同肠段,其遗传因子在不同部位有差异性表达, 可以使用数百种酶来消化藻类多糖,能够独自降解糖类营养物质[23]。
变形菌门中主要包含大肠杆菌等致病菌[24],试验结果表明乳酸菌组中的变形菌门含量较少,添加乳酸菌后可能促进了放线菌门及疣微菌门的生长,一定程度上抑制了变形菌门的生长。
2.3.2 菌群属水平分布 在属水平肠道物种分布相对丰度大于1%的微生物主要有9 个属,如表3所示, 两组菌属按照占比降序排列依次为克里斯滕森菌科R-7_group、拟杆菌属、产粪甾醇真细菌、瘤胃球菌属UCG_013、 瘤胃球菌属UCG_002、阿克曼菌属等。
从本试验验结果总体来看, 肠道中乳酸菌组的物种丰富度较高, 其中拟杆菌属和阿克曼菌属较为突出,两者丰度比例显著高于对照组(P<0.05),其功能不仅局限于发酵碳水化合物,还可能影响着代谢产物和免疫之间的平衡。 阿克曼菌属可以合成糖苷酶降解黏蛋白, 其菌膜上具有一种耐高温的细菌蛋白能抑制过度肥胖的发生,肠腔内产生的丙酸和丁酸作用于G 蛋白偶联受体起到改善宿主对营养物质吸收、 脂肪酸沉积以及转运代谢等功能, 进一步基于肠道菌群提高羊肉品质[25]。 克里斯滕森菌科、瘤胃球菌属于厚壁菌门,乳酸菌组与对照组之间二者丰度无显著差异,在动物肠道及黏膜中广泛存在, 前者促进宿主脂肪代谢沉积[26],后者主要发酵代谢产物为乙酸和甲酸, 以瘤胃球菌属为主的肠型中细菌主要靠吸收单糖和降解黏蛋白来获取能量。瘤胃球菌属、消化链球菌科均会产生短链脂肪酸, 短链脂肪酸除了能作为能源物质, 还能随着血液到肌肉组织当中降低肉的pH 值[27]。对照组中另枝菌属丰度显著高于乳酸菌组(P<0.05),另枝菌属对动物疾病和精神健康有着重要的作用, 研究表明高脂饮食(HFD)能促进另枝菌属中2 种与结直肠癌有关的致病菌富集,在大肠癌中具有致病性[28]。 从表3 分析可知, 与对照组相比饲喂乳酸菌能提高苏尼特羊盲肠中有益菌属的丰度。 有研究表明羊肉中的脂肪沉积与拟杆菌属和厚壁菌属的比例有着密切的关系, 菌的代谢产物能进一步调控脂代谢途径相关基因,继而影响脂肪沉积水平[29]。 吴琼等[30]通过高通量测序发现在草原红牛瘤胃菌群功能预测中,糖代谢、氨基酸代谢相关的基因较为富集,可能与相关微生物含有大量的木质纤维素降解酶基因有关。
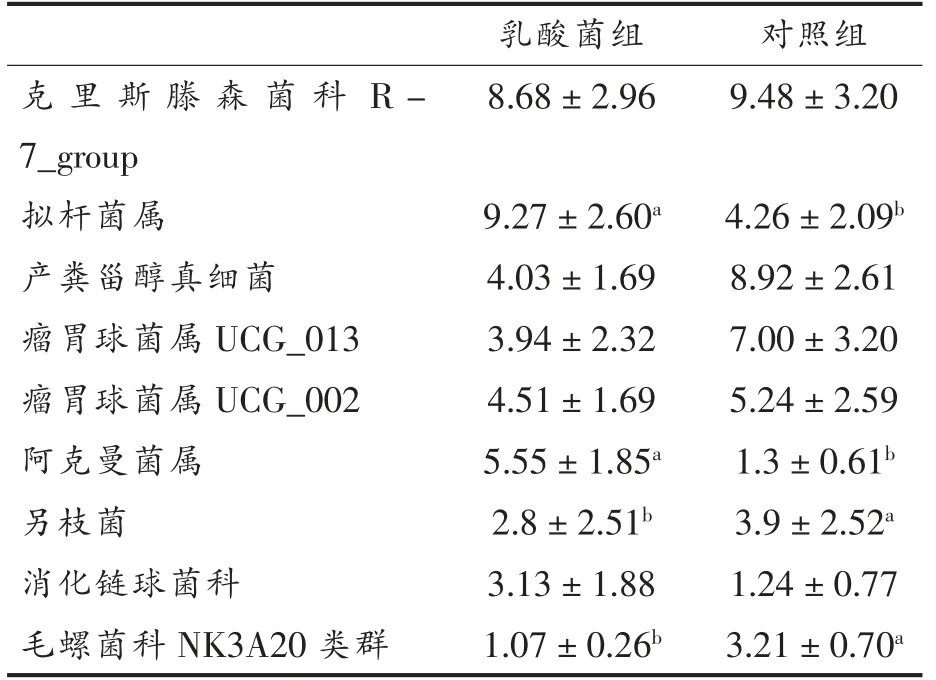
表3 乳酸菌对苏尼特羊盲肠菌群的影响(属水平,%)Table 3 Effect of lactic acid bacteria on the cecal flora of Sunit sheep (genus level, %)
2.4 乳酸菌对苏尼特羊肉品质的影响
肉的pH 值对胴体肌肉中蛋白质降解、 细菌繁殖、肉色、系水力等指标均有影响。 宰后肌肉活动的主要能量来源取决于糖原和磷酸肌酸的分解,其分解产物分别是乳酸、磷酸和肌酸。 由于酸性物质会在肌肉中贮存, 最终导致肌肉的pH 值下降,测定pH 值时间分别为45 min 和24 h。 PSE肉是指动物宰后肌肉出现色泽灰白(pale)、质地松散(soft)和肉表面渗水(exudative),DFD 肉是指动物宰后肌肉颜色暗黑(dark)、质地坚硬(firm)和表面干燥(dry),二者均是劣质肉的主要表现。 pH45min可以鉴别生理正常肉和PSE 肉。而pH24h可以反映羊肉是否成为了DFD 肉,乳酸菌能够在反刍动物瘤胃中进行定植并与其它菌群互作, 生长繁殖过程中还能产生乳酸等酸性代谢产物, 不断增强肠道蠕动,使钙、镁等营养元素处于较易吸收的离子状态。此外,乳酸菌在动物消化系统中会生成一部分活性物质供机体更好地吸收代谢矿物质元素,如活性肽, 能够通过协同螯合作用增加无机钙、镁、铁离子的含量,最终使畜禽肉中钙、镁蓄积[31]。乳酸菌对苏尼特羊肉中pH 值的影响, 如表4 所示。 乳酸菌组pH24h值显著低于对照组,说明乳酸菌可以产生一些酸性代谢产物, 可能增加羊肉中有机微量矿物质含量。
肌肉色泽, 可以作为直观评价肉品好坏的指标。 肌肉颜色变化主要是受到血红素的状态以及铁离子的氧化还原程度的影响, 铁离子的氧化还原能够引起3 种肌红蛋白(Mb)的转化,并在低氧分压下与氧结合生成MbO2, 使得肉色呈鲜红色。然而随着年龄的增加以及饲粮的不同, 动物的肉色会发生变化。 机体内能够自身产生多种抗氧化酶,能够保护机体免受自由基的损伤,自由基数量的减少能够保护肌肉中含磷脂的细胞膜免受脂质过氧化的伤害, 延缓分割肉中肌红蛋白变为高铁血红蛋白的速率[32]。 在乳酸菌的背最长肌的a*值和L*值略高于对照组,b*值在两组中均无显著差异(P>0.05),说明饲喂乳酸菌可以减缓肉色变暗的速度,使得肉质颜色更加鲜红。
肉的嫩度是指肉易切割的程度, 肉的嫩度主要取决于肌肉组织中肌纤维类型的基因表达及肌纤维的类型组成。 pH 值、离子强度和某些外源性酶类都能够影响肌纤维中的肌球蛋白, 使其发生改变。有研究表明肌原纤维的形态、结缔组织以及肌内脂肪的含量对肉的嫩度有着重要的影响[33]。肌肉嫩度增加, 肉质口感变好是由于肌纤维的密度降低,肌肉组织结构较为松散所导致[34]。 乳酸菌组的剪切力显著低于对照组(P<0.05),肉的剪切力值越小,嫩度则越大。饲喂乳酸菌可以改善羊肉的嫩度, 可能是乳酸菌通过调整苏尼特羊肠道菌群结构,影响脂肪酸代谢,进而使肉中脂肪沉积。
熟肉率也是评价肉品质指标之一, 熟肉率越高,表明加热后肉的失重少,水分流失少,缩水率低,乳酸菌组与对照组的熟肉率均无显著差异(P>0.05)。
风味作为肉的营养品质指标能直接影响消费者对羊肉接受程度。 风味由各种有机小分子挥发性物质共同形成,主要包括醛、醇、酮、酯、硫类化合物等[35]。 如表4 所示,醇、醛两类占比最大,乳酸菌组烃类、酮类、酯类以及其它风味物质均显著高于对照组(P<0.05),乳酸菌组的挥发性风味成分优于对照组,使得羊肉的风味品质更好[36]。
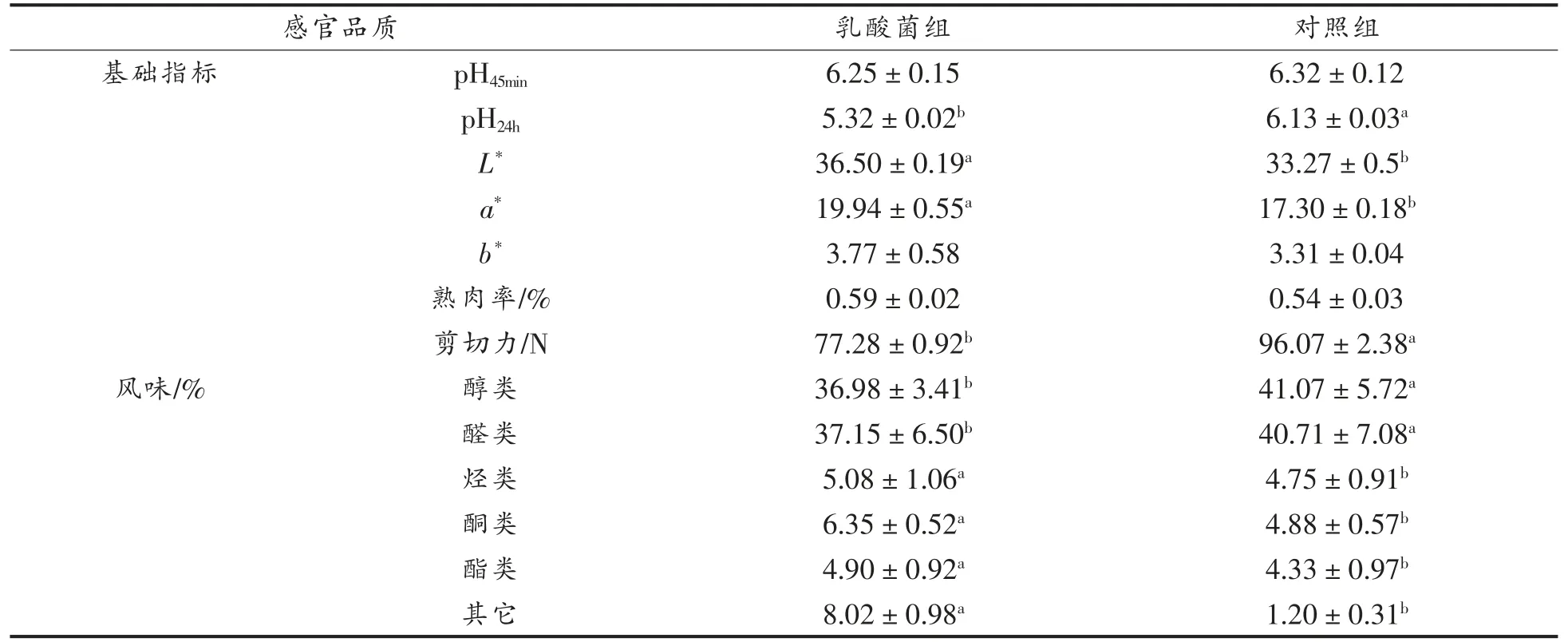
表4 乳酸菌对苏尼特羊肉感官及营养指标的影响Table 4 Effect of lactic acid bacteria on sensory and nutritional indexes of Sunit sheep
氨基酸是肉香味的前体物质以及呈味物质,其种类和比例能衡量羊肉的营养价值, 并维系人体的正常的生命活动。 氨基酸在加热条件下经过脱羧、 脱氨等化学反应, 最终分解形成呈味氨基酸,刺激人体味觉传感器使其具有甜味、苦味、鲜味和酸味, 一般熟知的呈特殊鲜味的氨基酸有谷氨酸、天冬氨酸、苯丙氨酸、丙氨酸、甘氨酸和酪氨酸这6 种[37]。 由表5 可知,乳酸菌组的总氨基酸含量显著高于对照组,羊肉的营养品质得到提高。

表5 乳酸菌对苏尼特羊肉营养品质的影响Table 5 Effect of lactic acid bacteria on nutritional quality of Sunit sheep
必需脂肪酸是人体维持正常代谢不可缺少的,同时必须通过食物供给的脂肪酸,其中n-3 系列多不饱和脂肪酸 (PUFA) 主要包括α-亚麻酸(ALA)、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等。 乳酸菌组中PUFA 以及n-3 PUFA 的含量显著高于对照组(P<0.05),乳酸菌组中EPA的含量显著高于对照组(P<0.05),n-3 多不饱和脂肪酸能通过不同代谢途径降低人体血清中低密度脂蛋白胆固醇和甘油三酯水平, 预防人体心血管疾病和炎症的发生。 花生四烯酸(AA)属于n-6 系列多不饱和脂肪酸, 影响着机体骨代谢以及肉中风味物质的形成, 乳酸菌组AA 含量显著高于对照组(P<0.05)。 本研究中乳酸菌组中多不饱和脂肪酸和单不饱和脂肪酸显著高于对照组 (P<0.05),这与乳酸菌影响肠道菌群代谢产物调控脂肪酸代谢有关。
3 结论
饲粮中添加乳酸菌会使苏尼特羊肠道微生物的组成和结构发生改变, 而肠道菌群代谢产物的改变继而影响肉品质。 整体上乳酸菌组肠道微生物丰富及均匀度更高, 门水平厚壁菌门和拟杆菌门为优势菌群, 属水平拟杆菌属和阿克曼菌属丰度高且均与脂肪代谢有关, 在饲粮中添加乳酸菌还可以显著提高肉的a*红度值、L*亮度值、 降低肉的剪切力、提高肌肉中风味物质、氨基酸以及不饱和脂肪酸的含量,起到改善羊肉品质的效果。
