模拟胃肠道消化对大豆低聚肽结构及抗氧化作用的影响
2022-03-04刘文颖冯晓文赵晓涵潘兴昌谷瑞增
刘文颖, 冯晓文, 赵晓涵, 潘兴昌, 谷瑞增
(1 中国农业大学工学院 北京100083 2 中国食品发酵工业研究院有限公司 北京市蛋白功能肽工程技术研究中心 北京100015)
大豆是一类蛋白质含量较高的植物原料,不仅富含色氨酸、苏氨酸等必需氨基酸,而且氨基酸的构成也符合联合国粮农组织和世界卫生组织所建议的基本食品氨基酸构成模式[1]。大豆中富含许多生物活性成份,具有抗氧化、降低过敏性、降血压、提高矿物质吸收率、防肥胖性、耐疲劳、抗癌等生理功能[2-4]。随着人们膳食观念的提高,有关大豆的科学研究日益深入。 大豆蛋白酶水解产物——大豆低聚肽与大豆蛋白比较, 更易于被机体消化吸收[5],并且具有优异的吸湿性和润透性以及较好的流动性和水溶性等优点[1]。
大豆低聚肽与大豆蛋白有类似的特性, 其抗氧化活性在一定程度上可减少人体肿瘤和心血管疾病的发病率,同时作为天然抗氧化剂,在抗衰老食品、 保健品及食品辅料的开发中具有广阔的前景[6]。 本研究使用胃蛋白酶、胰蛋白酶和先胃蛋白酶后胰蛋白酶处理大豆低聚肽,并分析处理前、后的分子结构变化,如分子质量分布、二级分子结构组成等,以及其抗氧化活性,如DPPH 自由基清除率、ABTS 自由基清除率等,探究胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理对大豆低聚肽结构和抗氧化活性的影响, 为大豆低聚肽的多元化开发提供参考。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白, 北京中食海氏生物技术有限公司;无水乙醇、氢氧化钠、浓盐酸、磷酸二氢钾、磷酸氢二钠、过硫酸钾、醋酸钠,北京化学试剂公司;胰蛋白酶(≥250 NFU/mg),美国Solarbio 公司;胃蛋白酶(≥250 U/mg)、1,1-二苯基-2-三硝基苯肼(DPPH)、2,2-偶氮二(2-甲基丙基咪)二盐酸盐(AAPH)、荧光素(Fluorescein)、水溶性维生素E(Trolox),色谱纯级,美国Sigma 公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS),分析纯级,南京森贝伽生物科技有限公司;2,4,6-三吡啶基-1,3,5-三嗪(TPTZ),酷尔化学科技(北京)有限公司;三氯化铁、硫酸亚铁,广东汕头市西陇化工有限公司。
YG30 型喷雾干燥机, 无锡市阳光干燥设备厂;HH-4 数显恒温水浴锅, 普瑞斯机械有限公司;FE20K 型pH 计,瑞士梅特勒-托利多公司;J-810 圆二色谱仪, 美国Jasco 公司;SpectraMax i3x多功能酶标仪, 美国MD 公司;LC-20AD 型高效液相色谱仪,日本岛津公司;UV-1780 紫外-可见分光光度计,日本SHIMADZU 公司。
1.2 试验方法
1.2.1 大豆低聚肽的制备 基于本中心前期研究的大豆低聚肽制备工艺制备得到大豆低聚肽粉[7]。
1.2.2 体外模拟胃肠道消化试验
1.2.2.1 胃蛋白酶消化试验 移取0.05 g/mL 的大豆低聚肽溶液0.04 L, 调节pH 值至2,37 ℃水浴加热2~3 min 为宜, 后边搅拌边加入3%(E/S)胃蛋白酶(≥250 U/mg),保持37 ℃不变,持续消化3 h,沸水浴灭酶活,得胃蛋白酶消化组样品,简称胃蛋白酶组样品。 同时取20 mL 不做任何处理的样品为未处理组样品[8-9]。
1.2.2.2 胰蛋白酶消化试验 取与胃蛋白酶消化试验等质量浓度的大豆低聚肽溶液0.02 L, 调节pH 值至6.8, 以37 ℃的水浴加热2~3 min 后边搅拌加入3%(E/S)胰蛋白酶(≥250 NFU/mg),其余试验步骤与胃蛋白酶消化试验操作相同, 得胰蛋白酶消化组样品,简称胰蛋白酶组样品[7]。
1.2.2.3 先胃后胰消化试验 取与1.2.2.2 节等体积的胃蛋白酶消化组样品, 进行胰蛋白酶消化处理后,得先胃蛋白酶消化后胰蛋白酶消化的样品,简称先胃后胰组样品[8]。
1.2.3 分子质量分布测定 参照蒋腾川等[10]和Liu 等[11]的方法测定分子质量分布。
1.2.4 紫外全波长扫描 紫外-可见分光光度计扫描波长200~330 nm,狭缝1.0 mm,采样间隔0.5 nm,慢速扫描。 于石英比色皿中加入2/3 体积的2.0 mg/mL 的试样溶液, 再进行紫外全波长扫描[12]。
1.2.5 圆二色光谱扫描 圆二色谱仪光源为氙灯;氮气输出压为0.4 MPa;带宽为1.0 nm;光谱测量范围为180~260 nm;步进0.5 nm;数据点的采集时间间隔为0.25 s。
1.2.6 ABTS 自由基清除能力测定 在离心管中依次加入1.5 mL 的ABTS 储备液和1.5 mL 的过硫酸钾溶液,经遮光处理后,静置一夜,溶液稀释得ABTS 工作液。在标准孔的对应孔依次添加0.2 mL ABTS 工作液和预先配制的各种浓度的Trolox标准溶液; 在样品孔相应孔先后添加0.2 mL ABTS 工作液和10 μL 1 mg/mL 样品溶液;而空白孔对应孔按先后顺序添加0.2 mL ABTS 工作液和10 μL 磷酸盐缓冲溶液(PBS)。25 ℃下遮光处理后反应5 min, 立即测定波长734 nm 处的光密度(OD)值。 依据标准组数据先拟合绘制标准曲线,而后计算样品的ABTS 自由基清除能力[13-14]。
1.2.7 DPPH 自由基清除能力测定 将不同组试样配成5 个梯度质量浓度值, 即1.0,2.0,5.0,10.0,15.0 mg/mL。 在空白组对应的孔中分别依次添加0.1 mL 的样品溶液和0.1 mL 的无水乙醇溶液,并标记为A0;在样品组对应的孔中依次添加0.1 mL 的样品溶液和0.1 mL 的DPPH-无水乙醇溶液,标记为AX;在对照组对应的孔中依次添加0.1 mL 的蒸馏水和0.1 mL 的DPPH-无水乙醇溶液,标记为A1。涡旋混匀3 min,于室温下遮光处理后反应0.5 h,测量波长517 nm 处的吸光值,DPPH自由基清除率按式(1)进行计算[15-17]。

1.2.8 氧自由基吸收能力测定 在避光条件下,标准孔: 各孔分别依次加入25 μL 不同浓度梯度的水溶性维生素E 标准溶液和100 μL 0.8 μmol/L 的荧光指示剂; 空白孔: 各孔分别依次添加25 μL 75 mmol/L PBS 和100 μL 荧光指示剂; 对照孔:各孔中分别依次添加25 μL 的75 mmol/L PBS和100 μL 荧光指示剂;样品孔:各孔分别依次添加25 μL 1 mg/mL 的样品和100 μL 荧光指示剂。各组重复3 个平行。37 ℃遮光处理反应20 min。反应结束后,除在空白孔中添加75 μL PBS,其它各孔迅速添加75 μL 150 mmol/L AAPH 溶液。 测定各组样品的吸光值。 基于标准品的吸光值得到各组样品的ORAC 值[18-19]。
1.2.9 铁还原能力测定 将10 体积的醋酸钠缓冲液与1 体积的TPTZ 和1 体积的氯化铁混合,制备FRAP 工作溶液。 当天配制FRAP 工作溶液,使用前于37 ℃加热10 min。 在空白组相应孔依次添加5 μL PBS; 标准组相应孔依次添加5 μL 不同浓度的FeSO4标准溶液; 样品组对应各孔依次添加5 μL 1 mg/mL 的样品溶液。 在每个试验孔中各加0.18 mL FRAP 工作液。 维持37 ℃条件下反应5 min,593 nm 处测定并计算各孔平均OD 值,再根据标准孔数据可制得标准曲线, 最后计算试样的铁离子还原能力[20-22]。
1.3 数据处理
各组重复3 个平行,将试验结果用平均值±标准偏差表示,使用Origin 8.5 软件作图。
2 结果与分析
2.1 处理前、后的分子质量分布结果
4 组的分子质量分布情况如表1 所示。 与未处理组相比,经胃蛋白酶消化后,不同范围的分子质量分布均未发生显著变化; 经胰蛋白酶消化之后,分子质量5 000~10 000 u 的组分显著减少,减少量高达90.22%, 同时分子质量<1 000 u 的组分有所增加,增加量可达9.94%,表明大豆低聚肽中的大部分大肽段含有够被胰蛋白酶特异识别的序列。经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后大豆低聚肽分子质量<1 000 u 的组分均有所增加, 并且4 组样品主要由分子质量<1 000 u 的组分组成,其中先胃后胰组比例可达88.46%。Zhang 等[23]研究了模拟胃肠道消化对大豆蛋白水解物抗氧化性能的影响, 其<1 000 u 的组分在经模拟胃肠道消化后有所增加,与本试验结果一致[24]。

表1 不同处理的大豆低聚肽的分子质量分布Table 1 Molecular weight distributions of soybean oligopeptides with different treatments
2.2 处理前、后的紫外全波长扫描结果
如图1 所示,4 组样品在波长275 nm 附近均有吸收峰, 其中先胃后胰组的大豆低聚肽的最大吸收峰峰值最大,为1.8677;胃蛋白酶处理组的最大吸收峰峰值最小,为1.6284;未处理组与胰蛋白酶处理组的最大吸收峰峰值几乎一致。 已知色氨酸和酪氨酸的芳杂环π-π*跃迁与波长280 nm 附近峰值的改变有关,4 组试样经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后, 不同组试样在波长280 nm 附近峰值均不同,表明溶液中色氨酸及酪氨酸残基上的芳杂环π-π*进行了跃迁,由此使得不同处理组的峰值有所差异[25]。

图1 不同处理大豆低聚肽的紫外全波长扫描Fig.1 UV full wave length scanning of soybean oligopeptides with different treatments
2.3 处理前、后的圆二色光谱扫描结果
图2 为4 组大豆低聚肽的圆二色光谱图。 表2 为CDNN 2.1-Simple Spectra 软件分析大豆低聚肽的圆二色光谱图所得的二级结构组成。 与未处理组相比,经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后,大豆低聚肽中α-螺旋和反平行式β-折叠所占比例虽增加, 但所占比例较低;平行式β-折叠、β-转角及无规则卷曲所占比例虽略微降低, 但仍为主要组成部分。 无规则卷曲较α-螺旋和β-折叠相比稳定性及结构紧密性较差,从而表明大豆低聚肽的分子无序性较高且结构疏松开放[26]。
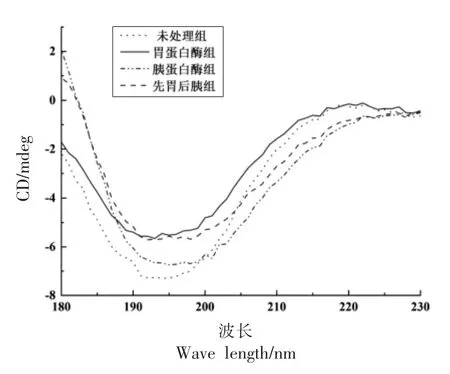
图2 不同处理大豆低聚肽的圆二色光谱图Fig.2 Circular dichroism spectrogram of soybean oligopeptides with different treatments

表2 不同处理大豆低聚肽的二级结构Table 2 Secondary structures of soybean oligopeptides with different treatments
2.4 处理前、后的ABTS 自由基清除能力
图3 是以不同浓度Trolox 标准溶液及相应的OD 值绘制的ABTS 标准曲线,拟合得到标准方程y=-0.54192x+1.13499,R2=0.99509。 将4 组大豆低聚肽的OD 值代入标准曲线表达式可得对应的ABTS 自由基清除率,结果如图4 所示。 通过分析可知,经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后, 大豆低聚肽的ABTS 自由基清除能力具有极好的稳定性。ABTS 自由基的清除与某些能提供质子、 还原具有氧化性自由基的氨基酸相关,消化前、后大豆低聚肽的ABTS 自由基清除率未发生变化的原因可能是消化前、 后溶液中能够起到提供质子、 还原具有氧化性自由基的氨基酸前后变化量不大[27]。

图3 ABTS 标准曲线Fig.3 ABTS standard curve

图4 不同处理大豆低聚肽的ABTS 自由基清除能力Fig.4 ABTS free radical scavenging capacity of soybean oligopeptides with different treatments
2.5 处理前、后的DPPH 自由基清除能力
图5 为各组大豆低聚肽的DPPH 自由基清除率。结果显示,胃蛋白酶对DPPH 自由基的清除活性几乎没有影响, 只在质量浓度为5 mg/mL 时略有提高,在其它质量浓度时无显著变化。而胰蛋白酶处理显著减少了大豆低聚肽的DPPH 自由基清除率(P<0.05),这可能是因为酶解进一步将形成的抗氧化肽分解为低或无抗氧化活性的小肽或氨基酸。Yang 等[17]以酱油槽为原料,用碱性蛋白酶水解酱油渣中的蛋白质得水解产物, 水解产物的DPPH 自由基清除率大小与浓度呈正相关性,与本试验结果一致。
2.6 处理前、后的氧自由基吸收能力
不同浓度水溶性维生素E 的动态荧光衰减曲线如图6 所示,经计算所得标准曲线见图7,相应的表达式为y = 0.03548x+0.62965,R2= 0.99765。根据上述表达式可得4 组大豆低聚肽的ORAC值,如图8 所示。与未消化组相比,经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后, 大豆低聚肽的ORAC 值均极显著升高(P<0.01),这可能是由于胃、 胰蛋白酶消化使得大豆低聚肽中的一些肽段发生破坏,生成小肽片段(三肽或二肽),而某些分子质量越小的肽片段抗氧化活性就越强,并且暴露出更多活性基团, 从而使ORAC 值提高[28-29]。其中经胃蛋白酶作用后的大豆低聚肽酶解物在经过胰蛋白酶的水解后, 断裂生成了具有抗氧化活性的多肽片段, 从而使得先胃后胰组ORAC 值变化最大。

图6 不同浓度水溶性维生素E 的动态荧光衰减曲线Fig.6 Dynamic fluorescence attenuation curves of trolox at different concentrations

图7 水溶性维生素E 标准曲线Fig.7 Trolox standard curve

图8 不同处理大豆低聚肽的ORAC 值Fig.8 ORAC values of soybean oligopeptides with different treatments
2.7 处理前、后的铁离子还原能力
基于不同浓度FeSO4标准溶液及所测得的OD 值得到FRAP 标准曲线,如图9 所示,其表达式为y=0.26247x+0.026(R2=0.99197),将不同处理组样品的OD 值代入标准方程, 即便得相应的FRAP 值,如表3 所示。与未处理组相比,经胃蛋白酶、 胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后的大豆低聚肽的FRAP 值均有所提高, 造成这一结果的原因可能是经胃蛋白酶、 胰蛋白酶及先胃蛋白酶后胰蛋白酶处理使得具有还原能力的氨基酸残基暴露出来,从而使得消化后大豆低聚肽FRAP值有一定程度的升高[30]。吴丽英[31]研究了玛咖蛋白体外消化产物的总还原能力, 结果表明随着玛咖蛋白的消化时间增加,消化程度加深,分子质量变小,铁离子还原力增强,这一变化趋势与大豆低聚肽的试验结果一致。
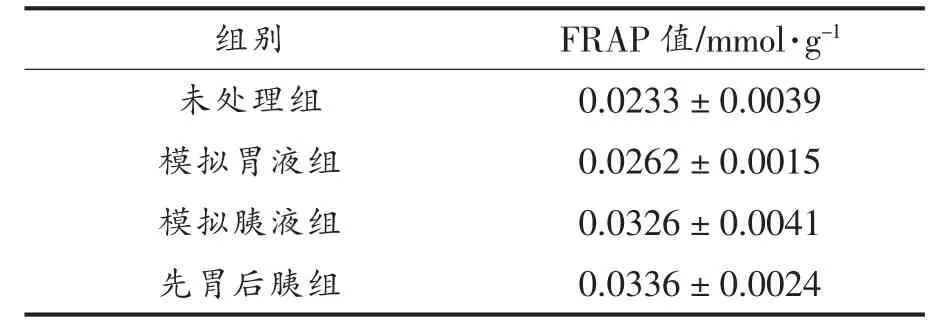
表3 不同处理大豆低聚肽的FRAP 值Table 3 FRAP values of soybean oligopeptides with different treatments
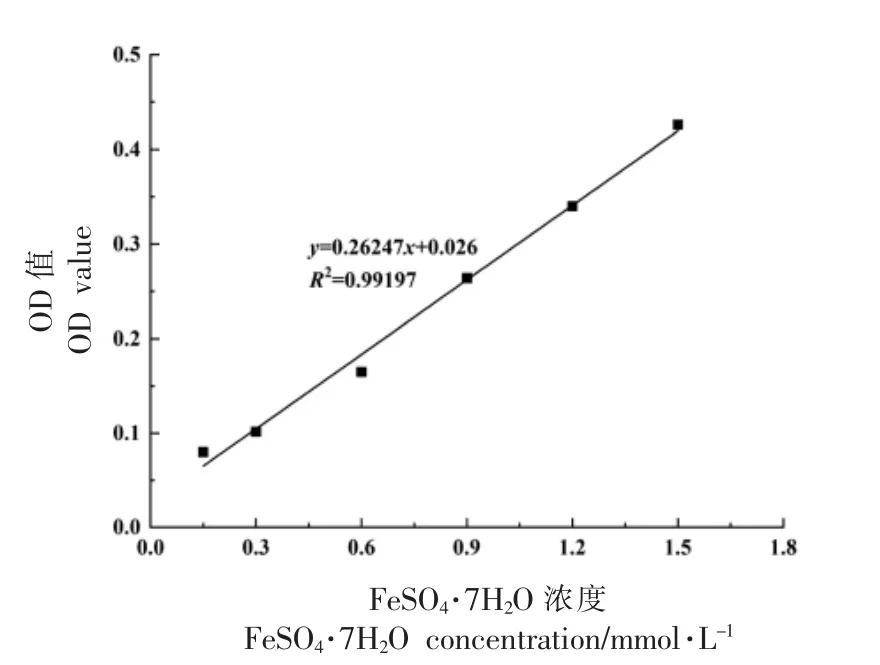
图9 FRAP 标准曲线Fig.9 FRAP standard curve
3 结论
本文研究胃蛋白酶、 胰蛋白酶及先胃蛋白酶后胰蛋白酶处理对大豆低聚肽结构和抗氧化活性的影响。 结果显示,胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理前、后,大豆低聚肽的分子质量分布主要为<1 000 u 的组分 (比例可达88.46%),且大豆低聚肽对胃蛋白酶消化具有较好的稳定能力,而经胰蛋白酶处理后,分子质量>5 000 u 的肽段发生显著降低,表明在>5 000 u 的肽段的组分中, 含有了许多能被胰蛋白酶识别和水解的肽段序列;紫外全波长扫描结果显示,通过胃蛋白酶和胰蛋白酶消化作用, 使得大豆低聚肽内部出现了电子跃迁;圆二色光谱扫描结果表明,大豆低聚肽的分子无序性较高,结构疏松开放。
测定大豆低聚肽的抗氧化能力发现, 胃蛋白酶对DPPH 自由基的清除活性几乎没有影响,而胰蛋白酶处理显著降低了大豆低聚肽的DPPH 自由基清除率(P<0.05)。 推测造成这一现象的可能原因是酶解进一步将形成的抗氧化肽分解为低或无抗氧化活性的小肽或氨基酸, 从而降低了DPPH 自由基清除活性;ABTS 自由基清除率结果表明大豆低聚肽的ABTS 自由基清除率几乎不受胰蛋白酶和胃蛋白酶的影响;胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理使铁还原能力和氧自由基吸收能力提高,其原因是:经胃蛋白酶、胰蛋白酶及先胃蛋白酶后胰蛋白酶处理后分子质量小于1 000 u 的组分均增加以及具有还原能力的氨基酸残基暴露出来, 从而使得处理后的还原能力和氧自由基吸收能力增强。
上述结果说明了经胃蛋白酶、 胰蛋白酶及先胃蛋白酶后胰蛋白酶处理虽使大豆低聚肽的结构发生了一定的变化, 但仍表现出较好的抗氧化活性并且有一定程度的增强, 这为大豆蛋白的多元化开发提供了理论基础。
