厄洛替尼联合吉西他滨治疗胰腺癌疗效与安全性Meta分析*
2022-03-03卫武吴冰洁仲飞
卫武,吴冰洁,仲飞
(1.安徽医科大学第一附属医院肿瘤科,合肥 230031;2.安徽医科大学附属阜阳医院肿瘤科,阜阳 236000)
胰腺癌是常见的消化道恶性肿瘤,侵袭性强,治疗效果不佳,5年生存率约8%[1]。自1997年以来,吉西他滨(gemcitabine)一直作为胰腺癌化学治疗(化疗)一线选择[2],以吉西他滨为基础的联合治疗方案也一直在探索之中[3-6]。厄洛替尼(erlotinib)抑制细胞内与表皮生长因子受体(epidermal growth factor receptor,EGFR)相关的酪氨酸激酶的磷酸化作用[7],2005年经FDA批准用于治疗胰腺癌。厄洛替尼联合吉西他滨较传统化疗治疗胰腺癌是否具有显著优势一直存在争议,多项前瞻性临床随机对照试验(randomized controlled trial,RCT)的结论并不一致[8-13]。笔者在本研究通过Meta分析比较厄洛替尼联合吉西他滨与吉西他滨单药治疗胰腺癌的疗效和安全性,以期为选择临床治疗策略提供参考。
1 资料与方法
1.1文献检索策略 采用主题词和关键词相结合的方法,以“胰腺癌”“厄洛替尼”“吉西他滨”为检索词,计算机检索中国知网、万方数据库、维普期刊库;以“pancreatic cancer”“pancreatic adenocarcinoma”“erlotinib”“gemcitabine”为检索词,检索PubMed、EBSCO、Web of Science数据库有关厄洛替尼联合吉西他滨与吉西他滨单药治疗胰腺癌RCT文献。检索时间均为建库至2020年3月。
1.2文献纳入和排除标准
1.2.1纳入标准 ①研究对象:病理学诊断胰腺癌的患者;②研究类型:RCT;③比较厄洛替尼联合吉西他滨与吉西他滨单药治疗胰腺癌的中英文文献;④结局指标至少包含疾病控制率(disease control rate,DCR)、总生存期(overall survival,OS)、无进展生存期(progression free survival,PFS)、无病生存期(disease free survival,DFS)及3/4级不良反应(adverse events,AEs)中的一项结局指标,且可以直接或间接获得效应量的文献。
1.2.2排除标准 ①重复发表的文献;②综述、系统评价文献;③回顾性研究;④无法提取结局指标的文献。
1.3文献筛选、资料提取及文献质量评价 由2名研究者依据上述纳入和排除标准独立筛选文献、数据提取及文献质量评价,如遇分歧讨论解决。提取资料包括:第一作者、发表年份、试验组和对照组病例数量、干预措施、结局指标等。采用Cochrane系统评价手册5.1.0版作为纳入RCT研究质量的评价标准,质量评价包括以下几个方面:①随机序列的产生;②分配方案隐藏;③研究过程中盲法的采用(受试者、干预提供者、结果评价者);④数据完整性;⑤是否选择性报告研究结果;⑥其他偏倚来源。针对每项研究结果,对上述内容做出“低风险”“高风险”和“风险不清楚”判断。
1.4统计学方法 采用RevMan 5.3版软件进行Meta分析。各纳入研究间的异质性分析采用Q检验,以I2作为统计量,若P>0.1,I2≤50%,则采用固定效应模型进行分析;若P≤0.1,I2>50%,则分析异质性来源,采用随机效应模型进行分析。OS、PFS及DFS使用风险比(hazard ratio,HR)及其95%置信区间(confidence interval,CI)作为效应分析统计量,若原文献中未给出HR及其95%CI,则使用TIERNEY等[8]方法通过Engauge Digitizer从生存曲线中提取数据后获得。DCR及3/4级不良反应使用相对危险度(relative risk,RR)及其95%CI作为效应分析统计量,Meta分析的检验水准为α=0.05。
2 结果
2.1文献筛选流程及纳入文献的基本特征 依据上述纳入和排除标准筛选文献,最终纳入RCT 7项[9-15],见图1。共入组胰腺癌患者2011例。其中ABRAMS等[9]、SINN等[10]的研究为胰腺癌术后厄洛替尼联合吉西他滨辅助化疗,MOORE等[12]、WANG等[13]、HAMMEL等[11]、沈俊等[14]及过雪丹等[15]的研究为厄洛替尼联合吉西他滨化疗局部进展期或转移性胰腺癌。纳入文献的基本特征见表1。

图1 文献筛选流程
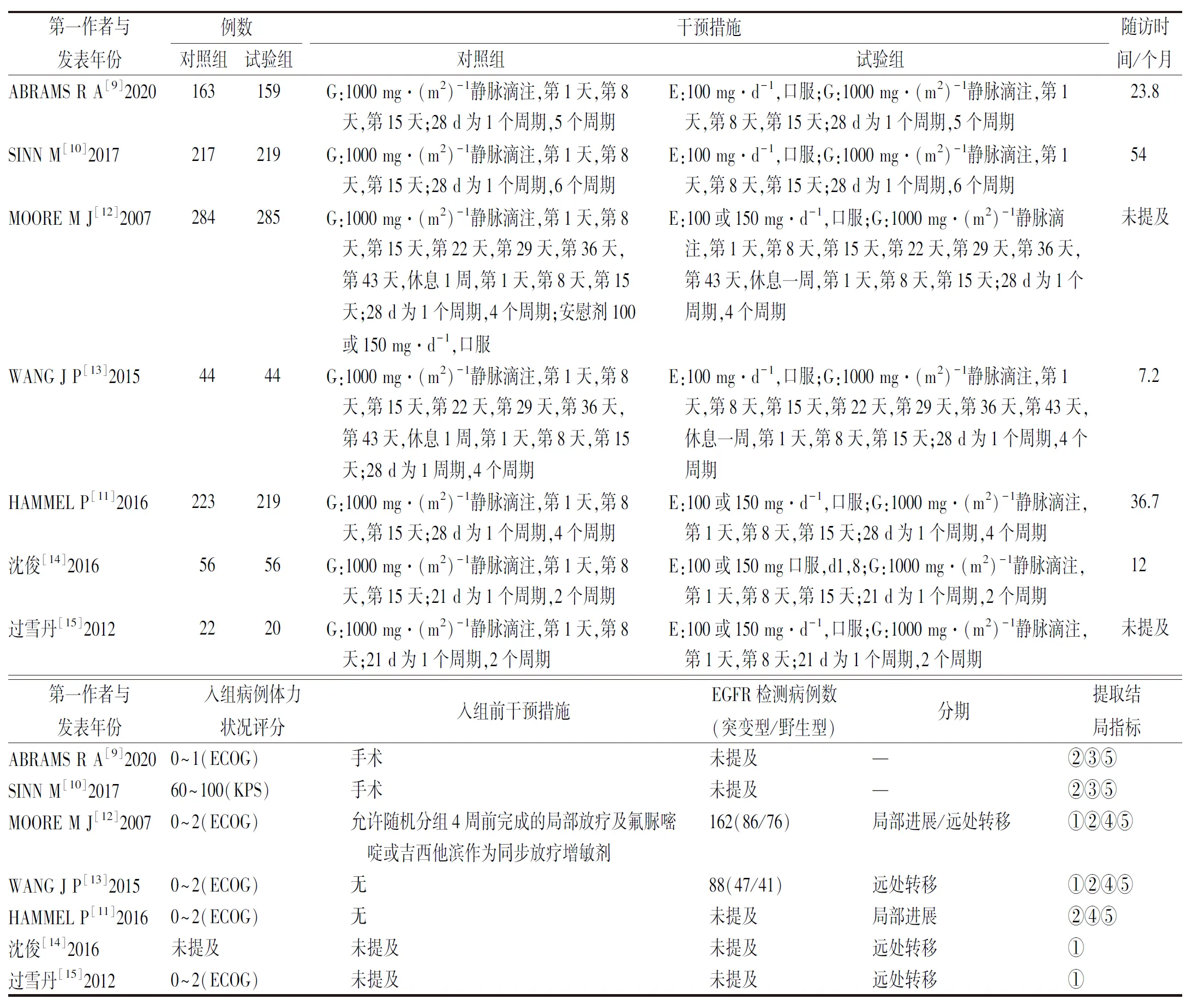
表1 纳入文献的基本特征
2.2纳入研究的质量评价 根据Cochrane Handbook5.1.0版手册的偏倚风险评估标准,对纳入文献的质量进行评价,包括随机序列的产生、盲法的采用、分配隐藏、数据完整性、选择性报告结果和其他偏倚来源。结果见图2。

图2 纳入文献质量评价结果
2.3Meta分析结果
2.3.1DCR的Meta分析结果 7项研究中有1项研究直接提供了试验组对比对照组的DCR,3项研究通过文中报告的完全缓解、部分缓解和病变稳定的病例数据间接获得DCR数据[13-15]。异质性检验:P=0.03,I2=67%,使用随机效应模型合并效应量。结果显示,RR=1.44,95%CI(1.11,1.88),试验组与对照组比较,DCR差异有统计学意义(P=0.006)。见图3。
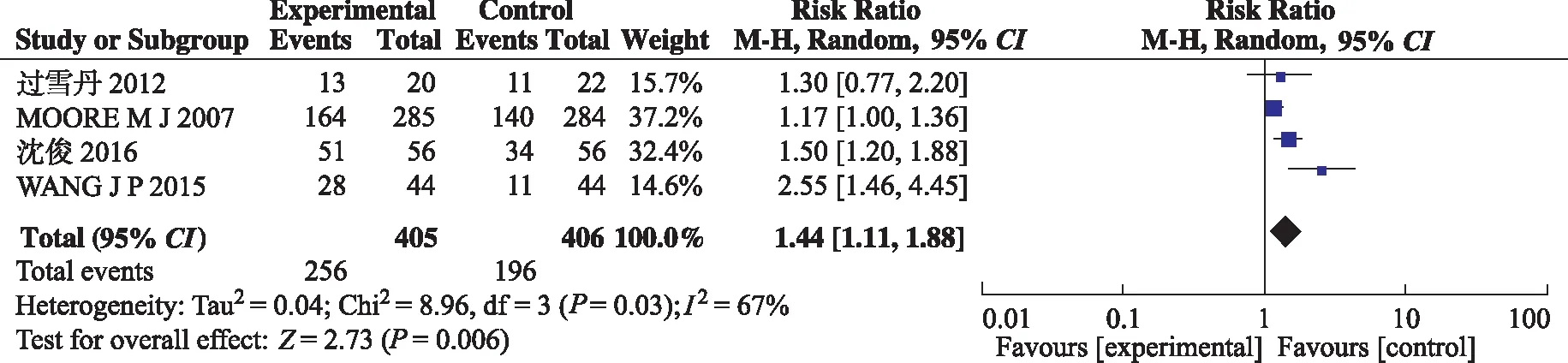
图3 两组DCR比较的Meta分析
2.3.2OS的Meta分析结果 7项研究中有3项研究直接提供了试验组对比对照组OS的HR及95%CI,2项研究采用TIERNEY等[8]方法通过Engauge Digitizer从生存曲线中提取数据后获得OS数据,SINN等[10]和WANG等[13]的研究经提取数据后所得OS的HR及95%CI分别为0.92(0.73,1.15),0.48(0.30,0.78)。异质性检验显示纳入研究的异质性较大(P=0.004,I2=74%),使用随机效应模型合并效应量。结果显示,HR=0.90,95%CI(0.73,1.12),试验组与对照组OS比较,差异无统计学意义(P=0.34)。见图4。
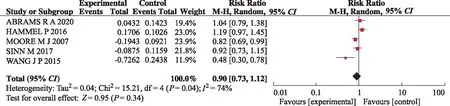
图4 两组OS比较的Meta分析
2.3.3DFS的Meta分析结果 7项研究中有2项研究为胰腺癌术后厄洛替尼联合吉西他滨辅助化疗,均直接提供了试验组对比对照组DFS的HR及95%CI,异质性检验:P=0.59,I2=0%,使用固定效应模型合并效应量。结果显示,HR=0.97,95%CI(0.83,1.14),试验组与对照组DFS比较,差异无统计学意义(P=0.72)。见图5。
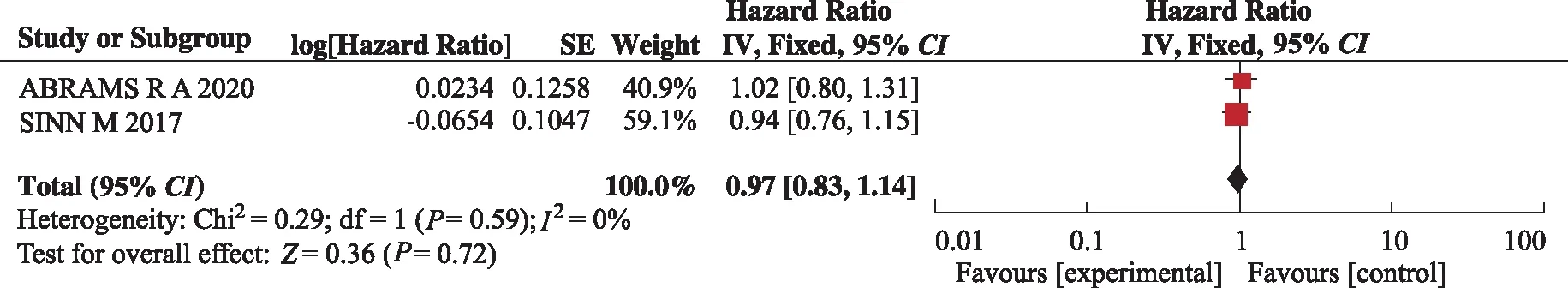
图5 两组DFS比较的Meta分析
2.3.4PFS的Meta分析结果 7项研究中有2项研究直接提供了试验组对比对照组PFS的HR及95%CI,WANG等[13]的研究采用TIERNEY等[8]的方法,通过Engauge Digitizer从生存曲线中提取数据后所得PFS的HR及95%CI为0.53(0.34,0.81)。异质性检验:P=0.001,I2=85%,使用随机效应模型合并效应量。结果显示,HR=0.80,95%CI(0.56,1.15),试验组与对照组PFS比较,差异无统计学意义(P=0.23)。见图6。

图6 两组PFS比较的Meta分析
2.3.53/4级不良反应Meta分析结果 7项研究中有5项研究直接报告了3/4级不良反应。Meta分析结果显示,试验组引发3/4级腹泻[RR=3.85,95%CI(2.22,6.68),P<0.000 01]和皮疹[RR=7.70,95%CI(3.19,18.62),P<0.000 01]的风险显著高于对照组,而3/4级中性粒细胞减少[RR=1.02,95%CI(0.87,1.20),P=0.81]、血小板减少[RR=1.21,95%CI(0.82,1.80),P=0.34]、疲劳[RR=1.12,95%CI(0.78,1.61),P=0.55]、恶心[RR=1.48,95%CI(0.55,3.97),P=0.43]的发生风险与对照组比较,差异无统计学意义。见表2。
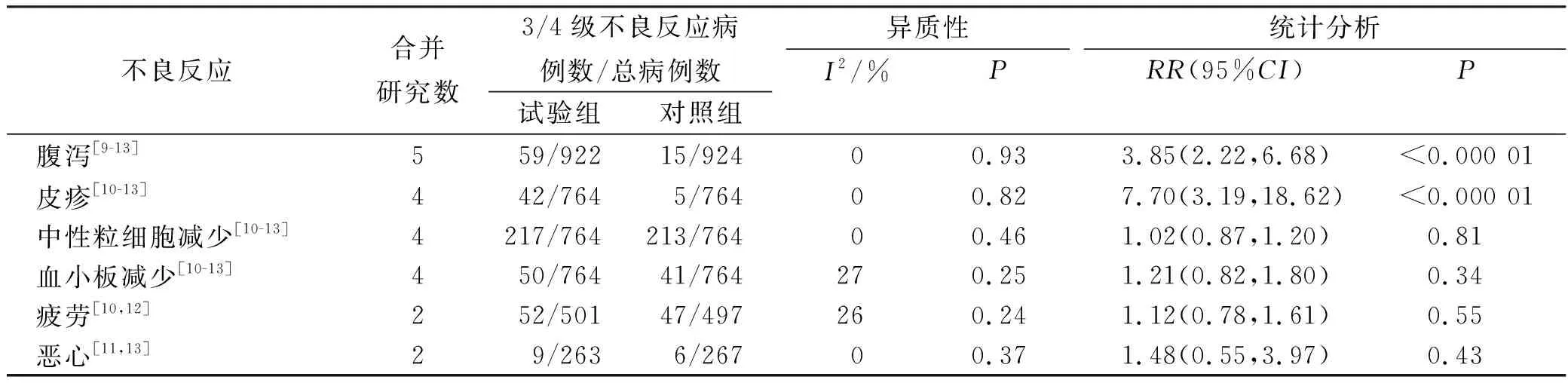
表2 两组3/4级不良反应Meta 分析
2.3.6以OS为结局指标亚组分析 因图4异质性检验提示纳入研究间存在明显异质性(P=0.004,I2=74%),合并分析共有5项研究,以OS为指标进行亚组分析。分别以EGFR突变型和野生型为亚组,术后辅助治疗和非术后辅助治疗为亚组及局部进展或远处转移性胰腺癌分期为亚组,异质性检验显示,研究间异质性均有减小。Meta分析结果显示,无论肿瘤EGFR为突变型[HR=0.56,95%CI(0.25,1.25),P=0.16]或野生型[HR=0.84,95%CI(0.57,1.26,P=0.40][12-13],术后辅助治疗[HR=0.97,95%CI(0.81,1.15),P=0.69][9-10]或非术后辅助治疗[HR=0.82,95%CI(0.56,1.22),P=0.33][11-13],局部进展期[HR=1.13,95%CI(0.94,1.35),P=0.18][11-12]或远处转移[HR=0.65,95%CI(0.41~1.05),P=0.08][12-13],两组OS比较,均差异无统计学意义。见表3。
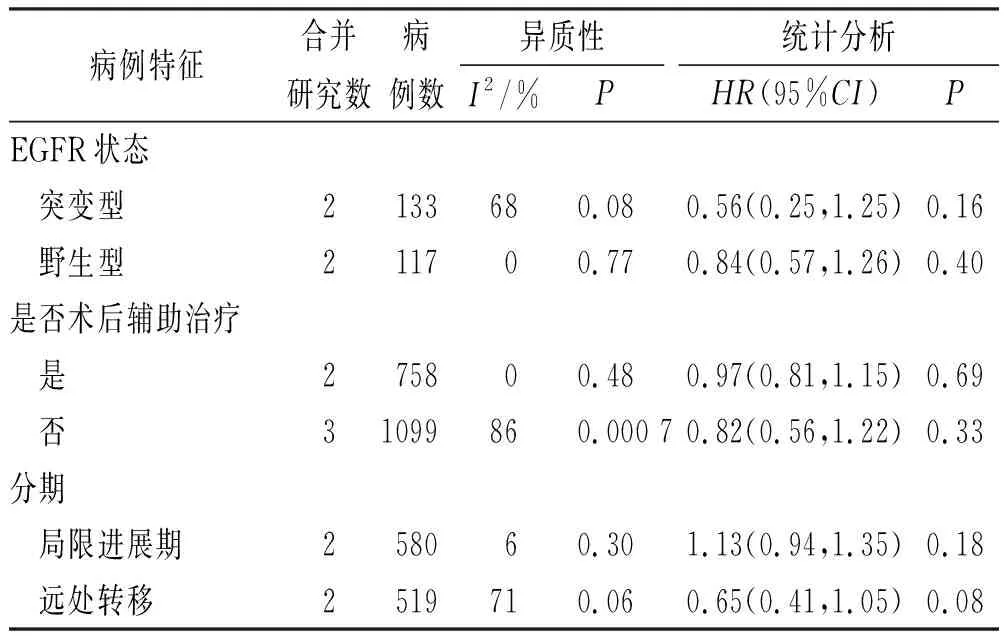
表 3 两组总生存期亚组分析
3 讨论
胰腺癌患者确诊时大多为中晚期,15%~20%患者可行根治性手术,但术后复发转移率高[16-17]。因此,无论是胰腺癌中晚期或根治术后的患者,均需要进一步内科治疗,而厄洛替尼联合吉西他滨治疗胰腺癌较单药吉西他滨是否具有显著优势仍然存在分歧。MOORE等[12]2007年发表1项Ⅲ期临床RCT,该研究将569例局部进展或远处转移性胰腺癌患者按1:1比例随机分为两组,分别接受厄洛替尼联合吉西他滨、单药吉西他滨治疗,结果显示两组中位OS分别为6.24个月和5.91个月(P=0.038),联合治疗较单药吉西他滨显示出更好的生存获益。尽管该研究取得了阳性结果,但试验组生存获益极其有限,且与后续多项前瞻性临床RCT结论并不一致。例如HAMMEL等[11]在2016年发表的Ⅲ期临床RCT LAP07研究中,共纳入局部进展期胰腺癌患者442例,试验组和对照组分别接受厄洛替尼联合吉西他滨和单药吉西他滨治疗,结果显示两组中位OS分别为11.9个月和13.6个月(P=0.09),差异无统计学意义。因此,本次研究采用Meta分析现有临床研究,比较联合治疗与单药吉西他滨治疗胰腺癌的疗效和安全性。
本次纳入的7项研究中,ABRAMS等[9]、SINN等[10]的研究入组病例均为胰腺癌术后,另5项为局部进展或远处转移性胰腺癌。Meta分析结果显示,联合用药组较单药吉西他滨组在DCR指标上显示出显著优势,但在OS、DFS及PFS指标上却无获益。亚组分析显示,无论肿瘤的EGFR状态是突变型或野生型、局部进展期或远处转移、是否为术后辅助治疗,联合用药组较单药吉西他滨组在OS上均无获益。5项研究报告了3/4级不良反应。Meta分析结果显示,厄洛替尼联合吉西他滨组引发3/4级腹泻和皮疹的风险显著高于单药吉西他滨组。
本研究的局限性:①检索文献仅限中、英文文献,纳入的RCT研究较少,纳入研究的样本量小;②原始研究纳入病例的肿瘤分期存在差异或缺少相关信息;③仅有2项研究报道了EGFR突变状态相关生存数据,2项研究通过生存曲线提取数据,3项研究通过文中报告的完全缓解、部分缓解和病变稳定的病例数据间接获得DCR数据;④不同研究间给药方法及疗程存在差异;⑤不同研究间入组病例体力状况评分标准差异或缺如;⑥纳入研究间随访时间不同,且差异较大,2项研究没有随访或无记录。由于存在上述临床及方法学异质性,分层分析又存在样本量少等问题,因此,本次研究的结论仍有待临床进一步验证。
综上所述,厄洛替尼与吉西他滨联合用药较单药吉西他滨治疗胰腺癌可以提高疾病控制率,但不能提高生存获益,且可增加3/4级腹泻及皮疹的风险。因此,临床应用厄洛替尼联合吉西他滨治疗胰腺癌应明确治疗目标,权衡厄洛替尼联合吉西他滨治疗胰腺癌患者的获益与风险,充分评估患者对相关不良反应的耐受性。
