白头翁皂苷对大鼠肠道菌群组成及多样性的影响*
2022-03-03刘亚丽周明月宋永贵周志炜谢明敏徐贞权李泽协关志宇张凌王萌苏丹
刘亚丽,周明月,宋永贵,周志炜,谢明敏,徐贞权,李泽协,关志宇,张凌,王萌,苏丹
(江西中医药大学1.科技学院;2.药学院,南昌 330004)
白头翁为毛茛科植物白头翁[Pulsatillachinensis(Bunge)Regel]的干燥根,广泛应用于中医临床,具有较好的退热作用,与板蓝根、金银花等同为 “清热解毒,凉血止痢”传统中药[1]。近年来,国内外对白头翁有效成分进行了较深入研究[2-4],发现其抗肿瘤[5]和抗血吸虫活性显著,抗氧化作用强,抗炎作用明确,可以有效抑菌、杀虫,该药应用范围日益广泛[6]。皂苷是中药中常见的一大类生物活性物质,近年越来越受到国内外学者的关注[7-9]。YU等[10]曾对中药皂苷类化合物的药动学研究现状进行过详细归纳和总结,涉及人参皂苷、甘草皂苷、薯蓣皂苷、黄芪皂苷和柴胡皂苷等。中草药口服后某些成分经肠道菌群降解生成苷元而发挥药理作用,这类药被认为是天然前体药物[11],只有较小部分以原型形式被吸收,体内环境中肠道菌群是完成中药有效成分代谢的重要因素之一[12]。近年来大量研究表明,肠道菌群在调节宿主营养与代谢、维持肠道微生态系统平衡、调节机体免疫系统和抑制肿瘤发生发展等方面,发挥着极其重要的作用[13]。此外,肠道菌群能够产生不同种类药物代谢酶,不同代谢酶参与各种不同类型药物代谢,从而改变药物作用趋向,包括药效改变、发生毒性反应等[14-15]。相对于传统肝脏和肠道黏膜药物代谢场所,肠道菌群最先直接与口服药物接触,己被认为是影响药物代谢的“器官”,研究药物在肠道菌群的处置对于理解其在体内的作用机制具有重要意义。笔者所在课题组前期对白头翁总皂苷进行分离鉴定和构效关系研究,发现齐墩果烷母核的白头翁皂苷为其主要活性成分。由于皂苷类物质在体内代谢转化器和酶系的多样性作用下其代谢产物在体内的浓度较低,肠内滞留时间长,易受到肠道菌群的作用[16]。笔者在本实验采用16S核糖体RNA(16S rRNA)高通量测序分析方法,研究白头翁皂苷对肠道菌群组成和多样性的影响,以期为白头翁皂苷的应用研究提供数据基础。
1 材料与方法
1.1实验动物 清洁级Sprague-Dawley (SD)雄性大鼠,体质量 (200±20)g,由江西中医药大学实验动物中心提供,实验动物生产许可证号:SCXK(赣)2018-003,实验动物使用许可证号:SYXK(赣)2017-0004。饲养室温度:(22±2) ℃,相对湿度:(50±20)%。自然光-暗循环饲养3 d,动物实验按照国家科学技术委员会《实验动物管理条例》规定进行。
1.2药品与试剂 白头翁根购自苏州一家中药店,由苏州大学药学院李笑然教授鉴定为毛茛科白头翁属植物白头翁Pulsatillachinensis (Bge.) Regel的干燥根。羧甲基纤维素钠(CMC-Na,作为白头翁皂苷的助溶剂),天津市福晨化学试剂厂提供,批号:20161202,净含量500 g。
1.3白头翁总皂苷提取物的制备 白头翁皂苷为笔者所在实验室 (中药固体制造技术国家工程研究中心天然药物部) 提取。回流条件下,70%乙醇萃取干燥的植物材料(2.5 kg)3次,减压干燥提取物。D101树脂柱上对残余物(280 g)进行色谱分析,水-乙醇梯度洗脱,组合用60%乙醇洗脱部分,冻干,获得粉末(125 g)[17],纯度75.1%。
1.4仪器与设备 HH-S数显恒温水浴锅(江苏省金坛市医疗仪器厂);SZ-93自动双重水蒸馏器(上海雅荣生化仪器设备有限公司);DT5-3 型低速台式自动平衡离心机(北京时代北利离心有限公司);IKA 涡旋仪(北京金达阳光科技有限公司);KQ3200E 型超声波仪(上海巴玖实业有限公司);AxyPrepDNA凝胶回收试剂盒(AXYGEN公司);QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)。
1.5动物的分组与处理 取清洁级SD雄性大鼠12只,适应性喂养3 d,因实验所用大鼠为同一批出生日期,且体质量均匀,均通过屏障内动物检疫,按照随机数目分组法分为对照组和给药组各6只。对照组给予空白溶剂(羧甲基纤维素钠溶液),给药组给予白头翁皂苷(将白头翁皂苷溶解于0.5% 羧甲基纤维素钠),300 mg·kg-1,均连续灌胃7 d。
1.6样品的处理
1.6.1样品的采集 实验结束时,在无菌操作台上取大鼠粪便标本。具体操作步骤为:戴一次性无菌手套,右手抓取大鼠,75%乙醇消毒其肛周部位,无菌棉签轻柔按摩大鼠腹部,刺激大鼠排便,使用灭菌镊子尽量从大鼠肛门口部直接夹取粪便,迅速保存至已消毒的自封袋并做好标记,取粪便时大鼠正下方摆放灭菌称量纸,以防止粪便不能及时夹取而落地受到污染,粪便收集后在30 min 内放入-80 ℃低温冰箱保存,每次收集1或2粒完整粪便,大鼠粪便保存在干冰中,寄送至上海美吉生物医药科技有限公司,委托该公司进行16S rRNA基因测序。
1.6.2目的基因的聚合酶链反应(PCR)扩增与测序 根据细菌通用引物338F (5′-ACTC-CTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA V3-V4可变区进行PCR扩增。将同一样本的PCR产物混合,2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,利用Illumina 公司的 MiSeqPE300 平台进行测序,原始数据上传至国家生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库。
1.6.3生物信息学分析 Miseq测序得到的PE reads首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行操作分类单元(operational taxonomic units,OTU),聚类分析和物种分类学分析,基于OTU聚类分析结果,对OTU进行多种多样性指数分析,以及对测序深度检测;基于分类学信息,在各个分类水平上进行群落结构统计分析。
1.7统计学方法 基于群落组成信息,进行OTU分析、稀释曲线分析、丰度等级曲线分析、ANOSIM/Adonis分析,得样本的丰富度和均匀度,说明分组的科学意义;通过Venn图分析、Beta多样性层级聚类分析和主坐标分析以及组间差异显著性检验等,进一步比较2组大鼠肠道菌群组成结构和丰度,反映不同分组的肠道菌群间差异。
2 结果
2.1可行性分析 本次测序选择97%相似度的OTU,绘制稀释曲线,结果见图1。由图1可知,样本曲线趋于平缓且分布较集中,说明测序数据量足够大,可以反映样本中绝大多数微生物信息。
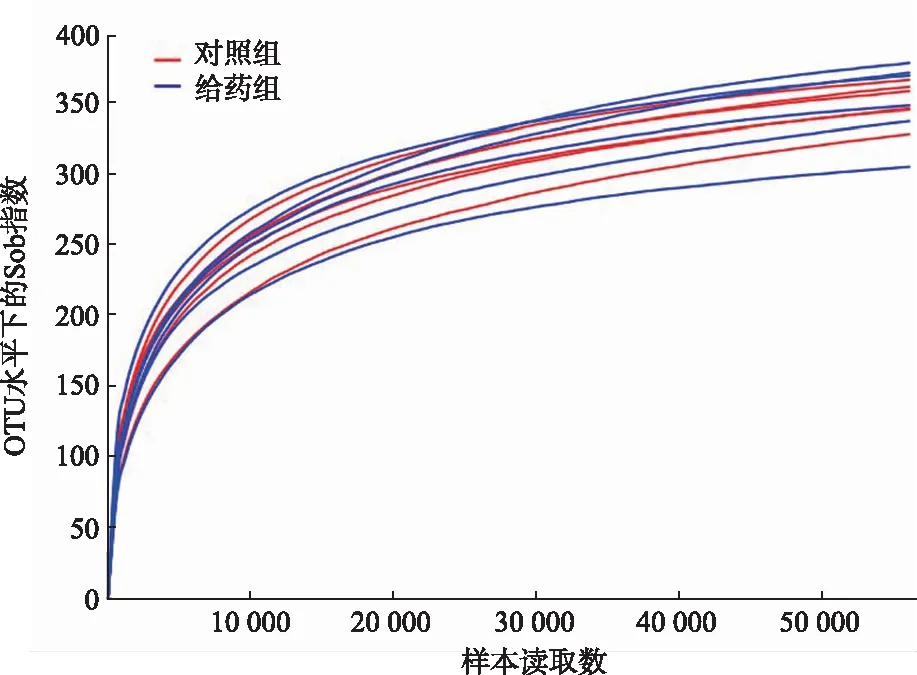
图1 大鼠粪便样品稀释曲线
为证实本次测序的多样性达到实验要求,绘制丰度等级曲线,见图2。由图2可知,所有样品水平宽度较宽,下降趋势平缓,说明本次样品物种丰度和均匀度较好。
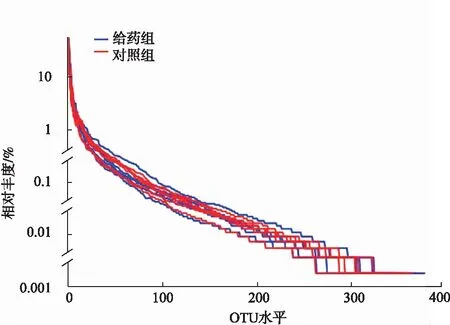
图2 大鼠粪样品菌群等级丰度曲线
2.2ANOSIM/Adonis分析 通过ANOSIM/Adonis分析可以检验组间差异是否大于组内差异,判断实验分组是否有意义。由图3可知,组间距离值大于组内距离值,说明本实验分组组间差异大于组内差异,分组有科学意义。

图3 ANOSIM/Adonis分析结果
2.3β多样性分析 采用β多样性分析比较不同样本间微生物群落间差异,结果见图4。由图4可知每个样本距离远近,除k3样本和Y2样本显示个体差异外,其他样本根据树枝的距离可以划分出不同分组。

图4 大鼠粪样品菌群层级聚类树
主坐标分析见图5。PC1和PC2对总体方差解释的百分比分别为78.84%和 16.64%,对照组样本点与给药组样本点除个别样本有差异外,其他样本可以完全分开,表明白头翁皂苷给药组肠道菌群整体结构与组成产生了较大变化。
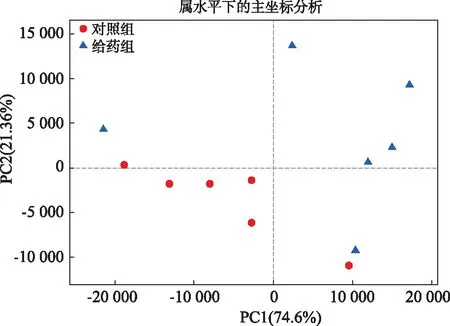
图5 大鼠粪样品菌群主坐标分析
2.4白头翁皂苷对大鼠肠道菌群结构和组成的影响
2.4.1OTU的Venn分析 对照组和给药组12个粪便样品(每只大鼠取的粪便算1份样品,两组一共12只大鼠,即12份粪便样品)共产生OTU 488个,其中共有OTU 452个,两组特有OTU分别为9和27个;对照组菌群OTU数目较给药组少,两组间差异有统计学意义(P<0.05),满足归类分析要求(图6)。
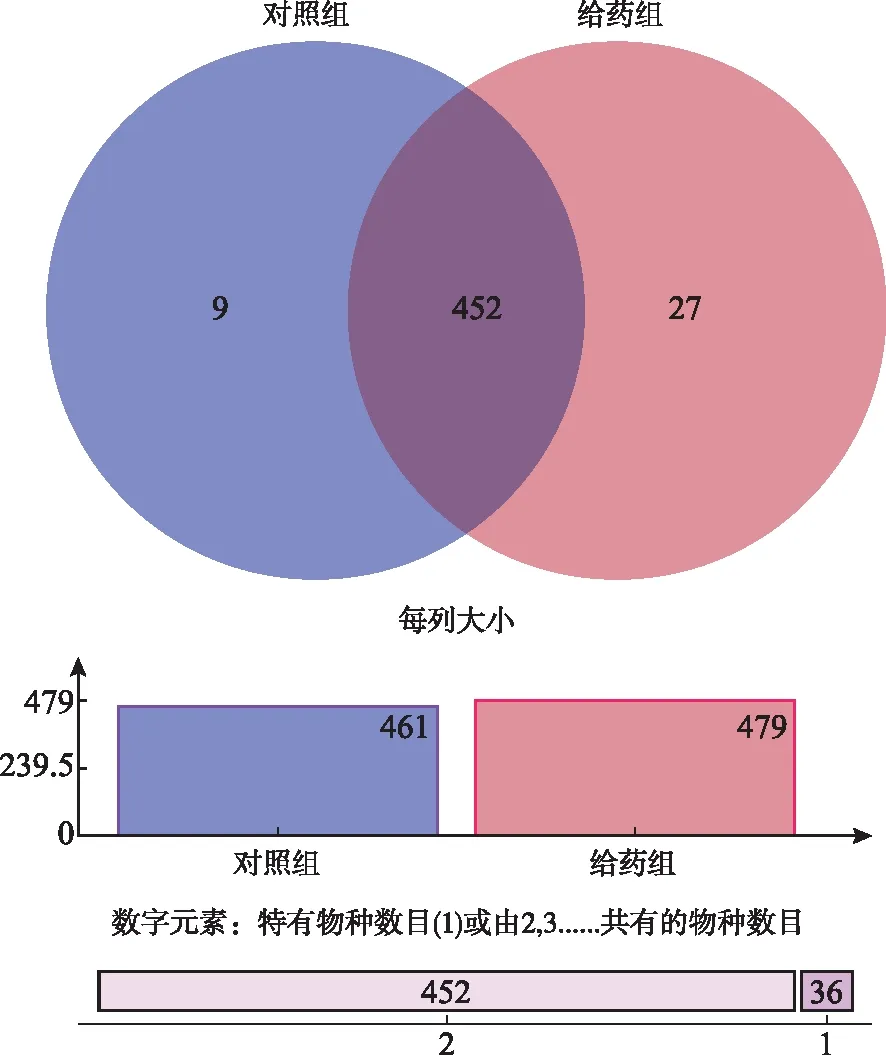
图6 OTU水平下 的Venn图
2.4.2群落组成分析
2.4.2.1门分类水平的丰度值及构成比较 门水平下各组样本肠道菌群的组成情况见图7,在所有样本中共检测到细菌门5个,厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)为优势类群,给药组的疣微菌门(Verrucomicrobia)丰度显著增加,给药组与对照组肠道菌群组成类似,结果表明白头翁皂苷虽然没有改变门水平上肠道菌群组成,但改变了菌群构成比例。
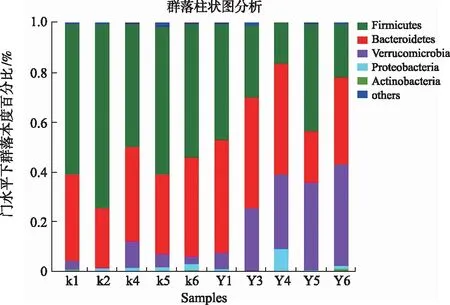
K.对照组;Y.给药组。
2.4.2.2属水平分析 由图8可知,在属水平上,对照组优势菌群为(norank_f_Muribaculaceae)和乳杆菌属(Lactobacillus);给药组优势菌群为(norank_f_Muribaculaceae)和艾克曼菌属(Akkermansia)。与对照组比较,给药组相对丰度降低的菌种有乳杆菌属(Lactobacillus)、脱硫弧菌属(Desulfovibrio)、毛螺菌属(Lachnospiraceae_NK4A136_group、 norank_f_Muribaculaceae)、未分类毛螺菌科(unclassified_f_Lachnospiraceae)、拟杆菌属(Bacteroides)、瘤胃菌属(Ruminococcaceae_UCG_014);丰度增加的菌种有艾克曼菌属(Akkermansia)、(Romboutsia)、瘤胃球菌型(Ruminococcus_1)、其他(Others)。
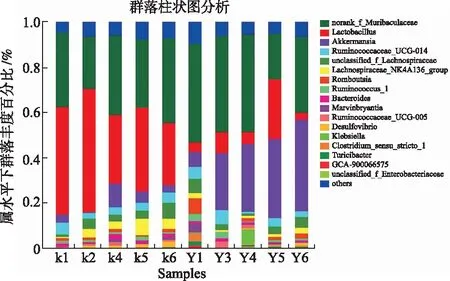
K.对照组;Y.给药组。
通过物种差异分析揭示两组之间科水平上具有显著差异的微生物类群,由图9可知,与对照组比较,给药组中艾克曼菌属(Akkermansia)丰度显著增高(P<0.05);脱硫弧菌属(Desulfovibrio)和瘤胃菌属(Ruminococcaceae_UCG-013)丰度显著降低(P<0.05)。
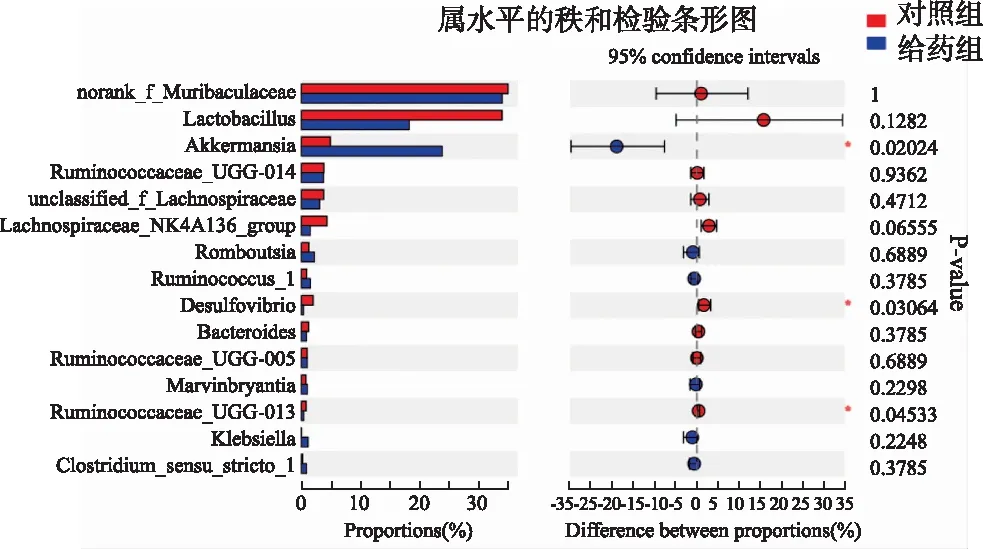
图9 组间差异显著性检验
3 讨论
肠道菌群是肠道的生物屏障,可以与肠道上皮细胞紧密结合,共同抑制病原菌的生长和入侵,在维持肠道健康中发挥重要作用。正常动物肠道内寄生细菌约10万亿个,分为有益菌、条件致病菌和有害菌,它们之间存在相互竞争、相互依存的关系,正常菌群对机体生理活动十分重要,具有保护、屏障、促进营养物质吸收、参与代谢等作用[18-19],而菌群的平衡极易受饲养环境、饮食、自身免疫力等因素的影响。菌群平衡被打破,则会导致菌群失调,增加肠道疾病发生的概率[20-21]。
基于16S rRNA的高通量测序技术克服了培养依赖及非培养依赖的传统分子生物学方法费时、费力、通量低、低丰度菌种难以鉴定等缺陷,实现了对复杂样品中混合菌种的分类学鉴定和精确定量,已成为肠道微生物研究的主流技术[22]。本实验运用稀释曲线、丰度等级曲线和ANOSIM/Adonis分析,测序深度充分,测序量合理,样本丰富度和均匀度都较好,且组间差异大于组内差异,分组具有科学意义,测序数据具有可靠性和科学性;通过 β 多样性层级聚类树和主成分分析(PCoA)发现白头翁皂苷对肠道菌群整体结构与组成产生了较大影响;通过Venn图分析发现两组之间差异性有统计学意义,满足归类分析要求;通过门水平和属水平群落组成分析发现在不同分类水平上群落组成情况及比例,也可以找出在不同分类水平上对照组和给药组优势菌群;通过组间差异性显著检验分析,发现在属水平上给药组和对照组具有显著性差异的菌种。
测序结果表明,对照组和给药组大鼠在门水平上的优势菌均是厚壁菌门(Firmicutes),其次是拟杆菌门(Bacteroidetes)。白头翁皂苷可以降低有害菌如毛螺菌属(Lachnospiraceae_NK4A136_group)、脱硫弧菌属(Desulfovibrio)、(norank_f_Muribaculaceae)、未分类毛螺菌科(unclassified_f_Lachnospiraceae)、拟杆菌属(Bacteroides)、瘤胃菌属(Ruminococcaceae_UCG_014),增加有益菌如艾克曼菌属(Akkermansia)、(Romboutsia)、瘤胃球菌型(Ruminococcus_1)的丰度。
综上所述,本研究表明两组大鼠肠道菌群具有显著差异,白头翁皂苷能够显著影响大鼠肠道菌群构成,显著增加有益菌艾克曼菌属丰度,降低有害菌毛螺菌属丰度。有研究表明,肠道菌群具有抗癌等积极作用,它们通过增强宿主抗肿瘤免疫反应抵抗肠道以外的恶性肿瘤[23]。同时有研究显示,肠道菌群能提高免疫检查点抑制剂反应性,如嗜黏蛋白-艾克曼菌具有调节肿瘤细胞和免疫细胞双重活性,进而提高免疫检查点抑制剂的疗效,白头翁具有抗肿瘤疗效[24]。本研究结果表明,大鼠灌胃白头翁皂苷可以提高艾克曼菌属丰度。白头翁皂苷是否通过调节肿瘤模型动物中肠道菌群中与抗肿瘤有关的菌种来发挥疗效,是下一步要解决的问题。基因组学、代谢组学等相关学科的发展,有助于深入探索肠道菌群对人体健康的影响途径,从而更好地理解白头翁皂苷作用机制,全面认识白头翁皂苷与肠道菌群的作用及关系,为更好地开发利用该成分、建立其质量控制方法提供依据。
