胚胎移植前供体牛与受体牛血浆外泌体miRNA差异表达分析
2022-03-03翟亚莹施巧婷楚秋霞朱肖亭滑留帅张子敬陈付英祁兴磊王二耀吕世杰
翟亚莹,施巧婷,楚秋霞,朱肖亭,滑留帅,张子敬,陈付英,祁兴磊,王二耀,吕世杰
(1.河南省农业科学院畜牧兽医研究所,河南省畜禽繁育与营养调控重点实验室,郑州 450002;2.河南农业大学动物科技学院,郑州 450008;3.泌阳县畜牧技术服务中心,驻马店 463700)
繁殖性状是奶牛和肉牛产业中重要的经济性状,繁殖效率的高低显著影响牛场的经济效益。母牛屡配不孕导致的输精次数增加、空怀时间加长和被动淘汰率升高等问题给牛产业带来了严重的经济损失。影响牛群受胎率的原因复杂,除了饲养管理外,与个体牛妊娠前后的体内环境变化也有关系,成功的妊娠不仅需要胚胎自身的正常发育,还需要有利于胚胎着床的子宫环境[1-2]。
近年来,关于外泌体的研究越来越多,由于绝大多数细胞均能分泌外泌体,并且其分泌量和内容物(核酸、蛋白质和脂质等)在正常及病理状态下存在显著差异,因此外泌体备受科研工作者关注[3-4]。外泌体是一种能被大多数细胞分泌的微小膜泡,是细胞间通讯的一种重要介质[5]。随着外泌体研究的不断深入,人们发现外泌体在哺乳动物妊娠过程中也发挥重要作用,如子宫液外泌体可以调控胚胎的发育和着床[6]。
对人而言,胎盘在怀孕6周就将外泌体释放到母体循环中[7]。外泌体作为细胞间信息传递介质,将作用于母体的蛋白质、mRNA等生物成分释放到母体循环后,被母体免疫和血管系统的细胞吸收,从而调节整个母体生理系统以适应妊娠引起的变化[8-11]。Ramkumar等[12]分析了人足月妊娠和早产的循环外泌体miRNA谱,并提出母体血液中循环外泌体miRNA含量可能代表妊娠进展的双分子“指纹”。外泌体也具有调控牛妊娠的作用,如Zhao等[13]运用转录组测序(RNA-Seq)技术,对奶牛妊娠各阶段的血浆外泌体miRNA进行分析,在奶牛妊娠的不同阶段都检测到了特异性的外泌体miRNA,妊娠30 d时外泌体通过bta-let-7和bta-miR-499等miRNA直接或间接靶向核因子κB(NF-κB)信号通路,调节子宫局部免疫微环境促炎/抗炎平衡[14]。另外,Kesavan等[15]对3头正常未妊娠和妊娠30 d的健康奶牛的血液样本进行miRNA的检测与分析发现,与正常未妊娠相比,妊娠30 d时有29个miRNAs差异显著。上述研究表明,血浆外泌体miRNA及血液miRNA对奶牛妊娠均具有一定的调控作用。母牛卵母细胞成功受精后第7天形成囊胚,并在子宫内处于游离状态,此时子宫开始为胚胎着床做准备,探明此时供体牛与受体牛血浆外泌体miRNA差异表达谱对调控早期妊娠具有重要作用。本研究通过分析人工授精后第7天供体牛与受体牛的血浆外泌体miRNA表达差异情况,以期为研究血浆外泌体miRNA对牛早期妊娠的调控作用提供参考。
1 材料与方法
1.1 试验动物及处理
本研究以3~6岁、体重480~600 kg的夏南牛作为研究对象,选取10头供体牛(G)进行同期发情、超数排卵和人工授精,23头受体牛(S)只进行同期发情。在人工授精后第7天冲洗供体牛子宫,根据供体牛冲出的胚胎情况选取3头胚胎数相近的供体牛用于后续研究。同时选取3头与供体牛体重和年龄均相近的受体牛。颈静脉采血,收集供体牛和受体牛血液并分离血浆,-80 ℃保存备用。
1.2 外泌体的分离与鉴定
将血浆样品37 ℃解冻后,4 ℃、2 000×g离心30 min,收集上清液,4 ℃、12 000×g离心45 min,去除较大的囊泡。 收集上清液,用0.45 μm滤膜过滤,将滤液4 ℃、110 000×g离心70 min。去除上清液,用10 mL预冷的PBS重悬,4 ℃、110 000×g离心70 min。去除上清液,用50 μL预冷的PBS重悬,-80 ℃保存备用。所得样品均采用ZetaView S/N 17-310(Particle Metrix,Germany)进行纳米颗粒跟踪分析(NTA)检测外泌体的粒径。
1.3 miRNA的筛选与鉴定
提取血浆外泌体总RNA,构建并纯化small RNA文库,检测质量合格后,使用高通量测序方法进行测序。 测序得到原始数据后去除接头序列,进行Q20质控,然后去掉序列长度<15 nt、>41 nt的所有重复序列,得到clean reads。 使用bowtie软件[16]将miRNA筛选出来,对过滤后的序列和miRBase数据库进行比对,统计已知的miRNA。未注释上miRBase数据库的序列,进行新miRNA预测。 通过Benjamini & Hochberg多重检验校正的FDR(false discovery rate)值筛选出差异显著的miRNA。
1.4 差异表达miRNA的的靶基因预测与分析
对已知miRNA和新预测miRNA进行表达量计算,采用TPM(transcript per million)值作为度量指标。使用R语言的DESeq数据包分析供体牛与受体牛的差异表达miRNA,以P<0.05和|log2FoldChange|>1作为差异表达阈值。使用miRanda软件[17]对差异表达miRNA进行靶基因预测(S≥150,ΔG≤-125.6 kJ/mol),并对靶基因进行GO功能富集分析和KEGG信号通路分析[18]。
2 结 果
2.1 血浆外泌体粒径分析
纳米颗粒跟踪分析(NTA)的结果显示,6个样本的囊泡粒径均在135 nm左右,符合外泌体的直径特征(图1)。
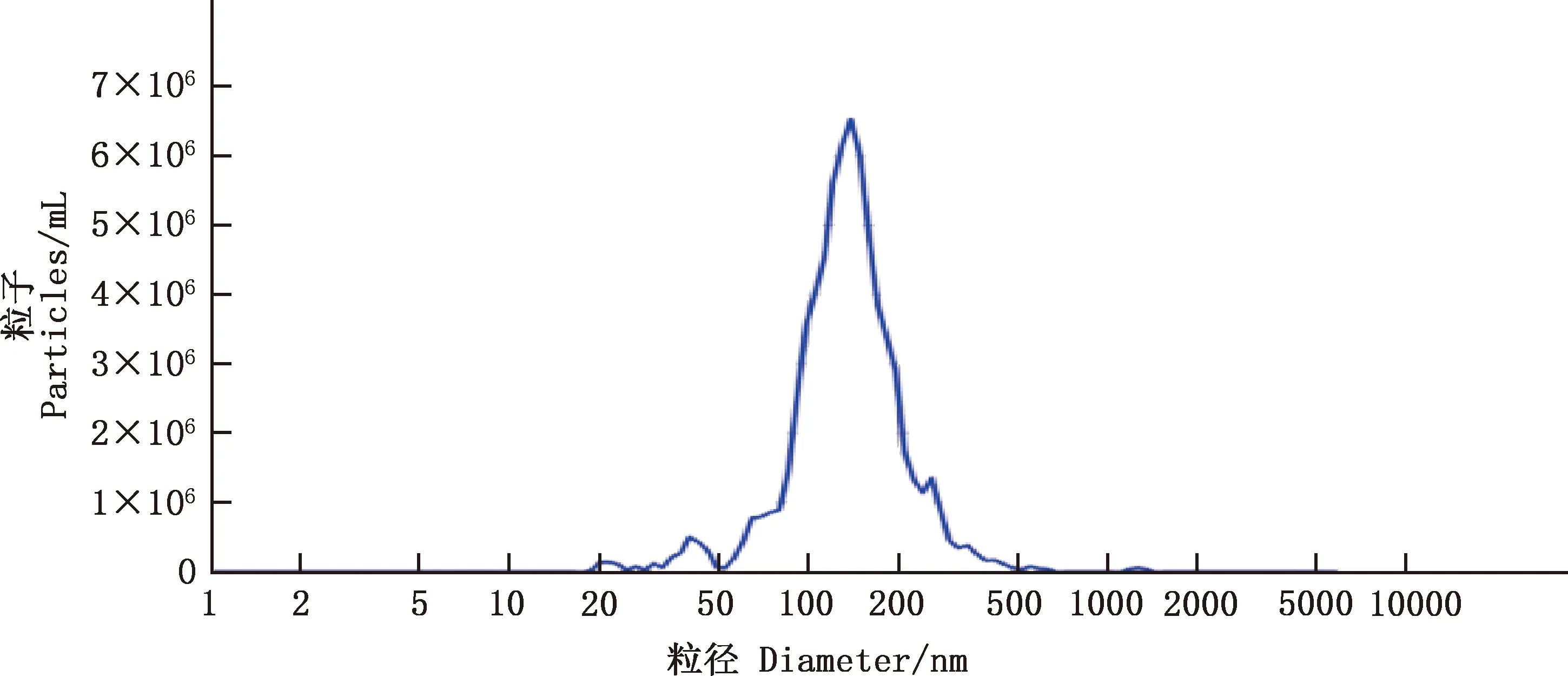
图1 血浆外泌体粒径
2.2 miRNA的鉴定分析
所有样本比对上已知miRNA的总数为432,新预测miRNA的总数为451。其中有22个miRNAs显著差异富集,通过Benjamini & Hochberg多重检验校正的FDR值,筛选出差异最显著(FDR<0.05)的5个miRNAs分别为bta-miR-2431-5p、bta-miR-4657、novel492-mature、novel56-star和novel376_mature(表1)。受体牛与供体牛对比分析发现,受体牛中有9个miRNAs上调,13个miRNAs下调(图2)。

表2 差异表达miRNA

①G,供体牛;S,受体牛
2.3 差异表达miRNA的GO功能富集分析和KEGG信号通路分析
22个差异表达的miRNAs中,有15个miRNAs预测到2 990个无重复靶基因,注释到52个GO亚类中(level 2),参与的生物学过程包括生物黏附(biological adhesion)、定位(localization)、定位的建立(establishment of localization)、生物调节(biological regulation)、刺激反应(response to stimulus)等;涉及的细胞成分为细胞器(organelles)、细胞连接(cell junction)和大分子配合物(macromolecular complexes)等;发挥的分子功能包括结合(binding)、催化活性(catalytic activity)、受体活性(receptor activity)、转运活性(transporter activity)等(图3)。其中生物黏附(biological adhesion)、定位(localization)和细胞连接(cell junction)等生物过程在胚胎着床中发挥着重要作用。

图3 差异表达miRNA的GO功能富集分析
KEGG信号通路分析发现81个显著富集信号通路,包括黏着斑(focal adhesion)、黏着连接(adherens junction)、催产素信号通路(oxytocin signaling pathway)、促性腺激素释放激素(GnRH)信号通路(GnRH signaling pathway)、Wnt信号通路(Wnt signaling pathway)、吲哚生物碱的生物合成(biosynthesis of indole alkaloids)和转化生长因子-β(TGF-β)信号通路(TGF-β signaling pathway)等(图4)。

图4 差异表达miRNA显著富集的KEGG信号通路(前20)
综合GO功能富集分析与KEGG信号通路分析,22个差异miRNAs中有10个miRNAs富集在与生物黏附(biological adhesion)、定位(localization)、细胞连接(cell junction)、黏着斑(focal adhesion)和黏着连接(adherens junction)有关的生物功能和信号通路上,分别是bta-miR-339a、novel229_mature、novel270_mature、novel305_mature、bta-miR-11971、novel475_mature、novel492_mature、novel588_mature、novel613_mature和bta-miR-199a-3p。其中bta-miR-339a、novel229_mature、novel305_mature和novel588_mature等4个miRNAs在供体牛中的表达量显著上调,其靶基因富集在细胞定位和黏附连接的通路上。
3 讨 论
胚胎着床是一个持续的动态过程,包括定位、黏附和侵入等着床事件,研究表明外泌体对胚胎着床具有重要影响[19]。目前关于人类的胚胎着床的研究较多,对胚胎反复着床失败患者与有生育能力的妇女所分泌子宫液的miRNA进行差异表达分析,发现其差异表达miRNA同样富集在黏着连接(adherens junction)、细胞黏附(cell adhesion)等信号通路上[20]。在胚胎准备着床时,人子宫内膜的黏附性会发生改变,为滋养层的成功植入做准备[21]。在胚胎准备着床时,仓鼠的子宫内膜上皮细胞的黏附蛋白也会发生变化,并且由于黏着连接(adherens junction)通路参与了细胞识别、黏附、建立细胞极性和通透性屏障的特性,对维持子宫结构的完整性、腔内环境的组成以及着床的开始都非常重要[22]。本研究表明,血浆外泌体中有22个差异表达的miRNAs,其中受体牛有9个miRNAs上调,13个miRNAs下调。GO功能富集分析表明,这些差异表达基因主要富集在生物黏附(biological adhesion)、定位(localization)、细胞连接(cell junction)等生物过程。将这些靶基因在KEGG数据库中进一步注释发现,差异表达miRNA在黏着斑(focal adhesion)、黏着连接(adherens junction)信号通路显著富集,这些通路调控着许多与胚胎着床有关的蛋白[23-26],进一步说明本研究得到的血浆外泌体差异表达miRNA所富集的通路与胚胎着床有关。
在TGF-β信号通路中发挥重要功能的TGF-β是一种抗炎细胞因子,研究表明,其可以促进羊膜上皮细胞的上皮-间质转化,以维持胎膜稳态[27]。在胎盘中,TGF-β1和胰岛素样生长因子结合蛋白3(IGFBP-3)可通过TGF-β受体信号影响人滋养层细胞的增殖[28]。对正常妊娠和分娩过程的外泌体miRNA的分析表明,TGF-β介导的组织稳态(调节细胞增殖和转化)是维持妊娠所必需的[29]。Wnt信号通路的功能最常见于胚胎发育和癌症,也参与成年动物的正常生理过程[30-33]。早在1993年,就有研究发现Wnt的错误表达对囊胚滋养层细胞的体外分化有明显影响,Wnt信号可以调节细胞间间隙连接的通透性,调节生长因子反应性及改变细胞黏附性[34]。目前已经有研究证明,Wnt信号对牛胎盘滋养层和囊胚的发育有重要影响[35-36]。不但如此,生殖系统的早期发育、卵巢的发育、动情周期、妊娠和乳腺发育都受到Wnt信号通路的调控与影响[37]。本研究中,KEGG通路分析发现了81个显著富集的通路,其中也包括Wnt信号通路(Wnt signaling pathway)、TGF-β信号通路(TGF-β signaling pathway),说明本试验得到的血浆外泌体差异表达miRNA所富集的通路与妊娠维持有关。
本研究发现,供体牛显著上调的4个miRNAs(bta-miR-339a、novel229_mature、novel305_mature、novel588_mature)参与了定位与黏附连接的生物过程。有研究表明,bta-miR-339a在奶牛怀孕4周和8周时的表达量与未怀孕的奶牛相比差异显著,而12周后差异不显著[29],bta-miR-339a在未怀孕与怀孕30 d奶牛的血液中的表达也存在显著差异[15]。这些均提示bta-miR-339a在妊娠早期胚胎着床过程中发挥了重要作用。 novel229_mature、novel305_mature、novel588_mature为新预测的miRNA,与bta-miR-339a作用在相同的功能通路与信号通路上,间接表明这3个miRNAs同样在胚胎着床中起到重要的调控作用。
尽管本试验选择了体重相近、年龄相仿的供体牛和受体牛进行血浆外泌体miRNA差异表达分析,但仍不能排除个体经济性状上的差异对试验结果造成的影响。差异miRNA的靶基因多富集在胚胎着床相关的功能和信号通路上,表明这些miRNA可能参与牛胚胎的着床。本试验所筛选的4个miRNAs可考虑作为牛胚胎着床相关的候选基因进行深入研究,但其生物学功能及其对胚胎着床的具体调控机制仍需要进一步验证。
4 结 论
本研究通过比较胚胎移植前供体牛和受体牛血浆外泌体miRNA的表达,获得了22个显著差异的miRNAs,GO功能富集分析和KEGG信号通路分析表明这些miRNA参与细胞定位和黏附连接有关的生物过程,说明血浆外泌体miRNA可能通过影响胚胎定位与细胞黏附调控胚胎着床而影响母牛妊娠,结果可为进一步探究外泌体miRNA对牛妊娠的调控机制提供理论参考。
