miRNA在哺乳动物配子发生中的作用研究进展
2022-03-03黄晓刚韩贝贝张守全
黄晓刚,韩贝贝,李 菊,张守全
(华南农业大学,动物科学繁殖实验室,广州 510642)
哺乳动物的二倍体原始生殖细胞需要通过减数分裂和分化才能转化成单倍体的卵母细胞或精子,这个过程称为配子发生。雌雄配子的发生是一个多步骤的动态过程,包括3个时期,即增殖期、生长期和减数分裂期,此过程涉及错综复杂的基因表达调控,其中包括编码基因的阶段特异性表达调控以及非编码基因的转录和转录后水平调控。
微小RNA(microRNA,miRNA)是其中一类小的非编码RNA,长度为19~22 nt,在真核生物中广泛表达[1],由具有发夹结构的长度为70~90 nt的单链RNA前体经核糖核酸内切酶(Dicer)加工后生成,通过识别靶基因非翻译区的结合位点,导致mRNA降解或者蛋白质翻译抑制,从而在转录后水平发挥调节作用[2-3]。近年来研究显示,miRNA参与生命过程中的一系列重要进程,包括早期胚胎发育、细胞增殖、细胞凋亡和细胞死亡等,它们在哺乳动物生殖活动中的作用也逐渐被揭示,部分研究表明,miRNA在哺乳动物精子发生、精子成熟、颗粒细胞增殖、卵母细胞成熟、卵泡发育及早期胚胎发育等过程中都发挥着重要作用[4-5]。因此,了解miRNA在这些过程中的作用机理对探究哺乳动物生殖活动的分子机制具有深远影响。作者主要就miRNA在哺乳动物生殖细胞配子发生中的表达和潜在作用进行综述,以期为深入研究哺乳动物配子发生调控机制提供参考。
1 miRNA在精子发生中的作用
精子发生是一个复杂的过程,包括精原细胞的有丝分裂增殖、早期精母细胞的形成、单倍体圆形精子的产生、染色质凝聚和核成形、多余细胞质的去除以及顶体和精子尾部的形成[6]。这一过程不仅受阶段特异性表达的编码基因的调控,还伴随着非编码基因的调节,其中,miRNA以细胞特异性的形式表达,通过对其靶mRNA转录后调节的方式在精子发生过程中发挥作用[7]。
在对哺乳动物精子发生的早期研究中,有学者通过调节对睾丸形成和精子发生具有关键作用的支持细胞的功能,揭示了不同miRNA在精子发生中的潜在作用[8]。后续研究表明,Dicer是miRNA加工必不可少的RNA核酸内切酶,若缺失会导致成熟的miRNA完全丢失[9],将支持细胞中的Dicer1选择性失活后,会导致生精小管内精子丧失及生精障碍[10],这表明miRNA在精子发生中具有重要作用。此外,Sara等[11]研究表明,miRNA表达的改变会导致精子异常,进一步证明miRNA对精子发生具有不可或缺的作用。近年来,许多体内和体外功能研究显示某些miRNA可通过调节支持细胞、精原干细胞和精细胞的功能和状态在精子发生的过程中发挥重要作用(表1)。
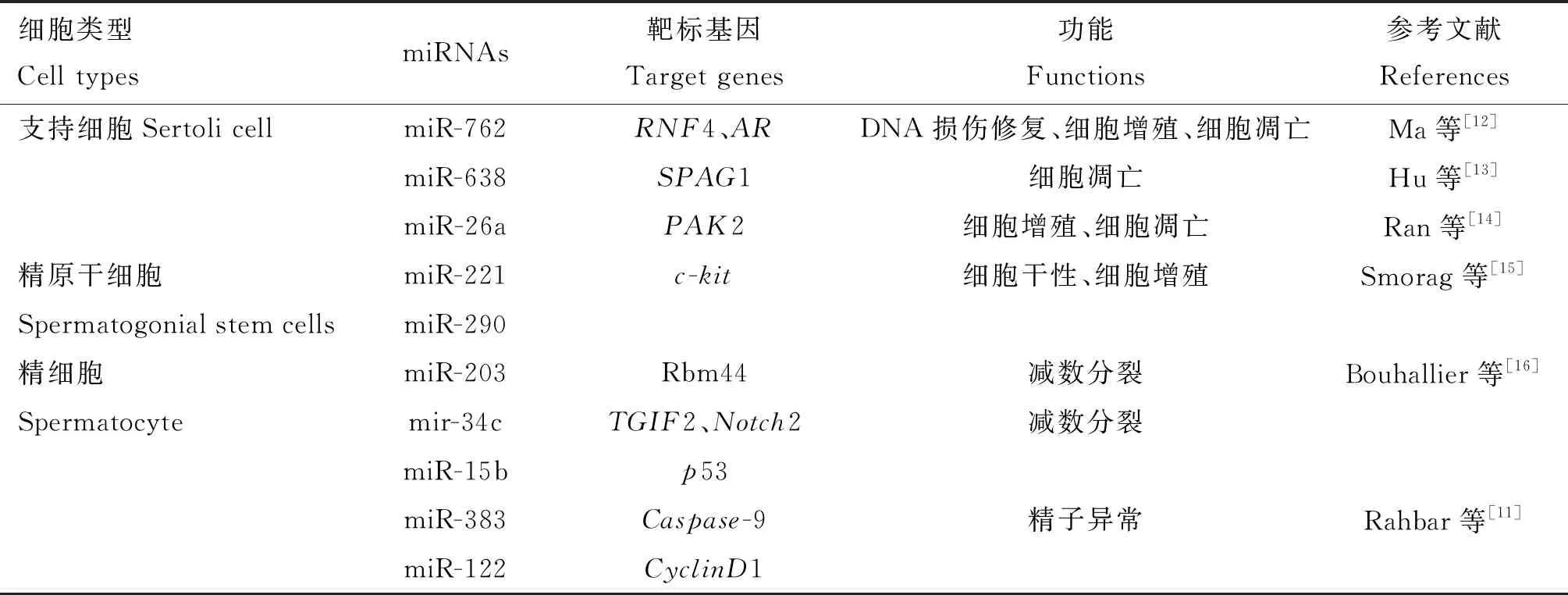
表1 miRNA在哺乳动物精子发生中的作用
1.1 miRNA对支持细胞的作用
支持细胞的功能对精子发生的顺利进行必不可少。在猪睾丸中,miR-762可以通过下调环指蛋白4(RNF4)和雄激素受体(AR)基因的表达及促进DNA损伤修复,从而促进未成熟支持细胞的增殖并抑制其凋亡,进而在精子发生中发挥作用[12]。miR-638则与miR-762相反,它通过抑制精子相关抗原1(SPAG1)基因的表达,间接灭活PI3K/Akt信号通路,从而促使猪睾丸中未成熟的支持细胞发生凋亡[13];同样地,miR-26a在猪睾丸组织不同发育阶段差异表达,可以通过靶向与精子形成有关的P21蛋白激活激酶2(PAK2)基因来抑制睾丸支持细胞的增殖并促使其凋亡,从而阻碍精子的产生[14]。以上研究结果表明,miRNA参与支持细胞增殖和凋亡的调控。因此,研究不同发育阶段的支持细胞中miRNA的差异表达将有助于揭示精子发生早期过程的调控机制。
1.2 miRNA对精原干细胞和精细胞的作用
miRNA除了调节支持细胞的增殖和凋亡外,还参与精子发生的后续过程。其中,miR-221可能通过抑制干细胞生长因子受体(c-kit)基因的表达与miR-290家族共同维持精原干细胞的干性,从而调节精原细胞和原代精母细胞的增殖[15];miR-203可以介导RNA结合蛋白44(Rbm44)基因表达的抑制,从而调节精细胞的减数分裂[15];miR-34c在生殖细胞中特异性表达,并且主要在减数分裂后期表达,可通过下调转化生长因子诱导因子同源框2(TGIF2)和Notch受体2(Notch2)基因的表达,在精子发生过程中发挥作用[16];miR-34家族可能与细胞周期阻滞和减数分裂进程有关,从而在精子发生后期发挥关键作用[15]。此外,miR-15b、miR-383和miR-122也可通过改变p53、半胱天冬酶9(Caspase-9)和细胞周期蛋白D1(CyclinD1)等靶基因的表达水平,参与调节精子异常[11]。以上研究结果表明,miRNA除了通过调节支持细胞的增殖和凋亡,间接参与调控精子发生外,还可以通过调节精原细胞、精母细胞及精细胞的细胞周期进程,直接调控精子发生。因此,研究雄性生殖细胞中miRNA的特异性表达将有助于揭示精子发生后续过程的调控机制。
1.3 miRNA在精子附睾成熟过程中的表达
精子在睾丸中形成后,需要通过附睾以获得运动能力和受精能力。选择性敲除小鼠附睾细胞中的Dicer1基因后,会导致其分化失调[17],推测miRNA在附睾发育和精子成熟中也具有调节作用。在精子通过附睾的过程中,附睾不但会以附睾小体的方式将蛋白质转运至精子上[18],也会分泌不同的miRNA并且转运至精子上[19],其中包括牛附睾头含量较高的miR-145、miR-143、miR-214和miR-199,以及附睾尾含量较高的miR-654、miR-1224和miR-395[20]。在小鼠附睾中,精子具有复杂的miRNA组成,并且在精子沿附睾移动的过程中,miRNA的组成会发生改变[21],表明精子miRNA的组成在精子发生后是动态的。miR-21a、miR-29c、miR-199a、miR-200b/c和miR-10a/b等miRNA在睾丸精子中含量相对较少,但在附睾的精子中会随着精子成熟而逐渐积累[19];miR-467e主要聚集在附睾头部,miR-204b-5p和miR-375-3p在附睾头和附睾体中含量较高,而miR-208b-3p、miR-196b-5p和miR-34c则在附睾尾含量较高[22]。虽然近年来已有研究表明miRNA在附睾中具有重要作用,但仍需要通过更进一步的研究来探明miRNA在精子通过附睾的过程中是如何调节精子成熟的。
2 miRNA在卵子发生中的作用
在卵子发生的过程中,卵母细胞与颗粒细胞、卵泡膜细胞等卵泡内的体细胞相互作用,促使成熟的卵母细胞通过排卵而释放。其中,颗粒细胞通过产生雌二醇(E2)[23]并以缝隙连接的方式使得卵母细胞与卵泡膜细胞之间的双向通讯桥交叉连接,从而参与调节卵母细胞的发育和成熟[24-26]。
在卵母细胞发育和成熟的过程中,已通过功能性敲除Dicer1基因[27]、Argonaute蛋白2(AGO2)基因(miRNA加工机制中RNA诱导的基因沉默复合体的关键组成部分)[28]和核糖核酸酶(drosha)基因(负责Pri-miRNA加工的基因)[29]证明miRNA的作用。miRNA在卵母细胞的发育中也表现出阶段特异性,如当猪卵母细胞从生发泡(GV)期进入第二次减数分裂中期(MⅡ)时,miR-486、miR-10b、miR-10a-5p、miR-183和miR-21升高,miR-210和miR-27b-3p降低[30];牛GV和MⅡ期卵母细胞之间存在包括miR-130b在内的几种miRNAs的差异表达[31],并且有30种miRNAs仅在其GV期卵母细胞中表达,包括miR-208a、miR-2317、miR-2320、miR-365-5p、miR-584、miR-628和miR-876等,有35种miRNAs仅在其MⅡ期卵母细胞中表达,包括miR-144、miR-1603、miR-190b、miR-29b、miR-29c、miR-29e、miR-412和miR-449b等[32]。近年来,许多体内和体外功能研究显示,某些miRNA通过调节卵母细胞、卵丘细胞和颗粒细胞的功能和状态在卵子发生过程中发挥作用(表2)。
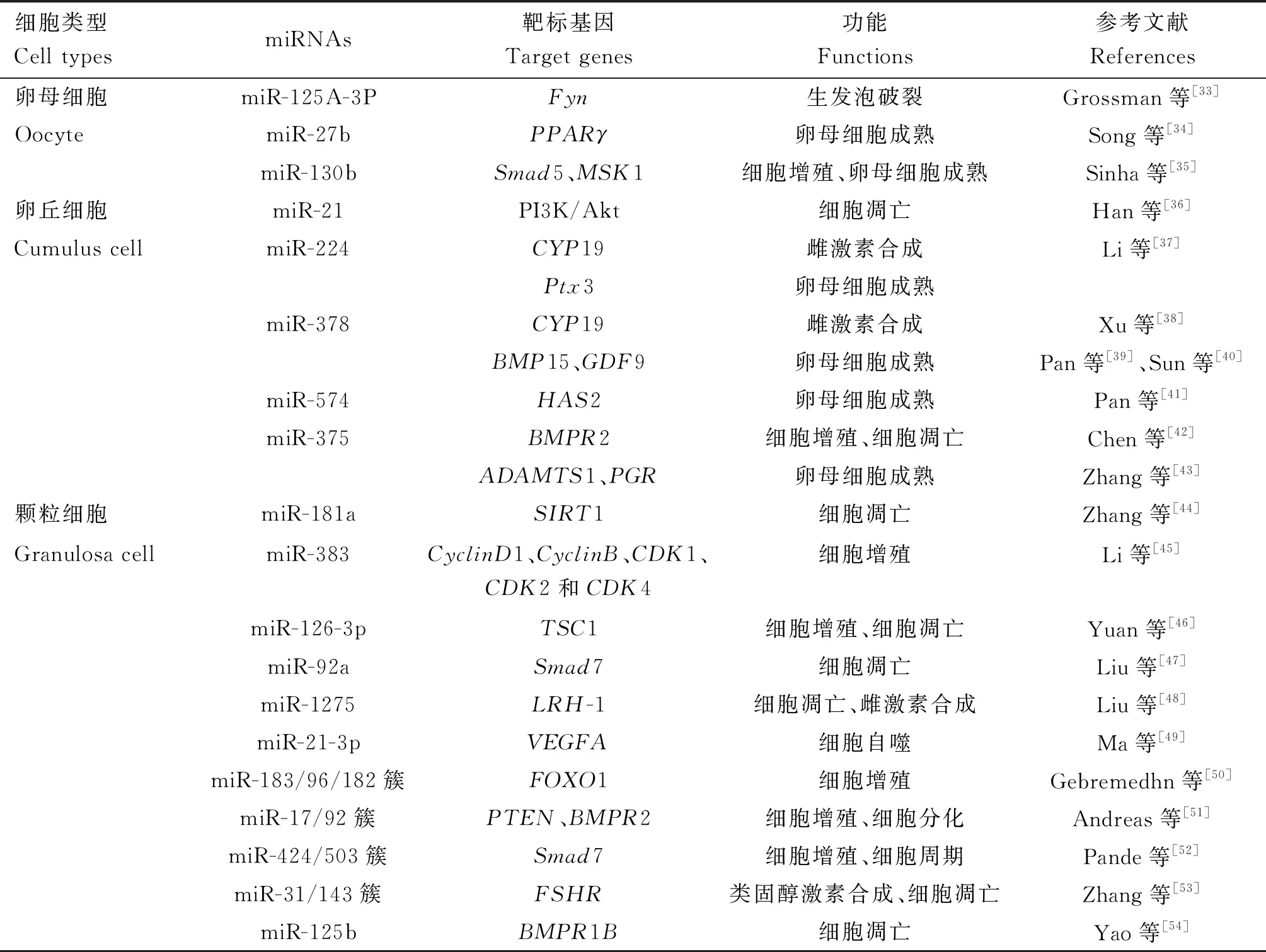
表2 miRNA在哺乳动物卵子发生中的作用
2.1 miRNA对卵母细胞的作用
在小鼠卵母细胞成熟的过程中,miR-125a-3p自身会下调,使得蛋白酪氨酸激酶(Fyn)基因表达上调,从而促进生发泡破裂[33];miR-27b则会通过靶向过氧化物酶体增殖物激活型受体γ(PPARγ)基因调节脂肪酸代谢,从而影响猪卵母细胞的成熟[34];而在牛卵母细胞发育的过程中,miR-130b通过靶向Smad家族成员5(Smad5)和丝裂原和应激激活蛋白激酶1(MSK1)基因促进卵母细胞成熟以及卵丘细胞和颗粒细胞的增殖[35]。这些研究证明miRNA对卵母细胞成熟过程具有调节作用,但关于不同发育阶段卵母细胞中miRNA表达的研究相对较少。因此,miRNA对卵母细胞成熟过程的调节机制仍需要进一步的研究来完善和丰富。
2.2 miRNA对卵丘细胞的作用
miR-21通过激活PI3K/Akt信号传导抑制猪和小鼠卵丘细胞凋亡[36];miR-224下调猪卵丘细胞中芳香化酶(CYP19)基因的表达,导致E2水平降低,并且可以通过下调卵丘细胞中的正五聚蛋白3(Ptx3)基因的表达,对卵母细胞成熟产生抑制作用[37];miR-378同样可以靶向芳香化酶调节卵巢E2的产生[38],也可能会通过抑制卵丘细胞与卵母细胞的相互作用及下调卵丘细胞中与卵泡发育相关的骨形态发生蛋白15(BMP15)和生长分化因子9(GDF9)基因的表达,间接影响猪和小鼠卵母细胞的成熟能力[39-40];miR-574直接靶向卵丘细胞中的透明质酸合成酶2(HAS2)基因(卵丘细胞产生细胞外基质的关键酶)抑制其表达,同样对猪卵母细胞成熟产生抑制作用[41];miR-375靶向骨形成蛋白Ⅱ型受体(BMPR2)基因影响BMP15/GDF9受体的表达水平,从而影响牛卵丘细胞的增殖和凋亡[42],也可以通过抑制卵丘细胞中的Ⅰ型血小板结合蛋白基序的解聚蛋白样金属蛋白酶(ADAMTS1)和孕酮受体(PGR)基因的表达,抑制牛卵母细胞的体外成熟[43]。这些发现显示miRNA不但可以调节卵丘细胞的增殖和凋亡,还可以调节其细胞间作用。因此,研究卵丘细胞中miRNA的表达将有助于揭示卵丘细胞调节卵母细胞发育的分子机制。
2.3 miRNA对颗粒细胞的作用
miR-181a通过下调沉默信息调节因子2相关酶1(SIRT1)基因的表达增加转录因子叉头框转录因子O亚族1(FOXO1)的乙酰化并促进小鼠颗粒细胞凋亡[44];miR-383通过下调与细胞周期相关蛋白(CyclinD1、CyclinB、CDK1、CDK2和CDK4)基因的表达,抑制小鼠颗粒细胞的增殖,从而影响卵母细胞的发育[45];miR-126-3p通过靶向并抑制结节性硬化复合物1(TSC1)基因的表达,从而促进猪颗粒细胞增殖并抑制细胞凋亡[46];miR-92a通过靶向Smad家族成员7(Smad7)基因同样起到抑制猪颗粒细胞凋亡的作用[47];miR-1275通过靶向并下调肝受体同源物1(LRH-1)基因的表达,阻断肝受体同源物1/脑内细胞色素P450芳香酶(LRH-1/CYP19A1)轴,促使猪颗粒细胞凋亡并抑制E2合成[48];miR-21-3p通过PI3K/Akt信号通路下调靶标血管内皮生长因子A(VEGFA)基因的表达,从而抑制牛颗粒细胞自噬[49];miR-183/96/182簇通过协同靶向FOXO1基因,促进牛颗粒细胞的增殖,从而影响卵母细胞的发育[50];miR-17/92簇通过共调节第10号染色体缺失性磷酸酶和张力蛋白同源物基因(PTEN)和BMPR2基因的表达来调节牛颗粒细胞的增殖和分化[51];miR-424/503簇通过激活素信号通路靶向Smad7基因来调节牛颗粒细胞增殖和细胞周期进程,从而影响卵母细胞发育[52];miR-31/143通过靶向促卵泡素受体(FSHR)基因调节类固醇激素的合成,并影响牛颗粒细胞的凋亡[53];miR-125b通过靶向骨形成蛋白Ⅰ型受体B(BMPR1B)基因调节牦牛颗粒细胞的凋亡[54]。这些发现显示miRNA参与调节颗粒细胞的增殖和凋亡,而颗粒细胞通过产生E2和缝隙连接的方式参与调节卵母细胞的发育和成熟,研究颗粒细胞中miRNA的表达及其对激素合成和缝隙连接的作用有助于更进一步揭示颗粒细胞调节卵母细胞发育和成熟的分子机制。
4 小 结
miRNA在哺乳动物配子发生到配子成熟的过程中具有重要的调控作用。在精子发生的过程中,miRNA会以细胞特异性的形式在支持细胞、精原干细胞和精细胞中表达并发挥调控作用;在卵母细胞成熟的过程中,miRNA除了对卵母细胞直接发挥调控作用外,还会影响卵丘细胞和颗粒细胞的增殖及激素合成,从而间接参与调控卵母细胞的发育和成熟。此外,前人的研究结果也已证明,miRNA由于序列较短,在哺乳动物中结构相对稳定,未来很有可能成为判断哺乳动物繁殖能力的分子标记。但是,大部分miRNA的功能尚未明确,其中包括miRNA与miRNA之间的互作调控关系以及miRNA在时空差异表达上的自身调控机制等。近年来有研究表明,环状RNA(circRNA)可以作为miRNA的海绵,调控miRNA的活性[55]。 因此,在研究miRNA对靶基因作用机制的基础上,探究circRNA对miRNA的调控作用,将有助于更深入地揭示miRNA的具体作用机制及其自身的调控方式。
