曲妥珠单抗和帕妥珠单抗联合化疗对HER2阳性乳腺癌新辅助治疗的真实世界研究
2022-02-23马祥敏张香梅周新平任晓菲张玮芳刘运江
马祥敏,张香梅,周新平,任晓菲,张玮芳,刘运江
0 引言
世界卫生组织国际癌症研究机构(International Agency for Research on Cancer,IARC)发布了2020年全球最新癌症负担数据,显示乳腺癌新发病例数快速增长,高达226万例,发病率全球第一,占女性恶性肿瘤死亡数第一位[1]。人表皮生长因子受体2(HER2)阳性乳腺癌占所有乳腺癌的15%~25%[2-3],其侵袭性强,预后差[4]。靶向药物的应用,显著改善了HER2阳性乳腺癌的生存率。新辅助治疗极大提高了肿瘤切除率和保乳率,病理完全缓解(pathologic complete response,pCR)可作为一个可靠的预后指标,达到pCR会获得更长的生存[5]。临床实验研究表明HER2阳性乳腺癌在标准的新辅助化疗中加入曲妥珠单抗可以获得更高的pCR,更好的预后,但仍有部分患者会出现耐药。
帕妥珠单抗是第二代抗HER2药物,在新辅助治疗中,与化疗加单药曲妥珠单抗相比,帕妥珠单抗和曲妥珠单抗联合化疗的双重抗HER2阻断策略显示pCR率增加。帕妥珠单抗于2018年12月在我国批准上市,2019年3月正式开始临床应用,因价格昂贵应用患者较少,2020年1月降价并正式进入国家医保,推动了我国HER2阳性乳腺癌规范化治疗的进程。本研究以2019年3月至2021年3月在河北医科大学第四医院乳腺中心收治的行曲妥珠单抗和帕妥珠单抗联合化疗新辅助治疗并完成手术的HER2阳性乳腺癌患者为研究对象,评价临床疗效和不良反应,为我国应用帕妥珠单抗和曲妥珠单抗提供真实世界临床数据。
1 资料与方法
1.1 研究对象
回顾性分析2019年3月至2021年3月在河北医科大学第四医院乳腺中心收治的行曲妥珠单抗和帕妥珠单抗联合化疗新辅助治疗并完成手术的HER2阳性乳腺癌患者的临床病理资料。纳入标准:经粗针穿刺活检病理确诊的HER2阳性乳腺癌;ECOG评分≤2;完成既定的新辅助治疗方案;曲妥珠单抗和帕妥珠单抗双靶向联合治疗≥4周期;行手术治疗;有完整的术后病理资料。排除标准:首诊Ⅳ期乳腺癌,隐匿性乳腺癌,未行手术治疗,临床病理资料不全。本研究经河北医科大学第四医院伦理委员会批准。
按纳入和排除标准共有6 3 例患者符合条件,患者筛选过程见图1。患者中位年龄为50岁(27~70岁)。61例患者病理类型为浸润性导管癌,1例为浸润性导管癌合并浸润性微乳头状癌,1例为黏液腺癌。在63例患者中,23例患者使用TCbHP方案治疗,27例患者THP方案治疗,其中有4例患者使用THP方案4周期,13例患者使用AC-THP方案治疗,在AC-THP方案中有8例患者使用ddAC-THP。新辅助治疗前经病理证实有淋巴结转移(cN1及以上)者59例,占93.7%。11例(17.5%)患者行保乳术,4例患者治疗前穿刺证实无淋巴结转移者行前哨淋巴结活检术,见表1。
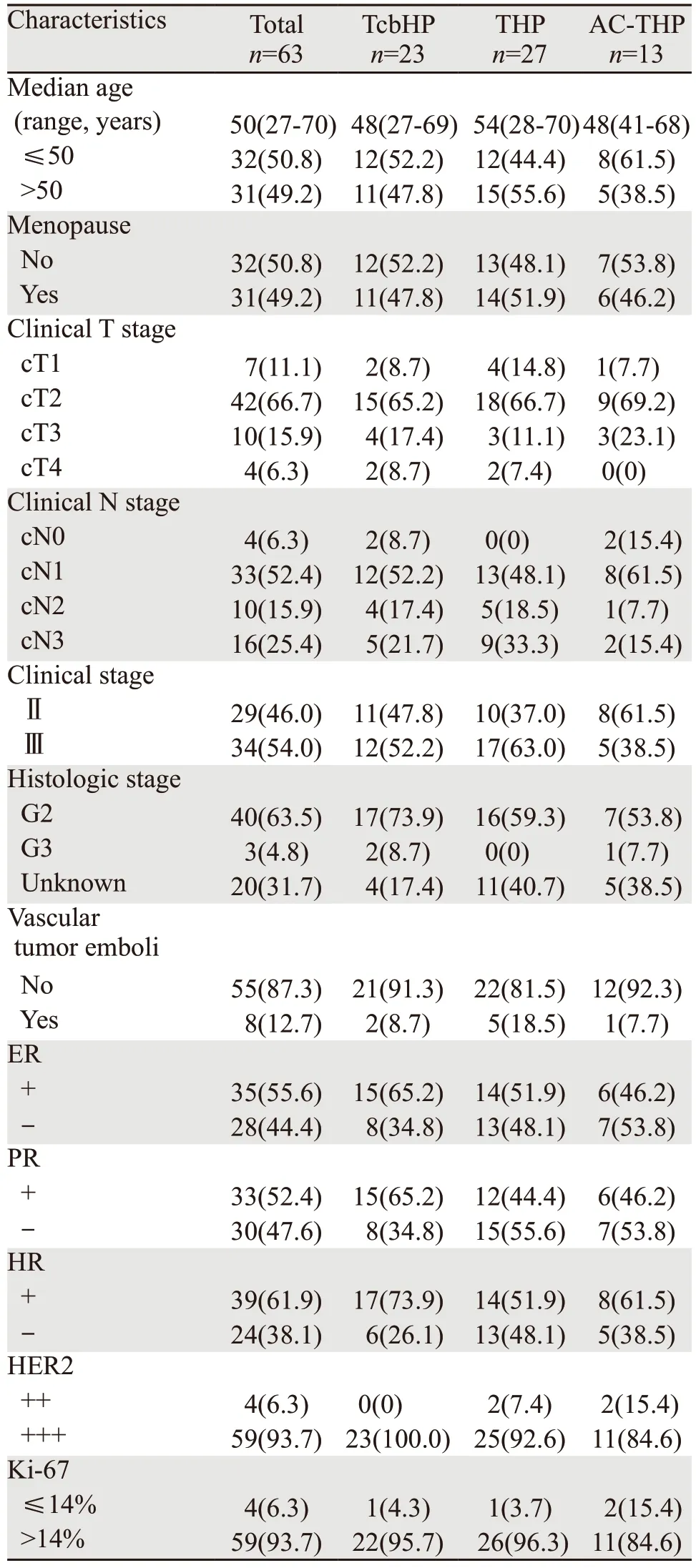
表1 行不同新辅助治疗方案的HER2阳性乳腺癌患者的临床病理特征 (n(%))Table 1 Clinical pathological characteristics of HER2-positive breast cancer patients treated with different neoadjuvant therapies (n(%))
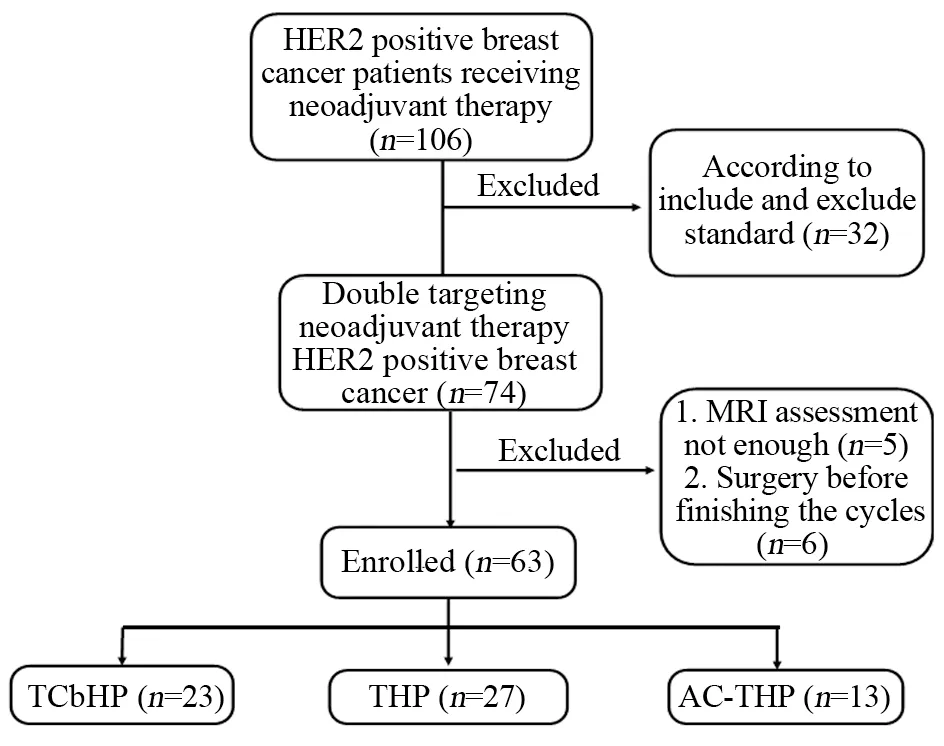
图1 患者筛选流程图Figure 1 Flow diagram of case screening
1.2 研究方法
1.2.1 免疫组织化学结果判定 免疫组织化学结果判读根据美国临床肿瘤学会/美国病理协会(ASCO/CAP)2010年乳腺癌雌激素受体(estrogen receptor,ER)/孕激素受体(progesterone receptor,PR)免疫组织化学检测指南[6]及2018年HER2指南[7]。ER和PR阳性定义为≥1%肿瘤细胞核染色。HER2结果评估标准:HER2阳性为免疫组织化学检测(immunohistochemistry,IHC)+++,或++行FISH 检测为阳性。激素受体(hormone receptor,HR)阳性定义为ER和(或)PR阳性。
1.2.2 新辅助治疗方案 新辅助治疗方案有以下三种:(1)曲妥珠单抗和帕妥株单抗联合紫杉类和卡铂药物(TCbHP),每21天给药一次,共6周期;(2)曲妥珠单抗和帕妥株单抗联合单药紫杉醇类药物(THP)治疗,每21天给药一次,共6周期;(3)AC序贯曲妥珠单抗和帕妥株单抗联合紫杉醇类药物(AC-THP)治疗:AC为每14天(或21天)给药1次,共4周期;THP每21天给药1次,共4周期;总共8周期。具体用药量:曲妥珠单抗首剂8 mg/kg,以后每次6 mg/kg;帕妥珠单抗首剂840 mg,以后每次420 mg;紫杉类(多西他赛:单用100 mg/m2,联合用药75 mg/m2,白蛋白紫杉醇:260 mg/m2,溶剂型紫杉醇:175 mg/m2);卡铂;AUC曲线下面积5~6 mg/ml/min;蒽环类(多柔比星脂质体:25 mg/m2,表柔比星:100 mg/m2,环磷酰胺:600 mg/m2)。
1.2.3 手术方式 手术时间为末次新辅助治疗后14到21天。符合保乳条件行保乳术。新辅助治疗前经穿刺活检证实腋窝淋巴结有转移者行腋窝淋巴结清扫术,无转移者行前哨淋巴结活检术。
1.2.4 疗效评价(1)临床疗效评价:采用RECIST1.1标准[8],新辅助治疗前及每2周期治疗后利用动态增强MRI对靶病灶进行疗效评价。(2)病理疗效评价:根据乳腺癌新辅助治疗的病理诊断专家共识(2020版)规定的Miler-Payne分级系统和RCB(Residual Cancer Burden)评估系统[9]。Miler-Payne分级系统:评估原发灶,比较新辅助治疗前空心针穿刺标本及治疗后手术标本。分为5级:1级(G1):浸润癌细胞无改变或仅个别癌细胞发生改变,癌细胞数量总体未减少;2级(G2:浸润癌细胞轻度减少,但总体仍高,癌细胞减少不超过30%;3级(G3):浸润癌细胞减少30%~90%;4级(G4):浸润癌细胞显著减少超过90%,仅残存散在的小簇状癌细胞或单个癌细胞;5级(G5):原肿瘤瘤床部位已无浸润癌细胞,但可存在导管原位癌。G3级以上即为病理评价有效。RCB评估系统可同时评价新辅助治疗后的乳腺肿瘤及淋巴结状况,是一种可以量化残余肿瘤的评估系统。具体分级:RCB 0:tpCR,表示浸润灶已达到完全缓解;RCBⅠ:可见少量病灶残留,浸润病灶部分缓解;RCBⅡ:可见中度病灶残留,浸润病灶部分缓解;RCBⅢ:可见广泛病灶残留。
总体病理完全缓解(total pathologic complete response,tpCR)定义为乳腺原发灶无浸润性癌(可存在导管原位癌)且区域淋巴结阴性,即原发灶MP5级且淋巴结阴性(ypT0/isypN0,tpCR)或RCB分级为0级。乳腺病理完全缓解(breast pathologic comlete response,bpCR)定义为乳腺原发灶无浸润性癌(可存在导管原位癌)即为MP5级(ypT0/is),腋窝病理完全缓解(axillary pathologic complete response,apCR)定义为区域淋巴结阴性(ypN0)。
1.2.5 安全性评价 采用CTCAE5.0版进行不良反应评价,分为1、2、3及4共四个等级。
1.3 统计学方法
SPSS21.0进行统计学分析,分类变量比较用卡方检验或Fisher’s精确检验,Logistics回归进行单因素和多因素分析,P<0.05为差异有统计学意义。
2 结果
2.1 新辅助治疗疗效评价
2.1.1 临床疗效评价 利用动态增强MRI采用RECIST 1.1标准进行评价,评估CR为26例(41.3%),PR为29例(46.0%),SD为8例(12.7%),无PD患者,总有效率(CR+PR)为87.3%,见表2。
2.1.2 病理疗效评价 患者总体tpCR率为65.1%,bpCR率为69.8%,apCR率为81.0%。TCbHP方案的pCR率最高,分别是tpCR为73.9%,bpCR为78.3%,apCR为87%。THP方案分别是tpCR为55.6%,bpCR为59.3%,apCR为81.5%。ACTHP方案的pCR率分别是tpCR为69.2%,bpCR为76.9%,apCR为69.2%。利用MP分级评价,90.4%(57例)患者达到G4~5级,98.4%(62例)患者在G3级及以上。TCbHP方案和AC-THP方案G3级以上达到100%。三种化疗方案在tpCR、bpCR、apCR、MP分级及RCB分级上均差异无统计学意义(均P>0.05),见表2。

表2 不同新辅助治疗方案的疗效评价 (n(%))Table 2 Curative effect evaluation of different neoadjuvant therapy schemes (n(%))
2.2 影响tpCR的相关因素
HR阴性患者的tpCR率为79.2%,高于HR阳性患者的56.4%。TCbHP方案中6例HR阴性患者均达到tpCR,HR阳性患者tpCR为64.7%。THP方案中HR阴性患者的tpCR率为69.2%,AC-THP方案中HR阴性tpCR率为80%。
单因素分析显示患者年龄、月经状态、T分期、N分期、临床分期、组织学分级、脉管癌栓、ER、Ki-67水平及新辅助方案均与是否达到tpCR无关(均P>0.05)。PR、HR与tpCR有一定相关性但未达到统计学意义(P=0.066)。HER2状态是影响tpCR相关因素(P=0.023),免疫组织化学HER2为+++的tpCR率明显高于++。HER2为++的4例患者均未达到tpCR。将单因素分析P<0.1的因素带入多因素分析,未发现影响tpCR的独立预测因素,见表3~4。

表3 影响行新辅助治疗的HER2阳性乳腺癌总体病理完全缓解率的单因素分析 (n(%))Table 3 Univariate analysis of influence factors for tpCR rate of HER2-positive breast cancer patients treated with neoadjuvant therapy (n(%))

表4 影响行新辅助治疗的HER2阳性乳腺癌总体病理完全缓解率的多因素分析Table 4 Multivariable analysis of influence factors for tpCR rate of HER2-positive breast cancer patients treated with neoadjuvant therapy
2.3 不良反应评价
采用CTCAE5.0版进行不良反应评价。患者新辅助治疗过程中,对于化疗后出现骨髓抑制患者给予相应升白治疗。患者新辅助治疗的三种方案中TCbHP方案发生3~4级不良反应最高,主要为骨髓抑制,白细胞及血小板减少,其他常见不良反应为恶心、呕吐,疲劳乏力。3例因发生3~4级不良反应调整化疗药剂量为原剂量的80%,患者耐受可,完成后续治疗,2例更改为THP方案。THP及AC-THP发生的不良反应多为1~2级。三种治疗方案中发生的心功能下降均为轻度(LVEF较基线下降10%~19%),AC-THP发生2例,TCbHP和THP方案各有1例,化疗结束后均恢复。三种方案没有导致死亡的不良反应报告,见表5。

表5 行新辅助治疗HER2阳性乳腺癌患者用药期间不良反应 (n(%))Table 5 Adverse effects related to neoadjuvant therapy in patients with HER2-positive breast cancer (n(%))
3 讨论
HER2阳性乳腺癌作为乳腺癌中一种复发转移风险高的类型,越来越引起重视。基于Neosphere研究结果,2013年FDA加速批准了帕妥珠单抗联合曲妥珠单抗用于HER2阳性乳腺癌的新辅助治疗。帕妥珠单抗和曲妥珠单抗联合化疗已成为HER2阳性乳腺癌新辅助治疗的标准方案。临床实验中双靶向联合不同化疗方案的pCR率在39%~66%之间[10-13]。
NeoSphere研究[10]结果显示THP组的乳腺pCR显著优于TH组和TP组,奠定双靶向在新辅助治疗中的地位。2016年发表的5年随访数据[14]显示无论DFS和PFS,双靶向新辅助治疗都优于单靶,且耐受性和安全性好。达到tpCR者5年PFS优于未达到tpCR者,证实了达到tpCR与远期生存的相关性。
TRYPHAENA研究[11]结果显示无论双靶向联合哪种化疗均可获得57.3%~66.2%的tpCR率,TCbHP的pCR率最高为66.2%。BERENICE研究[12]显示密集AC序贯单周紫杉醇联合双靶向的pCR率为61.8%,且不会增加心功能障碍的发生率。亚洲人群的Ⅲ期PEONY研究[13]结果显示双靶向的pCR率为39.3%优于单靶向的21.8%。在德国WSG ADAPT研究[15]中,HER2阳性/HR阴性的患者新辅助治疗双靶向联合紫杉醇12周疗法,pCR率可以达到90%。KRISTINE研究[16]结果显示标准的TCbHP方案的pCR率优于T-DM1+帕妥珠单抗(55.7%vs.44.4%),其3年的随访结果显示pCR与无远位侵袭性疾病生存(iDFS)下降相关[17]。
一项来自西班牙的真实世界研究(NEOPETRA)[18]共纳入243例HER2阳性行双靶向联合化疗新辅助治疗患者,40.4%为HR阴性,Ⅲ期占28.8%。74.1%使用HP抗联合蒽环类和紫杉类药物,11.1%使用单药紫杉类药物,14.4%使用含铂类化疗。总tpCR率为66.4%,三种方案的tpCR分别为71%、59.3%和48.6%。67.6%的患者达到了bpCR,HR阴性tpCR为80.9%高于HR阳性的55.4%。在影像评估CR的患者中,78.3%患者也获得了tpCR。本研究中HR阴性占38.1%,Ⅲ期患者占54%。本研究中tpCR率和bpCR率与该研究结果相似,TCbHP方案的tpCR率最高为73.9%,ACTHP为69.2%,THP为55.6%,另MRI评估CR患者中80%患者达到tpCR。HR阴性患者的tpCR率为79.2%高于HR阳性患者的56.4%,但差异无统计学意义(P=0.066),可能跟样本量少有关。
另一项单中心小样本的66例HER2阳性乳腺癌患者行ddAC-THP新辅助治疗,tpCR为72%[19]。本研究中AC-THP方案的tpCR率为69.2%,略低于上述研究。一项来自我国的10例行TCbHP方案用于HER2阳性新辅助治疗的研究显示8例患者达到tpCR,未出现严重不良反应[20]。本研究中TCbHP方案的tpCR率为73.9%,TCbHP方案的心脏毒性更小,临床中需关注患者骨髓抑制情况,尤其白细胞和血小板减少。一项来自美国哈弗医学院的研究[21]中,与ddAC-TH的pCR率46%相比,基于帕妥珠单抗的方案(包括ddAC-THP(60%)、TCHP(63%)、THP(55%))的pCR率更高。THP方案因毒性导致的周期延迟显著减少,且具有最少的剂量减少、最低的住院率和最低的治疗中断率。本结果与此研究相似,THP方案pCR率稍低,但不良反应较少,尤其适合老年患者,也是临床推荐的方案之一。
本研究发现HER2阳性乳腺癌双靶向联合化疗新辅助治疗的腋窝pCR率可高达81%,对这部分患者行前哨淋巴结活检有较高的安全性,可使患者免除腋窝淋巴结清扫。这为我们在临床中,新辅助治疗后行前哨淋巴结活检提供数据支持。
我们研究中临床分期较其他临床试验和真实世界研究晚,仍然有较高的pCR率,帕妥珠单抗和曲妥珠单抗联合化疗在我国患者获益明显。随着帕妥珠单抗进入国家医保,越来越多患者得到更有效的治疗,生存率进一步提升。本研究为小样本回顾性研究,仍需要扩大样本量获得更多临床数据,更好指导临床决策。
