MiR-129-5p靶向HMGB1抑制骨肉瘤细胞增殖和迁移
2022-02-23张怀斌杨国清梁文强谢犇王勇平
张怀斌,杨国清,梁文强,谢犇,王勇平,2
0 引言
骨肉瘤(Osteosarcoma,OS)是最常见的原发性恶性骨肿瘤,主要发病于骨骼快速增长的儿童和青少年,具有高度的侵袭性和远处转移的能力,容易在发病早期和术后产生血行转移,严重威胁儿童和青少年的健康与生命[1]。临床上,OS的治疗通常是多种治疗方式相结合,包括手术、化疗和放疗,虽然辅助化疗能显著提高OS患者的生存率[2],由于OS恶性程度高、预后不良、容易复发或转移,因此研究其发病机制,从而确定有效治疗方法是OS目前研究的重要方向。
MicroRNA(miRNA)是一种进化保守的非编码单链小分子,通过结合靶点的3’UTR(untranslation region,UTR)区调控蛋白编码基因的表达,导致mRNA降解或翻译阻塞[3-5]。miRNA在生理和病理条件下都发挥着关键作用,miRNA的异常表达通过调节癌基因或肿瘤抑制因子的表达参与癌症的进展[6]。研究显示miR-129-5p参与多种肿瘤的发生、发展,如卵巢癌、乳腺癌、前列腺癌、胃癌等[7-10]。高迁移率族蛋白B1基因(HMGB1)位于染色体13q12,其编码的蛋白质具有高度保守的结构域[11-12],在多种肿瘤中高表达,通过调控细胞DNA的转录、复制和修复,参与肿瘤的发生发展、增强肿瘤化疗敏感度[13-14];因此,本研究拟通过体外细胞实验探究miR-129-5p对骨肉瘤细胞增殖和迁移的影响及其对HMGB1的调控作用,从而为OS的分子靶向治疗奠定实验基础。
1 材料与方法
1.1 细胞株和主要试剂
骨肉瘤细胞株MG-63、Saos-2、成骨细胞hFOB1.19、H-DMEM、McCoy,s5A、DMEM/F12不完全培养基、OPTI无血清培养基、PCR引物及PCR试剂盒、Western blot上样蛋白Marker、PVDF膜、兔抗人GAPDH抗体、羊抗兔HRP、Transwell小室和CCK-8试剂盒均购自武汉Servicebio公司,胎牛血清购自上海HAKATA公司。miR-129-5p抑制物、模拟物及实验相关质粒由上海艾博思生物科技有限公司合成,脂质体转染试剂Lipofectamine 6000购自上海艾博思生物科技有限公司,兔抗人HMGB1抗体购自上海Abcam公司。
1.2 细胞培养
骨肉瘤细胞MG-63、Saos-2分别培养在含10%FBS的H-DMEM和McCoy,s5A培养液中,成骨细胞hFOB1.19用含10% FBS的DMEM/F12培养液培养,培养基含有1%双抗(链霉素100 μg/ml+青霉素100 U/ml),培养箱条件为37℃、5%CO2。每隔3 d进行一次换液或常规传代,收集对数生长期细胞用于后续实验。
1.3 实验分组及细胞转染
将对数生长期MG-63、Saos-2细胞接种到6孔板中,培养至细胞融合度约80%。细胞转染按照试剂说明书进行,根据转染的目的基因不同进行如下分组:miR-129-5p inhibitor组、miR-129-5p mimic组、溶剂为NC序列阴性对照组(NC组)及空白对照组。将配好的转染液加入各孔细胞中,置于37℃培养箱中,OPTI无血清培养基培养6 h后,更换为完全培养基继续培养。
1.4 双荧光素酶报告基因检测实验
经TargetScan Human7.2检测miR-129-5p与HMGB1基因存在结合位点,上海艾博思生物科技有限公司构建了荧光素酶报告载体质粒(HMGB1-WT/HMGB1-Mut)。将细胞接种于48孔板中,培养至融合度70%,使用Lipofectamine 6000试剂将HMGB1-WT、HMGB1-Mut与miR-129-5p mimic或miR-NC共转染,按照试剂使用说明,转染48 h后测定荧光素酶活性。
1.5 RT-PCR检测
用TRIzol试剂分别提取骨肉瘤细胞MG-63、Saos-2和成骨细胞hFOB1.19及转染后各组细胞中的总RNA,使用反转录试剂盒合成cDNA,SYBR Green Master(Rox)试剂进行RT-PCR,扩增条件:95℃ 3 min、95℃ 30 s、60℃ 30 s、72℃ 20 s,共40个循环,以2-ΔΔCt法计算目的基因的相对表达量。
1.6 Western blot检测
给骨肉瘤细胞MG-63、Saos-2和成骨细胞hFOB1.19以及转染后的各组细胞中加入蛋白裂解液提取细胞中的总蛋白,BCA法测定蛋白质浓度10%SDS-PAGE凝胶电泳分离蛋白,转膜,5%脱脂牛奶的封闭1 h。加入稀释后的兔抗人HMGB1单克隆抗体(1:800)和兔抗人GAPDH多克隆抗体(1:1000),4℃孵育过夜,再用稀释后的羊抗兔IgG-HRP(1:2000)室温孵育1 h。TBST洗膜,采用ECL显色并分析条带,用Image J软件进行灰度值分析。
1.7 CCK-8实验
收集转染后的骨肉瘤细胞,制成浓度为每毫升1×105个细胞悬液,按100 µl每孔接种于96孔板。37℃培养箱培养24、48、72、96 h后,向每孔细胞加入10 µl CCK-8试剂,继续培养2 h,酶标仪测定波长在450 nm处的吸光度值(OD)。
1.8 划痕实验
转染后的各组细胞丰度达到9 0%时,用RPMI 1640无血清培养基培养12 h,然后以载玻片作依靠,用移液枪枪头在每孔中心轴进行划痕并拍照(0 h),继续培养并每24 h拍照,培养箱条件37℃、5%CO2。
1.9 Transwell迁移实验
收集转染后的骨肉瘤细胞,以无血清培养液培养12 h后,用BSA无血清培养基重悬,制备浓度为每毫升1×105个细胞悬液,取100 µl加入Transwell小室上室,下室每孔加入含10%胎牛血清的培养基600 µl,37℃培养24 h。取出小室,移去孔中培养液,用PBS洗2次,甲醇固定30 min,0.1%结晶紫染色20 min,用棉签擦净上层未迁移的细胞,PBS洗3次,倒置显微镜下随机选取5个视野观察细胞情况并拍照,Image J分析软件计数。
1.10 统计学方法
采用SPSS20.0和GraphPad Prism 8统计学软件对各实验结果进行统计分析,计量数据用x±s表示,两组之间定量资料用t检验,多组定量资料间的比较采用方差分析,组内两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-129-5p在骨肉瘤细胞中低表达
RT-PCR结果显示,与成骨细胞hFOB1.19相比,miR-129-5p在骨肉瘤细胞Saos-2(P=0.0010)和MG-63(P=0.0028)中的表达量有不同程度降低,见图1。
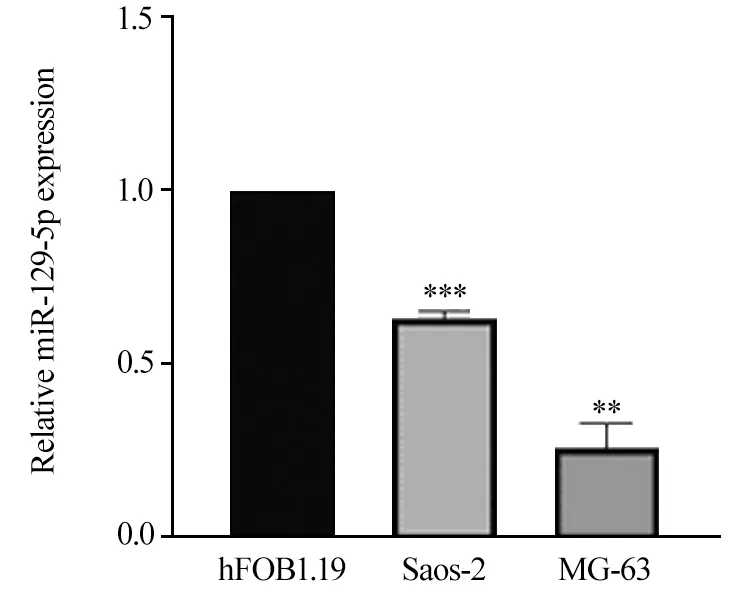
图1 miR-129-5p在不同骨肉瘤细胞株中的表达情况Figure 1 Expression of miR-129-5p in different cell lines
2.2 HMGB1在骨肉瘤细胞中高表达
Western blot结果表明,与成骨细胞hFOB1.19相比,HMGB1在骨肉瘤细胞Saos-2(P=0.0152)和MG-63(P=0.0199)中的表达呈不同程度的升高,见图2。
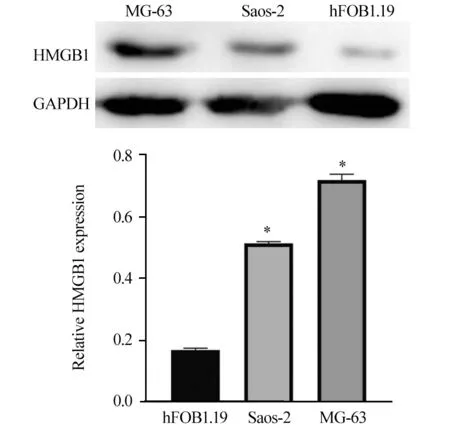
图2 HMGB1在不同骨肉瘤细胞株中的表达情况Figure 2 Expression of HMGB1 in different osteosarcoma cells
2.3 转染miR-129-5p抑制物和模拟物对骨肉瘤细胞中miR-129-5p表达的影响
MG-63、Saos-2细胞系分别转染miR-129-5p mimic、miR-129-5p inhibitor后,RT-PCR检测结果示:与NC组相比,miR-129-5p mimic组细胞中miR-129-5p的表达量显著增加(P=0.0349),见图3A;miR-129-5p inhibitor组细胞中miR-129-5p的表达量显著降低(P=0.0152),见图3B。

图3 转染miR-129-5p模拟物(A)和抑制物(B)对骨肉瘤细胞中miR-129-5p表达的影响Figure 3 Effects of transfection of miR-129-5p mimic(A) and inhibitor(B) on miR-129-5p expression in osteosarcoma cells
2.4 过表达miR-129-5p抑制骨肉瘤细胞的增殖和迁移
CCK-8检测结果表明,在MG-63细胞中转染miR-129-5p mimic后,其增殖能力受到明显抑制,与NC组相比,差异有统计学意义(P=0.0060),见图4A;划痕实验显示,在MG-63细胞中转染miR-129-5p mimic后,细胞迁移能力降低,与NC组相比,差异有统计学意义(P=0.0347),见图4B,Transwell迁移实验得出相同的结论(P=0.0034),见图4C。

图4 CCK-8法(A)、划痕实验(B)及Transwell迁移实验(C)分别检测转染miR-129-5p mimic对MG-63细胞增殖和迁移的影响Figure 4 Effects of miR-129-5p mimic transfection on proliferation and migration of MG-63 cells detected by CCK-8 assay(A),scratch assay(B) and Transwell migration assay(C)
2.5 抑制miR-129-5p促进骨肉瘤细胞的增殖和迁移
CCK-8检测结果表明,在Saos-2细胞中转染miR-129-5p inhibitor后,其增殖能力提高,与NC组相比,差异有统计学意义(P=0.0023),见图5A;划痕实验显示,在Saos-2细胞中转染miR-129-5p inhibitor后,细胞迁移能力增强,与NC组相比,差异有统计学意义(P=0.0348),见图5B,Transwell迁移实验得出相同的结论(P=0.025),见图5C。

图5 CCK-8法(A)、划痕实验(B)及Transwell迁移实验(C)分别检测转染miR-129-5p inhibitor对Saos-2细胞增殖和迁移的影响Figure 5 Effects of miR-129-5p inhibitor transfection on proliferation and migration of Saos-2 cells detected by CCK-8 assay(A),scratch assay(B) and Transwell migration assay(C)
2.6 HMGB1基因是miR-129-5p的下游靶点
根据生物信息学软件TargetScan预测miR-129-5p和HMGB1基因存在结合位点,见图6A。双荧光素酶报告基因检测实验结果显示,相比于mimiccontrol转染阴性对照组,miR-129-5p mimic转染能下调野生型HMGB1-WT质粒组的荧光素酶活性,差异有统计学意义(P=0.0429),见图6B;而突变型HMGB1-Mut质粒组的荧光素酶活性无明显变化(P>0.05),见图6B,提示HMGB1基因可能是miR-129-5p的下游作用靶点。
MG-63、Saos-2细胞系分别转染miR-129-5p mimic、miR-129-5p inhibitor后,Western blot结果表明:miR-129-5p mimic组细胞中HMGB1的表达量降低(P=0.0298),见图6C;miR-129-5p inhibitor组细胞中HMGB1的表达量显著升高(P=0.0432),见图6D,结果说明miR-129-5p与HMGB1基因之间存在靶向作用关系。
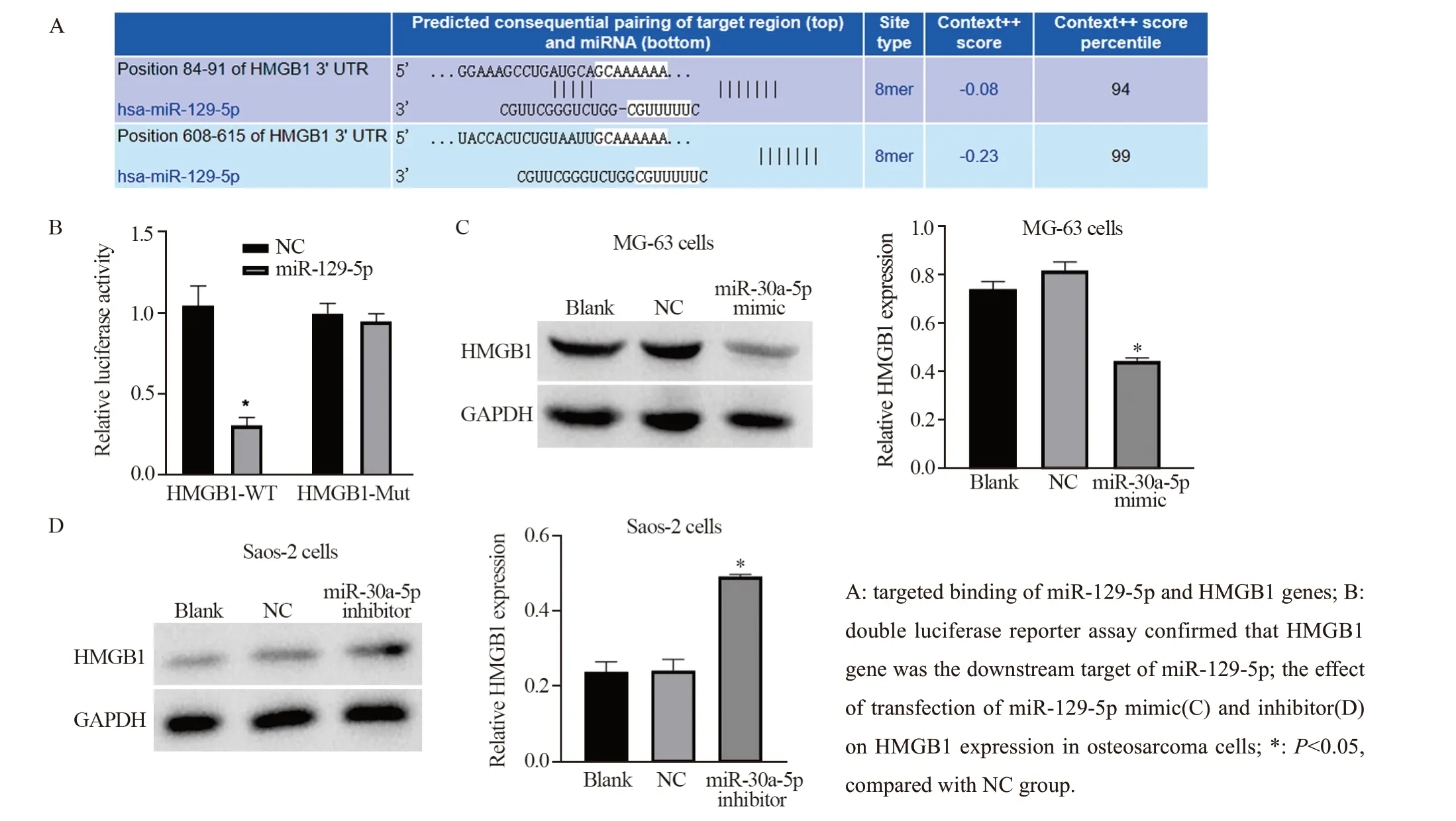
图6 miR-129-5p与HMGB1基因的靶向关系Figure 6 Targeting relationship between miR-129-5p and HMGB1 gene
3 讨论
miR-129-5p属于miR-129家族,研究表明,miR-129-5p参与乳腺癌、前列腺癌、胃癌和卵巢癌的发生发展[7-10],除了参与肿瘤细胞增殖、侵袭和迁移等生物学过程,miR-129-5p也被发现参与肿瘤细胞的上皮-间质转化、凋亡、迁移和自噬等[15-17],还具有逆转肿瘤耐药的重要功能[17-18]。Luan等[7]研究显示,通过SOX4/EZH2复合物介导的启动子H3K27me3修饰,miR-129-5p和SOX4相互调节影响乳腺癌细胞上皮间质转化和多药耐受。去甲斑蟊素可能通过抑制miR-129-5p上调Beclin-1,从而诱导前列腺癌细胞自噬、死亡和细胞增殖停滞[8]。另有研究[9]表明,miR-129-5p通过靶向IL-8参与胃癌细胞的迁移和侵袭过程。Tan等[10]研究显示miR-129-5p通过靶向转录协同激活因子YAP和TAZ抑制卵巢癌细胞增殖和存活。过表达miR-129-5p可增强MCF-7/ADM细胞对多柔比星、长春新碱的敏感度[18],还可直接靶向抑制脂肪前体细胞因子1(deltalike1 homologue,DLK1)基因影响非小细胞肺癌干细胞的耐药[17]。以上研究结果表明,miR-129-5p能够通过靶向不同基因发挥抑癌或促癌基因的作用。本研究首先通过RT-PCR分析miR-129-5p在不同骨肉瘤细胞中的表达水平,结果显示其在骨肉瘤细胞中的表达水平显著低于健康人成骨细胞,这提示miR-129-5p在OS中可能发挥抑癌基因的作用。本研究选取miR-129-5p表达量较低的MG-63细胞和较高的Saos-2细胞分别转染其模拟物和抑制物,以探讨该分子对骨肉瘤细胞增殖和迁移的影响及机制。结果发现,转染miR-129-5p模拟物后MG-63细胞中miR-129-5p的表达量显著升高,且MG-63细胞增殖和迁移能力受到显著抑制;转染miR-129-5p抑制物后Saos-2细胞中miR-129-5p的表达量显著降低,且Saos-2细胞增殖和迁移能力得到增强,提示miR-129-5p在OS中可能起抑癌作用。
本研究还通过Western blot实验研究不同骨肉瘤细胞系中HMGB1的表达水平,结果显示其在骨肉瘤细胞中的表达水平高于健康人成骨细胞,表明HMGB1高表达可能是导致OS的原因,且过表达和抑制miR-129-5p会引起骨肉瘤细胞中HMGB1表达的降低和增高。HMGB1编码的蛋白质是一种广泛存在于真核生物细胞核的高度保守的核蛋白,具有调控转录活性的功能。HMGB1高表达与多种恶性肿瘤的生长、浸润和转移相关[19-21]。Ladoire等[22]证实HMGB1在乳腺癌中表达与肿瘤浸润和转移程度呈正相关。Chen等[23]研究显示,瞬时敲低HMGB1可抑制肝癌细胞增殖,促进其凋亡,诱导S期阻滞,抑制其体外迁移和侵袭。Liu等[24]研究表明,miR-181b能够靶向HMGB1-3’UTR抑制其表达,进而抑制非小细胞肺癌细胞侵袭和转移。本研究通过生物信息学软件预测发现miR-129-5p和HMGB1基因存在结合位点,经双荧光素酶报告基因检测实验验证HMGB1基因可能是miR-129-5p的下游作用靶点,并发现转染miR-129-5p模拟物后MG-63细胞中HMGB1的表达量降低,而转染miR-129-5p抑制物后Saos-2细胞中HMGB1的表达量升高。
综上所述,miR-129-5p在骨肉瘤细胞中呈低表达,可以减弱骨肉瘤细胞的增殖和迁移能力,降低HMGB1的表达,提示miR-129-5p在骨肉瘤中扮演抑癌基因的角色,其作用机制可能是通过抑制HMGB1表达实现的。此外,本研究缺乏HMGB1基因过表达、敲除实验以及动物体内实验证明,后续将完善该部分实验并开展动物体内荷瘤实验,以期深入验证miR-129-5p和HMGB1在OS中的功能和作用机制。
