骆驼血清中不同抗体亚型对除草剂 麦草畏的性能研究
2022-02-21王志佳霍静倩张金林
何 枞,王志佳,霍静倩,周 惠,薛 雨,陈 来,张金林
(河北农业大学 植物保护学院, 河北 保定 071001)
麦草畏是农业上用于防治杂草的一类常用除草剂,在生产中,麦草畏的不合理使用可能会对土壤和水体造成污染[1]。2019 年1 月我国农业农村部批准了《2018 年农业转基因生物安全证书(进口)批准清单》,其中包含孟山都远东有限公司生产的耐麦草畏大豆(MON 87708)在内的20 个耐除草剂作物,这意味着我国开始接受并种植转基因作物,因此麦草畏的使用量也会进一步增加。此外,由于麦草畏漂移作用造成的非靶标作物药害问题也日益引起广泛重视。因此,构建麦草畏高效快速检测方法越显重要。
近年来,基于纳米抗体的酶联免疫技术在农药等小分子污染物的快速检测分析方面发挥重要作用。纳米抗体是20 世纪90 年代,由比利时的Hamers-Casterman C 等人在骆驼血清中发现的一种天然缺失轻链的IgG2 和IgG3 亚型的重链抗体,是目前已知最小的抗原结合片段[2]。随后,有研究人员在鱼鳐、鲨鱼等软骨鱼类动物中也发现类似重链抗体结构的抗原受体[3]。
纳米抗体最初应用于诊断和治疗领域,从生物学、免疫遗传学再到医学等各个领域,纳米抗体具有常规抗体无可比拟的优点。同时,从结构上来看,它可以识别常规抗体不能识别的结构以及隐蔽表位[4]。此外,相比传统的抗体而言,纳米抗体还具有许多优点,例如,它的分子量小,约为15 kD,仅为常规抗体的1/10;稳定性好,水溶性高,不易聚集,可以在细胞中发挥作用;亲和力高,纳米抗体与抗原结合的亲和力可达nM,甚至pM 级;它能耐受极端理化环境,如在90 ℃高温或蛋白酶存在下仍具有活性,特异性高,易于制备,能够在原核表达系统中高质量生产[5-6]。因而,纳米抗体成为检测食品毒素、农兽药残留及环境污染物的理想抗体。
本研究选用河北省唐山市丰南区漠尚客骆驼养殖专业合作社的3 岁雄性双峰驼,并利用麦草畏的免疫抗原对双峰驼进行免疫,以期获得具有较好灵敏性和特异性的抗血清,为后期淘选出能够特异性识别麦草畏的纳米抗体奠定基础。
1 材料与方法
1.1 试验材料
本试验所使用的麦草畏包被抗原(21-OVA)和免疫抗原(21-Thy)均为河北农业大学植物保护学院农药实验室制备和保存。试验过程中所用药剂均为市售化学纯或分析纯,所用缓冲液均为河北农业大学植物保护学院农药实验室制备和保存。
部分缓冲液配方如下:
10×磷酸盐缓冲液(10×PBS):320 g NaCl, 8 g KCl,116 g Na2HPO4·H2O,8 g KH2PO4,加超纯水定容至4 L,室温保存。1×磷酸盐缓冲液(1×PBS):取100 mL 的10×PBS 和900 mL 超纯水,混合均匀,室温保存。包被缓冲液:取0.795 g Na2CO3和1.465 g NaCO3加超纯水定容至1 L,调节pH 至9.6,4 ℃保存。1×磷酸盐吐温缓冲液(1×PBST):取2 L 1×PBS和1 mL 吐温20 混匀后,室温保存。
1.2 试验方法
1.2.1 血清的采集与处理 将麦草畏的免疫抗原,通过混合弗氏不完全佐剂皮下分点注射于骆驼体内。每2 周免疫1 次,免疫6 次后取血。通过静脉真空采血管收集血液,并于4 ℃保存。取50 mL 无菌离心管,将血液分装,并于4 000 r/min,4 ℃离心10 min, 取上清分装保存于-20 ℃。
1.2.2 IgG 分离纯化 分离纯化具体步骤为:首先用15 mL 的1×PBS 溶液清洗并平衡protein G 柱和protein A 柱,使层析柱内的pH 保持中性。之后取3 mL 血清加2 mL 的1×PBS 进行稀释,并用0.45 μm 滤膜过滤稀释样品。将样品缓慢通过protein A 柱,并收集流出液。该步骤重复2 次,保证蛋白结合率,之后再次收集流出液。分别用IgG3 buffer,IgG1 buffer 清洗protein G 柱,得到粗蛋白IgG3 和IgG1溶液。基于相同原理,用IgG2 buffer 清洗protein A柱,得到粗蛋白IgG2 溶液。将收集的粗蛋白溶液用1 mol/L Tris-HCl 缓冲液(pH 为9.0)调整pH 至7.0。
将上述所得溶液进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检验,并用SDS-PAGE 蛋白快速染液染色30 min,清水脱色并分析IgG 分离纯化结果。
1.2.3 ELISA 评估 取经纯化得到的IgG1、IgG2 和IgG3 溶液,用1×PBS 在4 ℃条件透析72 h,超滤管浓缩后进行下一步试验。
取麦草畏包被抗原21-OVA 稀释500 倍,稀释后的浓度为0.010 mg/mL,之后将100 μL 稀释后21-OVA 包被于96 孔板,4 ℃条件下包被过夜;取200 μL 的1×PBST 冲洗3 次并拍干后在孔内加入200 μL 的3%脱脂奶粉,并在室温条件进行封闭反应1 h。经3 次200 μL 的1×PBST 冲洗并拍干后,加入稀释后的血清或IgG 抗体,并在室温条件进行结合反应1 h。经5 次200 μL 的1×PBST 冲洗并拍干后,向孔内加入100 μL 的3 000 倍稀释后的羊抗驼HIS 二抗,并在室温条件进行结合反应1 h。最后用每孔200 μL 的1×PBST 冲洗5 次后并拍干,加入100 μL 显色液,室温条件下显色15 min 后,用50 μL 2 mol/L H2SO4终止反应并用酶标仪进行 读数。
采用间接竞争ELISA 试验评价不同抗体对麦草畏的亲和性能和特异性能包被,封闭,洗涤步骤同上。在进行间接竞争反应时,加入抗体的同时加入等量不同浓度的麦草畏或麦草畏结构类似物溶液。IgG1和IgG3 抑制效果测定所用的麦草畏浓度为0、0.1、0.5、1、5、10、25、50、100 μg/mL,IgG2 抑 制效果测定所用的麦草畏浓度为0、0.1、1、5、10、25、50、100 μg/mL,按照此浓度进行稀释后依次每孔加入50 μL 麦草畏或麦草畏结构类似物溶液和50 μL 抗体。
在特异性能试验中,方法、步骤都与亲和性能相同,其中IgG 抑制效果测定所用的麦草畏结构类似物浓度为0、0.1、1、5、10、25、50 和100 μg/mL。
1.3 数据分析
采用Origon 8.5 软件对数据进行处理分析,通过标准曲线,得出IC50,以此比较3 种不同抗体亚型对麦草畏的亲和性能。
通过测试IgG 对麦草畏结构类似物的交叉反应率(Cross-reactivity, CR)来评估不同抗体亚型对麦草畏识别的特异性能。CR 由以下公式计算:

2 结果与分析
2.1 IgG 分离纯化
通过交替使用Protein A 和Protein G 亲和层析柱,分离纯化得到常规抗体IgG1 和天然缺失轻链的重链抗体IgG2 和IgG3。如图1 所示,通过SDSPAGE 验证,其中IgG1 具有50 kD 的重链部分和25 kD 轻链部分,而IgG2 和IgG3 只有大小约为 50 kD 的重链部分。根据先前研究报道,3 个亚型大小基本符合[7]。
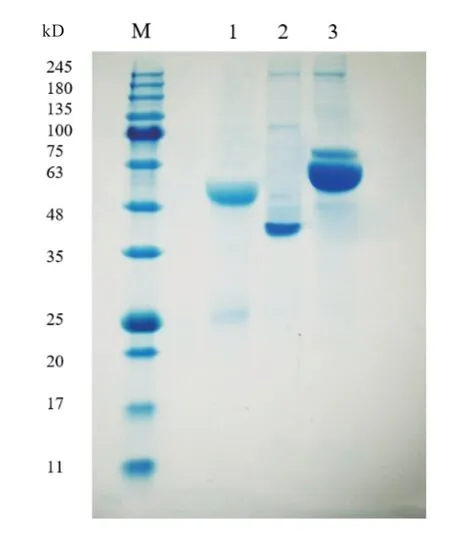
图1 不同抗体亚型的SDS-PAGE 分析Fig. 1 SDS-PAGE analysis of different antibody subtypes
2.2 免疫前血清ELISA 评估
根据1.2.3 方法进行试验,在免疫前对双峰驼原始血清进行效价评估,其中包被抗原和血清浓度如表1 所示,不同组合间均设置3 个重复。结果显示,在包被抗原浓度为0.05 mg/mL 时,不同浓度血清的OD 值没有差别,分别为0.279 和0.281。随着包被抗原和血清稀释浓度的增加,OD 值变化不大。由检测结果可知免疫前所用双峰驼的血清对麦草畏的效价较低,符合试验要求,可进行下一步的免疫试验。
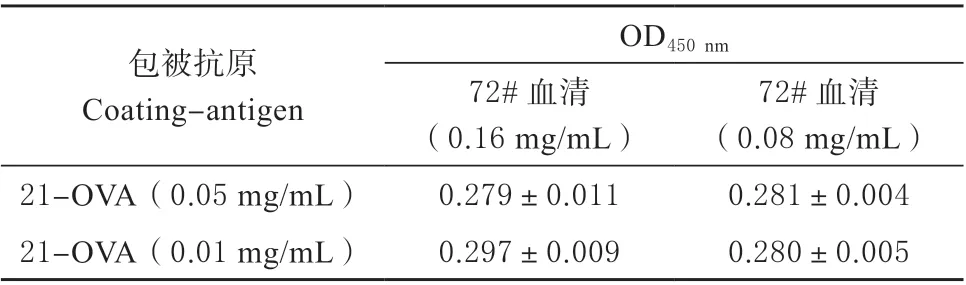
表1 原始血清效价分析Table 1 Analyzing the titer of original serum
2.3 免疫后血清ELISA 评估
取浓缩后的IgG1、IgG2 和IgG3,根据棋盘法筛选抗体与包被抗原最优组合。其中包被抗原和抗体浓度如表2 所示,不同组合间均设置3 个重复。结果发现随着抗体稀释倍数和包被抗原稀释倍数的增加,其OD 值呈下降趋势。
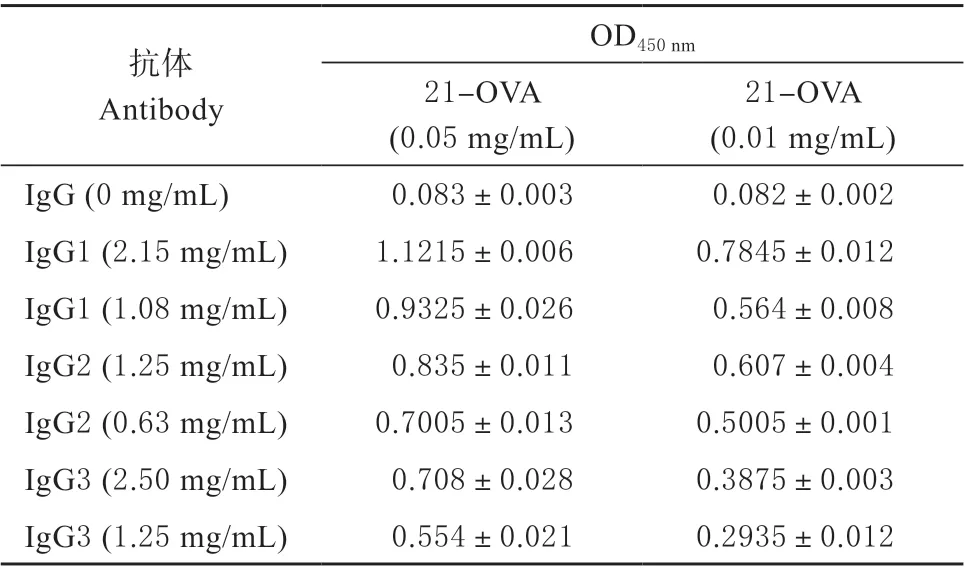
表2 棋盘法筛选抗体与包被抗原组合Table 2 Checkerboard method for screening the combination of antibody and coating-antigen
2.3.1 血清亲和性能测定 根据表2 结果筛选出OD值在0.8 ~1.2 之间的组合,分别为21-OVA(0.05 mg/mL) /IgG1(1.08 mg/mL)、21-OVA(0.05 mg/mL) /IgG2(1.25 mg/mL)、21-OVA(0.05 mg/mL) /IgG3(1.25 mg/mL),进行后续亲和性能的测定。麦草畏浓度如1.2.3 所示。根据竞争性ELISA 方法,可以得到以麦草畏浓度为横坐标,OD 值为纵坐标的S 型标准曲线。如图2 所示,随着麦草畏浓度的增大,3 个图中的OD 值均呈现下降趋势。图a 所示,针对麦草畏的IgG1 的IC50值为0.11 μg/mL,线性范围为0.002 ~5.47 μg/mL;如图b 所示,IgG2 的IC50值为0.10 μg/mL,线性范围为0.012 ~2.97 μg/mL;如图c 所示, IgG3 的IC50值为0.19 μg/mL,线性范围为0.013 ~2.98 μg/mL。
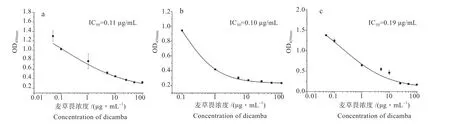
图2 不同抗体亚型的IC50 数据分析Fig. 2 Analysis of IC50 for different antibody subtypes
从结果来看,尽管IgG1 的IC50值最低,但3 种亚型IC50值却相差不大。这说明双峰驼体内产生针对麦草畏的纳米抗体的可能性较大,为后期筛选工作奠定基础。
2.3.2 血清特异性能分析 根据前人研究报道结果[8],对麦草畏结构类似物进行不同抗体亚型的特异性能分析。在筛选中,发现IgG1 对2,3,6-三氯苯甲酸有一定的交叉反应。其中IgG1 的IC50值为0.21 μg/mL。而IgG2 和IgG3 并没有得到相应的IC50值,说明这2种抗体亚型对麦草畏具有较好的特异性。
结果如表3 所示,在所有麦草畏结构类似物中,只有IgG1 对2,3,6-三氯苯甲酸存在一定的交叉反应,交叉反应率为52%,而IgG2 和IgG3 无交叉反应。由于IgG1 为传统抗体,交叉反应现象存在较为普遍。2,3,6-三氯苯甲酸对IgG2 和IgG3 无交叉反应,这表明双峰驼所产生的重链抗体对麦草畏的特异性较高,具有一定研究价值。
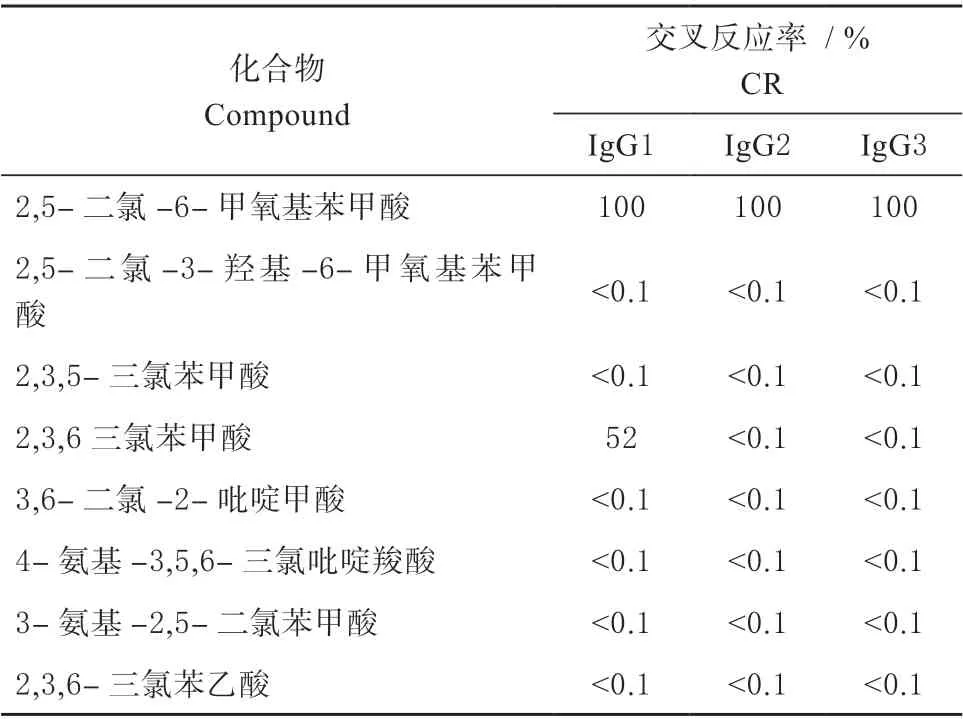
表3 IgG 对麦草畏结构类似物交叉反应Table 3 Cross-reactivity of IgG to structural analogues of dicamba
3 讨论与结论
目前,麦草畏的检测方法包括气相色谱[8]、液相色谱[9]等仪器检测方法。以上检测法都具备精确度高、检测范围广等优点,但是这些方法不适用于现场检测,通常需要繁琐的样品制备过程,且耗费时间和浪费大量有机溶剂,也不适用于快速检测大量样品[10]。在2001 年,Clegg 等人首次开发出麦草畏多克隆抗体,其IC50为195 ng/mL,灵敏性相对较低[11]。随后,Huo 等人建立了麦草畏的间接竞争化学发光酶免疫分析方法(CLEIA),该方法的IC50为0.874 ng/mL,灵敏性比常规酶免疫法高15 倍以上[12]。然而多克隆抗体也存在一些不足,例如交叉反应率高,不能大量产生,同时对免疫原蛋白纯度要求较高并且对外界环境较敏感等问题,因此不能广泛应用于各个检测领域。
近些年,纳米抗体由于其高表达量,高稳定性以及易于改造等优势逐步成为研究热点。相对于多克隆抗体和单克隆抗体,纳米抗体可变区中的CDR-H3 抗原结合区域更长,稳定性更强且具有更丰富的大凸环抗原结合构象,可以深入到具有裂缝结构的抗原内部来实现免疫应答[13]。而传统抗体Fab 片段及单链抗体的抗原结合表面常形成凹形拓扑结构,通常只能识别位于抗原表面的位点,无法和具有裂缝结构的抗原结合[14],因此纳米抗体可以结合常规抗体无法接近的抗原表位,从结构上来讲,IgG2 和IgG3 比IgG1 可能具有更强的结合能力。Xu 等人通过免疫骆驼获取纳米抗体,构建了一种检测土壤和韭菜中的氰虫苯甲酰胺和氯虫苯甲酰胺的ELISA 方法,其IC50分别为1.2 和1.5 ng/mL[15]。 此外,Li 等人通过免疫美洲驼,分离骆驼血清并提取RNA,进行目的片段扩增,构建纳米抗体噬菌体展示文库以及亲和淘选等方法获得能够特异性识别2,4-D 的纳米抗体,并基于该纳米抗体构建了一种快速检测2,4-D 的荧光酶免疫法(FLEIA),其IC50值为29.2 ng/mL,可以用于监测其在环境水体中的污染[16]。
本研究通过间接竞争性ELISA 试验,得出3 种不同抗体亚型IgG1、IgG2 和IgG3 的IC50值分别为0.11、0.10 和0.19 μg/mL。3 种 抗 体 亚 型 的IC50值接近且都比较低。同时,在IgG 对麦草畏的特异性试验中,发现只有IgG1 对2,3,6-三氯苯甲酸具有一定的交叉反应,说明本研究中获得的3 种抗体亚型具有较好的灵敏性和特异性,能够为后续试验中筛选出特异性识别麦草畏的纳米抗体奠定重要基础。
