血清E-cadherin、IFN-α、β2-GP1-Ab水平与系统性红斑狼疮患者疾病活动强度的关系*
2022-02-19汪方园银广悦
汪方园,孙 岩,张 维,武 杰,银广悦
河北中石油中心医院检验科,河北廊坊 065000
系统性红斑狼疮(SLE)是临床上较为常见的自身免疫性结缔组织病,可累及全身多个脏器及系统。SLE的发生发展受遗传、药物、环境、性激素等因素的影响,这些因素可诱发机体异常免疫应答,持续产生大量致病性补体和自身抗体,形成免疫复合物,从而造成组织损伤[1]。SLE患者存在外周血单核细胞黏附分子αEβ7高表达的情况,黏附分子E-钙黏蛋白(E-cadherin)为αEβ7的一个配体,因此E-cadherin可能与SLE疾病活动强度存在一定联系[2]。SLE激活的免疫细胞可产生并释放大量炎性因子如白细胞介素(IL)-6、干扰素-α(IFN-α)等,有研究报道非自身免疫功能紊乱患者接受IFN-α治疗后可产生自身抗体,并出现类似SLE的症状[3]。抗β2糖蛋白1抗体(β2-GP1-Ab)及其抗原可激活血管内皮细胞炎症因子、黏附分子、血小板(PLT)等,致使抗凝因子和凝血因子之间的平衡被打破,其可能参与了SLE的发生[4]。因此,本研究依照SLE疾病活动型指数(SLEDAI-2000)评分评估患者疾病活动强度,并对比了不同SLEDAI-2000评分患者E-cadherin、IFN-α、β2-GP1-Ab水平,以探讨以上指标在SLE发病和发展中的作用。
1 资料与方法
1.1一般资料 选取本院2017年8月至2020年8月收治的196例SLE患者为研究对象,纳入标准:(1)均符合美国风湿病协会1997年制订的SLE诊断标准[5];(2)经临床及病理学检查证实;(3)临床资料完整。排除标准:(1)合并其他自身免疫性疾病者;(2)合并原发性心血管疾病、糖尿病及其他肾损伤者;(3)近期服用影响本研究结果药物的患者;(4)依从性差及沟通障碍者。所有SLE患者通过SLEDAI-2000评分[6]评估疾病活动强度,标准:0~<5分为稳定;5~<10分为轻度活动;10~<15分为中度活动;≥15分为重度活动,并分为稳定组65例、轻度活动组51例、中度活动组42例和重度活动组38例。其中稳定组男9例、女56例,年龄13~55岁、平均(33.3±3.7)岁;轻度活动组男7例、女44例,年龄16~58岁、平均(32.7±3.9)岁;中度活动组男5例、女37例,年龄13~56岁、平均(33.6±3.9)岁;重度活动组男5例、女33例,年龄15~54岁、平均(33.2±3.7)岁。另选择同期40例体检健康者作为对照组,无相关禁忌证。各组研究对象性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究获得本院医学伦理委员会批准,所有受试者均自愿参与本研究并签署知情同意书。
1.2方法 所有患者于清晨收集5 mL空腹静脉血,采用ALLEGRAX-12医用离心机(美国贝克曼库尔特公司)3 000 r/min离心15 min分离血清,采用SF-3000型血细胞分析仪及配套试剂(日本希森美康株式会社)检测PLT水平,采用ACLFUTURA全自动凝血仪及配套试剂(美国IL公司)检测活化部分凝血活酶时间(APTT)、凝血酶原时间(PT),采用酶联免疫吸附试验检测红细胞沉降率(ESR)、C-反应蛋白(CRP)、IL-6、补体C3、补体C4、、E-cadherin、IFN-α、β2-GP1-Ab水平,试剂盒购自上海生工生物工程有限公司。操作流程均由专业人员严格依照仪器及试剂盒说明书进行操作。
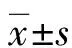
2 结 果
2.1各组临床指标水平比较 各组间ESR、CRP、PLT、IL-6、补体C3、补体C4、E-cadherin、IFN-α、β2-GP1-Ab水平及APTT、PT、SLEDAI-2000评分比较,差异均有统计学意义(P<0.05);稳定组与轻度活动组上述各指标比较,差异均无统计学意义(P>0.05),且稳定组与轻度活动组ESR、CRP、IL-6、E-cadherin、IFN-α水平、SLEDAI-2000评分低于中度活动组和重度活动组,APTT、PT、PLT、补体C3、补体C4、β2-GP1-Ab水平高于中度活动组和重度活动组(P<0.05);重度活动组与中度活动组上述各指标比较差异均有统计学意义(P<0.05)。见表1。

表1 各组临床指标水平比较

组别nAPTT(s)PT(s)E-cadherin(pg/mL)IFN-α(pg/mL)β2-GP1-Ab(U/mL)SLEDAI-2000评分(分)对照组4044.5±3.314.5±0.965.1±2.60.6±0.359.2±64-稳定组6541.5±3.2a13.6±1.9a68.2±2.9a3.1±0.4a40.3±5.8a3.3±0.8轻度活动组5141.1±3.4a13.5±1.7a68.5±3.0a3.1±0.6a38.7±5.5a8.1±1.0b中度活动组4236.2±3.7abc12.4±1.2abc70.5±3.3abc3.9±0.9abc25.3±3.4abc13.2±1.6bc重度活动组3830.2±2.5abcd10.6±1.2abcd79.8±3.9abcd5.6±1.3abcd9.2±1.6abcd18.5±2.3bcdF18.6779.81515.93911.54040.66539.370P<0.001<0.001<0.001<0.001<0.001<0.001
2.2各组临床症状发生率比较 各组口腔溃疡、脱发、皮疹、光敏感、血液系统损伤、浆膜炎发生率比较,差异均有统计学意义(P<0.05),其中重度活动组上述临床症状发生率高于其余3组(P<0.05),中度活动组皮疹、浆膜炎发生率高于稳定组和轻度组(P<0.05)。稳定组和轻度活动组临床症状发生率比较,差异均无统计学意义(P>0.05),各组发热、乏力、肌痛、关节炎、肝肾功能损伤发生率比较,差异均无统计学意义(P>0.05)。见表2。

表2 各组临床症状发生率比较[ n(%)]

组别n关节炎光敏感血液系统损伤浆膜炎肝肾功能损伤稳定组6524(36.9)2(3.1)3(4.6)5(7.7)5(7.7)轻度活动组5121(41.2)3(5.9)4(7.8)6(11.8)5(9.8)中度活动组4217(40.5)7(16.7)a6(14.3)a12(28.6)ab6(14.3)重度活动组3817(44.7)9(23.7)abc10(26.3) abc13(34.2)abc8(21.1)χ20.21413.44612.15615.7014.443P0.9750.0040.0070.0010.218
2.3E-cadherin、IFN-α、β2-GP1-Ab与临床指标的相关性分析 E-cadherin、IFN-α水平与CRP、IL-6、SLEDAI-2000均呈正相关(P<0.05),与补体C3、C4水平均呈负相关(P<0.05);β2-GP1-Ab与CRP、IL-6、SLEDAI-2000评分均呈负相关,与补体C3、C4均呈正相关(P<0.05)。见表3。

表3 E-cadherin、IFN-α、β2-GP1-Ab与临床指标的相关性分析
2.4SLE患者有无临床症状对E-cadherin、IFN-α、β2-GP1-Ab水平的影响 根据2.2中196例SLE患者临床症状发生情况,将其分为有临床症状组154例,无临床症状组42例,结果发现有临床症状组E-cadherin、IFN-α、β2-GP1-Ab水平高于无临床症状组。见表4。

表4 SLE患者有无临床症状对E-cadherin、IFN-α、β2-GP1-Ab水平的影响
3 讨 论
SLE自身免疫异常的表现较多,如淋巴细胞凋亡、细胞因子分泌异常、抗原呈递细胞功能紊乱、免疫耐受及补体缺陷等,SLE病情迁延难愈,具有较高的病死率,因此了解其发病机制并及早作出诊断和治疗至关重要。本研究结果显示,随着SLE患者疾病活动强度增加,PLT、补体C3、补体C4水平降低明显,ESR水平及APTT、PT明显升高(P<0.05)。PLT水平降低在SLE患者中较为常见,为SLE患者血液系统受损的主要表现[7]。补体水平降低与SLE疾病活动的相关性已有研究证实,有研究报道多数SLE患者在皮肤组织和肾组织存在大量补体C3沉积,造成低补体血症[8]。上述研究提示,PLT、补体C3、补体C4、ESR、APTT、PT等临床指标与SLE患者疾病活动强度相关。
细胞因子既是系统免疫功能执行的重要介质,也是神经系统、内分泌系统、血液系统等之间联系的桥梁物质。细胞黏附因子在免疫、炎症等反应中起着关键作用,细胞黏附分子是细胞与细胞、细胞与基质进行黏附的重要物质。E-cadherin为介导细胞间质黏附的钙依赖性跨膜糖蛋白,主要分布于机体上皮组织中。E-cadherin水平升高可导致细胞黏附性增加,E-cadherin还可作为一种免疫调节剂,研究证实E-cadherin水平在SLE合并肾炎患者中明显升高,是狼疮性肾炎诊断的有效标志物,αEβ7/CD103可与E-cadherin相互作用导致上皮炎症[9]。本研究中,随着SLE患者疾病活动强度增加,血清E-cadherin水平明显升高。在自身免疫性疾病中,由于炎症介质和细胞因子的刺激,可导致基质金属蛋白酶水平升高,促使E-cadherin裂解释放。本研究中,E-cadherin水平与SLE患者CRP、IL-6呈正相关,提示其与SLE患者系统性炎症存在密切关系。
在炎症因子聚集的影响下可导致SLE患者形成多种免疫复合物和自身抗体,从而造成多器官、系统的损伤。INF-α为活化T细胞、NK细胞、单核-巨噬细胞等产生的多功能细胞因子,可发挥抗病毒、免疫调节等作用。本研究中,SLE患者疾病活动性增加,IFN-α的水平也随之升高。IFN-α在SLE疾病发生发展中主要有以下几种作用[10-12]:诱导T细胞IL-2表达,从而刺激炎症因子释放,造成多靶点损伤;激活NF-kB等信号通路,增加促炎靶基因转录翻译,加速机体免疫失衡;诱导TGF-β活化,促进B细胞产生更多的自身免疫抗体。本研究中,IFN-α水平与疾病活动强度SLEDAI-2000评分、CRP、IL-6呈正相关,与补体C3、C4呈负相关。提示IFN-α是SLE发病的重要机制,与疾病活动强度关系密切。β2-GP1-Ab是以磷脂结合蛋白为抗原的抗磷脂抗体,是重要的抗磷脂抗体辅助因子,也是导致抗磷脂抗体综合征发生的主要抗体,研究表明β2-GP1-Ab参与了自身免疫性疾病的形成过程[13-14]。本研究中,β2-GP1-Ab随着SLE疾病活动强度增加而降低,证实了其参与了SLE的发生与进展。相关性分析结果显示,β2-GP1-Ab水平与SLE患者炎症标志物CRP、IL-6、SLEDAI-2000评分、补体C3、补体C4存在相关性。
在SLE患者中皮肤黏膜损伤的发生率较高,可分为非特异性损伤和特异性损伤两种,非特异性损伤包括皮肤血管炎、雷诺现象、脱发等,特异性损伤包括光敏感、口腔溃疡、浆膜炎等[15]。本研究中,随着SLE患者活动强度增加,口腔溃疡、脱发、皮疹、光敏感、血液系统损伤、浆膜炎等发生率升高;有临床症状组E-cadherin、IFN-α、β2-GP1-Ab水平高于无临床症状组(P<0.05)。提示,E-cadherin、IFN-α、β2-GP1-Ab与SLE患者皮肤损伤有关,三者参与了SLE疾病进展过程。本研究推测,SLE患者E-cadherin、IFN-α、β2-GP1-Ab均可干扰免疫调控通路,导致T细胞、B细胞等活化、炎性细胞增加,从而导致基质间黏附作用和内皮细胞活化,促使SLE的形成并促进稳定期向活动期转变。综上所述,SLE患者血清E-cadherin、IFN-α、β2-GP1-Ab水平异常,且与疾病临床表现和活动程度有密切关系。
