基于转录组测序方法研究加替沙星对小鼠的肝损伤作用
2022-02-15国瑞贤谢广云
国瑞贤,谢广云*,韩 莹*
(1.中央民族大学药学院,北京 100081;2.中国疾病预防控制中心职业卫生与中毒控制所,北京 100050;3.中国食品药品检定研究院化学药品检定所抗生素室,北京 102629)
【关键字】加替沙星;肝毒性;转录组学;差异表达基因;小鼠
氟喹诺酮类药物(fluoroquinolones,FQs)是一种常见的广谱杀菌药物,因其与很多抗菌药物之间的交叉耐药性比较低,广泛应用于治疗人类、农场动物和鸟类感染性疾病[1-3]。但是在临床使用中发现,FQs会对患者的肝脏造成一定的损伤[4-6]。曲伐沙星因其有致肝炎甚至严重肝衰竭等不良反应被撤出市场[7]。据研究表明[8],FQs中涉及肝毒性的共有环丙沙星、莫西沙星、氧氟沙星、洛美沙星、诺氟沙星、左氧氟沙星、加替沙星、依诺沙星等8个品种。FQs是我国生产和使用最为常见的一类抗生素,故研究FQs的毒理效应对于其安全性评价具有重要意义。
加替沙星(gatifloxacin,GAT)是第四代氟喹诺酮类药物的典型代表药物,广泛应用于国内外市场。由于可能产生低血糖或高血糖等严重乃至致命的不良反应,该药物从美国和加拿大市场上被撤销。而中国和其他一些发展中国家仍在使用GAT作为药物[9]。临床上报道[10],它会引起恶心、头晕、躁动和焦虑。Oladapo Rotimi等[11]研究了10、20、40和80 mg/kg 4个剂量加替沙星对大鼠肝脏氧化应激相关的表观遗传学和细胞凋亡相关基因的表达影响,结果表明,10 mg/kg的加替沙星即可诱导肝细胞凋亡和表观遗传变化。但是上述研究均未提及肝毒性。GAT在土壤、水和食物中的积累将通过食物链增加对人类健康的风险,因此需要评估GAT是否会导致肝毒性。
转录组测序(RNA sequencing,RNA-seq)技术可以捕捉不同组织或状态下的转录组动态变化,通过分析不同因素作用下的基因在RNA水平表达的差异,可以将显著差异表达的基因与某些生物学功能联系起来,用于检测早期损伤标志物和分子调控机制的研究[12]。
为了评估GAT暴露是否会产生肝毒性,本文以SPF级昆明小鼠为研究对象,通过检测小鼠血清肝功能指标变化,采用转录组测序技术检测对照组和GAT给药组小鼠肝组织的转录组动态变化,初步探讨加替沙星造成小鼠肝损伤的机制,为深入研究GAT造成人肝损伤的机制提供依据,并为FQs的环境质量标准、药物监管和风险评估提供理论依据。
1 材料与方法
1.1 试剂
加替沙星(GAT,纯度97.2%)由中国食品药品检定研究院提供。谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、碱性磷酸酶(alkaline phosphatase,AKP)、肌酐(creatinine,CRE)和甘油三酯(triglyceride,TG)试剂盒,均购自南京建成生物工程研究所。
1.2 实验动物与处理
32只SPF级雄性昆明小鼠(26~28 g)购自斯贝福(北京)实验动物科技有限公司,动物许可证号SCXK(京)2019-0010。本研究所涉及的动物实验由中央民族大学生物与医学伦理审查委员会批准,动物实验批准号ECNUC2021002AO。
小鼠适应性饲养3 d后,随机分为4组,每组各8只。对照组按10 mL/kg灌胃给予双蒸水。加替沙星低、中、高剂量给药组分别按25、50、100 mg/kg灌胃给药,每天1次,连续7 d。饲养环境保持22~24℃的温度,40%~60%的相对湿度,12 h/12 h昼夜交替。各组小鼠饲养和管理条件相同,每天为小鼠提供干净的饮用水和食物。给药7 d后处死小鼠,采血制备血清,取出肝脏并称取质量,按下式计算肝脏系数。
肝脏系数=肝脏质量/体质量×100%
1.3 血清肝功能指标检测
采用试剂盒检测各组小鼠血清中的ALT、AST、AKP、CRE和TG的浓度。
1.4 肝组织转录组测序
对照组和中剂量GAT组随机取3只小鼠的肝组织样本,用0.9%氯化钠溶液冲洗残余血迹,即刻置于含5倍量RNA later试剂的EP管中,随后置于-20℃冰箱备用。用TRIzol试剂(美国Sigma公司)从肝脏组织中提取总RNA,选择质量合格的总RNA作为mRNA测序的建库起始样品,其质量要求通过Agilent 2100 Bioanalyzer(Agilent Technologies,Santa Clara,CA,USA)检测,单次建库要求RNA总量1μg,浓度≥50 ng/μL,D(260)/D(280)介于1.8~2.2之间。用QUBIT RNA Assay Kit对起始的Total RNA进行准确定量。随后,反转录合成双链cDNA,对这些cDNA进行纯化、回收、黏性末端修复,并进行PCR扩增,最后建库测序。建库测序由上海美吉生物医药科技有限公司完成。
1.5 差异表达基因筛选
将得到的原始测序数据进行过滤筛选,得到高质量的测序数据(clean data)用于后续分析。使用软件RSEM(http://deweylab.github.io/RSEM/)分别对基因和转录本的表达水平进行定量分析,获得基因的read counts数后,进行样本间基因的表达差异分析。使用edgeR根据read count进行差异表达水平计算,筛选条件为:FDR<0.05,|log2FC|≥1。筛选出差异表达基因(differentially expessed gene,DEG)。
1.6 差异表达基因的GO和KEGG富集分析
得到DEG后,为进一步了解差异表达基因的功能,阐述其在分子水平上的作用,通过使用g:Profiler和Goatools的功能注释工具对差异表达基因进行GO注释,并采用京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库进行信号通路富集分析,Bonferroni校正的P<0.05。
1.7 统计分析
实验结果数据以±s表示,使用SPSS 20.0进行统计学分析。计量资料采用单因素方差分析法,组间两两比较方差齐性时用LSD法,方差不齐时用Dunnettt检验。P<0.05表示差异有统计学意义。
2 结果
2.1 小鼠肝脏的质量变化
给药7 d后,各组小鼠的肝脏质量和肝脏系数如图1所示,可见与对照组比较,高剂量GAT组小鼠的肝脏绝对质量降低(P<0.05),低剂量和中剂量GAT组小鼠的肝脏系数降低(P<0.05)。

图1 加替沙星对小鼠肝脏质量的影响
2.2 加替沙星对小鼠血清肝功能指标的影响
血清肝功能指标检测结果如图2所示,给药7 d后,与对照组比较,低、中剂量GAT组小鼠血清ALT水平显著降低(P<0.05或0.01);低剂量GAT组小鼠血清AST水平显著降低(P<0.01)。小鼠血清AKP和TG水平与对照组比较差异均无统计学意义,且均在正常范围内。3个剂量GAT组小鼠血清CRE浓度较对照组均显著降低(P<0.01)。

图2 加替沙星对小鼠血清肝功能指标的影响
2.3 差异表达基因的筛选结果
使用TPM方法分析对照组和GAT组小鼠肝组织的差异表达基因,将对照组和中剂量GAT组的数据进行标准化后分析其表达水平,最终筛选出27个差异表达基因,其中有20个表达水平上调,7个下调。为直观的显示出差异表达基因,绘制热图如图3所示,显示出多个基因在两组中的表达差异。
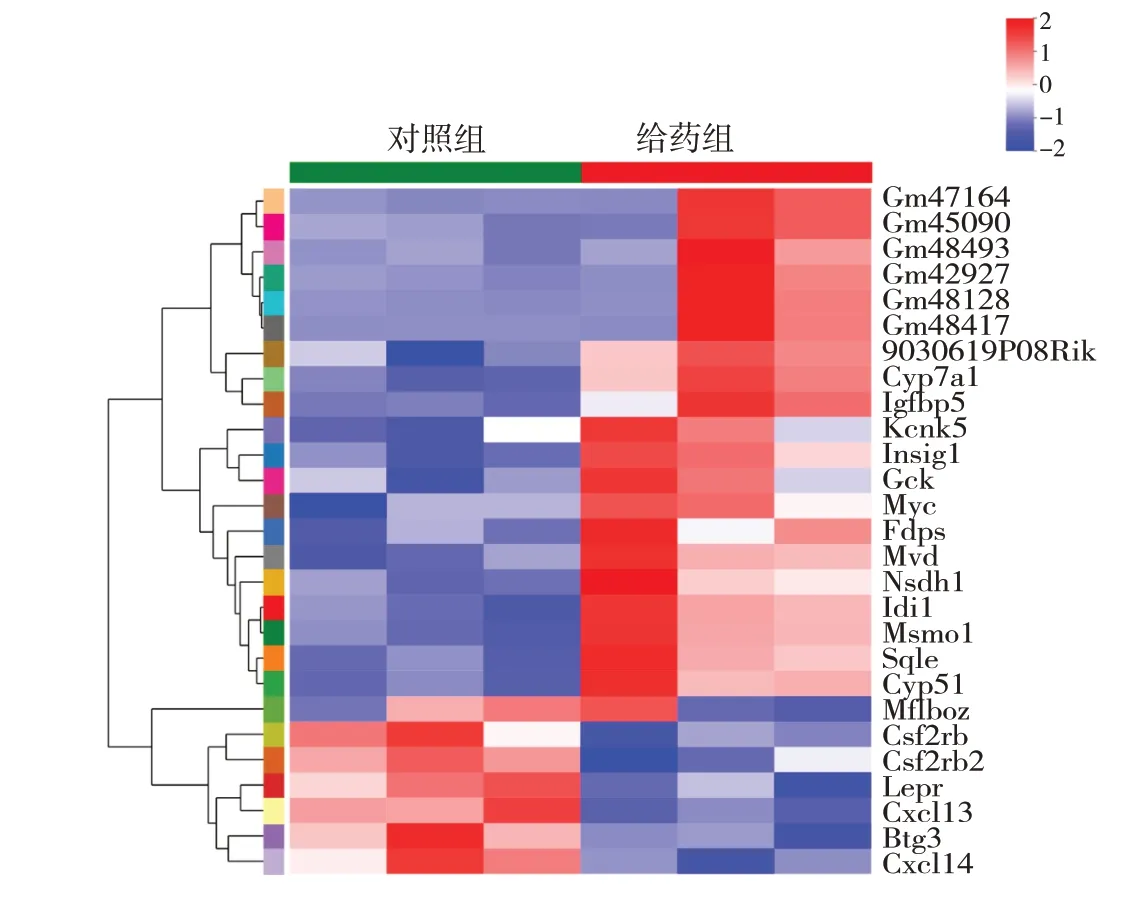
图3 对照组和GAT组小鼠肝组织差异表达基因热图
与对照组比较,20个表达显著上调的基因分别 是:Gm47164、Gm45090、Gm48493、Gm42927、Gm48128、Gm48417、9030169P08Rik、Cyp7a1、Igfbp5、Kcnk5、Insig1、Gck、Myc、Fdps、Mvd、Nsdhl、Idi1、Msmo1、Sqle、Cyp51;7个表达显著下调基因分别是:Nfkbiz、Csf2rb、Csf2rb2、Lepr、Cxcl13、Btg3、Cxcl14。
2.4 差异表达基因的GO功能富集分析
GO注释结果见图4,可见27个差异基因在10个生物过程中富集,其中包括免疫过程、多细胞生物过程、多生物过程、生殖过程、定位和发育过程、应激反应、代谢过程、生物调节、细胞过程;在8个细胞组分中富集,包括含蛋白复合物、胞外区、细胞膜、细胞器等;在2个分子功能中富集,包括催化活性和结合。

图4 GAT给药组中差异表达基因的GO分析
2.5 差异表达基因的KEGG富集分析
对27个差异表达基因进行KEGG通路分析,结果见图5,可见表达上调的基因在14条通路中富集,包括脂质代谢、萜类化合物和聚酮化合物的代谢、内分泌系统等;表达下调的基因在8条通路中富集,包括信号转导、信号分子和相互作用、癌症总览等。

图5 对照组和给药组差异表达基因KEGG富集通路直方图
3 讨论
自临床报道FQs的不良反应以来,已有部分药物被撤市;但是由于部分FQs药物的不可替代性,仍然应用于临床。GAT作为FQs典型代表药物,关于GAT不良反应的研究一直备受关注,其心血管毒性和引起血糖紊乱已被学界广泛认可,但是GAT引起的肝损伤还未得到证实,其具体机制还需进一步探讨。
本研究利用小鼠模型初步评价GAT的肝毒性并采用转录组测序技术初步探究其作用机制。结果显示,100 mg/kg GAT给药后可引起小鼠肝脏质量降低,25 mg/kg GAT给药后小鼠血清中ALT、AST和肌酐显著降低,这提示GAT暴露可造成小鼠肝脏功能的变化。在此基础上,进一步提取中剂量GAT组肝组织RNA进行高通量转录组测序,发现对照组和中剂量GAT组的差异基因数目为27个,其中,表达上调的基因有20个,下调的基因有7个。
细胞色素P450家族成员7A1(cytochrome P450 7A1,CYP7A1)是参与内源性胆固醇及其氧化衍生物(氧甾醇)代谢的细胞色素P450单加氧酶,是胆汁酸生物合成和胆固醇稳态的关键调节酶。有研究[13]发现,抑制CYP7A1基因的表达,调节胆汁酸合成、分泌、转运和吸收,可降低肝内胆汁酸浓度,避免肝脏过度暴露于胆汁酸而发生炎性、纤维化等病变。本研究中,与对照组相比,GAT给药Cyp7a1显著上调,提示GAT可能通过胆汁酸合成造成肝内胆汁酸浓度失衡,使肝脏暴露于失衡的胆汁酸环境中而发生损伤。
CYP51(又名羊毛甾醇14α去甲基化酶)是细胞色素C家族成员,将羊毛甾醇转化成胆固醇,是分布最广的细胞色素P450成员,是胆固醇代谢相关酶,现已成为降胆固醇药物研究的热点。Urlep等[14]研究发现,胆固醇合成缺陷可导致肝脏炎症和纤维化,实验敲除CYP51基因,实验动物出现肝脏肿大,伴有卵圆细胞增生、纤维化和炎症,但无脂肪变性。且CYP51底物的升高促进了综合应激反应。本研究中,与对照组相比,GAT给药后,Cyp51显著上调,提示GAT可能通过胆固醇合成的异常从而导致小鼠肝组织损伤的发生。
本研究采用高通量测序技术,从基因转录水平初步探讨了GAT致小鼠肝损伤的机制,实验结果可为GAT的急性毒理学分析提供基础数据。鉴于FQs的富集效应和可能引起的肝损伤疾病病例,本研究也有助于建立FQs的药物监管和风险的理论基础。此外,本研究可在以下几个方面作更深入的研究,比如可补充小鼠肝组织的病理变化,直观地对比GAT给药造成的组织损伤,以及采用qPCR技术对通路中的显著变化基因进行进一步验证,以期为日后研究GAT对人的肝损伤作用及其机制提供理论基础。
