1株产果胶酶中度嗜盐菌(Aspergillus aculeatus GLUT-01)的鉴定及产酶条件优化
2022-02-15池彬彬倪莹陈慧英刘红艳
池彬彬 倪莹 陈慧英 刘红艳






摘要:从海拔2 500~3 000 m处的盐井土壤样品中分离得到1株中度嗜盐菌,通过对该菌株的菌落形态观察、rDNA-ITS测序及同源序列比对,构建系统发育树,鉴定该菌株为曲霉属(Aspergillus),命名为棘孢曲霉(Aspergillus aculeatus) GLUT-01。该菌株能在3%~15% NaCl (最适7%)、20~30 ℃ (最适27 ℃)、pH值为4.0~10.0 (最适pH值为7.0)条件下生长,且能以部分污染物作为唯一碳源生长,这显示了一定的应用潜力。以其作为发酵真菌进行液态发酵培养,通过正交试验分析,在接种量为2%, 温度为28 ℃,起始pH值为6,C/N为1 ∶2条件下培养3~5 d,产生的果胶酶活性达到126.68 U/mL。试验结果丰富了嗜盐果胶酶的研究和开发依据,为高盐环境下食品工业加工提供了理论基础。
关键词:中度嗜盐菌;曲霉属;系统发育树;果胶酶;正交试验;产酶条件优化
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2022)02-0239-08
收稿日期:2021-04-12
基金项目:国家自然科学基金(编号:21762015、31860251);桂林理工大学科研启动基金(编号:GLUT2015038);广西自然科学基金面上项目(编号:2020GXNSFAA238037)。
作者简介:池彬彬(1997—),男,浙江温州人,硕士研究生,研究方向为微生物学。E-mail:837282401@qq.com。
通信作者:陈慧英,博士,副教授,主要从事微生物代谢产物开发,E-mail: hychen@glut.edu.cn;刘红艳,博士,副教授,主要从事功能微生物开发及应用,E-mail: lhyglite@126.com。
自然界中存在各种各样的盐域环境如盐湖、盐井、盐矿,也有人工合成的盐土环境如盐场、盐池等,而嗜盐菌(halophiles)则是在这样的高盐环境下能够生长的一类微生物,另外盐制发酵食品中也能够分离筛选出嗜盐菌[1-2]。与其他极端微生物相比,中度嗜盐菌可以在较高浓度(3%~15%)的盐溶液下生存[3],并且能利用不同种类的有机物作为碳源和氮源。因其独特的生理生化特性,确定了其在生产酶制剂、食品行业、污水净化等方面具有非常广阔的应用价值[4-5]。
果胶酶(pectinase)是世界四大酶制剂之一,是分解果胶质酶类的总称,主要包括原果胶酶、果胶酯酶、聚半乳糖醛酸酶和果胶裂解酶四大类[6]。主要来源于动植物及微生物,尤其是微生物,因其生长速度快、生长条件简单、代谢过程特殊等特征,成为果胶酶的重要来源[7]。目前,曲霉属的菌株已被广泛用于聚半乳糖醛酸酶的工业生产[8]。国内果胶酶需求量很大[9],但我国果胶酶发展速度缓慢,并且果胶酶大多都是单独使用,这在很大程度上限制了果胶酶的应用范围。因此,为了提高果胶酶制剂的质量,降低成本,选择适合工业化生产的高产果胶酶生产菌是关键[10-11]。
目前,多数果胶酶在高浓度盐溶液下存在酶活性较低的缺陷,限制了其更广泛的开发利用[12-13]。因此,本试验研究了1株中度嗜盐真菌(GLUT-01)的形态特征、生理生化特性、分子生物学系统分类、培养条件,同时还着重对该菌株的发酵产果胶酶条件进行探索,以期能丰富耐盐果胶酶的基础研究。
1 材料与方法
1.1 试验时间和地点
试验时间为 2018年10月至 2019年 6月,地点为桂林理工大学(110°18′21″E, 25°04′10″N)。
1.2 材料与仪器
1.2.1 材料 菌株GLUT-01由桂林理工大学化学与生物工程学院生物工程教研室分离筛选并保存。
1.2.2 主要试剂和仪器 乳糖购自成都市科龙化工试剂厂; D-果糖、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二胺艳(ABTS)、聚半乳糖醛酸均购自源叶生物科技有限公司; DZF-6050型真空干燥箱,上海一恒科学仪器有限公司生产; VIS-7220N可见分光光度计,北京瑞利分析仪器有限公司生产; iMark酶标仪,Bio-Rad Laboratoties Inc生产; SZGMA3-30K高速冷冻离心机,SZGMA德国生产。
1.2.3 培养基
菌种保藏培养基:马铃薯葡萄糖琼脂培养基(PDA固体培养基)。
种子液/发酵培養基:马铃薯浸出粉3.0 g/L,葡萄糖10.0 g/L,NaCl 28.0 g/L,pH值为6.8~7.0。
改良培养基:磷酸氢二铵10.0 g/L,葡萄糖20.0 g/L,FeSO4·7H2O 0.1 g/L,KCl 20.0 g/L,MgSO4·7H2O 40.0 g/L,pH值为6.8~7.0。
营养明胶培养基:蛋白胨5.0 g/L,牛肉膏3.0 g/L,明胶120.0 g/L,pH值为6.8~7.0。
液态发酵培养基:碳源(D-果糖、葡萄糖、菊糖、蔗糖、麦芽糖、乳糖)15.00 g/L,硫酸铵5.00 g/L,K2HPO4 1.00 g/L,MgSO4·7H2O 0.50 g/L,KCl 5.00 g/L,FeSO4·7H2O 0.01 g/L,pH值为6.8~7.0。
1.3 酶活力测定及蛋白质含量测定
1.3.1 粗酶液的制备 将保存于PDA斜面上的菌株活化后,接入种子培养基,30 ℃、180 r/min恒温培养48 h,作为种子液使用。以2%的接种量接入发酵培养基,30 ℃、180 r/min恒温培养72 h[14]。发酵液在4 ℃、10 000 r/min条件下冷冻离心10 min后取上清液作为粗酶液,4 ℃低温保存。
1.3.2 果胶酶活力测定 取编号为1、2的离心管2支,各加入800 μL聚半乳糖醛酸(浓度为1%),在40 ℃水浴锅中预热10 min,在试管1中加入 200 μL 适当稀释样品酶液,在试管2中加经煮沸 5 min 灭活的适当稀释样品酶液200 μL,2支试管同时放入40 ℃水浴锅中反应20 min后,立即加入 500 μL DNS试剂停止反应,用开水煮沸显色 5 min,立即冷却,取反应液体200 μL于540 nm波长下测其吸光度[15]。
1.3.3 酶活单位定义 在40 ℃条件下,1 min降解聚半乳糖醛酸产生1 μmol半乳糖醛酸所需酶量为1个酶活单位(U)。
1.4 形态学与生理生化鉴定
1.4.1 菌种形态观察 将分离得到的纯菌株进行划平板培养,30 ℃培养7 d,观察并记录单菌落的颜色、形状、透明度、大小、表面隆起和菌落培养基的颜色等[16]。在光学显微镜下观察细胞形态大小[17]。
1.4.2 液体培养形态观察 将分离得到的纯菌株接种在液体培养基中,30 ℃培养3 d,观察菌液颜色、菌丝体形状、菌丝体大小、透明度等。
1.5 生理生化特性试验
1.5.1 明胶液化 接种营养明胶培养基,30 ℃培养,分别于1、2、3 d观察,空管对照。观察前先把试管放置在冰箱中20~30 min。观察试管内菌液是否为液态判断其明胶液化能力。
1.5.2 甲基红试验 接种发酵液培养基,于30 ℃培养3 d,检测时,加入2~3 滴甲基红试剂到培养液中,混匀观察,若呈红色,即为阳性反应,若无颜色变化,则为阴性反应[18]。
1.5.3 吲哚试验 1%胰蛋白胨水溶液,0.5% NaCl,调节pH值为7.5,分装小管。接种培養3 d后检测。试管里加入2~3滴乙醚,再缓慢加入1~2滴吲哚试剂。乙醚层出现玫红色,代表阳性,乙醚层为黄色,代表阴性[19]。
1.5.4 药敏性试验 将硫酸庆大霉素、硫酸卡那霉素、氯霉素、盐酸林可霉素、盐酸土霉素、克拉霉素、硝酸益康唑、灰黄霉素分别配制成5 mg/mL抗生素溶液。抗生素溶液经紫外杀菌后,移取200 μL加入已灭菌的50 mL PDA培养基中,倒平板并涂布种子液,30 ℃静置培养2 d,观察并记录结果。
1.5.5 有机污染物降解初步试验 在改良培养基其他成分不变的情况下,不添加任何碳氮源,以芳香类化合物作为唯一的碳源以及能量,配制培养基[20]。芳香类化合物为双酚A、双酚AF、四溴双酚A、六溴十二烷、苯甲基磺酰氟、邻联甲苯胺。以2%接种量接入50 mL培养基,置于30 ℃,150 r/min 振荡培养3 d,观察并记录菌株生长情况。以不接种的培养基为阴性对照试验。
1.6 rDNA-ITS的PCR扩增及测序分析
采用ITS序列设计保守扩增引物(ITS1:5′-AGAGTTTGATCCTGGCTCAG-3′; ITS4: 5′-GGTTACCTTGTTACGACTT-3′)对菌株总 DNA 模板进行ITS1-5.8S-ITS4 rDNA 扩增, 扩增条件:94 ℃ 3 min;94 ℃ 60 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;72 ℃ 7 min。取4.5 μL PCR 产物,用1%琼脂糖凝胶电泳检测产物,紫外灯箱观察扩增效果。
序列测定和分析:将rDNA-ITS 扩增产物送交上海生工公司测序,所测序列在NBCI数据库进行blastn同源性比对分析,利用BLAST软件搜索相似序列后,利用MEGA 5.0软件的邻接法(Neighbor-Joining)以相近序列构建系统发育树[21]。
1.7 培养条件对菌株生长的影响
采取单因素试验设计优化培养条件[22]。在 50 mL 发酵培养基中接入1 mL种子液,分别加以菊糖、蔗糖、麦芽糖、葡萄糖、D-果糖、乳糖为碳源,以硫酸铵、牛肉膏、蛋白胨、柠檬酸氢二铵、酵母浸出粉为氮源,盐度设为3%、5%、7%、9%、11%、15%,起始pH值梯度设为4、6、7、8、9、10、11,温度设为4、20、27、30、37、40 ℃。均于150 r/min振荡培养3 d,进行烘干,记录菌体质量,比较菌株在不同培养条件下的生长情况。进行2个平行试验,取均值(下同)。
1.8 培养条件对发酵产酶的影响
研究不同碳源、氮源、C/N、温度、诱导剂、金属离子、起始 pH值、接种量对菌株发酵产酶的影响。
1.8.1 碳源、氮源 以2%的接种量接种50 mL发酵培养基(下同),分别设置菊糖、蔗糖、麦芽糖、葡萄糖、D-果糖、乳糖为碳源,以硫酸铵、牛肉膏、蛋白胨、柠檬酸氢二铵、酵母浸出粉为氮源。测定酶活,确定最佳碳源、氮源。
1.8.2 碳源、氮源添加量 在确定最佳碳源、氮源的条件下,分别设置碳源、氮源的添加量梯度为0.1、0.5、1.0、1.5、2.0、2.5 g,测定酶活,确定最佳碳源和氮源的添加量。
1.8.3 C/N 筛选出最合适的碳源、氮源后,固定碳源质量为0.5 g,改变氮源的质量,使得C/N分别为1 ∶10、1 ∶5、1 ∶2、1 ∶1、2 ∶1、5 ∶1、10 ∶1,测定酶活,确定最佳C/N。
1.8.4 温度 用优化后的发酵培养基,于20、28、30、32、35 ℃条件下培养,测定酶活,确定最佳发酵温度[23]。
1.8.5 诱导剂 在优化后的培养基中添加诱导剂,选择麸皮(1%)、羧甲基纤维素(1%)、木质素(1%)、苯酚(1 mmol/L)、ABTS (1 mmol/L)作为诱导剂,测定酶活,确定最佳诱导剂。
1.8.6 金属离子 通过向发酵培养基中分别添加0.25 g氯化铬、氯化钠、氯化钾、氯化钡、氯化钙、硫酸镁,测定酶活,确定最适添加的金属离子。选取最适金属离子,设置添加量为0.25、0.50、0.75、1.00、1.25、1.50 g,确定最佳金属离子的添加量。
1.8.7 初始pH值 在以上因素为最佳条件下,调节不同pH值为 3、4、5、6、7、8进行发酵试验,测定酶活,确定最佳初始pH值。
1.8.8 接种量 在最佳条件下,分别以1%、2%、3%、4%、5%、6%的接种量接种发酵培养基,测定酶活,确定最佳接种量。
1.9 正交试验分析
各培养条件对产酶的影响确定后,考虑不同因素之间的相互作用及影响程度,对单因素确定的C/N、温度、起始pH值、接种量进行正交试验设计[L9(34)],以确定最佳培养条件下的菌种发酵酶活。
2 结果与分析
2.1 菌株的形态学鉴定
2.1.1 固体培养菌落形态
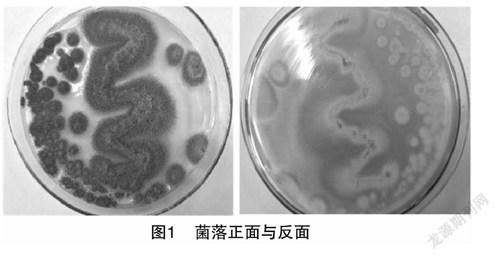
在PDA固体培养基培养7 d后的观察结果見图1,菌落直径约为8 mm,菌种生长速度较快,培养的第1天菌落即产生白色纤维状的初生菌丝,随着培养时间增加,菌丝正面转变为黑褐色,反面为淡黄色。该菌种菌落生长特点与李芬芳等报道的[24]基本相同。菌丝由中心向周围扩散生长,菌落边缘为全缘,表面粗糙,呈粉粒状。
菌株在显微镜下的观察结果(图2)显示,孢子由单细胞构成,呈球状,直径为1~2 μm,链状或堆积排列,表面光滑。
2.1.2 液体培养菌落形态
在PDA液体培养基上培养3 d后(图3),菌落为白色不透明的球状,菌体直径约为10 mm,培养基颜色变为透明。
2.2 分子生物学鉴定及系统发育树
菌株GLUT-01 的ITS1-5.8S-ITS4基因扩增条带测序结果如下:序列总长为557 bp,序列为GACCTGCGGAAGGATCATTACCGAGTGCTGGGTCCTTCGGGGCCCAACCTCCCACCCGTGCTTACCGTACCCTGTTGCTTCGGCGGGCCCGCCTTCGGGCGGCCCGGGGCCTGCCCCCGGGACCGCGCCCGCCGGAGACCCCAATGGAACACTGTCTGAAAGCGTGCAGTCTGAGTCGATTGATACCAATCAGTCAAAACTTTCAACAATGGATCTCTTGGTTCCGGCATCGATGAAGAACGCAGCGAAATGCGATAACTAATGTGAATTGCAGAATTCAGTGAATCATCGAGTCTTTGAACGCACATTGCGCCCCCTGGTATTCCGGGGGGCATGCCTGTCCGAGCGTCATTTCTCCCCTCCAGCCCCGCTGGTTGTTGGGCCGCGCCCCCCCGGGGGCGGGCCTCGAGAGAAACGGCGGCACCGTCCGGTCCTCGAGCGTATGGGGCTCTGTCACCCGCTCTATGGGCCCGGCCGGGGCTTGCCTCGACCCCCAATCTTCTCAGATTGACCTCGGATCAGGTAGGGATACCCGCTGAACTTAAGCATATCAATA。
将rDNA-ITS序列在NBCI数据库进行blastn比对分析,利用ClustalX和MEGA 5.0软件构建系统发育树(图4)。不同的种聚为不同的分支,菌种GLUT-01与菌种Aspergillus niger CBS 172.66 NR_111412.1聚为一支,自展值为100,表明两者亲缘关系非常近。结合形态学特征及系统发育学分析,可以鉴定菌株GLUT-01为棘孢曲霉(Aspergillus aculeatus)。
2.3 生理生化特性
菌株GLUT-1的生理生化特征结果见表1。该菌株在pH值为4.0~9.0时皆可生长,最适生长pH值为7.0;20~30 ℃时生长旺盛,最适生长温度为27 ℃;盐度为3%~9%时皆可生长, 最适生长盐度为7%,甲基红试验反应为阳性,吲哚试验反应为阴性。乳糖、葡萄糖、麦芽糖、D-果糖、菊糖皆可作为碳源,可水解明胶,硫酸铵、柠檬酸氢二铵、牛肉膏、蛋白胨、酵母浸出粉可作为氮源。
对硫酸庆大霉素、硫酸卡那霉素、盐酸土霉素、盐酸林可霉素、克拉霉素、氯霉素等抗生素敏感;对硝酸益康唑、灰黄霉素2类抗生素不敏感。能够在以双酚A、双酚AF、四溴双酚A、六溴十二烷、苯甲基磺酰氟、邻联甲苯胺为唯一碳源和能量的培养基上生长。Ekanayake等也曾报道,棘孢曲霉可有效分解染料[25]。
2.4 培养条件对菌株发酵产果胶酶的影响
2.4.1 碳源 从图5可以看出,经不同碳源培养,菊糖和D-果糖对液态发酵产果胶酶的影响最小,而葡萄糖可以明显提高果胶酶的活性,乳糖次之,因此选择葡萄糖为最适碳源。
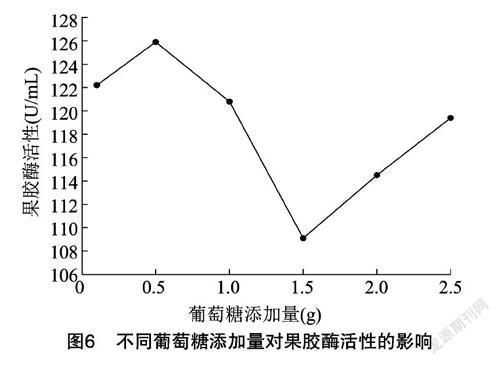
从图6可以看出,最佳的葡萄糖添加量为 0.5 g,此时酶活性可达到126.10 U/mL。随着葡萄糖添加量的增加,果胶酶活性出现峰值之后,呈先下降再升高趋势,但过高的葡萄糖浓度将抑制菌株生长,且依据趋势增长最高峰依旧难以达到前峰峰值。宜选择添加量少且效果显著的试验组,因此选择 0.5 g 作为葡萄糖最佳添加量。
2.4.2 氮源 从图7可以看出,在最佳碳源条件下,向发酵培养基中添加蛋白胨、酵母浸出粉和牛肉膏,对果胶酶活性提升不大;而硫酸铵能够相对提高果胶酶活力,因此选择硫酸铵作为最适氮源[26]。
从图8可以看出,最佳硫酸铵添加量为 0.5 g,此时果胶酶活性为122.30 U/mL。随着硫酸铵添加量的增加,果胶酶活性出现峰值之后呈下降趋势。可能与硫酸铵的酸化作用有关,少量硫酸铵分解产生的微酸环境提高了酶活性,而过量硫酸铵导致过酸抑制了酶活和菌的生长。
2.4.3 C/N 以葡萄糖作为碳源、硫酸铵作为氮源,确定葡萄糖为0.5 g,改变硫酸铵的质量,使得C/N分别为1 ∶10、1 ∶5、1 ∶2、1 ∶1、2 ∶1、5 ∶1、10 ∶1,考察不同C/N对嗜盐菌产果胶酶的影响,结果(图9)显示,1 ∶2为最佳C/N。
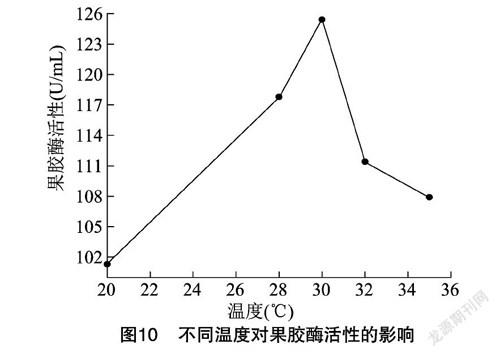
2.4.4 温度 从图10可以看出,30 ℃为最适产酶温度,此时果胶酶活性达到125.88 U/mL。培养的温度过高或者过低均不利于果胶酶的产生。当温度较低时,菌体代谢缓慢,所产的酶量也较少;当温度较高时,菌体自身代谢所需酶的活性降低,导致发酵减缓,从而影响产酶。
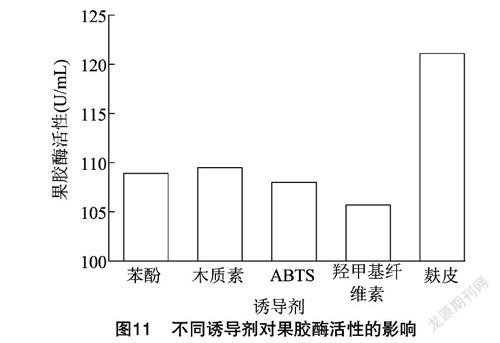
2.4.5 诱导剂 表面活性剂可以改变细胞膜的通透性,使细胞内的酶更容易通过细胞膜渗出,细胞内的酶逐渐合成,细胞外的酶则持续集聚,因而增加了酶的产量。由图11可知,麸皮的诱导效果最佳,其酶活为121.07 U/mL,其他4种诱导剂也有诱导效果,但是没有麸皮的效果好,因此确定最佳诱导剂为麸皮。
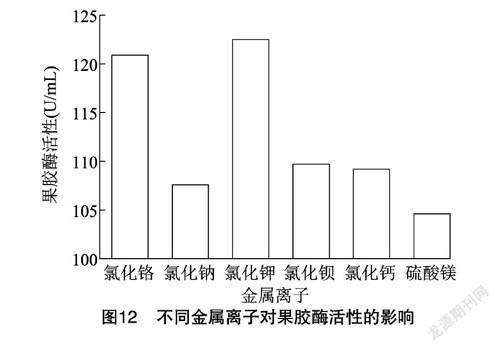
2.4.6 金属离子 金属离子是微生物生长和新陈代谢所必需的,同时,一些无机金属离子也是酶的激活剂,从图12可以看出,氯化铬、氯化钠、氯化钾、氯化钡、氯化钙、硫酸镁均能提高果胶酶活性,其中以氯化钾的促进作用最强,说明钾离子与酶之间可能存在潜在的结合关系[27]。
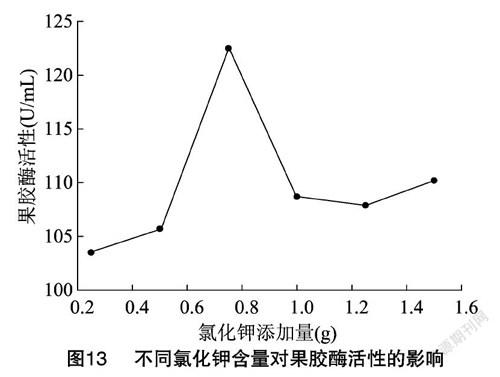
从图13可以看出,氯化钾的最佳添加量为0.75 g,此时果胶酶活性为122.45 U/mL。随着氯化钾含量的增加,出现峰值之后,果胶酶活呈下降趋势,说明氯化钾含量在一定范围内对果胶酶活性起到促进作用,含量过高反而会导致果胶酶失活。
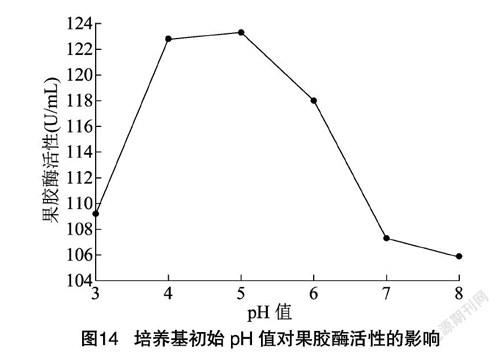
2.4.7 初始pH值 从图14可以看出,当pH值为5时,果胶酶活性达到124.03 U/mL。随着pH值的升高,出现峰值后,果胶酶活性呈下降趋势。pH值太低或太高会改变培养基中有机化合物的离子化作用程度,干扰物质进出细胞,从而影响产酶效率[28]。因此,确定该菌种最佳生产酶pH值为5,符合真菌来源的果胶酶较细菌偏酸的报道[29]。
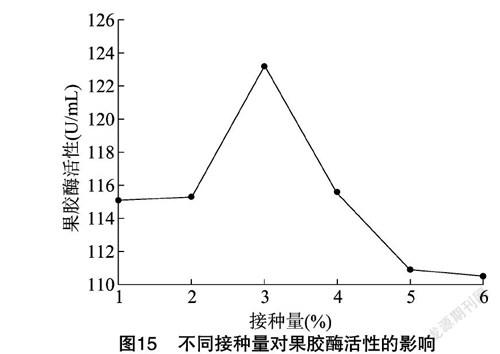
2.4.8 接种量 从图15可以看出,接种量在1%~6%间变动时,果胶酶的活性先上升后下降,当接种量为3%时达到最高。当接种量太小时会使初期菌种生长缓慢,导致延长生产酶周期;当接种量太大時,前期菌体生长繁殖速度快,营养物质主要用于细胞的合成,导致酶的合成下降。因此,确定该菌种的最佳接种量为3%。
2.5 利用正交试验优化产酶条件
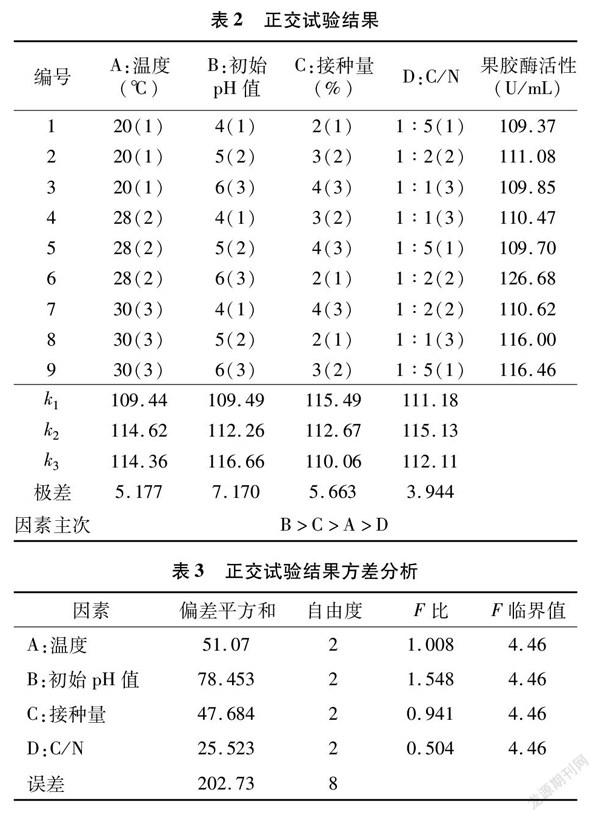
正交试验结果见表2。对试验所得的结果进行统计分析,从直观分析和极差分析中确定最佳组合。
从表2可以看出,对产酶影响因素的次序从大
到小为B>C>A>D。从表3方差分析可知,初始pH值对产酶量影响极显著,温度、接种量对产酶影响显著,而C/N对产酶影响不显著,与直观分析结果一致。因此,最佳方案为 A2B3C1D2,即果胶酶的最佳液体发酵产酶条件:发酵初始pH值为6,温度为28 ℃,C/N为1 ∶2,接种量为2%,在该条件下果胶酶活性达到126.68 U/mL。
3 结论与讨论
本研究以1株分离筛选自海拔2 500~3 000 m盐井土壤样品中的真菌为研究对象,结合形态学、rDNA-ITS序列测序及系统发育树、生理生化特性对该菌株进行鉴定,鉴定该菌株为曲霉属真菌,命名为棘孢曲霉GLUT-01。该菌株能耐受较大范围的NaCl浓度,且能以多种芳香类化合物为底物生长。此外,它可以产果胶酶,这扩大了产果胶酶菌种来源。
在本研究中,对菌株发酵产酶条件进行了优化,得到该菌种单因素最佳发酵条件:碳源为葡萄糖,氮源为硫酸铵,C/N为1 ∶2,金属离子为K+且添加量为0.75 g,接种量为3%,诱导剂为麸皮,温度为30 ℃,培养基初始pH值为5.0。通过4因素3水平的正交试验确定果胶酶发酵的最优条件:C/N为1 ∶2,培养基初始pH值为6,温度为28 ℃,接种量为2%。在此最佳条件下发酵得到的果胶酶活性达到126.68 U/mL。之前也有文献报道, 产果胶酶微生物有枯草芽孢杆菌等[30-31],且多为细菌,目前对中度嗜盐真菌产果胶酶的研究较少,该菌种在偏酸及高盐环境下果胶酶活性较高,具有一定的应用价值。
目前,笔者只对菌株棘孢曲霉GLUT-01 进行了初步研究,今后将进一步对其所产果胶酶进行酶学性质研究, 并将其应用于高盐环境下果胶的处理中,明确其在高盐环境下降解果胶的能力。
参考文献:
[1]董秀黄. 结合BIOLOG碳源筛选研究新疆两盐湖可培养嗜盐菌多样性[D].乌鲁木齐:新疆大学,2013.
[2]訾小利,李荣鹏,张 霞,等.江苏盐城盐场中度嗜盐菌的分离与鉴定[J].生物加工过程,2014,12(4):82-86.
[3]Ventosa A,Nieto J J,Oren A. Biology of moderately halophilic aerobic bacteria[J].Microbiology and Molecular Biology Reviews:MMBR,1998,62(2):504-544.
[4]Rohban R,Amoozegar M A,Ventosa A. Screening and isolation of halophilic bacteria producing extracellular hydrolyses from Howz Soltan Lake,Iran[J].Journal of Industrial Microbiology and Biotechnology,2009,36(3):333-340.
[5]刘莹莹. 中度嗜盐菌分离鉴定及在环境修复中的应用[D].大连:大连海事大学,2013.
[6]疏秀林,施庆珊,欧阳友生,等.微生物发酵生产果胶酶的研究概述[J].发酵科技通讯,2010,39(1):25-27.
[7]李 伟,吴 槟. 产酸性果胶酶的研究应用及展望[J].生物技术世界,2013,10(4):169.
[8]Dinu D,Nechifor M T,Stoian G,et al.Enzymes with new biochemical properties in the pectinolytic complex produced by Aspergillus niger MIUG 16[J].Journal of Biotechnology,2007,131(2):128-137.
[9]陈文俊. 食品添加剂应用问题的哲学思考[D].武汉:武汉科技大学,2006.
[10]张红霞,江晓路,牟海津,等.微生物果胶酶的研究进展[J].生物技术,2005,15(5):92-95.
[11]Amin F,Bhatti H N,Bilal M.Recent advances in the production strategies of microbial pectinases—A review[J].International Journal of Biological Macromolecules,2019,122:1017-1026.
[12]顾晓颖,李 冠,吴 敏. 巴里坤湖和玛纳斯湖嗜盐菌的分离及功能酶的筛选[J].生物技术,2007,17(3):26-30.
[13]Yuan S Q,Ren P G,Liu J,et al. Lentibacillus halodurans sp.nov.,a moderately halophilic bacterium isolated from a salt lake in Xin-Jiang,China[J].International Journal of Systematic and Evolutionary Microbiology,2007,57(3):485-488.
[14]李双双. ε-聚赖氨酸高产菌选育及其发酵优化[D].广州:华南理工大学,2011.
[15]张浩森,缪 静,余晓斌. 果胶酶高产菌株的筛选及产酶条件的研究[J].生物学杂志,2008,25(1):28-30,46.
[16]王昭凯,易志伟,刘 洋,等.产酯酶海洋中度嗜盐菌Halomonas sp. LYG1-1的分离鉴定及其酶学性质[J].热带海洋学报,2014,33(1):69-73.
[17]申玉凤,张 杰,张 映,等.一株产酯酶中度嗜盐菌的筛选及酶学性质的研究[J].安徽农业科学,2013,41(36):13840-13842.
[18]程 磊,金 宏,王丹丹. 甲基红指示剂对玻璃内表面耐水性测定结果的影响[J].中国药事,2014,28(5):507-510.
[19]东秀珠,蔡妙英. 常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[20]le Borgne S,Paniagua D,Vazquez-Duhalt R.Biodegradation of organic pollutants by halophilic bacteria and archaea[J].Journal of Molecular Microbiology and Biotechnology,2008,15(2/3):74-92.
[21]Kimura M. A simple method for estimating evolutionary rates of base substitutions through comparative studies of nucleotide sequences[J].Journal of Molecular Evolution,1980,16(2):111-120.
[22]凌 娟,董俊德,张燕英,等.一株珊瑚礁-海草床复合生态系统固氮菌的分离与鉴定[J].微生物学通报,2010,37(7):962-968.
[23]Li Q A,Ray C S,Callow N V,et al. Aspergillus niger production of pectinase and α-galactosidase for enzymatic soy processing[J].Enzyme and Microbial Technology,2020,134:109476.
[24]李芬芳,陈 娇,李奕星,等. 海南红毛丹果实采后病原菌棘孢曲霉的分离鉴定及其杀菌剂的筛选[J].热带农业科学,2020,40(4):41-48.
[25]Ekanayake E,Manage P M.Decolourisation and detoxification of CI Direct Blue 201 textile dye by two fungal strains of genus Aspergillus[J].Journal of the National Science Foundation of Sri Lanka,2020,48(1):69.
[26]耿 静,韩秋霞,高文静,等. 一株产蛋白酶的中度嗜盐菌Salinivibrio sp. MK070915的选育及产酶条件优化[J]. 江苏农业科学,2020,48(05):287-294.
[27]刘 娜,张美香,王 一. 不同浓度金属离子对酸性蛋白酶活性的影响[J].安徽农业科学,2010,38(32):18043-18044.
[28]孙玲玉. 枯草芽孢杆菌泰山株的分离鉴定及其对黄曲霉毒素的降解作用研究[D].泰安:山东农业大学,2014:36-37.
[29]周 熠,黄 河,冯 波,等. 一株碱性果胶酶产生菌的篩选、鉴定及发酵条件优化[J].湖北农业科学,2016,55(4):992-996.
[30]黄福佳,姜 宁,张爱忠,等. 枯草芽孢杆菌工程菌发酵技术的研究进展[J].黑龙江畜牧兽医,2017(5):63-67.
[31]Yu P,Zhang Y S,Gu D L. Production optimization of a heat-tolerant alkaline pectinase from Bacillus subtilis ZGL14 and its purification and characterization[J].Bioengineered,2017,8(5):613-623.
