α-甘露糖苷酶与木薯块根采后生理变质的关系
2022-02-15安飞飞薛晶晶韦卓文陈松笔
安飞飞 薛晶晶 韦卓文 陈松笔



摘要:分析α-甘露糖苷酶与木薯块根采后生理变质(PPD)发生的关系,为有效控制木薯PPD发生提供新思路。采用RT-PCR分析α-甘露糖苷酶基因在块根PPD发生过程中的表达模式,ELISA检测α-甘露糖苷酶活性变化。SC9完整薯块储存5 d后开始出现PPD现象,20 μmol/L几夫碱喷施木薯块根切片可显著延缓PPD的发生。随着PPD程度的加重,α-甘露糖苷酶活性显著增高,在储存9 d时达到最大值326.24 U/L。MeMNS1、MeMNS4、MeGMII的表达随着PPD过程而逐步增强,且MeGMII表达最显著,采后9 d SC9块根中MeGMII的表达量达到对照的28.05倍,而MeMNS3-1、MeMNS3-2、MeMNS5表达的变化与木薯块根PPD程度间无明显规律。α-甘露糖苷酶参与木薯块根PPD发生的过程,且α-甘露糖苷酶活性与PPD程度呈正相关,其中MeGMII可能是参与此过程的关键基因。
关键词:木薯;块根;α-甘露糖苷酶;采后生理变质
中图分类号:S533.01 文献标志码: A
文章编号:1002-1302(2022)02-0165-05
收稿日期:2021-05-17
基金项目:国家重点研发计划(编号:2019YFD1000501);海南省自然科学基金(编号:320MS100)。
作者简介:安飞飞(1983—),女,河北保定人,硕士,副研究员,主要从事木薯抗性育种研究。E-mail:aff85110@163.com。
通信作者:陳松笔,博士,研究员,主要从事木薯遗传育种研究工作。E-mail:songbichen@catas.cn。
木薯(Manihot esculenta Crantz)是世界亚热带和热带地区近10亿人的主要粮食作物,在我国南方主要作为淀粉工业和生物质能源的重要原料。与其他薯类作物(马铃薯、甘薯)相比,木薯的块根保质期非常短,通常在采后1~3 d就开始发生变质,这种木薯特有的现象称之为“采后生理变质(postharvest physiological deterioration,PPD)”[1]。PPD使木薯淀粉透明度下降,严重影响淀粉及燃料乙醇加工。据统计,每年亚洲、拉丁美洲、加勒比海地区及非洲因木薯PPD而造成的经济损失分别为8%、10%、29%[2],直接经济损失超过2亿美元[1-3]。木薯PPD已成为产业发展亟需解决的重要问题之一,而至今尚未有一种行之有效的方法能抑制块根PPD发生[2,4]。因此,解析延缓木薯块根PPD产生的分子机理、选育耐PPD木薯品种是全球木薯育种家面临的挑战。
木薯PPD发生过程分为初级变质和次级变质,初级变质由酚类等物质氧化引起,随后出现呼吸速率增强、脂质成分改变、乙烯合成、伤口诱导的氧化爆发、次级代谢物的积累[2,5-10]。然后,细胞壁结构发生变化,微生物侵入引发次级变质,最终导致整个块根变质[11-12]。其他薯类作物如马铃薯、甘薯薯块受到伤害后会产生一系列的应答反应,同时在细胞中形成木质素等次生代谢物,保留在细胞壁中修复细胞结构,重新形成保护屏障,减少水分散失和抵抗外界微生物侵染[13]。而木薯块根在生物进化过程中,其伤口修复功能慢慢退化[14-15]。因此推测,木薯块根不能及时修复细胞结构使伤口愈合,可能是木薯较其他薯类作物不耐贮存的原因之一;而关于通过细胞壁修复来延缓木薯PPD的研究还未见报道。细胞壁糖蛋白含有大量的N-聚糖结构,α-甘露糖苷酶是真核生物对N-聚糖进行修饰的关键酶,分为Ⅰ类、Ⅱ类α-甘露糖苷酶,Ⅰ类 α-甘露糖苷酶属于糖基水解酶47家族 (GH47),Ⅱ类α-甘露糖苷酶属于糖基水解酶38家族 (GH38)[16-17] 。2类酶均可通过水解N-聚糖中的各种α-甘露糖苷键,完成对N-聚糖的修饰[18-19]。α-甘露糖苷酶对N-聚糖的修饰直接影响细胞壁的组成,在桃果实中被证实可以通过改变细胞壁表面N-聚糖结构来延缓果实的成熟与软化过程[20]。研究表明随着植物果实的成熟与软化,α-甘露糖苷酶活性不断增强,α-甘露糖苷酶基因的表达也不断升高[21-22]。目前对于植物中α-甘露糖苷酶基因的相关研究在番茄[21]、辣椒[23]、芒果[24]、草莓[25] 、甜瓜[26]等物种中都有报道。Meli等利用RNAi干扰技术抑制番茄中Ⅱ类α-甘露糖苷酶基因的表达,在转基因果实中α-甘露糖苷酶活性、N-糖蛋白的降解、果实软化速率都受到了抑制,果实硬度提高了2.5倍,番茄货架期延长了 30 d,而超表达该基因的番茄果实软化时间提前,软化速率加快[21]。前期在Phytozome木薯数据库中进行比对,分析到5个编码Ⅰ类α-甘露糖苷酶的基因,同时克隆并分析其表达模式[27],在木薯中还存在1个编码Ⅱ类 α-甘露糖苷酶的基因,但关于α-甘露糖苷酶与木薯块根PPD发生的关系仍需进一步确定。
本研究将开展α-甘露糖苷酶与木薯PPD发生之间的关系研究,对6个编码基因在食用木薯品种SC9完整薯块储存过程(0、1、3、5、7、9 d)中的表达及酶活性进行分析,结合α-甘露糖苷酶抑制剂-几夫碱处理块根切片,最终明确两者的关系,旨在为有效控制木薯块根PPD的发生提供新思路。
1 材料与方法
1.1 材料
木薯华南9号(SC9),来自中国热带农业科学院热带作物品种资源研究所国家木薯种质资源圃,于种植后10个月选取完好的木薯块根进行试验。
1.2 方法
1.2.1 木薯块根PPD观察
10个月后收获其块根,将完整薯块置于26 ℃培养箱储存0、1、3、5、7、9 d,观察块根PPD情况并收集样品。块根采后切片(创伤)处理后喷施20 μmol/L的α-甘露糖苷酶抑制剂——几夫碱(Kif)后0、12、24、36、48、72 h观察PPD发生情况。
1.2.2 ELISA检测α-甘露糖苷酶活性
用纯化的植物α-甘露糖苷酶抗体包被微孔板,依次加入α-甘露糖苷酶,与辣根过氧化物酶(HRP)标记的 α-甘露糖苷酶抗体结合,彻底清洗后加入底物四甲基习苯胺(TMB)进行显色,测定450 nm波长下的吸光度(D值),利用标准曲线计算各样品中 α-甘露糖苷酶活性。
1.2.3 RNA提取及反转录
将研钵、研磨棒和勺子在300 ℃马弗炉中烘6 h,将样品研磨后称取约0.1 g粉末,参照多糖多酚植物总RNA 提取试剂盒(TIANGEN,DP441)提取总RNA;反转录合成cDNA第1链参照反转录试剂盒cDNA第1链试剂盒(TRAN,AT311-03)。
1.2.4 引物设计和RT-PCR分析
合成α-甘露糖苷酶基因的定量PCR引物,以MeActin为内参基因(表1)。利用合成的cDNA稀释5倍为模板,用HiScript Ⅲ RT SuperMix (Vazyme,R323-01)进行扩增。PCR反应体系10.0 μL:cDNA 1.0 μL,上下游引物各0.4 μL,HiScript Ⅲ RT SuperMix 5.0 μL,超纯水3.2 μL。采用2-ΔΔCT计算基因的相对表达量,每个样品测定3次。
1.2.5 数据统计分析
利用Excel 2013和DPS v7.05统计软件对数据进行分析,差异显著性标准采用Duncan’s新复极差法。
2 结果与分析
2.1 SC9块根PPD观察
取SC9完整薯块置于26℃培养箱中,分别储存0、1、3、5、7、9 d取样观察,如图1所示。收获时木薯块根横切后呈淡黄色,块根水分含量充足有光泽,没有PPD现象;储存5 d,块根出现轻微变质,横切面外围出现了黑色斑块;储存7 d,块根出现了较大面积变质,横切面内围也出现了PPD现象,面积约占横切面的1/3;储存9 d,块根整个横切面大部分出现PPD现象,块根出现裂缝。
取SC9完整薯块切片后喷施20 μmol/L α-甘露糖苷酶抑制剂——几夫碱,分别在喷施0、12、24、36、48、72 h后观察PPD发生情况。从图2可以发现,木薯切片12 h后周边开始出现轻微的PPD现象,横切面外围出现褐化,随后PPD现象逐渐加重,48 h后切片大部分出现裂缝,PPD现象严重。与对照相比,喷施抑制剂几夫碱后,明显延缓了木薯PPD现象,在喷施抑制剂36 h后才出现明显的PPD现象,且在48 h和72 h后,切片的变质面积明显小于对照。
2.2 SC9块根PPD发生过程中α-甘露糖苷酶活性变化
利用植物α-甘露糖苷酶的ELISA检测试剂盒测定SC9采后不同时间(0、1、3、5、7、9 d)块根中 α-甘露糖苷酶活性,结果如图3所示。结果显示随着采后时间的推移,木薯块根PPD程度加重,α-甘露糖苷酶活性也随之增高。在收获后9 d,块根中α-甘露糖苷酶活性达到最高326.24 U/L。
2.3 SC9块根PPD发生过程中α-甘露糖苷酶基因表达变化
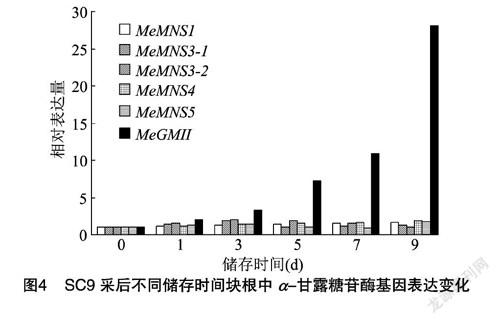
采用RT-PCR技术对上述时间点中6个编码α-甘露糖苷酶基因的表达情况进行分析,结果如图4所示。随着木薯块根贮存时间的延长,PPD程度的加深,MeMNS1、MeMNS4、MeGMII的表达逐步增强,采后9 d SC9块根中MeMNS1、MeMNS4、MeGMII的表达量分别达到对照的1.62、1.89、28.05倍。MeMNS3-1、MeMNS5在木薯块根PPD发生过程中的表达呈先上升后下降再上升的趋势,而MeMNS3-2呈现先上升后下降的趋势。在木薯块根PPD发生过程中,6个编码α-甘露糖苷酶基因的表达均有不同程度变化,其中MeGMII表达变化最明显。因此我们推测,α-甘露糖苷酶参与块根PPD发生过程,其中MeGMII是参与此过程的关键基因。
3 讨论与结论
PPD的发生涉及活性氧清除、细胞程序性死亡以及细胞壁修复、苯丙烷合成、淀粉降解、脂肪酸-氧化等途径[28]。细胞壁是植物阻挡外界伤害的第1道屏障,植物细胞壁含有大量的糖蛋白,其结构的改变关系到果实的成熟与软化。研究表明,植物果实的成熟过程伴随着细胞壁糖蛋白的降解,在此过程中α-甘露糖苷酶活性不断增强,基因表达也不断升高[29-30]。本研究木薯块根PPD过程中,α-甘露糖苷酶活性不断增强,部分基因表达也不断升高,且通过喷施α-甘露糖苷酶抑制剂——几夫碱,显著延缓了木薯PPD的发生,说明α-甘露糖苷酶参与块根PPD的调控过程。Ghosh等发现,抑制 α-甘露糖苷酶的表达可以延长辣椒的储藏时间[23]。通过抑制番茄GH38家族基因的表达,番茄细胞壁细胞排列更加紧凑,储藏时间显著延长[21]。α-甘露糖苷酶对果实成熟及储藏产生影响,是由于其改变了细胞壁表面N-聚糖结构,导致细胞壁结构变化,从而影响果实的生理状态[31]。研究显示,木薯块根PPD的过程受到蛋白质N-糖基化修饰调控[27,32],关于α-甘露糖苷酶与果实储藏的关系研究大多集中于GH38家族,对于GH47家族研究很少。在木薯块根PPD过程中发生显著变化的 α-甘露糖苷酶基因是MeGMII。采后9 d SC9块根中MeGMII的表达量达到对照的28.05倍,推测MeGMII是参与此过程的关键基因,该基因属于GH38家族。其他5个属于GH47家族的基因在PPD过程中也发生了变化,MeMNS1、MeMNS4的表达逐步增强,表明GH47家族基因与木薯PPD发生也存在一定关系,这与An等的研究结果[27]一致。
由于木薯固有的易腐烂性,改进其储藏技术只能部分抑制块根PPD的发生,因此依靠传统育种和转基因培育耐PPD木薯是解决木薯PPD发生的有效方法[33-34]。自然界中存在耐PPD的木薯种质,且通过杂交也可获得[35]。过表达清除活性氧的代谢酶(线粒体交替氧化酶、过氧化氢酶、超氧化物歧化酶和谷胱甘肽过氧化物酶)或淬灭活性氧的物质(β-胡萝卜素)均可提高木薯块根的耐PPD能力[2,36-38]。本研究结果推测MeGMII是参与木薯块根PPD过程的关键基因,目前已构建了MeGMII的过表达及Crispr载体,可通过遗传轉化平台在基因水平上改良该基因,有望获得一系列耐PPD的株系,从而减少因木薯PPD带来的经济损失。
20 μmol/L幾夫碱喷施木薯块根切片可明显延缓PPD现象的发生。随着PPD程度的加重,α-甘露糖苷酶活性逐渐增高,MeMNS1、MeMNS4、MeGMII的表达逐步增强,且MeGMII的表达变化最明显。α-甘露糖苷酶参与木薯块根PPD发生的过程,且 α-甘露糖苷酶活性与PPD的程度呈正相关,其中MeGMII可能是参与此过程的关键基因。
参考文献:
[1]马秋香,许 佳,乔爱民,等. 木薯储藏根采后生理性变质研究进展[J]. 热带亚热带植物学报,2009,17(3):309-314.
[2]Djabou A S M,Carvalho L J C B,Li Q X,et al. Cassava postharvest physiological deterioration:a complex phenomenon involving calcium signaling,reactive oxygen species and programmed cell death[J]. Acta Physiologiae Plantarum,2017,39(4):91.
[3]张 鹏,安 冬,马秋香,等. 木薯分子育种中若干基本科学问题的思考与研究进展[J]. 中国科学(生命科学),2013,43(12):1082-1089.
[4]Djabou A S M,Qin Y L,Thaddee B,et al. Effects of calcium and magnesium fertilization on antioxidant activities during cassava postharvest physiological deterioration[J]. Crop Science,2018,58(3):1385-1392.
[5]Qin Y L,Djabou A S M,An F F,et al. Proteomic analysis of injured storage roots in cassava (Manihot esculenta Crantz) under postharvest physiological deterioration[J]. PLoS One,2017,12(3):e0174238.
[6]秦于玲. 木薯贮藏根采后生理腐烂的蛋白质组和转录组分析 [D]. 广州:华南师范大学,2017.
[7]Uarrota V G,Maraschin M.Metabolomic,enzymatic,and histochemical analyzes of cassava roots during postharvest physiological deterioration[J]. BMC Research Notes,2015,8:648.
[8]Hu W,Kong H,Guo Y L,et al. Comparative physiological and transcriptomic analyses reveal the actions of melatonin in the delay of postharvest physiological deterioration of cassava[J]. Frontiers in Plant Science,2016,7:736.
[9]Ma Q X,Zhang T,Zhang P,et al. Melatonin attenuates postharvest physiological deterioration of cassava storage roots[J]. Journal of Pineal Research,2016,60(4):424-434.
[10]Uarrota V G,Moresco R,Schmidt E C,et al. The role of ascorbate peroxidase,guaiacol peroxidase,and polysaccharides in cassava (Manihot esculenta Crantz) roots under postharvest physiological deterioration[J]. Food Chemistry,2016,197:737-746.
[11]Morante N,Sánchez T,Ceballos H,et al. Tolerance to postharvest physiological deterioration in cassava roots[J]. Crop Science,2010,50(4):1333-1338.
[12]Salcedo A.Insights into the physiological,biochemical and molecular basis of postharvest deterioration in cassava (Manihot esculenta) roots[J]. American Journal of Experimental Agriculture,2011,1(4):414-431.
[13]Neubauer J D,Lulai E C,Thompson A L,et al. Wounding coordinately induces cell wall protein,cell cycle and pectin methyl esterase genes involved in tuber closing layer and wound periderm development[J]. Journal of Plant Physiology,2012,169(6):586-595.
[14]Beeching J R,Reilly K,Gómezvásquez R,et al. Post-harvest physiological deterioration of cassava [D]. Bath:University of Bath,2002.
[15]Owiti J,Grossmann J,Gehrig P,et al. iTRAQ-based analysis of changes in the cassava root proteome reveals pathways associated with post-harvest physiological deterioration[J]. The Plant Journal,2011,67(1):145-156.
[16]王 铎,孙春玉,陈 静,等. 真核生物α-甘露糖苷酶生物信息学分析[J]. 生命科学研究,2018,22(3):173-183.
[17]王姗姗,徐向军,路 浩,等. α-甘露糖苷酶研究进展[J]. 动物医学进展,2012,33(1):92-97.
[18]Park J K. Purification and characterisation of a novel alkalophilic α-D-mannosidase from Pseudomonas fluorescens[J]. Biocontrol Science and Technology,2013,23(11):1324-1335.
[19]Strasser R,Schoberer J,Jin C S,et al. Molecular cloning and characterization of Arabidopsis thaliana Golgi α-mannosidase II,a key enzyme in the formation of complex N-glycans in plants[J]. The Plant Journal,2006,45(5):789-803.
[20]罗 川,曹丽军,赵彩平,等. 耐贮性不同桃果实采后软化过程中α-甘露糖苷酶活性变化[J]. 西北农业学报,2013,22(10):116-119.
[21]Meli V S,Ghosh S,Prabha T N,et al. Enhancement of fruit shelf life by suppressing N-glycan processing enzymes[J]. PNAS,2010,107(6):2413-2418.
[22]Jagadeesh B H,Prabha T N,Srinivasan K. Activities of β-hexosaminidase and α-mannosidase during development and ripening of bell Capsicum (Capsicum annuum var. variata)[J]. Plant Science,2004,167(6):1263-1271.
[23]Ghosh S,Meli V S,Kumar A,et al. The N-glycan processing enzymes α-mannosidase and β-D-N-acetylhexosaminidase are involved in ripening-associated softening in the non-climacteric fruits of Capsicum[J]. Journal of Experimental Botany,2011,62(2):571-582.
[24]Yashoda H M,Prabha T N,Tharanathan R N.Mango ripening - Role of carbohydrases in tissue softening[J]. Food Chemistry,2007,102(3):691-698.
[25]薛炳烨,毛志泉,束怀瑞. 草莓果实发育成熟过程中糖苷酶和纤维素酶活性及细胞壁组成变化[J]. 植物生理与分子生物学学报,2006,32(3):363-368.
[26]党维鑫. 转α-甘露糖苷酶基因超表达、干扰载体甜瓜株系的生理生化分析[D]. 呼和浩特:内蒙古大学,2015.
[27]An F F,Baker M R,Qin Y L,et al. Relevance of class Ⅰ α-mannosidases to cassava postharvest physiological deterioration[J]. ACS Omega,2019,4(5):8739-8746.
[28]Zainuddin I M,Fathoni A,Sudarmonowati E,et al. Cassava post-harvest physiological deterioration:from triggers to symptoms[J]. Postharvest Biology and Technology,2018,142:115-123.
[29]黃志明,林素英,傅明连,等. 枇杷果实发育过程中果肉质地与胞壁酶活性的变化[J]. 热带作物学报,2012,33(1):24-29.
[30]罗 川,曹丽军,赵彩平,等. 桃沙红果实α-甘露糖苷酶基因(α-man)克隆及其在软化过程中的表达分析[J]. 农业生物技术学报,2013,21(9):1060-1067.
[31]王 铎,张美萍,王 义. α-甘露糖苷酶的研究进展[J]. 生命科学,2018,30(6):652-658.
[32]安飞飞,崔梦佳,杨 龙,等. 木薯MeGalt1基因克隆、在采后生理腐烂过程中表达分析及载体构建[J]. 福建农林大学学报(自然科学版),2021,50(2):244-249.
[33]陈松笔,安飞飞,张振文,等. 木薯综合育种理论探讨[J]. 生命科學,2016,28(7):807-816.
[34]赵平娟,孙海彦,黎娟华,等. 木薯采后生理性变质的研究进展[J]. 热带农业科学,2013,33(1):35-41.
[35]Ceballos H,Iglesias C A,Pérez J C,et al. Cassava breeding:opportunities and challenges[J]. Plant Molecular Biology,2004,56(4):503-516.
[36]Xu J,Duan X G,Yang J,et al. Enhanced reactive oxygen species scavenging by overproduction of superoxide dismutase and catalase delays postharvest physiological deterioration of cassava storage roots[J]. Plant Physiology,2013,161(3):1517-1528.
[37]Vanderschuren H,Nyaboga E,Poon J S,et al. Large-scale proteomics of the cassava storage root and identification of a target gene to reduce postharvest deterioration[J]. The Plant Cell,2014,26(5):1913-1924.
[38]Beyene G,Solomon F R,Chauhan R D,et al. Provitamin A biofortification of cassava enhances shelf life but reduces dry matter content of storage roots due to altered carbon partitioning into starch[J]. Plant Biotechnology Journal,2018,16(6):1186-1200.
