1株海洋芽孢杆菌对黄瓜灰霉病的防治效果及防治机制研究
2022-02-15方佩罗远婵田黎李淑兰李元广
方佩 罗远婵 田黎 李淑兰 李元广



摘要:为研究1株海洋芽孢杆菌对黄瓜灰霉病的防治效果及防治机制,从室内生测、盆栽药效及田间药效3个方面研究了1株海洋芽孢杆菌对黄瓜灰霉病的防治效果。同时,从拮抗作用、定殖特性、诱导抗病性3个方面来研究其生防机制。室内生测及盆栽药效结果表明,该菌株对灰霉病菌的抑菌作用显著优于对照药剂嘧霉胺(P<0.05),其发酵液处理在接种病原菌5 d后对黄瓜灰霉病的盆栽防效为83.23%。此外,菌株制剂300倍液对灰霉病的田间治疗效果达77.31%。防治机制研究表明,该菌株发酵上清液能使灰霉病菌菌丝畸形生长,原生质浓缩并外渗,导致菌丝死亡;能抑制灰霉病菌孢子萌发,并导致萌发孢子不能正常生长;该菌株能在黄瓜苗的根、茎、叶等生态位点良好定殖,定殖量维持在10万~100万CFU/g;黄瓜苗经菌株发酵液处理后,与抗病相关的过氧化物酶和过氧化氢酶活性均升高,CAT对应的基因转录量也增加,从生理水平和转录水平说明该菌株发酵液对黄瓜有诱导抗病性的作用。说明该株海洋芽孢杆菌对黄瓜灰霉病有较好的防治效果,且防治机制包括抑菌、定殖和诱导抗病性。
关键词:黄瓜灰霉病;海洋芽孢杆菌;防治效果;生防机制
中图分类号: S436.421.1+9 文献标志码: A
文章编号:1002-1302(2022)02-0091-06
收稿日期:2021-09-07
作者简介:方 佩(1987—),女,湖北洪湖人,硕士,主要从事生物防治研究。E-mail:fpwonderful116@126.com。
通信作者:罗远婵,博士,讲师,主要从事微生物防治研究,E-mail:luoyuanc@ecust.edu.cn; 李元广,博士,教授,主要从事微生物农药、微藻培养研究,E-mail:ygli@ecust.edu.cn。
近年來,随着大棚蔬菜面积扩大,重茬黄瓜棚增多,黄瓜灰霉病(Botrytis cinerea)发病日趋严重,已成为设施栽培黄瓜上的一种重要病害。在湿度大、通风条件差的情况下,一旦发病,不能及时防治,就会造成很大损失,一般减产20%~30%,严重时全棚萎蔫、绝产[1-2]。化学防治是目前黄瓜灰霉病的主要防治措施,然而高强度、高频次地使用化学农药致使灰霉病菌对常用的杀菌剂已产生了抗药性,而且对环境也造成了一定的农药污染[3-4]。随着人们环保意识的增强和对食品安全的注重,对无公害蔬菜的需求日益增多,生物农药由于其低污染、低残留的特性已成为灰霉病防治研究的热点[4]。
海洋微生物因其生境特殊,常产生有异于陆地微生物的代谢产物而成为近年来海洋微生物资源开发的热点[5]。利用海洋微生物进行药剂开发的研究主要集中在医药方面,而在防治灰霉病农药开发方面的研究并不多,但也有学者开始相关研究。如Edwards等研究发现,短短芽孢杆菌(Brevibacillus brevis)可在液体、固体培养基及白菜离体叶片上抑制灰霉病菌的萌发和生长[6];Wang等从中国东南海域分离的酵母(Rhodosporidium paludigenum),离体及活体都能较好地抑制灰霉病菌的生长[7];聂亚锋等从海水中分离的细菌PT-sw-1,其胞外粗提物对番茄灰霉病菌等几种病原菌有较好的抑菌活性[8];崔荣强等对来自潮间带红树植物的芽孢杆菌T28菌株进行了研究,发现T28菌株对番茄灰霉病防治效果显著,且对番茄生长有多种促进作用[9];魏新燕等从渤海海水和底泥样品中分离出1株甲基营养型芽孢杆菌BH21,它对灰霉菌菌丝生长有较好的抑制效果[10];邱森森等对从东海海底土壤沉积物中分离获得的芽孢杆菌菌株ZDC-01的室内防效进行了研究,发现该菌株菌悬液对茄子灰霉病菌有一定的防治效果,与对照药剂腐霉利防治效果相当[11];杨可等研究发现,海洋生境贝莱斯芽孢杆菌(Bacillus velezensis)TCS001对黄瓜灰霉病菌菌丝生长和孢子萌发有显著的抑制作用,形态学观察发现TCS001发酵滤液可导致黄瓜灰霉病菌孢子萌发芽管中间或顶端膨大畸形[12]。Ma等研究发现,来自海洋沉积物的解淀粉芽孢杆菌SH-B74能产生制磷脂菌素(Pastastatin A1),该物质能有效降低番茄灰霉病的发病率[13]。目前,还未见有来自海洋的芽孢杆菌对防治黄瓜灰霉病详细田间实际应用效果的报道。
田黎研究员课题组与笔者所在实验室合作,从渤海潮间带盐地碱蓬中分离到1株海洋芽孢杆菌。为明确该菌株防治黄瓜灰霉病的效果并了解其防治黄瓜灰霉病的机制,本试验以黄瓜灰霉病菌为靶标,对该株海洋芽孢杆菌的室内生测、盆栽药效、田间药效试验及生防机制进行了全面探究。
1 材料和方法
1.1 材料
生防菌:海洋芽孢杆菌(Bacillus marinus),分离自渤海潮间带盐地碱蓬,由笔者所在实验室保藏。
病原指示菌:黄瓜灰霉病菌(Botrytis cinerea),分离自上海南汇地区的黄瓜上,由笔者所在实验室保藏。
培养基:PDA培养基[14]、海洋芽孢杆菌培养基[15]。
药剂:400 g/L嘧霉胺悬浮剂[拜耳作物科学(中国)有限公司,农药登记证号:PD20060014]。
1.2 海洋芽孢杆菌对灰霉病菌的室内生测
以400 g/L嘧霉胺悬浮剂为对照药剂,用平板扩散法来测定海洋芽孢杆菌摇瓶培养[15]上清液对黄瓜灰霉病菌的抑菌活性。每个处理设3个重复,灭菌蒸馏水为空白对照。将各处理平皿置于28 ℃培养箱中培养48 h后,用十字交叉法测量皿底抑菌圈的大小,计算平均抑菌圈直径。采用Duncan’s新复极差法进行方差分析,以下同。
1.3 海洋芽孢杆菌对灰霉病的盆栽防治效果测定
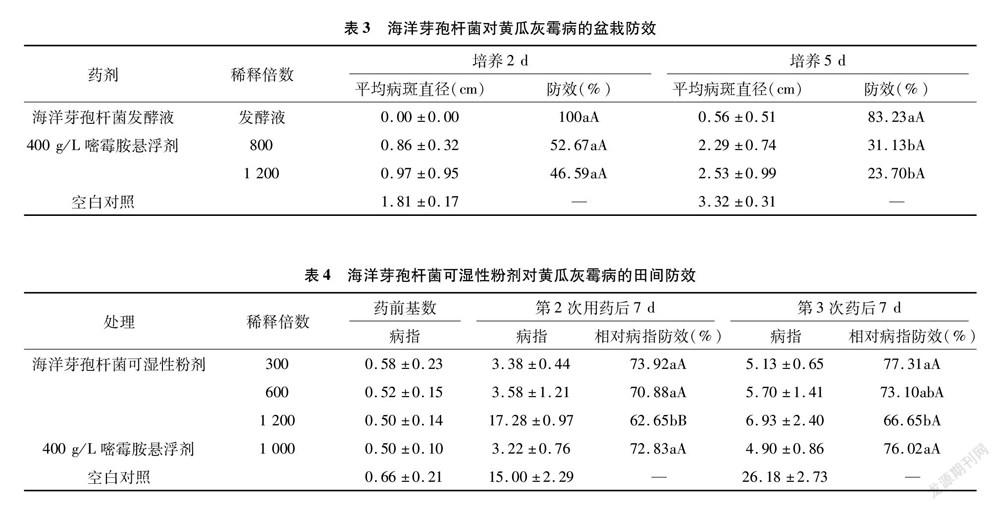
盆栽试验方法参考上海南方农药研究中心“创制农药生物活性评价SOP规范”进行。取1叶1心期长势一致盆栽黄瓜苗(宝杂2号),分别用海洋芽孢杆菌 5 L发酵罐培养30 h的发酵液、嘧霉胺800倍稀释液、嘧霉胺1 200倍稀释液、清水喷雾处理后,放在人工气候箱中(相对湿度100%,温度 20 ℃,光照6 000 lx 12 h),2 d后于黄瓜苗叶片中央接种病原菌菌饼(直径5 mm)。各处理设3个重复,每天观察黄瓜苗生长状况,2~5 d后空白对照充分发病时,以灰霉病菌菌块为中心,测定每片黄瓜叶片病斑直径(cm),并按公式(1)和公式(2)计算防效。
平均病斑直径=∑病斑直径叶片数;(1)
防治效果=对照平均病斑直径-处理平均病斑直径对照平均病斑直径×100%。(2)
1.4 海洋芽孢杆菌制剂对灰霉病的田间药效
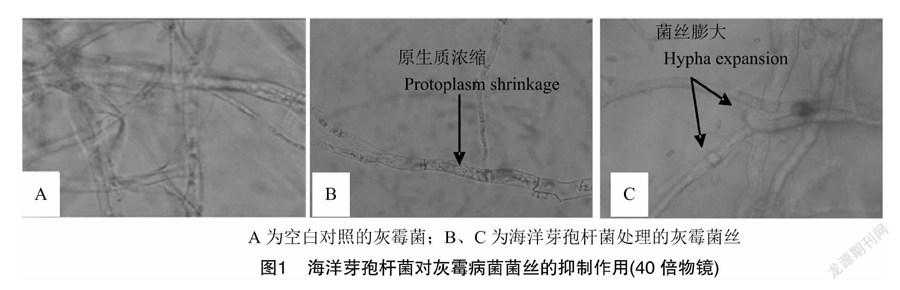
2020年在江西省南昌市郊进行黄瓜灰霉病田间试验,于第1次施药前进行病指基数调查并开始用药,共喷施3次,每次间隔7 d。处理为海洋芽孢杆菌可湿性粉剂300倍液、600倍液和1 200倍液、嘧霉胺1 000倍液以及空白对照,各处理占地 25~50 m2。定期检查病情指数,并按公式(3)和公式(4)计算病指防效。
依据GB/T 17980.28—2000《农药田间药效试验准则(一) 杀菌剂防治蔬菜灰霉病》,灰霉病分级标准:0级,无病斑;1级,单叶片有病斑3个;3级,单叶片有病斑4~6个;5级,单叶片有病斑7~10个;7级,单叶有病斑11~20个,部分密集成片;9级,单叶片有病斑密集占叶面积1/4以上。
病情指数=∑(各级病株数×相对级数值)调查总株数×最高级数值×100%。(3)
相对病指防效=1-CK0病情指数×pt1病情指数CK1病情指数×pt0病情指数×100%。(4)
式中:CK0、CK1 分别为清水对照区施药前病株率(病指)、施药后病株率(病指);pt0、pt1 分别为药剂处理区施药前病株率(病指)、施药后病株率(病指)。
1.5 海洋芽孢杆菌对灰霉病菌生长抑制作用的测定
1.5.1 对菌丝抑制作用的测定
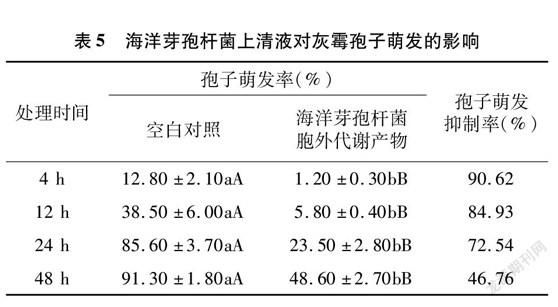
取室内生测“1.2”节中靠近平皿中央孔口(注入海洋芽孢杆菌摇瓶培养上清液或无菌水)的病原真菌菌丝,于显微镜下观察菌丝形态,并拍照记录。
1.5.2 对孢子萌发抑制作用的测定
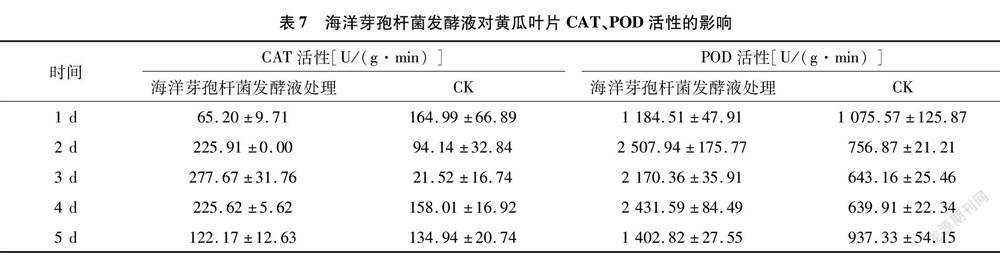
将病原真菌以无菌生理盐水制备成孢子悬浮液(浓度约为 10万孢子/mL)。取海洋芽孢杆菌摇瓶培养上清液,与病原菌孢子悬浮液等体积混合,加入凹玻片凹穴中,20 ℃暗培养,定期检查孢子萌发状况,计算孢子萌发率。用无菌生理盐水为对照。以芽管长度超过孢子小端直径一半时记录为萌发,每处理3个重复,计算孢子萌发率及孢子萌发抑制率。
孢子萌发率=萌发孢子数孢子总数×100%;(5)
孢子萌发抑制率=对照孢子萌发率-处理孢子萌发率对照孢子萌发率×100%。(6)
1.6 海洋芽孢杆菌的定殖
用薄膜将黄瓜苗茎基部以下部分包裹住,喷雾海洋芽孢杆菌摇瓶培养液后去除薄膜,于人工气候箱中培养(培养条件同“1.3”节),3、6、9、12、15 d对黄瓜苗的叶、茎、根进行分离,并用稀释法计算接种后不同时间、不同器官内海洋芽孢杆菌的含菌量。每处理设50株苗,每次取10株苗的不同器官检测活菌含量。
1.7 海洋芽孢杆菌发酵液对黄瓜抗病相关防御酶活性的影响
共设2个处理。处理1:海洋芽孢杆菌摇瓶培养液,喷雾;处理2:CK,清水喷雾。每处理设15株苗。每次取3株苗检测酶活性。分别于用药后1、2、3、4、5 d取黄瓜叶片测定POD、CAT的活性,酶活测定方法參照《植物生理学研究技术》[16]。
1.8 荧光定量PCR检测海洋芽孢杆菌对黄瓜cat基因表达的影响
共设2个处理。处理1:海洋芽孢杆菌摇瓶培养液,喷雾;处理2:清水对照,CK。各处理15盆苗,分别于药剂处理后的0、1、2、3、4 d在各处理中随机抽取3盆、摘取3张真叶,称质量后于液氮中研磨成粉末状,用“植物总RNA提取试剂盒”(TIANGEN公司)提取黄瓜叶片中的总RNA,用“反转录试剂盒”(TIANGEN公司)合成cDNA第一链,然后以cDNA为模板进行荧光定量PCR,每个点做3次重复。
荧光定量PCR所用试剂盒为TOYOBO公司,所用仪器为ABI StepOne plus(ABI公司),反应体系(20 μL):模板 2 μL,引物F 0.8 μL,引物R 0.8 μL,2.5×RealMasterMix/20×SYBR solution 10 μL,补充超纯水至20 μL。程序:95 ℃预变性 30 s;95 ℃ 变性5 s,50~61 ℃退火10 s,72 ℃延伸15 s,40个循环。依据引物设计原则及cat和番茄的18S rRNA基因序列、选取序列中的一段保守序列进行相应的引物设计(表1)。数据处理方法用相对定量法中的2-ΔΔCT法[17]。
2 结果与分析
2.1 海洋芽孢杆菌对灰霉病菌的室内抑菌作用
从表2可以看出,海洋芽孢杆菌摇瓶培养上清液原液至稀释20倍液对灰霉病菌都有明显的抑菌圈。其上清液原液至稀释20倍液对灰霉病菌的抑菌圈直径分别为68.70、57.27、48.30、38.87 mm;嘧霉胺800倍、1 600倍稀释液对灰霉病菌的抑菌圈直径分别为33.47、28.20 mm。海洋芽孢杆菌上清液原液至稀释20倍液与嘧霉胺800倍液和1 600倍液的抑菌圈直径在0.05和0.01水平上均差异显著。由上述结果可见,海洋芽孢杆菌摇瓶培养上清液原液至稀释20倍液对灰霉病菌的抑制作用明显优于嘧霉胺800倍液和1600倍液。
2.2 海洋芽孢杆菌对黄瓜灰霉病的盆栽防效测定
室内生测结果(表3)显示,海洋芽孢杆菌对灰霉病菌有较强的抑菌作用,且优于常用化学药剂嘧霉胺;盆栽试验也显示了相同的结果:在接种病原菌5 d后,海洋芽孢杆菌发酵液对黄瓜灰霉病的防效为83.23%,显著优于对照药剂嘧霉胺田间推荐使用浓度(P<0.05)。
2.3 海洋芽孢杆菌可湿性粉剂对黄瓜灰霉病的田间药效
由表4可知,在第3次药后7 d,海洋芽孢杆菌可湿性粉剂的防效随着用药浓度的升高而升高,且300倍稀释液对黄瓜灰霉病的相对病指防效为77.31%,与对照药剂400 g/L嘧霉胺1 000倍稀释液防效相当。
2.4 海洋芽孢杆菌对灰霉病菌抑制作用机制
2.4.1 对菌丝抑制作用的测定
由图1可知,与空白对照相比,海洋芽孢杆菌摇瓶培养上清液可使灰霉病菌的菌丝畸形生长,使其原生质浓缩,导致菌丝死亡。
2.4.2 对孢子萌发抑制作用的测定
由表5可知,海洋芽孢杆菌上清液48 h内对灰霉孢子的萌发有明显的抑制作用。处理4~48 h,海洋芽孢杆菌上清液对灰霉孢子的抑制率为46.76%~90.62%,随着时间的延长抑制作用开始减弱。镜检海洋芽孢杆菌上清液处理48 h萌发孢子的形态,发现芽管比对照短且粗大。可以看出,生防菌株海洋芽孢杆菌上清液对灰霉孢子的作用还表现为推迟孢子的萌发时间,并导致萌发孢子不能正常生长。
2.4.3 海洋芽孢杆菌在黄瓜苗上的定殖情况
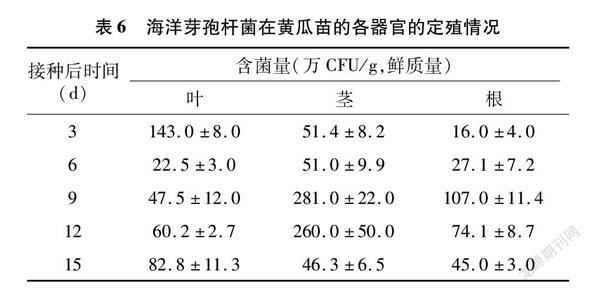
由表6可知,海洋芽孢杆菌发酵液喷雾接种到黄瓜苗上3~15 d时,在叶、茎、根上均能良好定殖。叶部可能由于保水能力不强,其含菌量从接种3 d的 143万CFU/g 下降到6 d时的22.5万CFU/g,此后在9 d有所上升,到15 d时含量达到82.8万CFU/g。
茎部和根部保水能力较好,其含菌量从接种3 d后持续上升,到9 d时达到最大值(100万CFU/g),此后开始虽有所下降,但15 d时茎和根内仍含有 45万CFU/g 左右的活菌。由此可见,海洋芽孢杆菌在黄瓜苗各器官内可以良好定殖。
2.4.4 海洋芽孢杆菌发酵液对黄瓜抗病相关防御酶活性的影响
过氧化物酶(POD)和过氧化氢酶(CAT)属于植物活性氧清除酶系,对于超氧阴离子自由基和过氧化氢的清除,保护膜结构发挥了重要作用。这2种酶均为植物抗病性的重要指标。由表7可见,黄瓜叶片经海洋芽孢杆菌培养液处理后,叶片内的CAT和POD这2种酶的活性与对照相比均明显升高。其中,CAT在3 d时活性达到最高,POD在2 d时达到最高,在4 d时又出现第2个酶活性高峰。酶活性的增加在一定程度上反映了植物抗病性的增加,说明海洋芽孢杆菌发酵液对黄瓜有诱导抗病的作用。
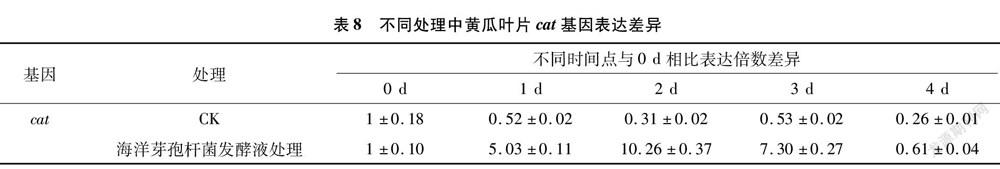
2.5 海洋芽孢杆菌发酵液对黄瓜防御酶cat基因表达量的影响
运用实时荧光定量PCR技术,以18S rRNA為内参基因,分析黄瓜苗经发酵液处理后cat基因的差异表达。由表8可知,经海洋芽孢杆菌培养液处理后,黄瓜叶片中的cat基因mRNA转录量增加。与对照相比,cat基因在处理后3 d时转录量达到最大,CAT活性也在3 d时达到最大。cat基因转录量和CAT活性的增加分别从分子水平和生理水平上说明了海洋芽孢杆菌发酵液能诱导黄瓜植株产生抗病性。
3 讨论
利用生物防治法防治灰霉病已有诸多文献报道,且被认为是代替化学药剂的有效方法之一[7]。海洋的特殊生境(高盐、低温、高压、寡营养和流动等特点)使生活于其中的海洋生物极易产生与陆地生物不同的代谢产物,对病害防治可能有与陆地微生物不同的效果;此外,对于资源日渐匮乏的陆地,可持续开发海洋资源已成为当今研究的热点[5]。
田黎研究员课题组与笔者所在课题组合作,从渤海潮间带盐地碱蓬根际分离到1株海洋芽孢杆菌。室内生测及盆栽药效试验显示,海洋芽孢杆菌对黄瓜灰霉病菌的抑菌效果优于常用化学药剂 400 g/L嘧霉胺悬浮剂(推荐稀释倍数800~1 200倍);海洋芽孢杆菌制剂在田间药效能达到77.31%,与400 g/L嘧霉胺悬浮剂(稀释1 000倍)的药效相当,且对环境友好,对作物及其他生物无药害。此外,笔者所在课题组刘荣峰等从其发酵液中分离到3个新结构的环脂肽化合物,这些化合物对灰霉病菌也有较强的抑菌活性[18-20];最低抑菌浓度(MIC)为50 μg/mL,进一步盆栽试验结果表明,环脂肽物质(125 μg/mL)对黄瓜灰霉病的盆栽防效高达95.6%,而嘧霉胺(500 μg/mL,推荐使用浓度)的防效仅为51.1%[20]。可见产生环脂肽物质是海洋芽孢杆菌抑制灰霉病的重要机制之一。
本研究结果表明,海洋芽孢杆菌菌株代谢产物对黄瓜灰霉病菌菌丝生长有强烈的抑制作用,同时该菌株代谢产物能杀死分生孢子,降低孢子萌发率。海洋芽孢杆菌能在黄瓜根、茎、叶生态位点有良好的定殖能力,并对黄瓜苗有诱导抗病性的作用。因此,可以推断海洋芽孢杆菌对黄瓜病害的防治机制包括拮抗、位点竞争和诱导抗病性。本研究用荧光定量PCR法研究了海洋芽孢杆菌诱导植物抗病相关基因表达量的变化,从转录水平说明了其对黄瓜有诱导抗病性作用。
生防微生物应用后防治效果能否稳定持久,受多种因素的影响。尤其是灰霉病菌,它是一种极易变异的植物病原菌,使其生物防治变得更复杂。只有详细了解了生防菌对不同来源的抗性和敏感性灰霉病菌菌株的抑制效果,生防菌使用后在植物内生防菌与灰霉病菌的消长情况,生防菌产生的抑制灰霉病菌的主要抑菌活性物质及其在生防菌代谢产物内的含量,以及不同环境因素对生防菌的存活和防效的影响后,才能更好地发挥生防菌对灰霉病的防病功能。目前,正在开展海洋芽孢杆菌在不同类型田间土壤的定殖能力、适生性、稳定性及其在不同地区防治灰霉病效果的研究,以期充分探究其防治不同来源灰霉病的机制和效果。
参考文献:
[1]陈 晋,郭玉杰,吕 恒,等. 黄瓜灰霉病的生防木霉菌株筛选[J]. 长江大学学报(自然科学版),2019,16(8):71-76.
[2]Valeri M C,Novi G,Weits D A,et al. Botrytis cinerea induces local hypoxia in Arabidopsis leaves[J]. New Phytologist,2021,229(1):173-185.
[3]Mendoza L,Castro P,Melo R,et al. Improvement of the antifungal activity against Botrytis cinerea of syringic acid,a phenolic acid from grape pomace[J]. Journal of the Chilean Chemical Society,2016,61(3):3039-3042.
[4]Shi J F,Sun C Q.Isolation,identification,and biocontrol of antagonistic bacterium against Botrytis cinerea after tomato harvest[J]. Brazilian Journal of Microbiology,2017,48(4):706-714.
[5]刘 淼,王继红,姜 健,等. 海洋微生物应用于生物农药的研究进展[J]. 中国农学通报,2014,30(3):232-236.
[6]Edwards S G,Seddon B. Mode of antagonism of Brevibacillus brevis against Botrytis cinerea in vitro[J]. Journal of Applied Microbiology,2001,91(4):652-659.
[7]Wang Y F,Yu T,Xia J D,et al. Biocontrol of postharvest gray mold of cherry tomatoes with the marine yeast Rhodosporidium paludigenum[J]. Biological Control,2010,53(2):178-182.
[8]聂亚锋,刘永锋,李德全,等. 海洋细菌PY-sw-1产生的抗菌物质及其抑菌活性[J]. 植物保护学报,2008,35(4):373-374.
[9]崔荣强,张久明,马湘君,等. 海洋生境芽孢杆菌(Bacillus sp.)T28菌株对番茄生长的多功能促进作用[J]. 植物生理学报,2015,51(11):1855-1860.
[10]魏新燕,黄媛媛,黄亚丽,等. 拮抗灰霉菌的海洋细菌甲基营养型芽孢杆菌的筛选、鉴定及其抑菌活性物质的研究[J]. 中国生物防治学报,2017,33(5):667-674.
[11]邱森森,胡修俊,朱凤蒙,等. 地下芽孢杆菌ZDC-01抑菌效果及其防效研究[J]. 现代农业科技,2018(13):97-98,102.
[12]杨 可,郑柯斌,黄晓慧,等. 海洋生境贝莱斯芽孢杆菌TCS001的鉴定及抑真菌活性[J]. 农药学学报,2018,20(3):333-339.
[13]Ma Z W,Hu J C. Plipastatin A1 produced by a marine sediment-derived Bacillus amyloliquefaciens SH-B74 contributes to the control of gray mold disease in tomato [J]. Biotech,2018,8(2):125.
[14]胡 杨. 农用抗真菌海洋微生物菌株筛选、发酵及活性物质分离纯化的研究[D]. 上海:华东理工大学,2010.
[15]何培青,田 黎,李光友,等. 海洋细菌B-9987发酵条件的优化及胞外抑菌物质的理化特性[J]. 中国海洋药物,2001,20(2):8-12.
[16]孙 群,胡景江.植物生理学研究技术[M]. 杨凌:西北农林科技大学出版社,2006.
[17]Bustin S A,Benes V,Garson J A,et al. The MIQE guidelines:minimum information for publication of quantitative real-time PCR experiments[J]. Clinical Chemistry,2009,55(4):611-622.
[18]Liu R F,Zhang D J,Li Y G,et al. A new antifungal cyclic lipopeptide from Bacillus marinus B-9987[J]. Helvetica Chimica Acta,2010,93(12):2419-2425.
[19]Zhang D J,Liu R F,Li Y G,et al. Two new antifungal cyclic lipopeptides from Bacillus marinus B-9987[J]. Chemical & Pharmaceutical Bulletin,2010,58(12):1630-1634.
[20]劉荣峰. 海洋芽孢杆菌B-9987抑菌物质的分离及生物活性研究[D]. 上海:华东理工大学,2011:47-48.
