CRISPR/Cas9技术在节肢动物中的应用研究
2022-02-14黄津伟胡乐贞齐佳辰孙金生李冉
黄津伟 胡乐贞 齐佳辰 孙金生 李冉


摘要 CRSPR/Cas9系统是基于RNA的适应性免疫系统,广泛存在于细菌和古细菌中。其特点在于单个蛋白质Cas9与两个短RNA序列结合后,可作为位点特异性核酸内切酶在体内或体外发挥作用。与传统的由核酸酶介导的DNA编辑技术不同,CRISPR/Cas9对DNA的识别不是由蛋白质指定的,而是由 20-nt向导RNA(guide RNA)序列指定的。CRISPR/Cas9系统由于其设计过程和使用过程简单高效而被广泛应用。总结CRSPR/Cas9系统作用机理、导入方法及其在节肢动物中不同类群及不同基因的应用进展,以期为重要农业及经济节肢动物的功能基因研究与遗传育种研究提供有价值的参考。
关键词 CRISPR/Cas9;导入方法;节肢动物;基因编辑
中图分类号 Q78 文献标识码 A 文章编号 0517-6611(2022)01-0001-07
doi:10.3969/j.issn.0517-6611.2022.01.001
Research on the Application of CRISPR/Cas9 Technology in Arthropods
HUANG Jin-wei, HU Le-zhen, QI Jia-chen et al
(College of Life Sciences,Tianjin Normal University, Tianjin 300387)
Abstract The CRISPR/Cas9 system is an RNA-based adaptive immune system which exists in bacteria and archaea. Its characteristic is that following the compound of a single protein Cas9 with two short RNA, it can act as a site-specific endonuclease in vivo/in vitro. Unlike traditional nuclease-mediated DNA editing technology, the recognition of DNA by CRISPR-Cas9 is not specified by the protein, but by the 20-nt guide RNA (guide RNA) sequence. The CRISPR-Cas9 system is widely used due to its simplicity in design, use and high efficiency. Summarizes the mechanism of CRSPR/Cas9 system, the introduction method and the application progress of different groups and different genes in arthropods, in order to provide a valuable reference for the research of functional genes and genetic breeding of important agricultural and economic arthropods.
Key words CRISPR/Cas9;Introducing method;Arthropod;Gene editing
基金项目 “蓝色粮仓”国家重点研发计划子课题(2018YFD0901301)。
作者简介 黄津伟(1997—),女,天津人,硕士研究生,研究方向:水生生物学。
通信作者,孙金生,研究员,从事重要水产动物疾病的发生和免疫防治研究;李冉,副教授,从事重要水产动物生长生理及分子育种研究。
收稿日期 2021-08-01;修回日期 2021-08-23
基因组编辑技术是研究各种生物体靶基因功能的有效手段,在CRISPR/Cas9系统被发现之前,锌指核酸酶(zinc finger nucleases,ZFNs)和转录激活因子样效应核酸酶(transcription activator-like effector nucleases,TALENs)技术常用于基因编辑,这2种技术均可用于设计DNA结合域,可以有效地识别和修改基因序列,被广泛应用于各个领域。然而锌指核酸酶和转录激活因子样效应核酸酶需要使用多种核酸酶,核酸酶的脱靶效应会导致细胞毒性,且使用方法较为复杂[1],因此这2个基因组编辑系统最近被CRISPR/Cas9系统取代。CRISPR/Cas9系统进行基因编辑简单高效,已被广泛用于哺乳动物。
节肢动物物种繁多,包括与农林渔业相关的诸多物种,了解相关物种的基因功能从而在农林渔业中合理应用是非常重要且必要的。CRISPR/Cas9已应用于节肢动物的部分物种,笔者对已成功应用的物种及研究进展进行总结,以期为重要农业及经济节肢动物的功能基因研究与遗传育种研究提供有价值的参考。
1 CRISPR/Cas系统
1.1 CRISPR/Cas的作用机理及类型
CRISPR/Cas(Clustered Regularly Interspaced Short Palindromic Repeats/ CRISPR associate proteins)系統最早发现于细菌内,是以RNA为基础的适应性免疫系统,主要防御外来核酸的侵染,维持细菌自身正常生命代谢活动[2]。CRISPR/Cas系统由反式激活CRISPR RNA基因(tracrRNA)、Cas操纵子和CRISPR DNA区域3部分组成,其中CRISPR由一组重复间隔序列及多个非重复间隔序列组成,非重复间隔序列是早先侵入细菌内的病原体核酸片段经过不断进化形成的。tracrRNA作为一种独特的非编码RNA,与CRISPR间隔序列具有同源性。Cas操纵子目前已发现有多种,如Cas9、Cas1、Cas2和Csn2,可经转录翻译生成Cas蛋白(核酸酶)。当侵染过的病毒再次入侵细胞,CRISPR DNA区域转录生成前体CRISPR RNA(pre-crRNA),tracrRNA与pre-crRNA通过碱基互补配对及RNA酶的作用形成成熟的crRNA[3]。crRNA与tracrRNA组成单链导向RNA(sgRNA),并利用细菌中的核酸酶进一步修饰crRNA的5′端,使其长度最终减少到20 nt。当crRNA下游存在特定的前间区序列邻近基序(PAM)时,Cas蛋白将被引导至入侵病原体DNA与crRNA互补的位点处进行切割,完成免疫过程。基于上述过程,有研究者提出可以在体外合成sgRNA模拟体内crRNA和tracrRNA的结构,并与Cas9结合形成CRISPR/Cas9系统。Jinek等[4-5]研究出利用sgRNA对特定DNA进行剪切的核酸酶系统,首次证明了CRISPR/Cas9可以被应用于基因工程。Mali等[6-7]创建CRISPR/Cas9系统并应用于基因编辑。由于其设计使用较为简单且有效,CRISPR/Cas系统得到了生物学届和医学界的广泛关注,并广泛应用于基因编辑、转录扰动、表观遗传调节和基因组成像等相关研究[8]。根据目前CRISPR/Cas位点的分类[9],CRISPR系统被分为6种不同的类型(I~VI),各类型都使用特定的Cas蛋白和crRNA。相比其他系统来说,II型系统的结构最简单,即CRISPR/Cas9系统。
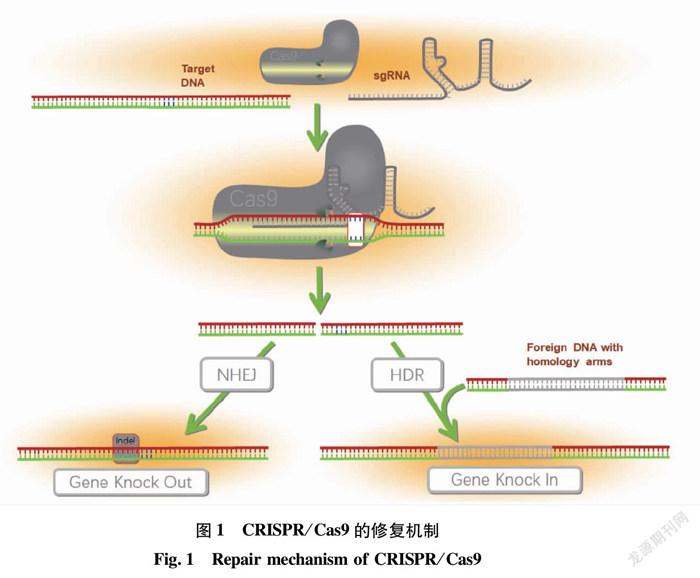
1.2 CRISPR/Cas9的修复机制
Cas9蛋白包含2个结构域,其中HNH结构域可剪切与sgRNA互补的靶DNA链(目标链),RuvC结构域则剪切另外一条核酸链,造成目标DNA的双链断裂(double-strand DNA break,DSB)。双链断裂后细胞内会启动修复机制,细胞在不同的分裂时期会启动不同的修复机制。每个细胞分裂时期都可以发生非同源修复机制(nonhomologous end joining,NHEJ),这种机制不需要同源模板存在。DNA双链断裂后修复酶会对断裂末端进行酶切修饰,便于DNA连接酶将断裂的两端DNA重新连接在一起,这种修复方式易在断裂位点出现碱基插入或缺失,且通常会产生移码突变,从而导致蛋白质翻译的提前终止,转录物降解或蛋白质丢失。另一种细胞修复机制只能发生在细胞分裂间期,它需要同源修复模板,称为同源修复机制(homology-directed repair,HDR),模板可以是ssDNA或dsDNA,在导入CRISPR/Cas9的同时,需要提供带同源臂的供体DNA作为整合模板,其可以携带外源DNA序列从而引入新的基因。CRISPR/Cas9系统也是当前应用最多的系统可以利用非同源修复机制使目的基因转录失败或使目的蛋白失去功能,进而实现基因敲除,在哺乳动物中的成功率较高,Cas9中的HNH结构域可以利用多个sgRNA通过非同源修复机制实现一个试验中多个靶基因(序列较短)的突变[7,10],也可通过引入2个sgRNA敲降较长的基因组片段。
1.3 CRISPR/Cas9系统的导入方法
1.3.1 CRISPR/Cas9系统的封装方式。
目前导入CRISPR/Cas9的方式有很多,分别可以mRNA、DNA、蛋白-核酸的形式引入。在RNA水平上,2015年Hruscha等[11]将sgRNA和Cas9 mRNA通过显微注射导入到斑马鱼胚胎中,对斑马鱼基因组进行编辑;在DNA水平上,主要通过质粒或病毒介导DNA导入;在蛋白质-核酸水平上,通常在体外表达Cas9蛋白,并与sgRNA孵育结合形成Cas9蛋白-sgRNA复合体后将其导入受精卵或细胞中进行基因编辑[12-13]。
1.3.2 显微注射法。
显微注射法是将外源基因导入胚胎的最常见且最直接的方法,在节肢动物的模式生物中应用较为广泛,也是当下CRISPR/Cas9导入的主要技术。但显微注射技术仍在应用方面存在一些阻碍:例如部分节肢动物的卵膜会在排卵后很快变硬导致在注射时胚胎破裂,由于卵细胞内外渗透压不同造成注射时内容物的外流等。目前研究人员针对不同情况已经提出了相应的解决方法,对于卵膜硬化问题,解决的方法是选择合适的时间,在产卵后应立即收集胚胎,将卵置于某些试剂(如蔗糖、次氯酸盐)中[13-14]或置于冰上,防止卵膜变硬;而对于卵细胞渗透压差异问题,平衡渗透压是最有效的解决方法,海洋动物的卵或胚胎可以放在海水中[15];探索合适的培养条件,如Hiruta等[16]提出水蚤中分离的胚胎培养于2%琼脂、60 mmol/L蔗糖的培养基上最有利于显微注射。虽然显微注射技术目前应用得相对广泛,但由于需要精密昂贵的注射设备、高难度的操作技术且成活率較低,研究者们在积极探求更优的技术方法。
1.3.3 精子介导法。
1971年首次报道了精子能携带异源基因整合到受精卵中[17],1989年Lavitrano等[18]将外源DNA与小鼠精子在等渗溶液中孵育15 min,在后代中检测出外源基因被带入受精卵,证明精子细胞具有吸收外源DNA并将其携带到卵细胞的能力。但是,由于精子是成熟的生殖细胞,无法在分裂之前选择成功整合外源DNA的细胞,即使精子进入卵细胞后在受精卵或子一代中成功转入外源基因,也可能是以染色体外形式存在,而不是整合到宿主基因组中[19]。2008年Wu等[20]将109个精子和50~300 mg DNA在体外17 ℃孵育,后经人工授精,检测到仔猪存在转基因个体,但70~90 d龄的仔猪均未检测到外源DNA,表明精子摄取DNA仅在早期传递给后代,研究人员推测是由于早期细胞分裂复制过程导致外援DNA丢失。为了优化精子介导法,研究者进行了多种尝试,例如使用线性化质粒[18]、通过转染试剂优化DNA转移[21],并且发现精子摄取DNA效率与精子的运动性高度相关[20]。目前精子介导基因转移技术已经在小鼠[22-23]、牛[24-25]、猪[23]、鸡[26-27]、鱼类等生物中得到一定改良和应用,2014年Xin等[28]发现海洋鱼类精子由于精浆中存在DNA酶,摄取外源DNA能力较弱,可通过除去精浆并用脂质体包装DNA的方法实现精子介导基因转移。精子介导法有操作简便、成本低廉的优点,通过精子介导CRISPR/Cas9到节肢动物的受精卵或胚胎也作为引入CRISPR/Cas9的可行性方法受到研究者的关注,但在节肢动物中尚未报道。
1.3.4 纳米颗粒介导法。
用纳米颗粒包装CRISPR/Cas9系统进入细胞可以增大体内细胞对CRISPR/Cas9系统的内化率,克服离体基因编辑的限制,为内容物分子提供屏障以防止降解,还可通过设计纳米颗粒的结构和成分,灵活实现靶向特定的组织。CRISPR/Cas9进入细胞的3种方式产生的复合物与质粒均可以被纳米颗粒包装进入细胞[29-31]。对于通过纳米颗粒包装CRISPR/Cas9系统进入细胞来说,以Cas9 mRNA和sgRNA混合物的方式进行包装优于Cas9-sgRNA质粒包装,原因在于质粒DNA中包含了大量非编码序列,长度较大,使得包装难度高[32]。此外,mRNA可以直接在细胞质中进行翻译,不需整合到宿主基因组中,没有插入诱变的风险,脱靶率较低,质粒则需要进入细胞核中完整进行转录和翻译的过程。当前各种纳米颗粒的应用有很多,例如两性离子氨基脂质(zwitterionic amino lipids,ZALs)纳米颗粒[33]、外泌体-脂质体杂合纳米颗粒[34]、脂质纳米颗粒[35]和阳离子类脂质纳米颗粒[36-37]等都实现了递送CRISPR/Cas9进入细胞并实现基因编辑。但由于纳米颗粒传导法前期制备方法复杂、成本较高,因而在一定程度上限制了其在基因编辑操作中的广泛应用。
1.3.5 病毒介导法。
以病毒为载体导入CRISPR/Cas9主要用到的是慢病毒(lentivirus)、腺病毒(adenovirus)和腺相关病毒(adeno-associated virus,AAV)。慢病毒可以将外源DNA整合到宿主染色体中,形成稳定遗传的细胞系,但毒性较大,感染效果较差。腺病毒感染效果好,但免疫原性高、维持时间短。目前比较成熟的是腺相关病毒,它的免疫原性低,并且有多种血清型可以靶向不同的器官或组织,但是AAV的装载能力比较差,需要构建双载体进行导入。研究中用的比较多的是酿脓链球菌Cas9(spCas9,~4.2 kb)。例如Ran等用来自金黄色葡萄球菌的Cas9蛋白(saCas9,~3.2 kb)代替spCas9,从而将sgRNA和Cas9构建于一个载体中[38-39]。以上3种病毒介导CRISPR/Cas9进入细胞或胚胎的技术较为成熟,但是它们只能侵染哺乳动物,无法感染节肢动物,因此无法应用于节肢动物转基因工作。目前廣泛应用于节肢动物转基因工作的病毒载体是杆状病毒(baculovirus)[40]。Zhu等[41]通过磁性纳米粒子-杆状病毒载体(MNP-BVs),在磁场的作用下介导CRISPR/Cas9系统进行体内靶向基因编辑。Dong等[42]构建杆状病毒诱导CRISPR/Cas9系统进入昆虫细胞,在很大程度上降低了脱靶效应。Naik等[43]研究发现加州苜蓿多核多角体病毒(AcMNPV)可以有效地介导外源基因进入蚊子细胞,通过合适的启动子诱导高效表达基因,而且对细胞繁殖和生存力没有明显消极影响。对于基因组信息尚未解析的物种,无法确定高效启动外源基因表达的启动子,因此在这些物种中使用病毒介导外源基因的技术还不成熟。
1.3.6 卵黄蛋白原介导法。
大多数卵生动物雌性在卵巢发育的过程中会向卵细胞中输送蛋白质,其中最重要的是卵黄蛋白的输入。在昆虫和其他节肢动物中,卵黄蛋白前体(yolk protein precursors,YPPs)在脂肪体中合成,分泌到血淋巴,并通过受体介导的内吞作用进入卵巢。在卵黄发生过程中,卵母细胞膜上有多个受体,并与YPP配体结合,这些配体被内吞进入小泡中,并被分选为卵黄颗粒,为发育中的胚胎储存营养物质[44]。Chaverra-Rodriguez等[44]发现节肢动物卵黄蛋白原前体的配体可以与Cas9整合成重组蛋白,从而将Cas9-sgRNA带入卵内。可以通过将与CRISPR系统整合的卵黄蛋白原前体注射到甲壳动物的血淋巴中,同时引入胞浆的内吞小泡释放剂(主要为氯奎、皂素),防止进入的复合物局限于小泡而不被释放导致基因编辑成功率降低,使用这种方法进行基因编辑的编辑效率为30%。该方法操作要求低,目前已成功应用于丽蝇蛹集金小蜂、斯氏按蚊等物种[45-46]。
1.3.7 电穿孔转导法。
电穿孔传导法是利用电场震动细胞,使细胞膜出现孔道,流动性增加,从而使带电的外源基因实现转移[2,47]。DNA或其他带电分子通过高电压在细胞膜上制造暂时的穿孔进入细胞,可以通过这些小孔。在一次电穿孔试验中可以有多个胚胎同时作为试验材料,相比显微注射有更高的效率。但对于体内基因编辑来说,电穿孔会对细胞造成损伤,当下主要将其用于体外基因编辑研究中。在啮齿动物中已使用电穿孔技术导入CRISPR系统并成功完成基因编辑[48-50]。根据试验物种特异性,不同的物种适用于不同的传递方法,也可以同时应用2种导入方法来增加基因编辑的成功率[51]。
2 CRISPR/Cas系统在节肢动物中的应用
节肢动物包括的物种众多,与农业、林业、渔业、公共卫生等领域密切相关。因此将CRISPR/Cas9系统应用于节肢动物会为人类社会创造极大的价值。
2.1 甲壳动物中的应用
2.1.1 水蚤。
水蚤(Daphnia)的研究历史非常深远,在水生食物链中占有重要地位。在水生毒理学和对环境的适应性影响,使其成为环境、生态、进化和发展基因组学研究的重要模型。水蚤的完整基因组于2011年测序完成[52],为研究甲壳动物基因功能和CRISPR/Cas系统的应用提供了基础。
2.1.1.1 建立基因编辑模型。
2014年Nakanishi等[53]首次报道CRISPR/Cas9在大型蚤(Daphnia magna)中成功突变无眼基因(eyeless)。通过显微注射将Cas9 mRNA和sgRNA导入受精卵中,后代有18%~47%眼部出现异常,成熟后眼睛变形率高达8.2%。Kumagai等[54]通过显微注射将Cas9/gRNA核糖核酸蛋白(RNPs)注入水蚤受精卵中,发现D.magna中包含纯化的Cas9蛋白和gRNA的Cas9 RNP的切割活性,后将Cas9蛋白与无眼基因gRNA一起温育并注射到D.magna卵中,得到典型的无眼突变体表型。Hiruta等[55]组装靶向Distal-less基因(Dll)的sgRNA,该基因是编码无脊椎动物和脊椎动物远端肢体发育必不可少的同源域转录因子,研究者将Cas9 RNP显微注射至淡水枝角水蚤(Daphnia pulex)受精卵中,注射的胚胎显示出第二触角的形成缺陷和附肢的发育紊乱,在Dll基因座中检测到插入缺失突变。此外,DapmaSt是大型蚤(D.magna)眼睛中黑色素沉着必须的基因,因此常被选来作为大型蚤的颜色标记基因,Ismail等[56]通过显微注射Cas9 mRNA和靶向DapmaSt的sgRNA,建立了眼点白化的DapmaSt突变株。
2.1.1.2 5-羟色胺影响的信号通路。
5-羟色胺具有调节动物的发育、生长、繁殖和行为的关键功能。Campos等[57]在水蚤(Daphnia magna)中通过CRISPR/Cas9系统分别构建了5-羟色胺(Tryptophan hydroxylase,TRH)单等位基因和双等位基因缺失的突变体,与野生型个体相比单等位基因突变体生长更慢、繁殖更晚,双等位基因突变体变型更显著。转录组学和功能基因分析显示TRH突变体的生长、蜕皮和能量代谢信号通路基因都出现下调,缺少5-羟色胺的双等位基因突变体呈现出5-羟色胺酸突触和花生四烯酸的代谢途径被下调,色氨酸至犬尿氨酸代谢途径中的基因被上调表达,从而表明了5-羟色胺酸与花生四烯酸的代谢途径之间存在相互作用关系,对胰岛素生长因子介导的信号通路的影响很小[58]。
2.1.1.3 选择环境性别决定激活剂。
转录因子Doublesex(Dsx)调节通路的差异是动物性别决定机制进化的基础,但是目前关于环境性别决定中Dsx的调控知之甚少。在D.magna中,环境性别决定是通过Dsx直系同源基因Dsx1的雄性特异性表达来实现的。Mohamad等[59]使用CRISPR/Cas9在水蚤(Daphnia magna)雄性基因组的目标位点引入突变,破坏D.magna雄性基因组上Dsx1增强子导致Dsx1表达的降低。通过CRISPR/Cas9定向诱导,确定Vri为Dsx1的转录激活因子,表明基因调控网络在性别决定中具有显著的可塑性。
2.1.1.4 研究蜕皮类固醇在水蚤早期胚胎中的作用。
蜕皮类固醇是调节节肢动物生长、繁殖和胚胎发生的重要激素,但是蜕皮类固醇在水蚤中各个时期的表达情况及作用,尤其是早期胚胎中研究尚不明确。Adhitama等[60]用CRISPR/Cas9生成含蜕皮激素响应原件(EcRE)和报告基因(mCherry)的转基因水蚤,命名为EcRE-mCh。EcRE-mCh系统的建立及其在时空上表现出蜕皮甾体活性的能力,为阐明动物体内早期蜕皮甾体作用提供基础。此外EcRE-mCh还可用于监测环境水中蜕皮类固醇的活性。
2.1.2 脊尾白虾。
脊尾白虾(Exopalaemon carinicauda)是重要的经济物种,它的繁殖周期为60 d,在实验室环境中可以全年保持繁殖能力,因此在基础研究中比其他虾种更有优势。它的基因草图已经完成,基因组装覆盖了95%以上的编码区[61]。近年来CRISPR/Cas9在脊尾白虾中的应用总结见表1。
2.1.3 夏威夷明钩虾。
夏威夷明钩虾(Parhyale hawaiensis)广泛分布于热带浅水生境中,近10年中,已经成为遗传和分子细胞生物学研究中最有力的甲壳纲动物模型于2014年成功应用了CRISPR/Cas9系统[53]。2018年Jarvis等[67]利用合成sgRNA和CRISPR/Cas9敲除夏威夷明钩虾的Hox基因,研究Hox基因在附肢鉴定中的相互作用。
2.2 节肢动物中其他物种的应用
2.2.1 果蝇。
果蝇(Drosophila)属于节肢动物门(Arthropoda)、昆虫纲(Insecta)、双翅目(Diptera),是典型的模式生物,广泛存在于热带与温带之间。容易饲养、繁殖周期短、性状丰富等特点让它成为典型的模式生物,发育过程经历卵、幼虫、蛹、成虫4个阶段。果蝇细胞系适用于生化试验、转录组学、功能基因组学和生物医学等研究。目前,针对果蝇细胞系开发了基于CRISPR/Cas9的功能基因组学。CRISPR/Cas9系统在果蝇中的研究已经非常广泛,表2中列举了近3年取得的重要进展。
2.2.2 蚊科。
昆虫纲(Insecta)、双翅目(Diptera)中的蚊科(Culicidae)是多种疾病的传播载体及阻断疾病传播的研究对象,因此在传染病中对蚊体内调控与病毒共存的相关基因进行基因编辑是目前防控的研究热点。
在疟疾的防控研究中,了解按蚊(Anopheles)传播疟疾寄生虫的寄生分子机制对阻断疾病传播非常重要。按蚊的中肠、血淋巴和唾液腺中物质与疟原虫感染息息相关,蚊-疟原虫相互作用的关键物质是阻断传播的靶点。控制疟原虫感染的一个明显优势是可以通过多种手段进行调控,如激动剂基因缺失,RNAi介导的基因沉默,或通过抗体或小分子干扰。然而,由于缺乏针对按蚊的有效的基因编辑工具,在探索制定疟疾控制策略方面仍落后于其他方法。最近开发的基于CRISPR/Cas9的按蚊基因组编辑方法为疟原虫宿主因子的研究提供了新的和有前景的工具。疟原虫在蚊媒传播途径中需要多种激动剂的参与,在转录前或转录后干扰相关激动剂成为控制疟疾蚊媒传播的途径,纤维蛋白原相关蛋白1(FREP1)是蚊媒传播途径中激动剂的一种,Dong等[73]通过CRISPR/Cas9突变FREP1,发现FREP1突变的成年按蚊,在卵囊和子孢子阶段对人和啮齿类疟疾寄生虫的感染均被显著抑制。但是,FREP1的失活也影响了突变后代多种生命活动过程,包括显著降低采血倾向、繁殖力和卵孵化率、化脓时间延迟以及血餐后寿命降低。
伊蚊(Aedes)作为传播登革热、寨卡、基孔肯雅热病毒的媒介也被广泛关注,但是缺乏对基因的功能、进展进行研究的工具。Liu等[74]通过向伊蚊胚胎注射Cas9-sgRNA RNP对犬尿肾上腺素羟化酶(kynurenine hydroxylase,kh)和多巴色素转化酶(dopachrome conversion enzyme)进行突变,发现可育伊蚊中有30%~50%产生突变,在子代蛹和成虫中观察到眼睛和身体色素沉着缺陷。Ling等[75]使用CRISPR-Cas9基因编辑方法破坏埃及伊蚊Aa5HT2B基因,导致其体型减小、发育延迟、寿命缩短、卵巢生长受阻、脂质积聚显著减少、胰岛素样肽(ILP)基因ilp2和ilp6的表達下调及ilp5和ilp4的表达上调。结果表明,Aa5HT2B与ILP6之间存在调节联系。这些研究表明,可以用CRISPR/Cas9介导的基因编辑系统作为伊蚊基因组规模分析和生物学研究的有效工具来防控多种疾病。
2.2.3 家蚕。
昆虫纲(Insecta)、鳞翅目(Lepidoptera)中的家蚕(Bombyx mori)作为典型的工业物种一直为很多地区提供经济支持,但是大规模饲养容易遭受病毒的迫害,通过CRISPR/Cas9技术对家蚕基因进行改造,增强家蚕抗病能力有望成为提高家蚕经济应用价值的新兴技术。
2.2.3.1 靶向敲除病毒。
Dong等[76]在家蚕中构建了载体系统(pSL1180-Cas9-U6-sgRNA)包含多重sgRNA和Cas9蛋白,靶向突变家蚕细胞中的核型多角体病毒(BmNPV)。此外还构建了多重编辑载体(PSL1180-Cas9-sgIE1-sgLEF11-sgGP64,sgMultiple)来有效地进行基因突变,在病毒入侵后抑制病毒的复制。这一多重系统可以显著提高基于CRISPR/Cas9的多重基因组工程在昆虫病毒研究中的潜力[77]。
2.2.3.2 研究生長发育基因用于育种。
CRISPR/Cas9也被用于突变生长发育相关基因,Xu等[78]使用CRISPR/Cas9突变家蚕中的Hpo基因导致身体大小调节和发育出现缺陷、色素积聚、早逝,表明Hpo对于调节家蚕的生长和发育至关重要。Liu等[79]使用CRISPR/Cas9对家蚕TCTP进行突变导致三龄幼虫发育停滞并致死,研究发现生长损伤是由于细胞减少,并且肠上皮细胞的增殖和分化也受到影响,家蚕TCTP突变显著影响碳水化合物代谢、脂质代谢和消化系统,表明BmTCTP在控制幼虫的生长和发育中起关键作用。
2.2.3.3 防控虫害。
Xu等[80-82]通过在家蚕中利用CRISPR/Cas9技术介导基因突变探索卵特异性蛋白(egg-specific protein,Esp)、卵巢丝氨酸蛋白酶(ovarian serine protease,Osp)和Yorkie的基因功能。卵特异性蛋白是家蚕卵黄蛋白原的一种,研究发现Esp突变导致雌性不育,突变个体产出卵较小、颜色浅、不能孵化,这种变化可以遗传给后代;Osp突变也会导致雌性不育,突变体产卵量少于野生型雌性,卵也不会孵化;Yorkie的缺失导致身体尺寸缩小、蜕皮缺陷,并最终导致幼虫死亡。Esp和Osp对雌性生殖至关重要,Yorkie是Hippo信号通路的关键下游效应子,可以作为害虫管理的潜在靶标。
2.2.3.4 研究ITPR在信号网络中的作用。
Sun等[83]利用CRISPR/Cas9突变ITPR,ITPR是昆虫离子转运肽(ITP)的受体,作为多种生理过程的调节剂。研究发现家蚕ITPR突变导致幼虫期延长了3.5 d,翅膀展平失败,消化道中食物迁移速度是野生型1.55倍,幼虫阶段排泄量是野生型1.56倍,导致体内水分的流失,一氧化氮合酶酶活性和一氧化氮(NO)含量以及下游Ca2+/NO/cGMP信号通路相关分子显著上调,胰岛素和蜕皮激素信号通路中的关键基因也受到影响,表明ITPR在调节家蚕水的体内稳态和发育中起关键作用。
2.2.3.5 确定Ovo在家蚕中的作用。
Bi等[84]使用CRISPR/Cas9系统突变Ovo基因。Ovo是果蝇种系性别确定中重要基因的同源物。研究发现Ovo突变体的卵形异常,在卵巢中排列无序,性腺发育异常,翅膀不能正常发育,Ovo基因在翅原基和表皮中表达量升高。与野生型动物相比,在Ovo突变体中,涉及Wnt信号通路的基因和翅膀发育基因WCP10和E74被下调。这些结果表明,BmOvo基因在翅变态中起重要作用。
2.2.3.6 其他应用。
Zhang等[85]利用CRISPR/Cas9系统蜘蛛丝蛋白基因成功整合到家蚕基因组中。所得纤维的强度与天然蜘蛛丝一样强(1.2 GPa抗拉强度),证明了将家蚕作为天然蜘蛛丝生产者用于工业生产高性能纤维的可行性。此外,Li等[86]证明了CRISPR/Cas9依赖性碱基编辑器(BE3)在家蚕中的使用效率,BE3是一种新的CRISPR工具,无需将DNA双链断裂即可将胞苷转化为胸腺嘧啶(C转化为T),在家蚕中使用BE3作为敲除工具,通过碱基编辑诱导外源和内源基因突变的效率高达66.2%,为节肢动物中进行单碱基和多碱基编辑提供更好的工具。
3 小结和展望
CRISPR/Cas9系统作为新兴的基因工程编辑工具得到了广泛的关注,从目前的研究成果可知,在节肢动物中,模式生物家蚕和果蝇为CRISPR/Cas9的技术主要研究物种,研究的基因也较为广泛,技术多且相对成熟,并且昆虫纲物种的占比很大,研究类群已经扩展到5个目10余科。相较于昆虫纲,甲壳纲类群在CRISPR/Cas9技术的应用相对较少,甲壳纲中包含了克氏原螯虾、南美白对虾、中华绒螯蟹、三疣梭子蟹等众多经济物种,生长、繁殖、病害防治通路中基因的研究有待深入,由于其与昆虫纲同属节肢动物门,所以昆虫纲模式生物的应用技术可以为甲壳动物提供参考,例如在伊蚊中的卵黄蛋白原介导法可以为甲壳动物基因编辑目的基因的导入提供参考。在未来的几年,CRISPR/Cas9系统将作为新兴的基因编辑系统在节肢动物中取得更多的突破和进展,为人类进一步了解基因、利用基因功能奠定基础。
参考文献
[1] GAJ T,GERSBACH C A,BARBAS C F.ZFN,TALEN,and CRISPR/Cas-based methods for genome engineering[J].Trends Biotechnol,2013,31(7):397-405.
[2] DOETSCHMAN T,GEORGIEVA T.Gene editing with CRISPR/Cas9 RNA-directed nuclease[J].Circ Res,2017,120(5):876-894.
[3] DELTCHEVA E,CHYLINSKI K,SHARMA C M,et al.CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III[J].Nature,2011,471(7340):602-607.
[4] JINEK M,CHYLINSKI K,FONFARA I,et al.A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity[J].Science,2012,337(6096):816-821.
[5] JINEK M,EAST A,CHENG A,et al.RNA-programmed genome editing in human cells[J].eLife,2013,2:1-9.
