菟丝子总黄酮对大鼠卵巢储备功能减退的改善作用
2022-02-13顿彩虹白爱红谢文燕戚静宜
顿彩虹, 白爱红, 谢文燕, 戚静宜
(1.漯河市妇幼保健院生殖遗传科,河南漯河 462000;2.洛阳市中心医院生殖医学科,河南洛阳 471699)
卵巢储备功能是指卵巢皮质区域卵泡生长、发育、形成可受精卵泡的功能,反映女性生育潜能及生殖内分泌功能[1]。若卵巢储备功能下降,将减少卵巢内储存的可募集卵泡数目,导致卵巢形成卵子的能力减弱、卵泡质量下降,影响女性的生育能力,表现为闭经、月经稀发、不孕甚至卵巢早衰等[2-3]。中医在调节女性生殖功能失调性疾病方面具有独到之处,对卵巢储备功能减退主要从肝肾辨证论治入手,同时兼顾痰湿、气血等,可促进性腺轴恢复正常,增强卵巢功能,防止出现病理性改变,平衡性激素分泌[4]。菟丝子为旋花科植物菟丝Cuscuta chinensisLam.的种子,味辛、甘,性微温,入肝、肾经,具有补肾益精、养肝明目、安胎的功效。菟丝子为温阳补肾之要药,可改善机体内分泌,增强性功能,具有抗氧化、调节免疫等作用[5]。菟丝子总黄酮为菟丝子的主要成分,现代药理研究表明,其可改善大鼠生殖内分泌系统损伤[6],对下丘脑-垂体-性腺轴有多方面作用,可恢复下丘脑-垂体促性腺功能,增加垂体、卵巢对激素的反应性,促进卵泡发育,提高卵巢激素受体数量与功能,有类雌激素样活性[7-8]。本研究构建卵巢储备功能减退大鼠模型,旨在探讨菟丝子总黄酮改善卵巢储备功能的作用及其可能机制,以期为临床应用菟丝子总黄酮改善卵巢储备功能提供实验基础,现将研究结果报道如下。
1 材料与方法
1.1 实验动物SPF级健康雌性SD大鼠68只,21日龄,体质量(50±2)g,购自北京斯贝福生物技术有限公司,生产许可证号:SCXK(京)2019-0010。实验单位为河南中医药大学动物实验中心。实验开展前适应性饲养1周,自由摄食水,自然光照。
1.2 药物、试剂与仪器菟丝子总黄酮(纯度>98%,购自上海谱振生物科技有限公司,批号:20191204)。去氧乙烯基环己烯(4-cinylcyclohexene diepoxide,VCD)、环磷酸腺苷(cAMP)/蛋白激酶A(PKA)信号通路抑制剂H-89(纯度>99%,碧云天生物技术有限公司);促卵泡激素(FSH)、促黄体激素(LH)、雌二醇(E2)、cAMP酶联免疫吸附分析(ELISA)试剂盒(上海士锋生物科技有限公司);兔抗大鼠卵泡刺激素受体(FSHR)、PKA、磷酸化PKA(p-PKA)、β-actin单克隆抗体(北京中杉金桥生物技术有限公司);辣根过氧化物酶标记的山羊抗兔免疫球蛋白(IgG)抗体(艾美捷科技有限公司)。电子天平(奥豪斯仪器有限公司);-80℃超低温冰箱(美国Thermo Fisher Scientific公司);恒温冰冻切片机、EG1150组织包埋机(德国Leica公司);全波长酶标仪(美国Thermo Fisher Scientific公司);Image-Pro Plus 6.0图像分析软件(美国Media Cybernetics公司)。
1.3 分组与造模68只21日龄的雌性大鼠适应性饲养1周后达28日龄,阴门开启,经阴道脱落细胞涂片筛查,性周期正常。抽取10只大鼠设为正常组,其余构建卵巢储备功能减退模型[9],方法:取VCD溶入芝麻油,配制浓度为80 mg/kg,每天1次,连续腹腔注射15 d,0.2 mL/只。正常组腹腔注射等体积芝麻油,每天1次。造模期间每日上午7∶00—8∶00进行阴道涂片,阴道上皮无动情周期变化,或动情周期明显延长,则提示卵巢储备功能减退大鼠造模成功[10]。造模成功大鼠48只,成功率为82.76%,随机分为抑制剂组、模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组,每组12只。
1.4 干预方法造模成功后次日给药:抑制剂组灌胃H-89 0.1 mg/kg[11],菟丝子总黄酮组灌胃菟丝子总黄酮530.1 mg/kg[12],抑制剂+菟丝子总黄酮组先灌胃菟丝子总黄酮530.1mg/kg再灌胃H-890.1mg/kg,模型组、正常组灌胃等体积生理盐水,均连续4周,每周休息1 d。
1.5 观察指标与方法
1.5.1 取材 给药结束后,用戊巴比妥钠麻醉大鼠,经腹主动脉取血5 mL。处死大鼠,分离两侧卵巢组织,称质量。继而将卵巢组织处理如下:一份液氮冷冻;一份以40 g/L多聚甲醛固定24 h,冲洗后滤纸吸干多余水分,梯度酒精脱水,二甲苯透明,浸蜡,包埋,制作蜡块保存。
1.5.2 观察大鼠一般状况及测定卵巢湿质量、卵巢指数 观察大鼠一般状况,包括形态、活动、毛色、体质量等,称两侧卵巢湿质量,计算卵巢指数,公式:左侧(右侧)卵巢指数=左侧(右侧)卵巢湿质量(mg)/大鼠体质量(g)。
1.5.3 ELISA法检测血清性激素水平 取大鼠腹主动脉血液标本,取血后快速置入促凝管内,室温静置1 h,3 000 r/min离心(离心半径10 cm)10 min,取血清待用。按照ELISA试剂盒说明书检测血清FSH、LH、E2水平,并计算FSH/LH。应用酶标仪检测450 nm波长处的吸光度值,计算各指标浓度。
1.5.4 苏木素-伊红(HE)染色法观察卵巢组织形态学变化 取卵巢组织蜡块,制作5μm切片,展片;干净玻片捞片,烘干;二甲苯脱蜡,梯度酒精水洗,常规苏木素染色10 min;水洗,1%盐酸酒精分色20 s,1%氨水溶液返蓝;自来水冲洗15 min,1%伊红水溶液复染5 min;水洗,梯度酒精脱水,二甲苯透明,中性树胶封片。显微镜下观察卵巢形态学变化。
1.5.5 ELISA法检测卵巢组织中cAMP含量 取液氮冷冻的卵巢组织,匀浆,以3 000 r/min(离心半径10 cm)离心10 min,取上清。用96孔板,每孔加入50μL抗体,加入10μL标准品,室温孵育2 h,洗板,显色,终止,读板,450 nm波长上机检测,570 nm波长校正。二喹啉甲酸(BCA)法检测组织总蛋白浓度,计算各组大鼠卵巢组织中cAMP含量,公式:cAMP含量=ELISA检测浓度值/各样本BCA结果。
1.5.6 蛋白免疫印迹(Western Blot)法检测卵巢组织FSH-cAMP信号轴相关蛋白FSHR、PKA、
p-PKA表达 取液氮冷冻的卵巢组织在冰盒中研磨,匀浆后置入低温离心机,以4℃、20 000 r/min(离心半径10 cm)离心20 min,取上清。BCA法检测蛋白浓度,根据蛋白浓度,按上样量40μg计算样本稀释浓度,沸水浴10 min变性,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后湿法转膜。将硝酸纤维素膜置入50 g/L脱脂奶粉中封闭2 h;再取出置入一抗稀释液[兔抗大鼠FSHR、PKA、p-PKA、β-actin(内参)单克隆抗体,稀释比例分别为1∶500、1∶1 000、1∶2 500]中孵育过夜;TBST洗膜后,再置入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶5 000稀释)中,室温下孵育1 h;TBST洗膜,电化学发光试剂(ECL)显色。经成像系统采集硝酸纤维素膜上的蛋白信号,采用Image-Pro Plus 6.0图像分析软件计算目的条带灰度值。结果以目的蛋白与内参蛋白的灰度值比值表示。
1.6 统计方法采用SPSS 25.0统计软件分析数据,计量资料以均数±标准差(±s)表示,并进行正态分布检验与Levene检验。符合正态分布且方差齐者,用单因素方差分析、LSD-t比较,方差不齐者用Welch检验、Dunnett’s T3比较。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般状况比较实验过程中正常组大鼠饮食、活动、二便等情况均正常,皮毛整洁、有光泽,体质量渐增,动情周期规律;模型组大鼠进食、二便次数减少,大便稀,毛色枯燥,有脱毛,体质量渐降,动情周期延长、紊乱,镜下见上皮细胞增多,多于动情间期;抑制剂组大鼠异常表现较模型组严重,抑制剂+菟丝子总黄酮组、菟丝子总黄酮组则相对轻微。
2.2 各组大鼠卵巢湿质量与卵巢指数比较表1
表1 各组大鼠卵巢湿质量与卵巢指数比较Table 1 Comparison of ovarian wet mass and ovarian index of rats in various groups (±s)

表1 各组大鼠卵巢湿质量与卵巢指数比较Table 1 Comparison of ovarian wet mass and ovarian index of rats in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与抑制剂组比较;③P<0.05,与模型组比较;④P<0.05,与抑制剂+菟丝子总黄酮组比较
?
结果显示:各组大鼠卵巢湿质量、卵巢指数组间比较,差异均有统计学意义(P<0.05)。与正常组比较,抑制剂组、模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的左侧和右侧卵巢湿质量及卵巢指数均降低(P<0.05)。与抑制剂组比较,模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的左侧和右侧卵巢湿质量及卵巢指数均升高(P<0.05);与模型组比较,抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的左侧和右侧卵巢湿质量及卵巢指数均升高(P<0.05);与抑制剂+菟丝子总黄酮组比较,菟丝子总黄酮组的左侧和右侧卵巢湿质量及卵巢指数均升高(P<0.05)。
2.3 各组大鼠性激素水平比较表2结果显示:各组大鼠FSH、FSH/LH、E2水平组间比较差异有统计学意义(P<0.05),LH水平组间比较差异无统计学意义(P>0.05)。与正常组比较,抑制剂组、模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSH、FSH/LH、E2水平升高(P<0.05)。与抑制剂组比较,模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSH、FSH/LH、E2水平降低(P<0.05);与模型组比较,抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSH、FSH/LH、E2水平降低(P<0.05);与抑制剂+菟丝子总黄酮组比较,菟丝子总黄酮组的FSH、FSH/LH、E2水平降低(P<0.05)。
表2 各组大鼠性激素水平比较Table 2 Comparison of sex hormone levels of rats in various groups (±s)

表2 各组大鼠性激素水平比较Table 2 Comparison of sex hormone levels of rats in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与抑制剂组比较;③P<0.05,与模型组比较;④P<0.05,与抑制剂+菟丝子总黄酮组比较
?
2.4 各组大鼠卵巢组织形态变化比较图1结果显示:正常组卵巢体积较大,卵泡生长活跃,黄体发育良好;模型组卵巢萎缩明显,卵泡数量减少,黄体减少;与模型组比较,抑制剂组卵巢萎缩更明显,卵泡与黄体数量更少,而抑制剂组+菟丝子总黄酮组、菟丝子总黄酮组卵巢、卵泡与黄体数量明显改善。

图1 各组大鼠卵巢组织形态变化比较(HE染色,×100)Figure 1 Comparison of histomorphological changes of ovarian tissue of rats in various groups(by HE staining,×100)
2.5 各组大鼠卵巢组织中cAMP含量比较表3结果显示:各组大鼠卵巢组织中cAMP含量组间比较差异有统计学意义(P<0.05)。与正常组比较,抑制剂组、模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组卵巢组织中cAMP含量降低(P<0.05)。与抑制剂组比较,模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的cAMP含量升高(P<0.05);与模型组比较,抑制剂+菟丝子总黄酮组、菟丝子总黄酮组cAMP含量升高(P<0.05);与抑制剂+菟丝子总黄酮组比较,菟丝子总黄酮组cAMP含量升高(P<0.05)。
表3 各组大鼠卵巢组织中cAMP含量比较Table 3 Comparison of content of c AMP in ovarian tissue of rats in various groups(±s,pmol·mg-1)
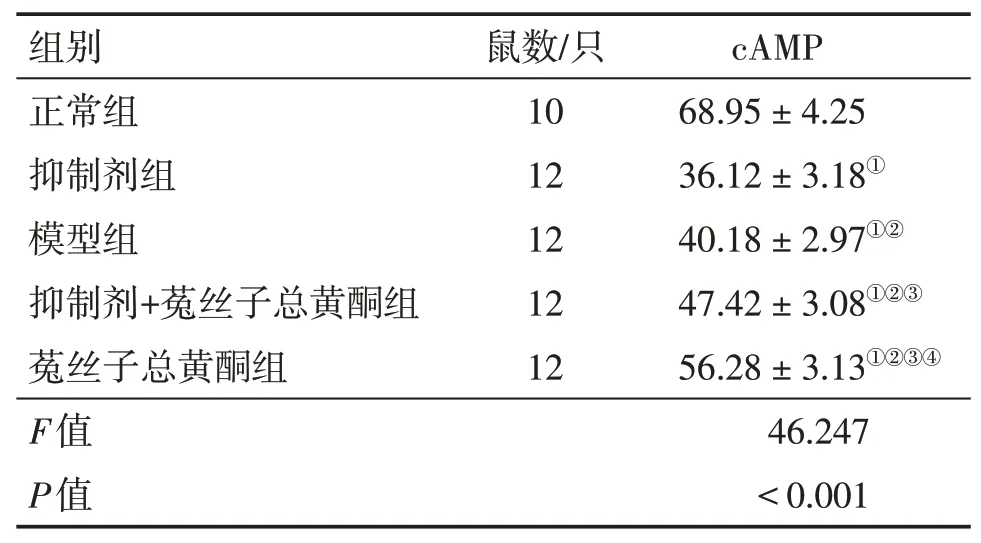
表3 各组大鼠卵巢组织中cAMP含量比较Table 3 Comparison of content of c AMP in ovarian tissue of rats in various groups(±s,pmol·mg-1)
①P<0.05,与正常组比较;②P<0.05,与抑制剂组比较;③P<0.05,与模型组比较;④P<0.05,与抑制剂+菟丝子总黄酮组比较
?
2.6 各组大鼠卵巢组织中FSH-cAMP信号通路相关蛋白表达比较表4、图2结果显示:各组大鼠FSHR、p-PKA蛋白相对表达量组间比较差异有统计学意义(P<0.05),PKA蛋白相对表达量组间比较差异无统计学意义(P>0.05)。与正常组比较,抑制剂组、模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSHR、p-PKA蛋白相对表达量降低(P<0.05)。与抑制剂组比较,模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSHR、p-PKA蛋白相对表达量升高(P<0.05);与模型组比较,抑制剂+菟丝子总黄酮组、菟丝子总黄酮组的FSHR、p-PKA蛋白相对表达量升高(P<0.05);与抑制剂+菟丝子总黄酮组比较,菟丝子总黄酮组的FSHR、p-PKA蛋白相对表达量升高(P<0.05)。

图2 大鼠卵巢组织中FSHR、PKA、p-PKA蛋白Western Blot电泳条带图Figure 2 Western Blot bands of FSHR,PKA and p-PKA proteins in ovarian tissue of rats
表4 各组大鼠卵巢组织中FSHR、PKA、p-PKA蛋白相对表达量比较Table 4 Comparison of protein relative expression of FSHR,PKA and p-PKA in ovarian tissue of rats in various groups (±s)

表4 各组大鼠卵巢组织中FSHR、PKA、p-PKA蛋白相对表达量比较Table 4 Comparison of protein relative expression of FSHR,PKA and p-PKA in ovarian tissue of rats in various groups (±s)
①P<0.05,与正常组比较;②P<0.05,与抑制剂组比较;③P<0.05,与模型组比较;④P<0.05,与抑制剂+菟丝子总黄酮组比较
?
3 讨论
卵巢作为女性生殖器官,负责卵子的产生与排出,分泌的激素对女性的经、带、胎、产过程具有调节作用。随着女性年龄的增长,卵巢功能日渐衰退,致卵巢储备功能减退,影响受孕能力,甚或伴发闭经并至全身其他系统疾病。卵巢储备功能减退涉及遗传、医源性、环境等影响因素,发病机制目前尚不完全清楚[13]。本研究通过腹腔注射VCD构建卵巢储备功能减退实验动物模型,高度模拟了女性卵巢储备功能减退状态。可见造模后的大鼠形态、活动、毛色、动情周期等出现异常变化,卵巢湿质量减轻,卵巢指数下降,而经菟丝子总黄酮治疗后则明显改善,提示菟丝子总黄酮可恢复卵巢储备功能减退大鼠动情周期,增加卵巢质量,纠正降低的卵巢指数,改善卵巢储备功能。本研究经HE染色观察大鼠卵巢组织形态学与卵泡情况后发现,模型组卵巢明显萎缩,卵泡数量减少,闭锁卵泡增多,而菟丝子总黄酮组卵巢体积增大,皮质内可见大量生长卵泡,较多接近成熟卵泡,提示菟丝子总黄酮可促进卵巢储备功能减退大鼠卵巢各级卵泡发育。
血清性激素是反映卵巢储备功能的指标。FSH是腺垂体促性腺激素细胞合成、分泌的糖蛋白类促性腺激素,其分泌可影响卵巢内卵泡的发育、排卵[14]。LH通过与卵巢膜细胞LH受体结合,刺激卵泡膜细胞分泌雄激素,从而为雌激素的产生提供原料。卵巢储备功能减退初期,FSH、LH均上升,前者早于后者,且更显著,FSH/LH比值升高则可预判卵巢储备功能减退。E2由卵巢膜细胞、颗粒细胞分泌,在FSH和LH作用下合成,是评价卵巢储备功能的常用指标[15]。膜细胞合成的雄激素进入颗粒细胞,在芳香化酶P450作用下转化为雌激素。长期高E2、FSH/LH水平不利于优势卵泡发育,因而恢复FSH、E2、LH水平对卵巢早衰的治疗十分重要。本研究结果显示,与模型组比较,菟丝子总黄酮组的FSH、E2、FSH/LH比值下降,提示菟丝子总黄酮具备调节血清性激素功能的作用,体现了其类雌激素样作用。
卵泡是卵巢局部与循环雌激素的主要来源,雌激素水平受FSH调控,FSH调节卵巢颗粒细胞膜中芳香化酶基因表达,并触发cAMP依赖的信号级联调节芳香化酶基因转录,诱导雌激素生物合成。FSH-cAMP/PKA信号转导通路是经典的调节卵巢功能的通路之一,FSH与颗粒细胞上分布的FSHR特异性结合,通过细胞膜上G蛋白受体激活cAMP,增加细胞中cAMP浓度,打破cAMP平衡[16]。据报道[17],cAMP在卵巢发育过程中可调控卵母细胞成熟与卵泡发育。高浓度的cAMP激活细胞内PKA,活化(磷酸化)的PKA转录激活目的基因,促使特异性蛋白合成并分泌至卵巢内,促进卵泡的发育。本研究结果显示:从抑制剂组到模型组、抑制剂+菟丝子总黄酮组、菟丝子总黄酮组,卵巢组织中FSHR、p-PKA蛋白表达水平及cAMP含量逐渐升高,提示菟丝子总黄酮可能通过调节FSH,激活cAMP/PKA信号转导通路,增加卵巢局部cAMP含量,促进卵泡发育,从而改善卵巢的储备功能。
综上所述,菟丝子总黄酮可能通过激活FSHcAMP/PKA信号转导通路,发挥对卵巢储备功能减退大鼠卵巢储备功能的保护作用。
