纳米炭示踪前哨淋巴结在宫颈癌诊治中的应用价值
2022-02-03林小丽何金梅卢佳蕴黄承颖
林小丽,何金梅,卢佳蕴,黄承颖,刘 楠
1南方医科大学南方医院妇产科,广东 广州 510515;2湛江中心人民医院妇产科,广东 湛江 524000
作为早期宫颈癌患者的独立预后因素和术后辅助治疗的依据,盆腔淋巴结转移已被纳入修订后的2018年国际妇产科联盟(FIGO)分期。盆腔淋巴结清扫是早期宫颈癌患者标准手术治疗中主要组成部分,也是唯一能准确判断盆腔淋巴结状态的方法。然而,早期宫颈癌的盆腔淋巴结转移率较低,有研究[1]显示仅为15%~20%,这意味着至少80%的患者接受了不必要的盆腔淋巴结清扫,并且盆腔淋巴结清扫存在短期及长期并发症[2],严重影响患者术后的生活质量。
前哨淋巴结[3](SLN)是指原发肿瘤引流区域发生转移时所经的第1站淋巴结,若SLN阴性,理论上其他淋巴结也为阴性。然而,SLN检测技术在临床上的实施有限,一方面是缺乏标准化的培训和技术[4],另一方面是SLN检测术对患者及示踪剂的选择仍存在争议。此外,临床上常用的SLN示踪剂也存在一些缺点,如蓝色染料易发生过敏反应、核素示踪剂锝具有放射性、吲哚氰氯需特殊的荧光腹腔镜设备且成本高昂。而作为中国唯一获得国家药品监督管理局批准的淋巴结示踪剂,纳米炭已被证实能高效示踪各种实体肿瘤的SLN,如结直肠癌[5]、乳腺癌[6]、甲状腺癌[7]等。但纳米炭在宫颈癌SLN的示踪中应用较新,据文献报道[8,9],纳米炭示踪宫颈癌SLN的检出率可高达91.29%~100%,具有良好的应用前景,但是纳米炭示踪宫颈癌的SLN仍存在一定比例的假阴性结果,假阴性率为0%~4.35%,且国内外文献报道中小样本较多,在示踪宫颈癌SLN方面并没有广泛开展,其安全性及可行性仍需更多的研究进一步验证。此外,对于仅行SLN检测的患者,病理超分期是宫颈癌SLN检测中的重要组成部分[10],但既往大部分纳米炭示踪宫颈癌SLN的研究并未对阴性的SLN进行病理超分期检测。
鉴于此,本研究旨在通过纳米炭示踪并获取宫颈癌的SLN,通过计算出检出率、敏感性、阴性预测值等参数评估纳米炭示踪SLN在宫颈癌中的应用价值;并通过超分期检测进一步评估SLN的淋巴结状态,进一步探讨超分期检测在宫颈癌中的研究意义。
1 资料和方法
1.1 一般资料
选取2018年6月~2021年1月在南方医科大学南方医院妇产科收治的诊断为IA2期、IB1期、IB2期、IIA1期、IIICp1期(FIGO,2018年)的宫颈癌患者79例。本研究已获得医院伦理委员会的批准(NFEC-2019-180)。所有患者术前均知情并签署了知情同意书。
纳入标准:18岁以上的女性患者;患者或法定监护人理解并自愿签署知情同意书;宫颈癌临床分期(FIGO,2018 年)IA1 期伴淋巴脉管浸润(LVSI)、IA2 期、IB1期、IB2期、IIA1期、IIICp1期的宫颈癌患者。排除标准:宫颈原位癌;高度怀疑盆腹腔严重粘连;既往有其他盆腹腔恶性肿瘤病史;既往有后腹膜手术史者;体格检查及影像学检查提示有盆腔或后腹膜侧盆腔淋巴结阳性;妊娠合并宫颈癌;具有手术禁忌症;对纳米炭混悬注射液、聚维酮K30、枸橼酸钠过敏者。符合任何其中一项均不能入组。
1.2 研究方法
1.2.1 主要试剂 纳米炭混悬注射液(25 mg,0.5 mL,重庆莱美药业股份有限公司);广谱细胞角蛋白抗体(CKAE1/AE3,厦门通灵生物医药科技有限公司)。
1.2.2 注射方法 取纳米炭混悬液1支,麻醉诱导后由同一手术组的医生在距离宫颈肿瘤原发病灶周围约0.5 cm的正常组织内3点和9点方向各注入0.25 mL纳米炭混悬液,注射深度为2~3 mm,缓慢推注3 min,注射完毕后压迫5 min。
1.2.3 手术方法及记录 术中先打开后腹膜,沿着黑染的淋巴管走形进行解剖,逐一识别并切除黑染的淋巴结作为SLN,如图1,记录SLN的数目和部位,获取SLN后,全部行盆腔淋巴结清扫术+广泛性子宫切除术±腹主动脉旁淋巴切除术。
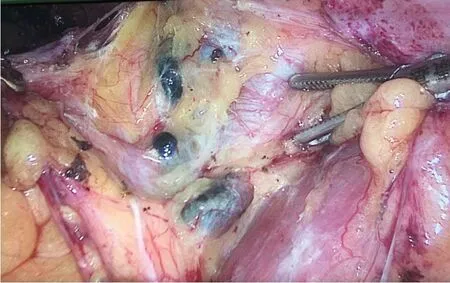
图1 黑染的淋巴结Fig.1 Black-stained lymph nodes(sentinel lymph nodes,SLNs).
1.2.4 病理检查主要步骤 SLN全部取材并单独送检,首先对所有SLN行常规HE染色,然后对常规病理检查结果为阴性的SLN石蜡标本再间隔200 μm连续切4张,每片厚2 μm,每个水平均取第1张行HE染色检查,取第2张行免疫组织化学检测,另外两张备用(评估肿瘤直径是否增大)。所有切片均由两名病理学医师进行独立检查。术后病理学检查结果为诊断的金标准。
1.2.5 SLN检测技术评价标准 按照美国Louisville大学SLN 检测技术评价标准,SLN真阳性:SLN病理结果为阳性;SLN真阴性:SLN及非SLN病理结果均为阴性;SLN假阴性:SLN病理结果为阴性,而非SLN病理结果为阳性;SLN检出率=(检出SLN病例数/研究组总病例数)×100%;灵敏度=(SLN真阳性病例数/检出SLN中总淋巴结阳性的病例数)×100%;特异度=(SLN真阴性病例数/检出SLN中总淋巴结均为阴性的病例数)×100%;准确率=[(SLN病理检查为真阴性和真阳性病例总数)/检出SLN病例数]×100%;假阴性率=(SLN病理阴性而非SLN病例阳性病例数/检出SLN患者中淋巴结阳性病例数)×100%;阴性预测值=[SLN真阴性病例数/(SLN假阴性病例数+SLN真阴性病例数)]×100%。
1.2.6 统计学分析 本实验获得的数据均采用SPSS20.0版本统计学分析软件进行数据分析,符合正态分布的计量资料用均数±标准差表示,偏态分布的计量资料用中位数(M)表示;年龄及体质量指数对SLN总检出率的影响采用t检验;计数资料采用率n(%)表示,组间率的比较采用卡方检验或Fisher确切概率法;通过单因素分析筛选自变量,将P<0.1纳入多因素分析,多因素分析采用二元Logistic回归分析;SLN转移与盆腔淋巴结转移的一致性采用Kappa检验;P<0.05时认为差异有统计学意义。
2 结果
2.1 基本病例特征
79例宫颈癌患者年龄为(50.35±9.56)岁;BMI值为(23.33±2.87)kg/m2;FIGO(2018)分期,IA2期5例,IB1期45例,IB2期16例,IIA1期5例,IIICp1期8例;术前宫颈锥切15例,未行宫颈锥切64例;肿瘤病灶大小≥2 cm 19例,<2 cm 60例;鳞癌60例,腺癌17例,其他类型2例(表1)。

表1 病例基本特征Table 1 General demographic,pathological and surgical data of the patients[Mean±SD,n(%)]
2.2 SLN检测评价指标
79例宫颈癌患者中,其中67例患者至少识别出1枚SLN,故SLN总检出率为84.8%(67/79),4例SLN及非SLN 均阳性,1 例SLN 阳性而非SLN 为阴性,1 例SLN阴性而非SLN阳性,61例患者的SLN及非SLN病理结果均为阴性,据此计算敏感度为83.3%(5/6),特异度为100%(61/61),假阴性率为16.7%(1/6),阴性预测值为98.4%(61/62),准确率为98.5%(66/67)(表2)。
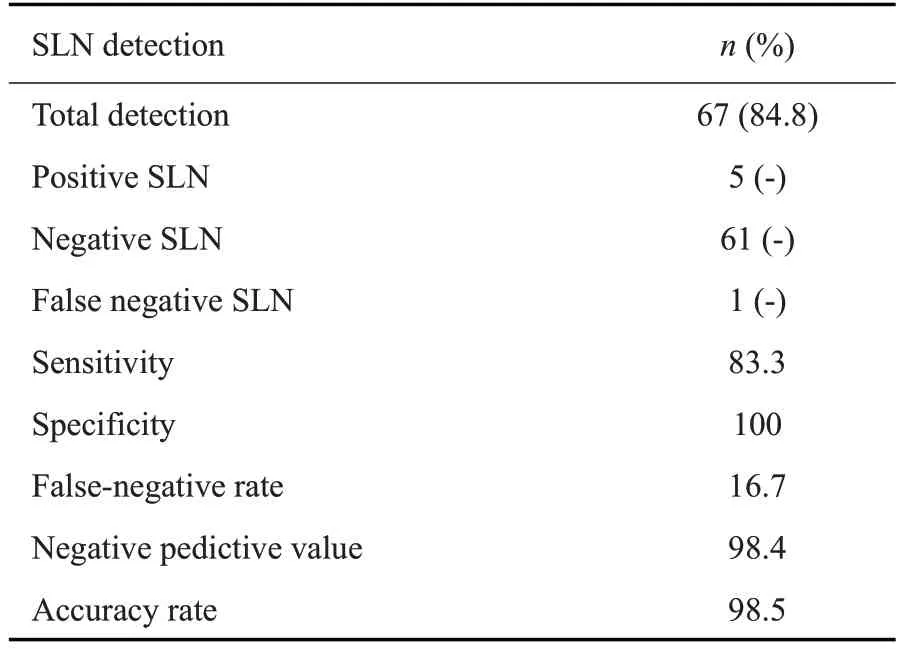
表2 SLN检出评价指标Table 2 Evaluation indexes for pelvic SLN detection
2.3 SLN分布情况
79例患者共切除淋巴结2251枚,每例切除(28.49±9.52)枚;67例患者共检出417枚SLN,每例切除(5.28±4.02)枚SLN(图2),其主要分布为闭孔区31.89%(左30.88%,右32.86%),髂外区27.82%(左27.45%,右28.17%),髂内区19.66%(左21.08%,右18.13%),髂总区15.11%(左16.67%,右13.61%),宫旁、腹股沟、腹主动脉旁也可见淋巴结显影。
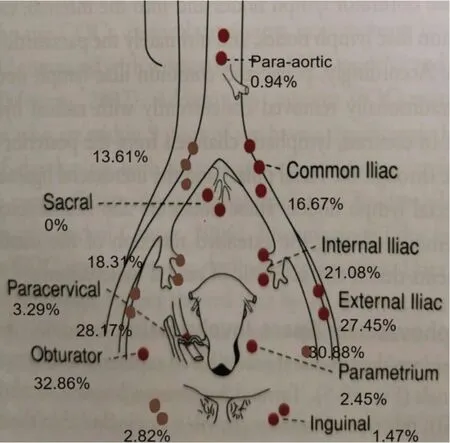
图2 每一侧骨盆SLN分布的情况Fig.2 Location of SLNs on each side of the pelvis.
2.4 SLN与盆腔淋巴结转移一致性情况
79例宫颈癌患者中67例成功检出至少1枚SLN,SLN和PLN阳性的病例数为4例,SLN阳性而PLN阴性的病例数为1例,SLN和PLN均为阴性的病例数为61例,PLN 阳性而SLN 阴性的病例数为1 例,采用SPSS20.0统计软件,对SLN和PLN转移情况的一致性进行Kappa 检验,Kappa 值为0.901,P<0.001,SLN 和PLN转移情况高度一致(表3)。
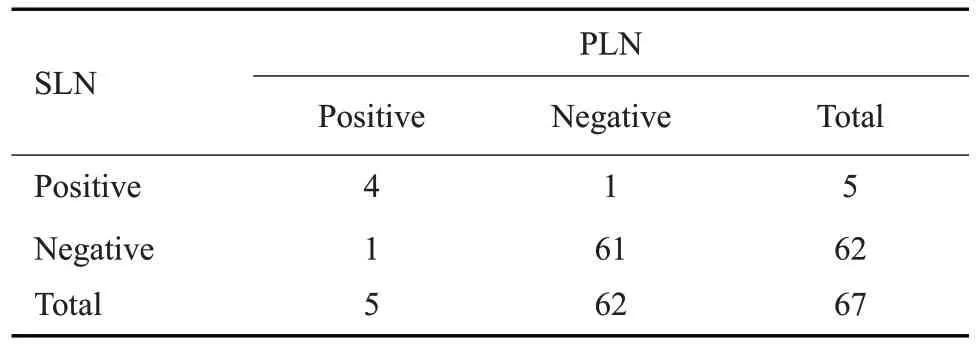
表3 SLN与PLN转移一致性检验Table 3 Consistency test of SLN and PLN
2.5 SLN总检出率的影响因素
SLN总检出率的影响因素(表4),在单因素分析中,年龄、BMI、LVSI、手术途径、宫颈浸润深度对SLN的总体检出率均无影响,仅术前宫颈锥切(P=0.045)、肿瘤大小(P=0.033)对SLN总体检出率的影响均有统计学意义。在多因素分析中,肿瘤病灶大小(OR=9.901;95%CI=1.808-54.219;P=0.008)、术前宫颈锥切(OR=10.439;95%CI=1.796-60.678;P=0.009),肿瘤大小及术前宫颈锥切P值均<0.05,差异均有统计学意义。Kappa=0.901,P<0.001.
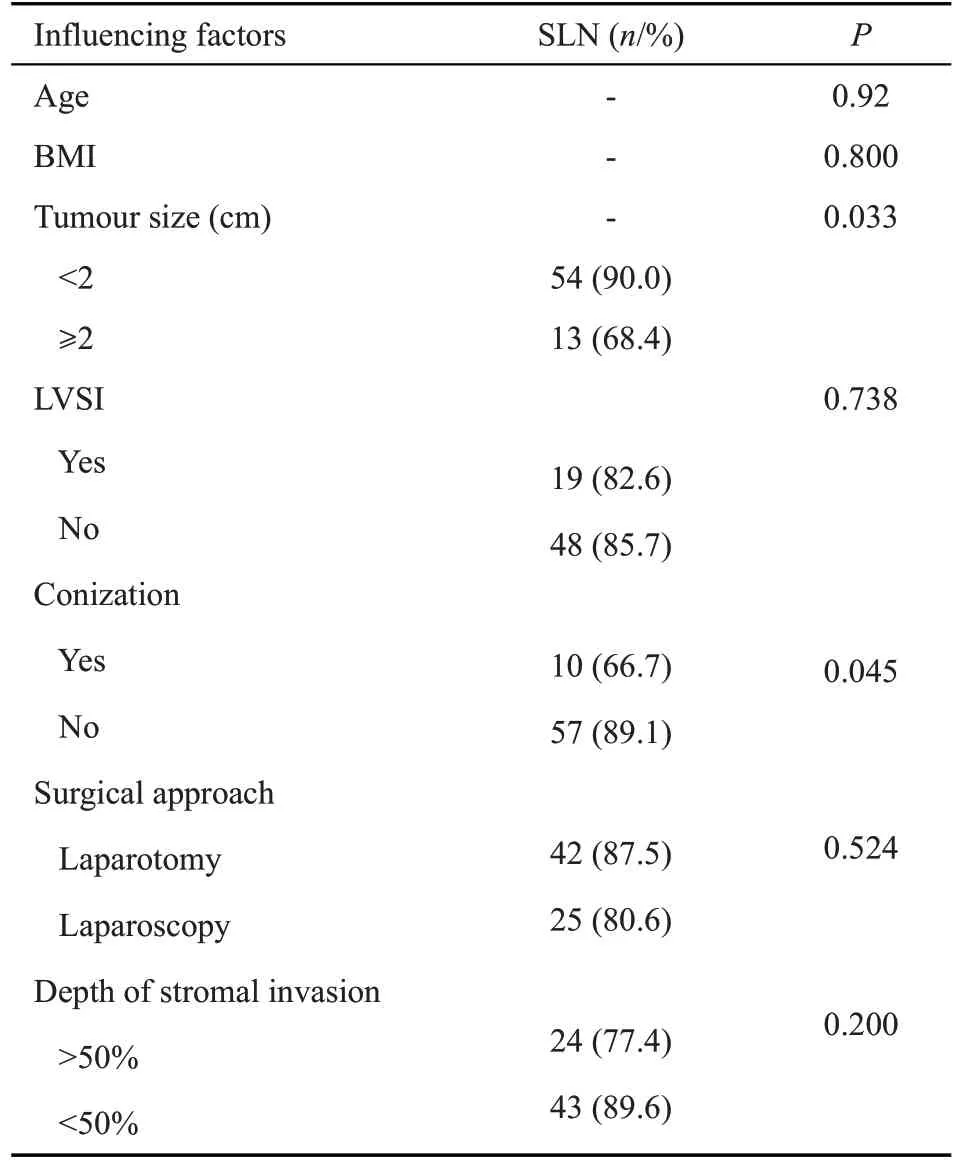
表4 影响SLN总检出率因素的单因素分析Table 4 Univariate analysis of factors affecting the total detection rate of SLNs
2.6 假阴性病例的基本特征
研究中包括1例SLN 假阴性的病例,其基本特征见表5。FIGO分期为IIA1期,组织学类型为鳞癌,肿瘤最大直径为3 cm,左侧宫旁淋巴结有转移,而仅右侧髂外及闭孔检出SLN,且均为假阴性淋巴结,局部脉管内癌栓形成。
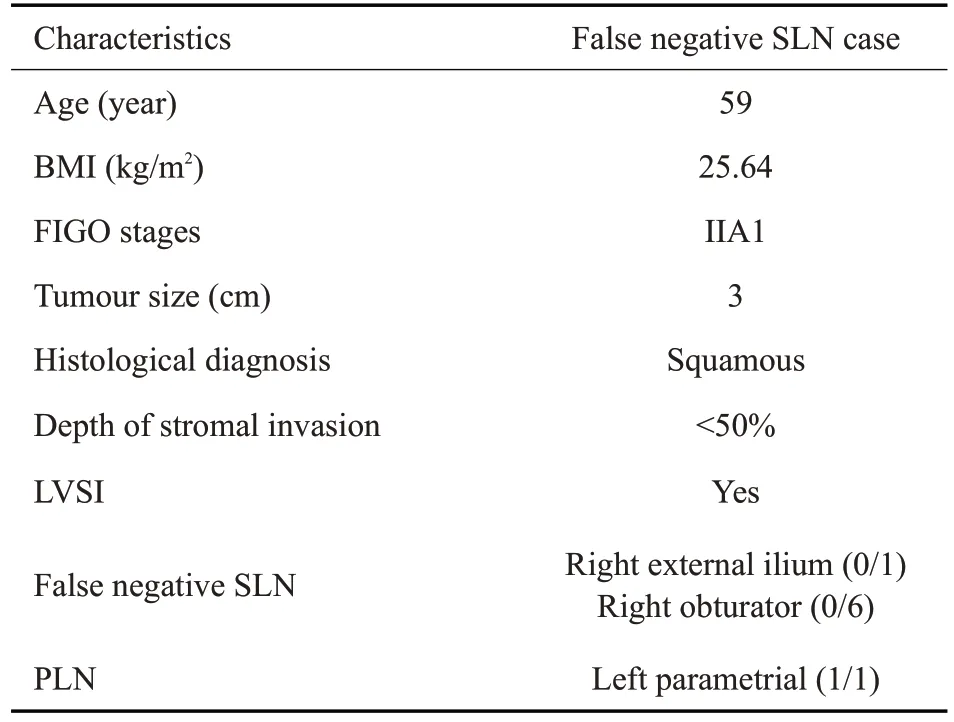
表5 假阴性病例的基本特征Table 5 Demographic and pathological data of cases of false negative SLNs
2.7 常规HE染色及免疫组织化学染色的病理结果
选取30例常规HE染色病理结果为阴性的SLN行病理超分期检测,HE染色、CKAE1/AE3均为阴性(图3A、B)、结果均未发现微转移或孤立肿瘤细胞,超分期检测微转移和孤立肿瘤细胞的检出率为0%。
3 讨论
目前,临床上常用的SLN示踪剂有生物染料法、放射性核素法、两者联合法及荧光成像法。蓝色染料的检出率为73.1%~90.0%,灵敏度为79.2%~88.9%[11,12],操作方法简单,但其在淋巴结中停留的时间短,并且容易渗入周围组织污染手术视野,甚至影响手术操作,还有可能发生皮疹、瘙痒、过敏反应等[13]。本研究中也没有患者出现过敏反应或严重不良事件。放射性核素锝,无论是其单独使用或联合蓝色染料,均具有较高的检出率[14],但其操作程序复杂,需配备专业的技术人员且具有放射性,也需在患者没有麻醉下提前注射,增加了患者的痛苦。而纳米炭操作方法简便,无需提前注射。吲哚氰氯与近红外荧光成像技术总体检出率、双侧检出率均高于锝或蓝色染料及两者的联合使用[15],但需要特殊的荧光腹腔镜设备且成本高昂,限制了其推广,特别是在资源匮乏的国家。而纳米炭黑染的淋巴结肉眼可见,无需近红外成像设备或淋巴显像术。在本研究中,纳米炭示踪宫颈癌的SLN,总体检出率为84.8%,灵敏度为83.3%,而阴性预测值及准确率高达98%以上,可见其在宫颈癌中具有安全性及可行性。同时,国内一项前瞻性研究[9]对356例早期宫颈癌患者使用纳米炭示踪SLN,结果显示,SLN的总体检出率为91.29%,敏感性为96.65%,阴性预测值为99.29%,后者根据SLN检测的学习曲线,未将前30名入选患者纳入最终统计分析,因此,两项研究中的差异可能与操作者的熟练程度有关。在临床上实施SLN检测时,应对操作者进行相关培训。
在我们的研究中,SLN最常分布的部位为闭孔区(31.89%)、髂外区(27.82%)、髂内区(19.66%),与既往文献报道的结果一致[16,17]。本研究中髂总区SLN检出率为15.11%,较以往文献报道的结果高,这可能与纳米炭示踪后黑染的SLN与周围组织对比明显,很容易被识别并切除有关,这也是纳米炭的优点之一。根据宫颈癌淋巴结引流途径,宫旁淋巴结为宫颈癌淋巴引流最先到达的淋巴结,理论上最可能成为SLN,但本研究中宫旁淋巴结的检出率仅为2.89%,低于既往文献(4.31%)[18],究其原因,可能与宫旁淋巴结体积小,常常隐藏在子宫颈横韧带中,很容易被外科医生忽略,而且其解剖位置靠近宫颈肿瘤,易受示踪剂的干扰而导致识别困难。本研究中1例假阴性患者转移的淋巴结为左侧宫旁淋巴结,而检出的右髂外及右闭孔SLN为阴性,因此,应进行更多对于宫旁淋巴结的研究,避免遗漏受累的淋巴结,而导致临床治疗不足。
影响SLN检出率的因素有很多,如我们的研究所示,在单因素及多因素分析中,肿瘤的大小显著影响SLN的总检出率,肿瘤直径越大,SLN检出率越低。研究也证明了肿瘤直径≥2 cm(P=0.048)是影响SLN检出率降低的因素,且差异有统计学意义[19]。NCCN指南也指出,肿瘤直径<2 cm检测效果最好。本研究认为肿瘤较大难以找到足够的注射部位或者肿瘤较大导致肿瘤发生坏死而使示踪剂反流或肿瘤侵犯了淋巴管而改变了原有的淋巴结引流,从而降低了SLN的检出率。本研究中,术前行宫颈锥切组的SLN检出率为66.7%,明显低于术前未行宫颈锥切组(检出率为89.1%),在单因素及多因素分析中,差异均具有统计学意义。同时,最近研究也显示宫颈锥切史与降低SLN的检出率相关,且差异具有统计学意义[17,20]。
据文献报道[21],微转移的发生率为15%~20%,通过对SLN进行病理超分期检测,不仅可以发现常规病理检查不能发现的小体积转移灶[22],还可以提高SLN示踪术的敏感性、降低假阴性率[23,24]。Salvo等[25]对188例早期宫颈癌患者进行SLN示踪,对所有的SLN进行超分期检测,在SLN阳性的淋巴结中,有22%仅通过超分期检出,14个淋巴结为微转移,3个淋巴结为孤立肿瘤细胞,SLN联合病理超分期检测无疑是SLN检测广泛应用于临床的关键部分[22]。本研究中对30例常规病理检查结果为阴性的SLN进行病理超分期检测,HE染色及CKAE1/AE3的免疫组织化学染色检测结果均为阴性,结果显示均未检出微转移或孤立肿瘤细胞,未能提高小体积转移灶的检出率,与既往文献报道的超分期检测结果不一致,究其原因,我们认为,第一可能与本研究纳入样本量太少密切相关,需要加大样本量进一步研究。第二,因为SLN超分期检测目前在国际上并没有标准的方案,检测方法的差异可能导致结果出现偏倚。最近一项单机构回顾性队列研究中[26],纳入了226例宫颈癌患者所有SLN均在术后进行了病理超分期检测,检测出14例MAC,16例微转移,8例孤立肿瘤细胞,中位随访时间为65个月,有22例发生复发,所有患者的无病生存率为90%,淋巴结阴性患者无病生存率为93%,MAC患者为89%,孤立肿瘤细胞为87%,而微转移患者仅为69%,SLN中微转移的存在与无病生存率(P=0.001)和总体生存率(P<0.001)显著降低有关,差异均有统计学意义,他们认为微转移和MAC患者应进行类似的治疗,最近的一项荟萃分析[27]也得出了类似的结论,SLN超分期检测应成为早期宫颈癌患者治疗中不可或缺的一部分。但从我们检测的结果来看,与常规的淋巴结评估方案相比,SLN超分期检测病理人员工作量大、耗时长和成本高,其在部分癌症中心的推广仍具有挑战性。而且,最近的一项研究也显示常规的超分期检测的成本效益低[28],因此,期待技术更新优化这项检查。
综上所述,纳米炭示踪宫颈癌SLN具有较高的检出率、灵敏度、阴性预测值等,其应用于宫颈癌的前哨淋巴结检测是安全可行的,尤其是应用于术前未行宫颈锥切或肿瘤直径<2 cm的患者更安全可靠。SLN联合病理超分期检测暂不能提高微转移、孤立肿瘤细胞的检测率。但目前仍需要大样本、多中心的前瞻性研究验证SLN检测取代盆腔淋巴结清扫术的准确性及安全性,长期随访以明确淋巴结微转移或孤立肿瘤细胞是否对宫颈癌患者的总生存率及无复发生存率存在影响。
