WP1130通过抑制NLRP3炎症小体活化缓解小鼠的感染性休克
2022-02-03刘迪迪杨燕青王凤超
陆 莉,刘迪迪,杨燕青,王凤超
1蚌埠医学院第一附属医院检验科,安徽 蚌埠 233004;2蚌埠医学院慢性疾病免疫学基础与临床安徽省重点实验室,安徽 蚌埠 233030
核苷酸结合寡聚化结构域受体蛋白3(NLRP3)炎症小体是一类大的多聚蛋白复合物,由模式识别受体NLRP3蛋白、接头蛋白凋亡相关斑点样蛋白(ASC)以及效应蛋白pro-caspase-1 组成。其功能主要是通过活化caspase-1促进白细胞介素1β(IL-1β)、白细胞介素18(IL-18)的成熟与分泌从而介导炎症反应,维持机体免疫稳态[1]。适度的炎症反应有助于减轻感染,清除受损细胞,但当炎症反应持续发生或NLRP3炎症小体活化异常时则会引发多种炎症性疾病和自身免疫病,如二型糖尿病、动脉粥样硬化、帕金森病[2,3]等疾病。目前治疗NLRP3炎症小体相关疾病的方法主要是针对其活化产物IL-1β,但此方法与靶向NLRP3的抑制剂相比还存在非特异性、易影响其他细胞功能等局限性[4]。近年来,多种小分子化合物被报道对NLRP3炎症小体表现出良好的抑制效果[5,7],但仍未有一种化合物能够直接应用于临床。因此,寻找一种高效且特异的NLRP3炎症小体活化抑制剂对治疗NLRP3炎症小体相关炎性疾病尤为重要。
外源小分子化合物WP1130是一种针对USP9x[8]、USP24[9]、USP5[10]的部分选择性去泛素化酶抑制剂[11],能够增加巨噬细胞的抗感染能力[12],增强了对金黄色葡萄球菌[13]和单核细胞增生李斯特菌的杀灭[14],抑制一些细菌和病毒病原体的细胞内复制,如WP1130显著降低了鼠巨噬细胞样细胞系中鼠诺如病毒和其他RNA病毒的复制[15,16]。WP1130也具有强大的抗肿瘤活性,为胰腺癌[17]、T细胞急性淋巴细胞白血病[9]胰腺导管腺癌[10]、B细胞淋巴瘤[18]和非小细胞肺癌[19]的治疗提供了新策略,然而其抗感染功能是否与NLRP3炎症小体相关尚不明确。本研究拟通过在细胞水平和动物水平探究WP1130 对NLRP3 炎症小体活化的作用,以期为NLRP3炎症小体相关疾病的治疗提供新的思路。
1 材料和方法
1.1 实验动物及细胞
6~10周龄,体质量18~24g的SPF级C57BL/6雄性小鼠,购自江苏集萃药康生物科技股份有限公司,生产许可证号:SCXK(苏)2018-0008,小鼠饲养于无特定病原体(SPF)环境,温度21~25 ℃,湿度50%~60%,保持12 h/12 h光照黑暗周期,给予辐照灭菌垫料、饲料和高压灭菌水,保证小鼠自由饮水和摄食,动物实验严格按照实验动物管理规范进行。人急性单核细胞白血病THP-1细胞系,受赠于蚌埠医学院汪洪涛教授课题组。本研究经蚌埠医学院伦理委员会审核批准(伦动科批字[2020]第057号)。
1.2 药品与试剂
WP1130(上海陶素生化,纯度>99%);巨噬细胞集落刺激因子(M-CSF)(Novoprotein);尼日利亚菌素(nigericin)、三磷酸腺苷(ATP)、尿酸单钠晶体(MSU)、佛波酯(PMA)(Sigma);脂多糖(LPS)、聚脱氧腺苷酸(poly A: T)、Pam3CSK4(Invivogen);Lipofectamine2000(Invitrogen);RPMI 1640培养基、高糖DMEM 培养基、OPTI-MEM 培养基、胎牛血清(Gibco);ELISA 试剂盒(Mouse IL-1β、IL-6、TNF-α,Human IL-1β、TNF-α ELISA kit)(R&D);人caspase-1(p20)、pro-caspase-1 抗 体(Human caspase-1)(Cell SignalingTechnology);鼠caspase-1(p20)、pro-caspase-1抗体(Mouse caspase-1)(AdipoGen);β-actin 抗体(Abmart);辣根过氧化物酶(HRP)标记的山羊抗鼠IgG和山羊 抗 兔IgG(Jackson IR);Mitotracker、DAPI(Thermo Fisher)。
1.3 动物分组及处理
SPF 级雄性C57BL/6 小鼠随机分成空白对照组(Control组)、感染性休克组(LPS组)和WP1130治疗组(WP1130+LPS组),每组6只,空白对照组不给予LPS造模,WP1130 治疗组小鼠腹腔注射WP1130 溶液(10 mg/kg)1 h后,LPS组和治疗组小鼠同时腹腔注射等剂量的LPS溶液(20 mg/kg),空白对照组腹腔注射等体积的PBS溶液。4 h后,眼球取血,颈椎脱臼法处死小鼠并收集小鼠腹腔液。
1.4 细胞刺激分化
BMDM细胞诱导分化:颈椎脱臼法处死小鼠,剥离出小鼠的胫骨和股骨,无菌条件下用20 mL注射器吸取20 mL DMEM细胞培养基冲洗小鼠骨髓细胞,离心,加入2~3 mL 红细胞裂解液吹打,用含有M-CSF 的DMEM完全培养基重悬细胞,5%CO2、37 ℃条件下分化4~6 d可获得贴壁生长的BMDM细胞。分化后的细胞呈细长梭形,通过流式细胞术鉴定巨噬细胞表面标志物(F4/80+CD11b+细胞亚群)。人THP-1细胞诱导分化:1×106/mL THP-1细胞中加入含有400 ng/mL PMA的RPMI 1640完全培养基刺激过夜,细胞贴壁分化成梭形并用流式细胞术鉴定。
1.5 炎症小体活化刺激
分化完成的小鼠BMDM和人THP-1细胞按每孔5×105个细胞分别接种于12孔板中培养过夜,加入LPS(100 ng/mL)预刺激4 h后,分别加入多种经典的NLRP3炎症小体活化剂,其中nigericin、ATP活化细胞30 min,MSU活化细胞3 h。加入Pam3CSK4(200 ng/mL)预刺激4 h后,胞内转染LPS活化非经典NLRP3炎症小体。加入LPS(100 ng/mL)预刺激4 h后,转染poly A:T(1 μg/mL)刺激4 h,活化黑色素瘤缺乏因子2(AIM2)炎症小体。
1.6 蛋白免疫印迹实验(Western blotting)
检测caspase-1(p20)、pro-caspase-1(Pro-casp1)蛋白表达。收集细胞培养上清,利用甲醇氯仿法提取上清中的蛋白,加入裂解液;12孔板中直接加入裂解液裂解细胞,转至1.5 mL EP管中,与上清蛋白裂解液一同金属浴100 ℃煮10 min。将收集的蛋白样品进行SDS-PAGE电泳,恒压90V转膜1 h,5%BSA室温封闭2 h,加入一抗抗体,4 ℃摇床上孵育过夜,PBST洗膜3次,10 min/次,随后加入二抗抗体(1∶10 000)室温孵育1 h 30 min,PBST洗膜3次后凝胶成像仪显影。
1.7 酶联免疫吸附测定(ELISA)
收集细胞培养上清及小鼠血清和腹腔液,离心去沉淀,按照ELISA试剂盒说明书检测IL-1β、白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)的分泌水平,主要步骤包括稀释捕获抗体包被至96孔酶标板,室温静置过夜,10%FBS封闭30 min,加入标准品和样本2 h,加入检测抗体1 h,加入HRP孵育20 min,加入底物TMB显色5~10 min,1 mol/L H2SO4终止反应,酶标仪450 nm测定吸光度值,绘制标准曲线计算样品浓度。
1.8 线粒体损伤检测
将细胞按2×105/mL接种于提前放置了细胞爬片的12孔细胞培养板中,置于37 ℃培养箱培养过夜;LPS(100 ng/mL)预刺激4 h 后,加入WP1130 处理细胞30 min 后,加入Nigericin 活化细胞,细胞活化结束前30 min各组加入线粒体染料Mitotracker(200 nmol/L);孵育结束后,弃去上清,加入PBS洗3次,4%多聚甲醛室温固定15 min;随后PBST洗3次,10 min/次;DAPI染色并封片,室温避光过夜;利用激光共聚焦显微镜观察并拍照。
1.9 统计学分析
采用GraphPad Prism 8软件进行数据的统计学分析,所用数据用均数±标准差表示。两组之间的比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果
2.1 WP1130 抑制Nigericin 诱导的NLRP3 炎症小体活化
Western blot 检测结果显示,WP1130 剂量依赖性地抑制了caspase-1 的分泌(P<0.05,图1A、B),对pro-caspase-1(Pro-casp1)的表达无显著抑制(P>0.05,图1A、C)。ELISA检测结果显示,WP1130剂量依赖性地抑制了细胞培养上清液中IL-1β的分泌水平(P<0.001,图1D),对核转录因子κB(NF-κB)信号通路活化产生的非炎症体依赖性细胞因子TNF-α、IL-6的分泌无明显影响(P>0.05,图1E、F)。
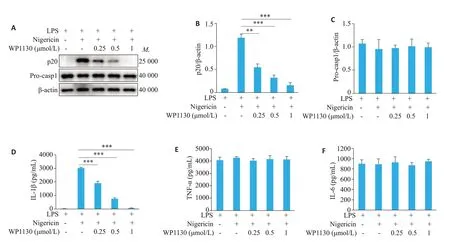
图1 WP1130抑制nigericin诱导的NLRP3炎症小体活化Fig.1 WP1130 suppresses Nigericin-induced NLRP3 inflammasome activation in mouse bone marrow-derived macrophages(BMDM).A:Western blotting of cleaved caspase-1(p20)in the culture supernatants(SN)and pro-caspase-1(Pro-casp1)in the cell lysate(Input)of BMDM.B,C:Quantitative analysis of the expressions of p20 and Pro-casp1 in BMDM.D-F:ELISAof IL-1β,TNF-α and IL-6 in cell culture supernatants,respectively.**P<0.01,***P<0.001.
2.2 WP1130 抑制其他活化剂诱导的NLRP3 炎症小体活化
Western blot检测结果显示,WP1130剂量依赖性地抑制了ATP 和MSU 活化NLRP3 炎症小体诱导的caspase-1的表达(P<0.05,图2A、B),但对pro-caspase-1的蛋白表达无显著影响(P>0.05,图2A、B)。ELISA检测结果显示,WP1130剂量依赖性地抑制了细胞培养上清液中IL-1β的分泌水平(P<0.001,图2C、D)。
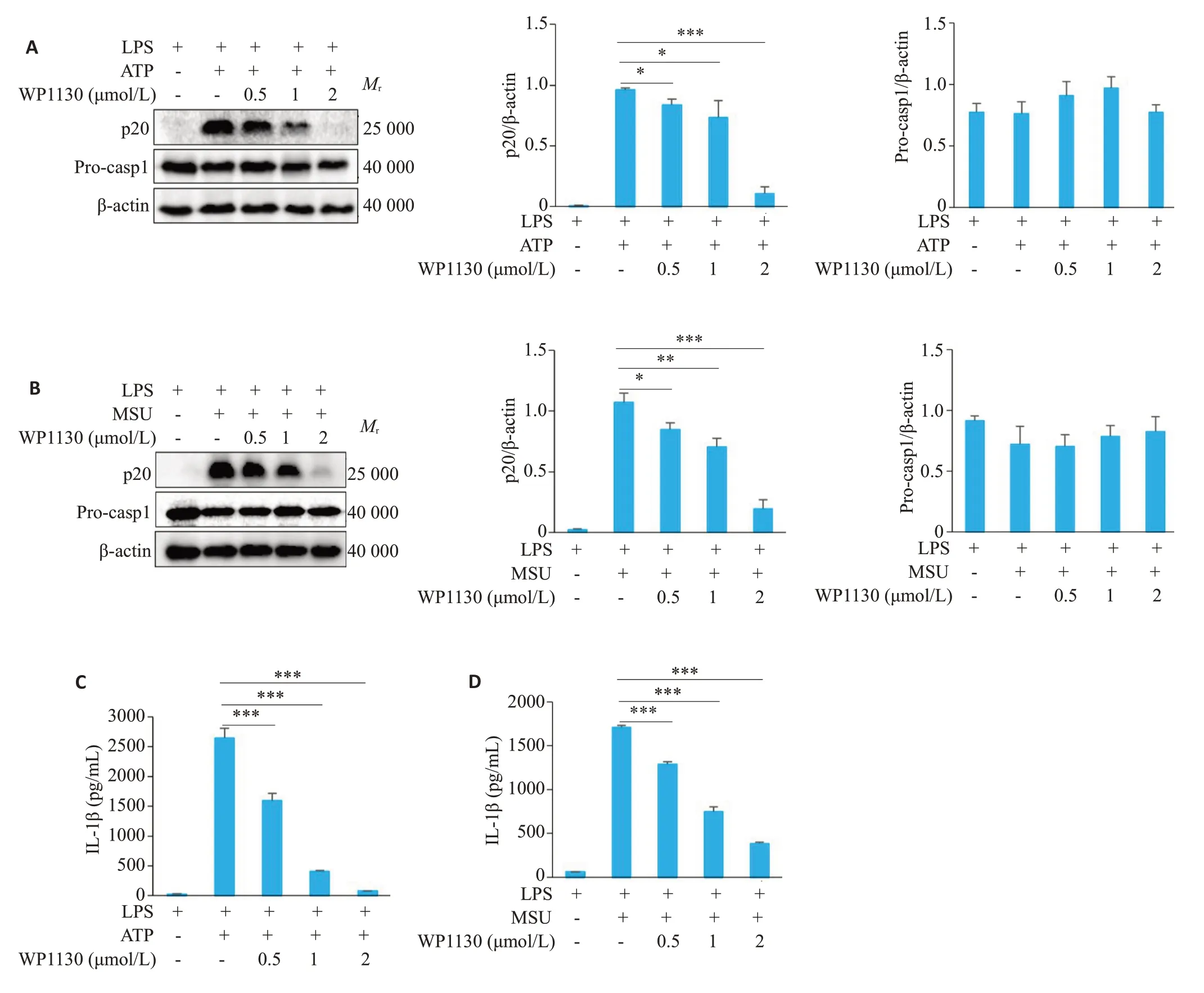
图2 WP1130抑制ATP和MSU诱导的NLRP3炎症小体活化Fig.2 WP1130 inhibits NLRP3 inflammasome activation in BMDM induced by other agonists.A,B:Western blotting of p20 in supernatants (SN) and Pro-casp1 in cell lysates (Input) of BMDM.C,D: ELISA of mature IL-1β in the culture supernatant of BMDM.*P<0.05,**P<0.01,***P<0.001.
2.3 WP1130抑制非经典NLRP3炎症小体活化
Western blot检测结果显示,WP1130剂量依赖性地抑制了非经典NLRP3炎症小体活化产物caspase-1的产生(P<0.05,图3A、B),但对pro-caspase-1的表达无显著影响(P>0.05,图3A、C)。ELISA检测结果显示,WP1130剂量依赖性地抑制了细胞培养上清液中IL-1β的水平(P<0.001,图3D)。
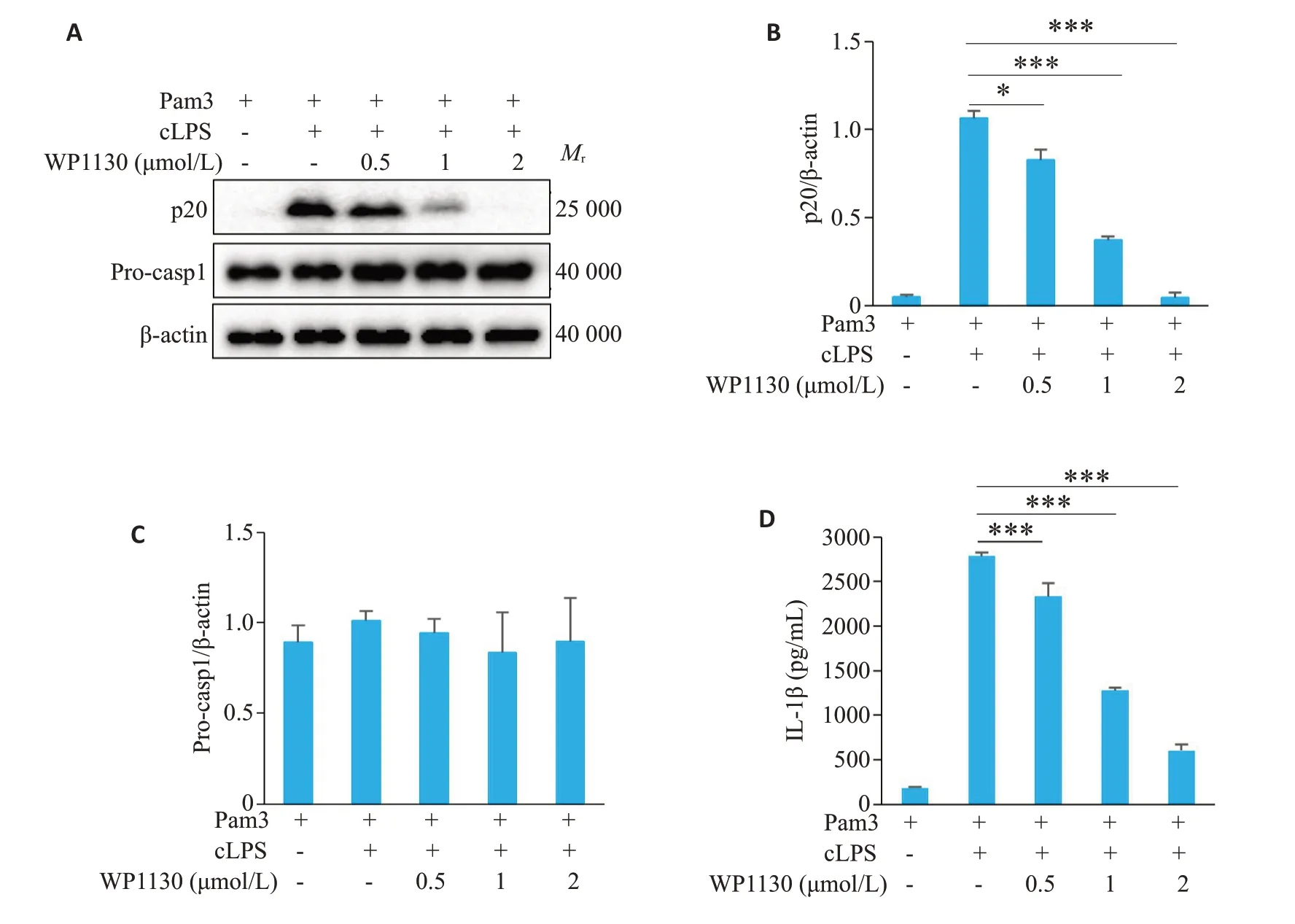
图3 WP1130抑制非经典NLRP3炎症小体活化Fig.3 WP1130 inhibits non-canonical NLRP3 inflammasome activation in BMDM.A:Western blotting of p20 in culture supernatants(SN)and Pro-casp1 in lysates(Input)of BMDM.B,C:Quantitative analysis of the expressions of p20 and Pro-casp1 in BMDM.D:ELISAof mature IL-1β in the culture supernatant of BMDM.*P<0.05,***P<0.001.
2.4 WP1130对AIM2炎症小体活化无影响
Western blot 检测结果显示,与WP1130 抑制nigericin活化NLRP3炎症小体相比,加入WP1130并不抑制poly A:T 活化AIM2 炎症小体介导的caspase-1的蛋白表达(P>0.05,图4A、B),同时WP1130 对procaspase-1 的表达无显著影响(P>0.05,图4A、C)。ELISA 检测结果显示,WP1130 抑制nigericin 诱导的IL-1β分泌,对poly A:T诱导的IL-1β分泌无显著抑制作用(P>0.05,图4D)。
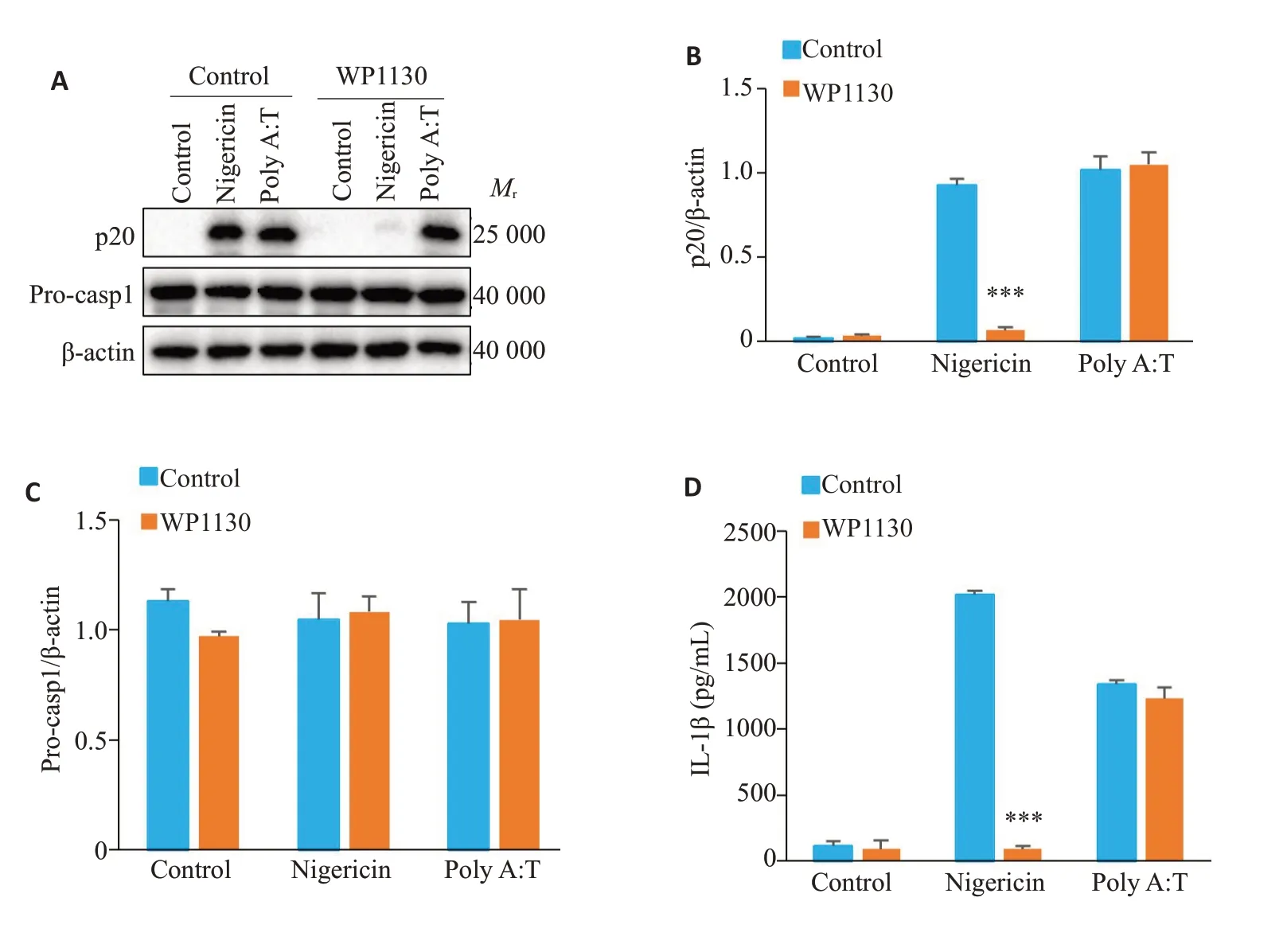
图4 WP1130对AIM2炎症小体活化无影响Fig.4 WP1130 does not affect AIM2 inflammasome activation in BMDM.A:Western blotting of p20 in culture supernatants (SN) and Pro-casp1 in lysates (Input) of BMDM.B,C:Quantitative analysis of the expressions of p20 and Pro-casp1 in BMDM.D:ELISA of mature IL-1β in the culture supernatant of BMDM.***P<0.001 vs control.
2.5 WP1130 抑制人THP-1 细胞中NLRP3 炎症小体活化
Western blot 检测结果显示,nigericin 诱导了人THP-1细胞中NLRP3炎症小体活化,促进caspase-1的表达,加入WP1130可剂量依赖性地抑制细胞培养上清中caspase-1的表达(P<0.05,图5A、B),但对细胞裂解液中pro-caspase-1的表达无显著影响(P>0.05,图5A、C)。ELISA检测结果显示,WP1130剂量依赖性地抑制细胞培养上清中IL-1β的分泌(P<0.05,图5D),TNF-α的分泌水平各组无统计学差异(P>0.05,图5E)。
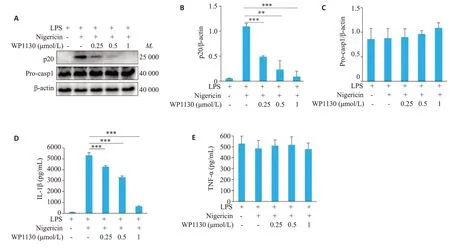
图5 WP1130抑制人THP-1细胞中NLRP3炎症小体活化Fig.5 WP1130 inhibits NLRP3 inflammasome activation in human THP-1 cells.A: Western blotting of p20 in culture supernatants(SN)and Pro-casp1 in lysates(Input)of human THP-1 cells.B,C:Quantitative analysis of the expressions of p20 and Pro-casp1 in human THP-1 cells.D,E: ELISA of IL-1β (D) and TNF-α (E) in the culture supernatant of THP-1 cells.**P<0.01,***P<0.001.
2.6 WP1130不影响nigericin刺激引起的线粒体损伤
激光共聚焦显微镜观察线粒体染色结果显示,空白对照组与单加WP1130处理组线粒体形态正常无损伤,加入nigericin 显著诱导了线粒体的断裂和聚集。与nigericin组相比,nigericin+WP1130组线粒体仍表现为断裂和聚集这一损伤形态(图6)。
2.7 WP1130对小鼠感染性休克的影响
ELISA 结果显示,与空白对照组相比,腹腔注射LPS导致小鼠血清和腹腔液中IL-1β、TNF-α的分泌显著增高,与感染性休克组(LPS组)相比,WP1130治疗组(WP1130+LPS 组)明显降低了小鼠血清和腹腔液中IL-1β的分泌水平(P<0.05,图7A、C),但对NF-κB信号通路介导的细胞因子TNF-α的产生无显著影响(P>0.05,图7B、D)。
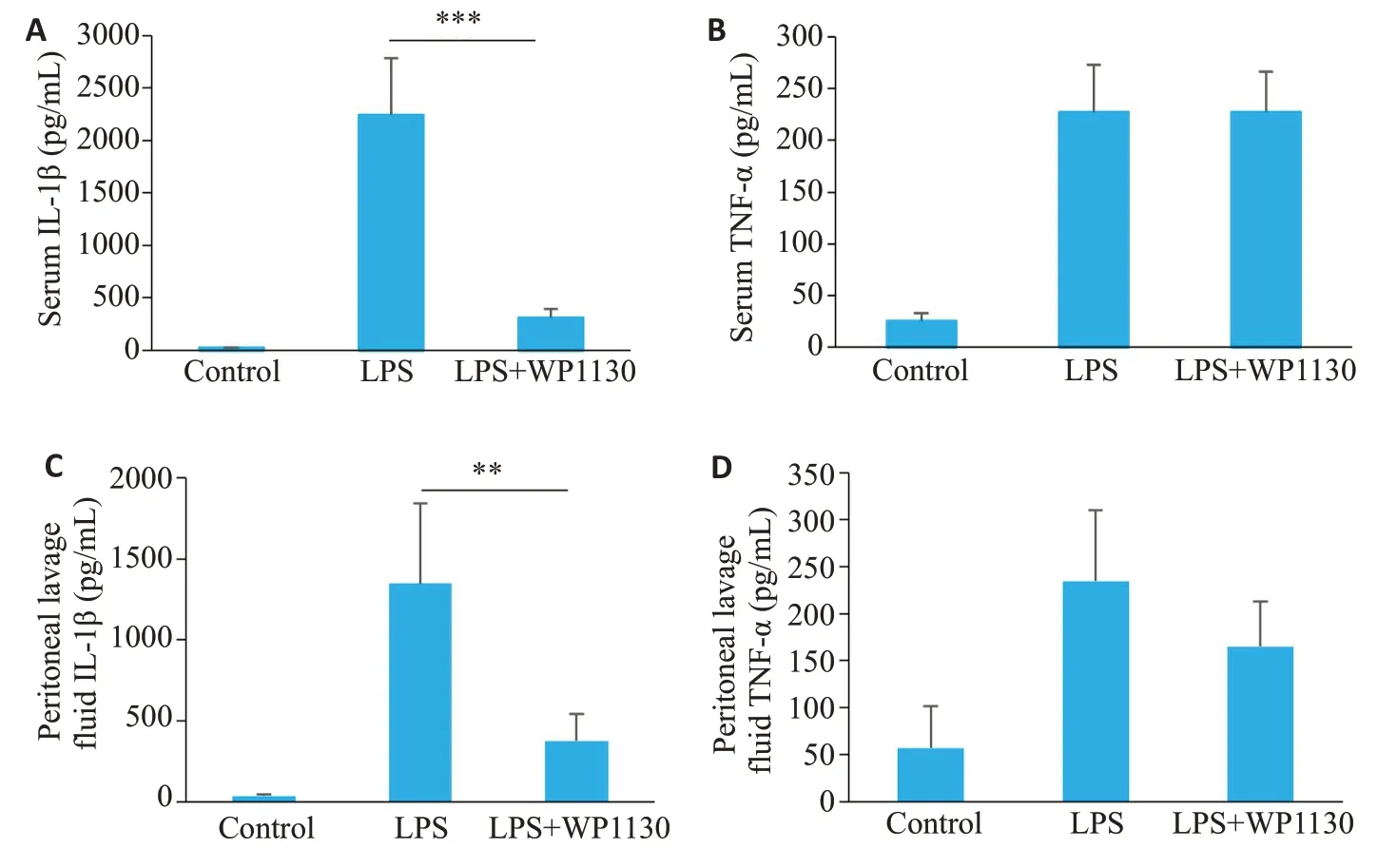
图7 WP1130缓解LPS诱导的小鼠感染性休克Fig.7 WP1130 alleviates LPS-induced septic shock in mice.A,B: Levels of IL-1β (A) and TNF-α (B) determined with ELISA in the serum from C57BL/6 mice in control,LPS-treated and LPS plus WP1130-treated mice.C,D:Levels of IL-1β (C) and TNF-α (D) in peritoneal lavage fluid measured by ELISA.**P<0.01,***P<0.001.
3 讨论
NLRP3炎症小体与多种感染性疾病相关,可被多种病原体激活,导致炎性因子的大量释放,引发多种炎症性疾病,如脓毒血症[20]、炎症性肠病[21]、痛风[22]等,因此阻断NLRP3炎症小体活化成为治疗NLRP3炎症小体相关疾病的新策略[23]。已有研究表明WP1130具有抗感染作用,可抑制一些细菌和病毒病原体的细胞内复制,其抗感染作用是否与NLRP3炎症小体有关尚不清楚,本研究通过细胞实验和体内动物实验探究小分子化合物WP1130 对NLRP3炎症小体活化的影响。
多种病原相关分子信号和危险相关分子信号可诱导NLRP3炎症小体活化,剪切caspase-1,促进IL-1β分泌[24-26],本研究首先利用nigericin活化炎症小体,初步证实了WP1130能够抑制NLRP3炎症小体活化,利用另外两种经典活化剂ATP和MSU,进一步证实WP1130可广谱的抑制NLRP3炎症小体活化,且相较于其他小分子去泛素化酶抑制剂,如P22077[27],WP1130发挥抑制作用的浓度更低,效果更好。此外,NLRP3炎症小体存在非经典激活途径,caspase-11识别胞内LPS,从而诱导非经典NLRP3炎症小体活化[28],本研究表明WP1130也抑制NLRP3炎症小体非经典途径的活化。
目前研究较多的其他经典炎症小体还包括AIM2炎症小体,其激活可保护机体免受感染[29],本研究表明WP1130对AIM2炎症小体的激活并无影响,仅特异性的抑制NLRP3 炎症小体活化。进一步探究发现WP1130不仅作用于小鼠细胞,其在人THP-1细胞中对NLRP3炎症小体活化同样有显著抑制效果。
NLRP3炎症小体的活化需要两个关键信号,预刺激信号和组装活化信号[30],本研究结果显示,WP1130对预刺激信号介导的NF-κB信号通路的激活无影响,提示WP1130可能影响组装活化信号阶段。其中线粒体损伤被认为是NLRP3炎症小体组装活化的重要上游信号[31-33],NLRP3炎症小体活化剂通过产生大量线粒体活性氧并将其释放到胞质诱导线粒体损伤,从而激活NLRP3炎症小体[34],本研究中共聚焦显微镜结果表明WP1130并不影响线粒体损伤这一重要上游信号,提示WP1130可能直接影响NLRP3炎症小体复合物的组装过程。
NLRP3炎症小体的异常活化会导致大量炎性因子释放,腹腔注射LPS诱导的感染性休克是一种常见的NLRP3炎症小体相关的急性疾病模型,主要由细菌感染引起,伴有严重的全身性炎症反应,感染性休克发生过程中,会导致血清和腹腔液中细胞因子的分泌增加,如IL-1β、TNF-α[35-37]。本研究通过腹腔注射LPS构建小鼠感染性休克模型,结果表明WP1130可显著抑制小鼠血清和腹腔液中IL-1β的分泌,但对非炎症小体依赖的细胞因子TNF-α无影响。以上结果证实WP1130可在体内外抑制NLRP3炎症小体活化,缓解相关疾病。但WP1130抑制NLRP3炎症小体的具体作用机制还需后续研究去阐明。
综上所述,本研究证实WP1130抑制多种激动剂诱导的NLRP3炎症小体活化,对NLRP3炎症小体的活化具有特异性,在鼠和人细胞中均有良好抑制效果,通过阻断体内NLRP3炎症小体激活,减轻了LPS诱导的感染性休克。本研究的发现为后续深入研究WP1130抑制NLRP3炎症小体活化可能的作用机制提供了实验依据,也为治疗感染性休克以及其他NLRP3炎症小体相关疾病提供了新的方向和策略。
