苗药验方四大血可减少关节炎大鼠滑膜组织的坏死性凋亡和血管新生:基于抑制RIPK1/RIPK3/MLKL通路
2022-02-03王远迎戴兴月陈春彦程培钧陈松江黎欣悦吴昌学
王远迎,戴兴月,陈春彦,程培钧,陈松江,黎欣悦,毕 炫,程 瑶,吴昌学,吴 宁
贵州医科大学1基础医学院,2麻醉医学院,3临床医学院,4医学分子生物学重点实验室,贵州 贵阳 550004
类风湿性关节炎(RA)是一种慢性、炎症性疾病[1],致残率极高,但发病机制尚未完全阐明,血管翳作为RA重要病理特征,主要由新生微血管、持续增生肥大的RA滑膜细胞、炎性细胞构成,具体形成机制不清[2],而VEGF在血管生成中起着至关重要的作用,包括调节血管通透性、破坏血管壁、降解基底膜、增加细胞外基质的迁移和侵袭,以及促进血管内皮细胞的增殖,是目前已知的作用最强的促血管生成因子[3]。
研究者发现[4,5]受体相互作用蛋白激酶1(RIPK1)或受体相互作用蛋白激酶3(RIPK3)激酶活性丧失均会降低VEGF 表达以及血管通透性和血管发芽程度,RIPK1、RIPK3是一种多功能细胞内蛋白,是细胞坏死性凋亡的关键介质,RIPK1的激活促进RIPK3的募集,形成RIP1-RIP3复合物,随后,RIPK3的激酶磷酸化混合谱系激酶结构域样蛋白(MLKL),p-MLKL进行寡聚化并转移到质膜,造成质膜破裂并向细胞外空间释放促炎细胞内容物,这种细胞坏死和炎症形成的正反馈回路,即坏死性凋亡[6,7],而血管翳作为RA重要病理特征,目前普遍认为滑膜炎症因子大量表达,使得形成利于血管新生的微环境[8],坏死性凋亡可加重持续炎症反应[9],提示坏死性凋亡可能参与了RA血管新生过程,目前,坏死性凋亡在动脉粥样硬化、糖尿病肾病等疾病中研究较多,但基于RIPK1/RIPK3/MLKL通路研究坏死性凋亡与血管新生之间关系研究较少,有研究者报道称,RIPK1、RIPK3和p-MLKL的表达在CIA小鼠滑膜中增加,同时发现坏死性凋亡介质表达增加[10],而利用RIPK1抑制剂(NST)-1s可以通过抑制坏死性凋亡来减弱CIA 中的病理反应[11]。因此基于RIPK1/RIPK3/MLKL探索坏死性凋亡与血管新生的作用将为RA的发生发展提供关键线索。
目前,以非甾体类抗炎药、糖皮质激素为代表的治疗药物起效慢,且毒副作用较大[12]。因此开发疗效好、毒副作用小的新药迫在眉睫,贵州特色苗医药方“四大血”(SX)是由鸡血藤、五花血藤、见血飞、黑骨藤四种藤本药材组成,作为苗族地区流传的通气散血的代表方剂,是治疗RA的优势药物,但其作用机制不清,尚处于经验用药阶段[13]。课题组前期研究结果显示,SX水煎液可减轻胶原诱导性关节炎大鼠(CIA)关节滑膜炎性细胞浸润程度,抑制关节滑膜组织增生,通过下调VEGF、VEGFR-2的表达,减少血管生成改善血管新生等病理表现[13-15],故本研究通过构建CIA大鼠模型,以RIPK1/RIPK3/MLKL信号通路为靶点,探究SX对CIA大鼠坏死性凋亡及滑膜血管增生的干预机制,为挖掘SX药用价值,开发其临床应用提供理论基础和科学依据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物与药物 42只雄性SPF级SD大鼠,8周龄,体质量为180~220 g,贵州医科大学实验动物中心提供,合格证号[SYXK(黔)2018-001]。SX由五花血藤、鸡血藤、见血飞、黑骨藤按15∶22∶15∶8比例组成,药材均由贵阳中医学院苗医药教研室提供,并经田振华副教授鉴定,雷公藤多苷片购至黄石飞云制药公司(批号:20080301)。
1.1.2 主要试剂与仪器 不完全弗氏佐剂(Sigma),牛II型胶原(Chondrex),TNF-α及、IL-17 及IL-1β试剂盒(上海巧伊生物科技有限公司),一抗VEGF、RIPK3、Caspase-8、β-actin(Bioworld),MMP9(华安生物),Ang-1、STAT-3(HUABIO),RIPK1、MLKL(abcam),p-MLKL(ABclonal),二抗(Bioworld,),PCR逆转录试剂盒(宝日医生物技术有限公司),水平电泳槽DYY-Ⅲ31D(北京六一仪器厂),酶标仪(BIO-TEK),Quanity One凝胶成像分析系统(BIO-RAD),DYY-5型稳压稳流电泳仪(北京六一仪器厂)。
1.2 方法
1.2.1 分组与造模 42只SPF级雄性SD大鼠,体质量为180~200 g,随机分为空白组(Nor)、模型组(Mod)、“四大血”高剂量组(SX 40 g/kg)、中剂量组(SX 20 g/kg)、低剂量组(SX 10 g/kg)和雷公藤多苷片对照组(GTW),7只/组。适应性饲养1周后造模,将2 mg/mL牛Ⅱ型胶原与等量不完全弗氏佐剂于冰上混合,充分乳化后,以1滴乳化剂于水中不扩散为准,大鼠麻醉后,取乳化后的混合物0.2 mL于尾根部皮下注射进行初次免疫,1周后于足跖皮下加强免疫1次,通过关节炎指数(AI)评分判定造模情况,其中,达到4分及4分以上,则判定造模成功。
1.2.2 药物制备与给药方案 五花血藤、鸡血藤、见血飞、黑骨藤,按照15∶22∶15∶8比例配制,共取2000 g,加适量水煮3次(时间分别为1 h、30 min、30 min),合并浓缩液500 mL,生药浓度为4 g/mL,4 ℃冰箱备用。第2次造模结束后开始给药,给药方案:SX高、中、低剂量组灌胃给药浓度分别为40、20、10 g/kg(按生药计);GTW组给药浓度为40 g/kg,Nor组和Mod组用等量0.9%氯化钠注射液灌胃,1次/d,连续21d。
1.2.3 各组大鼠AI、关节肿胀率测算 每日定期观察大鼠情况,拍照记录关节红肿、关节畸形情况,初次注射乳化剂当天起,采用AI评分观察大鼠后足关节病变情况,每隔7 d观察1次,共5次。AI评分标准如下:0分(无红肿);1分(关节有红色斑点或轻度肿胀);2分(关节病变中度红肿);3分(关节除中度红肿外,伴有轻度功能障碍);4分(关节重度红肿,僵直甚至畸形,严重功能障碍);将2只后踝关节的病变程度累计积分,计算关节炎指数,每只大鼠AI评分最高为8分,AI评分越高表示关节病变越严重。初次免疫起,每隔1周,采用大鼠足部容积测量仪测量大鼠双后足肿胀度,足肿胀度计算公式如下:ER(%)=(V1-V2)/V2×100%(其中V2为造模前的容积,V1造模后的容积)。
1.2.4 标本采集 给药21 d后,使用10%水合氯醛麻醉各组大鼠,真空采血管进行心脏取血,静置10 min后4 ℃,3000 r/min 离心10 min,分离血清用于ELISA实验;取脾脏和胸腺组织并称量各组织质量,计算脾腺指数,胸腺指数(脾指数)=胸腺(脾)质量(g)/体质量(g)×100%;并取各组大鼠炎性后腿,一部分使用4%多聚甲醛固定,用于HE染色,另一部分使用生理盐水冲洗后置于-80 ℃冰箱保存,用于Western blot及Real-time PCR检测相关蛋白表达水平。
1.2.5 滑膜组织病理学观察 将固定于4%多聚甲醛中的膝关节滑膜组织进行石蜡包埋、切片、贴片、染色,并使用光学显微镜观察周围组织病理变化。
1.2.6 ELISA检测大鼠血清中IL-1β、IL-17、TNF-α表达使用ELISA试剂盒检测大鼠血清中IL-1β、IL-17、TNF-α表达水平,操作严格按说明书进行。
1.2.7 Real-time PCR检测滑膜组织中RIPK1、RIPK3、Caspase-8、MMP-9、VEGF、Ang-1 mRNA 表达 使用Trizol Reagent试剂盒提取总RNA,反转录为cDNA,以cDNA为模板进行PCR扩增,GAPDH作为内参,采用2-ΔΔCt法对结果进行分析,扩增程序为:95 ℃300 s;循环反应,95 ℃10 s,60 ℃20 s,循环40 次。引物序列(表1)。

表1 各基因引物序列Table 1 Primer sequences for RT-PCR
1.2.8 Western blot 检 测RIPK1、RIPK3、Caspase-8、MLKL、p-MLKL、VEGF、MMP9、Ang-1、STAT-3 蛋白表达 使用RIPA裂解液提取滑膜组织总蛋白,BCA试剂盒检测蛋白浓度。聚丙烯酰胺凝胶进行蛋白电泳,PVDF 转膜,封闭,加入对应的一抗RIPK1(1∶1000)、RIPK3(1∶1000)、Caspase-8(1∶1000)、MLKL(1∶1000)、p-MLKL(1∶1000)、VEGF(1∶1000)、MMP9(1∶1000)、Ang-1(1∶1000)、STAT-3(1∶1000)、β-actin(1∶5000),4 ℃孵育过夜,TBST洗涤5 min/次,共6次,加入二抗(1∶5000),室温摇床缓慢摇动1.5 h,TBST洗涤5 min/次,共6 次,凝胶成像仪上进行蛋白条带检测,Image Pro Plus 6.0软件分析蛋白表达量。
1.2.9 统计学分析 应用SPSS 23.0软件进行数据分析,数据采用均数±标准差表示,各组间数据比较采用单因素方差分析,以P<0.05表示差异有统计学意义,所有实验都是独立重复3次。
2 结果
2.1 SX对各组大鼠关节肿胀度的影响
第2次造模结束后,与Nor组相比,各组大鼠双后肢均出现明显红肿,毛发干枯现象,行动迟缓甚至无法直立行走,连续给药3周后,与Mod组相比,各给药组足肿度均降低,其中GTW组、SX 40 g/kg足肿度降低最显著(P<0.001,表2、图1)。
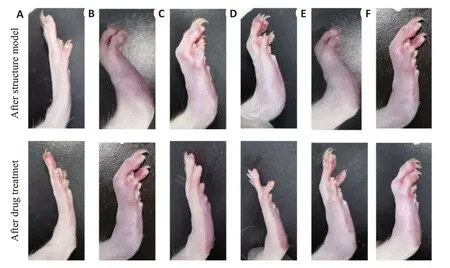
图1 各组大鼠足肿胀度Fig.1 Hind limb joint swelling of the rats in each group.A-F:Normal control group,CIA model group,GTW group,SX 40 g/kg group,SX 20 g/kg group,and SX 10 g/kg group,respectively.
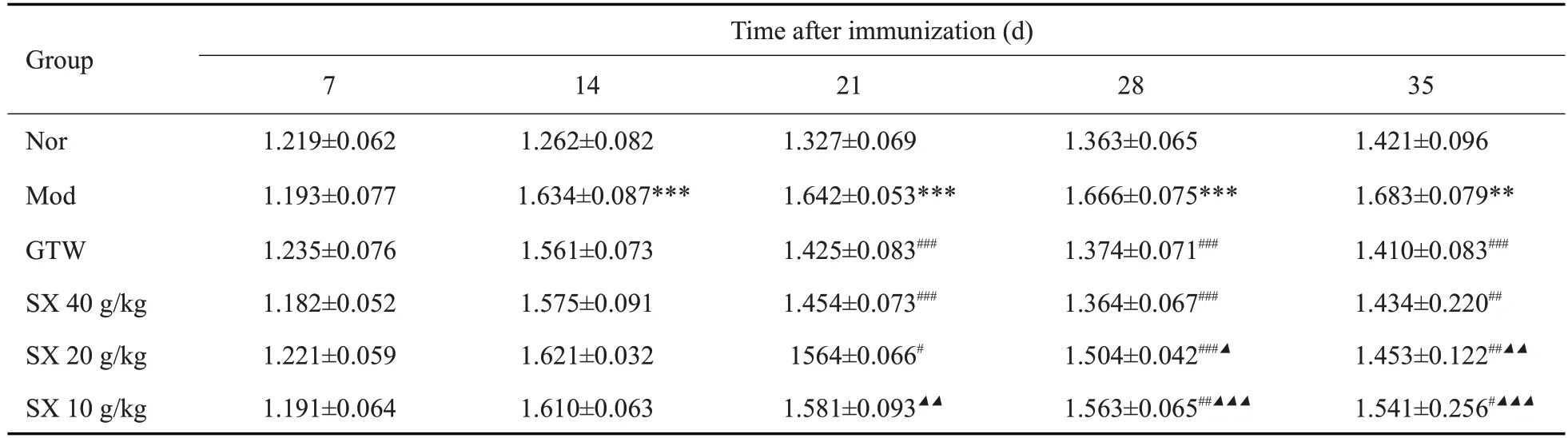
表2 SX对CIA大鼠双后肢足肿胀度的影响Table 2 Effect of SX on swelling of bilateral hind limb joints in CIArats(Mean±SD,n=7)
2.2 SX对各组大鼠关节AI评分的影响
AI评分可以客观反映出大鼠发病的情况,连续给药3周后,与Nor组相比,Mod组大鼠AI评分明显增高(P<0.001),而与Mod组相比,GTW组和SX 40 g/kg组的AI评分明显下降(P<0.001、P<0.01),而其余给药组差异无统计学意义(表3)。
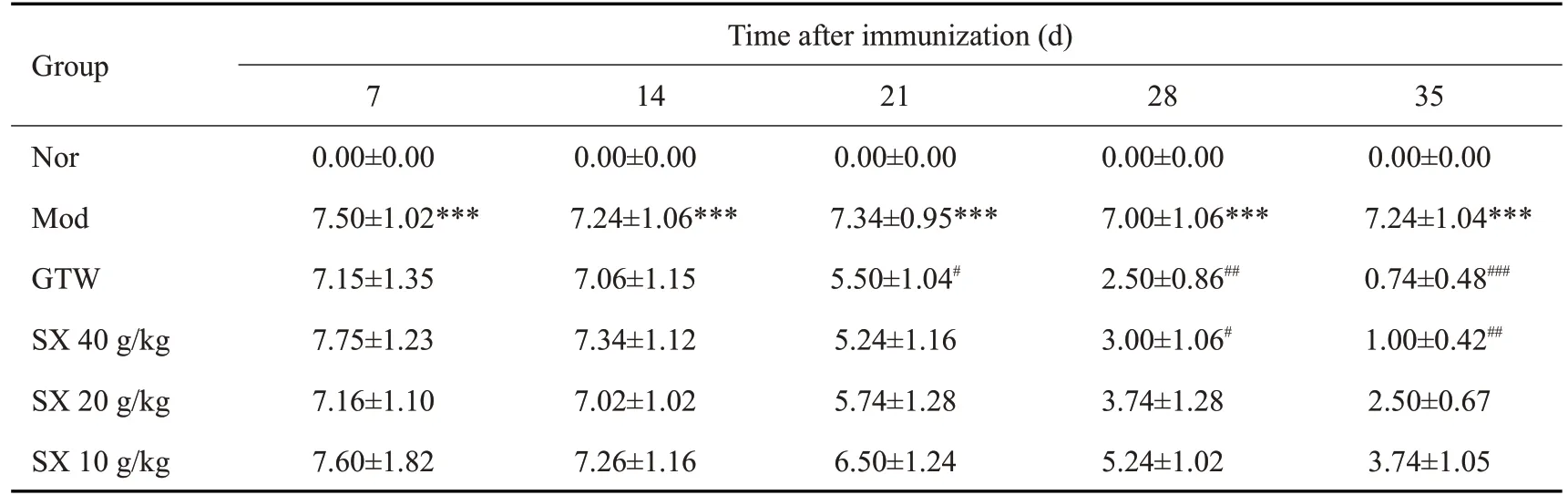
表3 SX对CIA大鼠关节AI评分的影响Table 3 Effect of SX on arthritis index score in CIArats(Mean±SD,n=7)
2.3 SX对CIA大鼠脾脏及胸腺的质量分数的影响
连续给药3周后,与Nor组相比,Mod组胸腺和脾脏指数均升高(P<0.001),与Mod组相比,其中,GTW组、SX 40 g/kg组胸腺和脾脏指数均明显降低(P<0.001),SX 20 g/kg胸腺和脾脏指数有所下降(P<0.05、P<0.01),且SX 40 g/kg组与GTW组相比,无统计学意义(图2)。
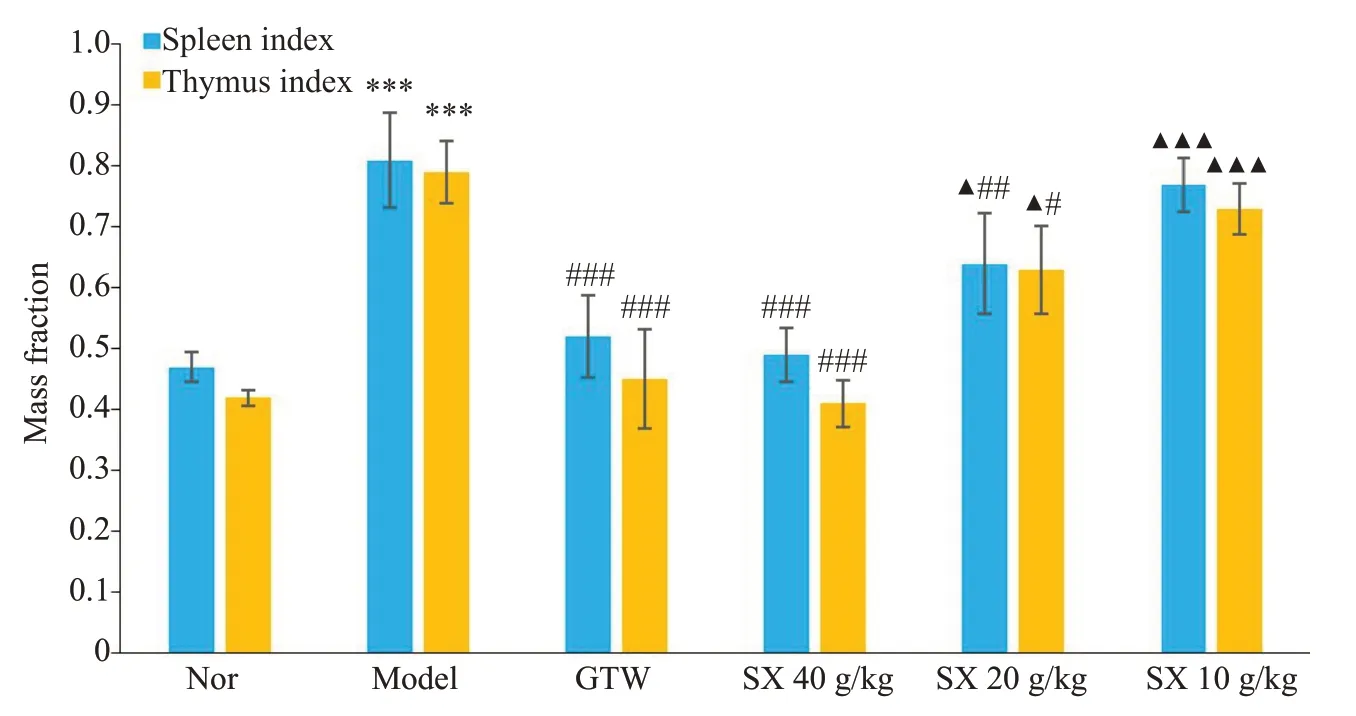
图2 SX对CIA大鼠脾脏及胸腺的质量分数的影响Fig.2 Effect of SX on mass fraction of the spleen and thymus in the rats (n=7).***P<0.001 vs the Nor group;#P<0.05,##P<0.01,###P<0.001 vs Model group;▲P<0.05,▲▲▲P<0.001 vs GTW group.
2.4 SX对CIA大鼠滑膜组织病理学的影响
光镜下观察组织病理变化显示,连续给药3周后,Nor组关节软骨表面光滑,层次清楚,关节滑膜未见增生,未见炎症细胞浸润;Mod组关节腔内见大量炎性细胞渗出,滑膜上皮明显增生,滑膜重度炎性细胞浸润;GTW组组织轻度充血及少量炎细胞浸润现象发生;SX 40 g/kg、SX 20 g/kg组关节腔内滑膜组织充血明显减轻,未见明显炎性细胞浸润。SX 10 g/kg组软骨组织中度增生,软骨细胞生长活跃,炎性细胞浸润程度较Mod组有所减轻(图3)。
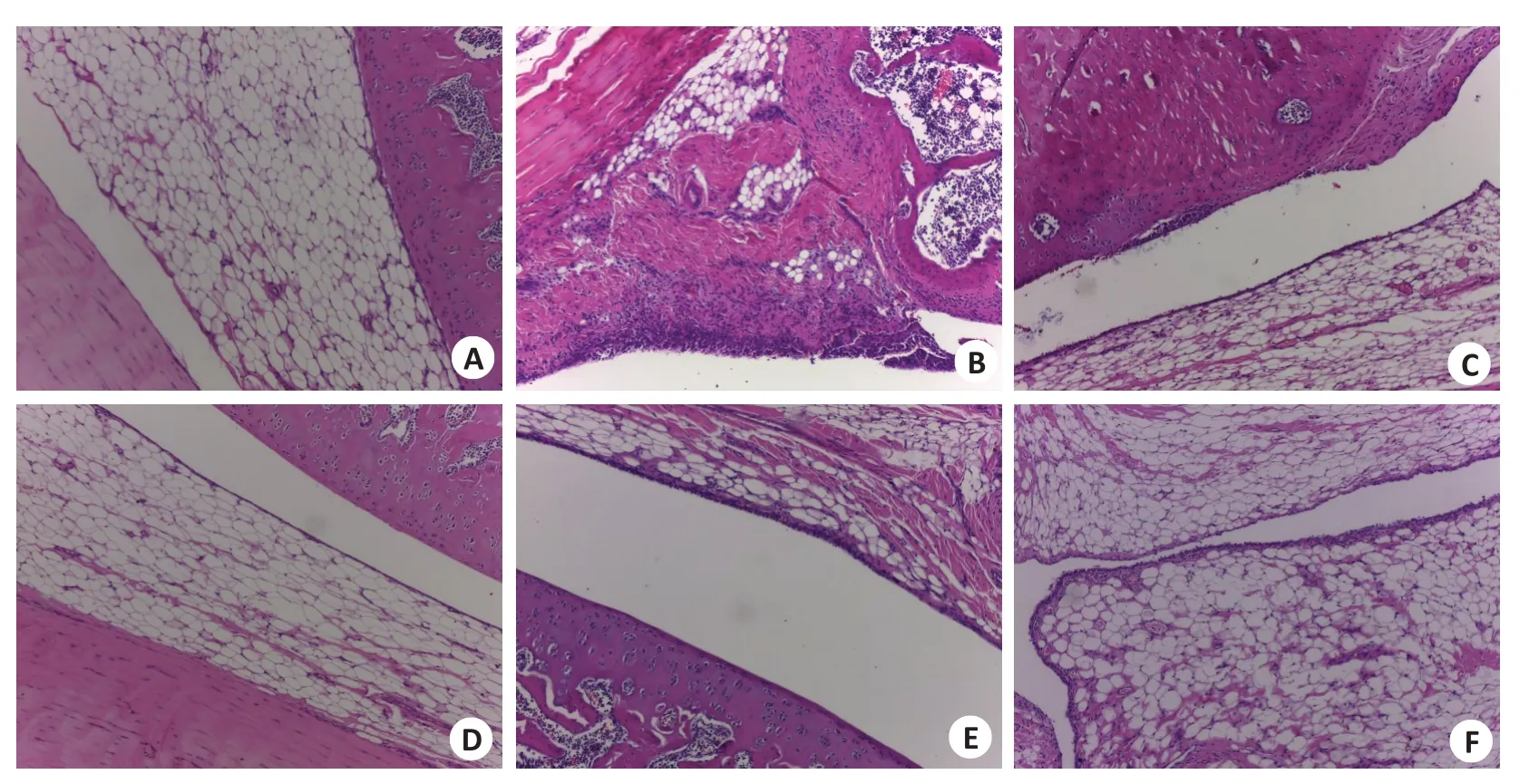
图3 SX对各组大鼠滑膜组织病理改变的影响Fig.3 Effect of SX on pathological changes of the synovial tissue of the rats(HE staining,original magnification:×100).A-F:Normal control group,CIA model group,GTW group,SX 40 g/kg group,SX 20 g/kg group,and SX 10 g/kg group,respectively.
2.5 SX对CIA大鼠血清细胞因子的影响
给药3周后,取各组大鼠的血清进行ELISA实验,与Nor组相比,Mod组大鼠血清中IL-17、IL-1β、TNF-α含量均升高(P<0.05、P<0.01、P<0.01);与Mod组相比,各给药组IL-1β、TNF-α、IL-17 含量均下降;其中SX 40 g/Kg组中下降更显著(P<0.01、P<0.01、P<0.05,表4)。
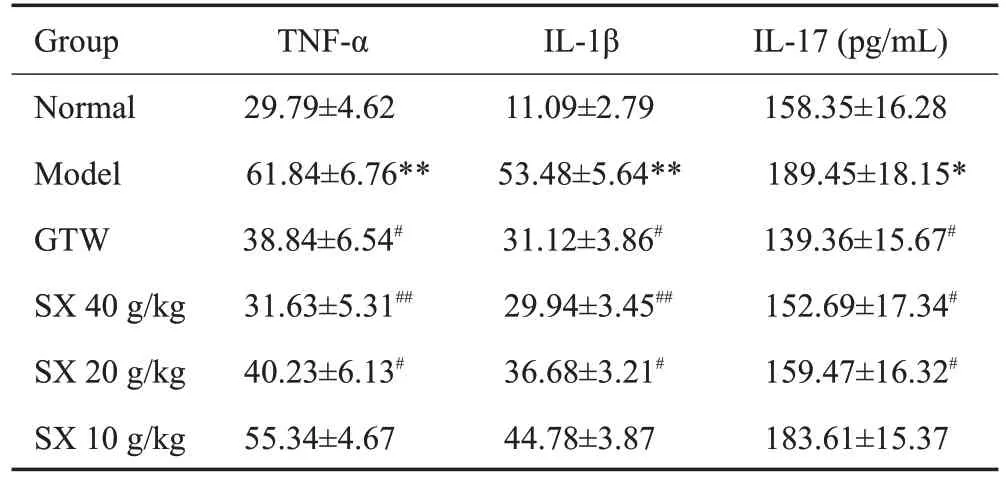
表4 SX对CIA大鼠血清细胞因子的影响Table 4 Effect of SX on serum cytokine levels in CIArats(Mean±SD,n=7)
2.6 SX对CIA大鼠中RIPK1、RIPK3、Caspase-8、VEGF、MMP9、Ang-1 mRNA表达水平的影响
给药21 d后,取大鼠膝关节滑膜组织进行RT-PCR实验,结果显示,与Nor组相比,Mod组中RIPK1、RIPK3 mRNA表达水平增高(P<0.01),Caspase-8 mRNA表达水平降低(P<0.01);而与Mod组相比,SX 40 g/kg组RIPK1、RIPK3 的mRNA 表达水平降低(P<0.01、P<0.05),Caspase-9 mRNA表达水平增加(P<0.01),而SX 20 g/kg、SX 10 g/kg组差异无统计学意义(图4A~C)。
进一步检测促血管生长因子VEGF、MMP9、Ang-1 mRNA表达,结果显示,与Nor组相比,Mod组中VEGF、MMP9、Ang-1 mRNA表达均增高(P<0.001、P<0.001、P<0.01),而与Mod组相比,SX 40 g/kg、SX 20 g/kg组VEGF、MMP9、Ang-1 mRNA 表达均降低,其中,SX 40 g/kg组降低更显著(P<0.001、P<0.001、P<0.01),而SX 10 g/kg组差异无统计学意义(图4D~F)。
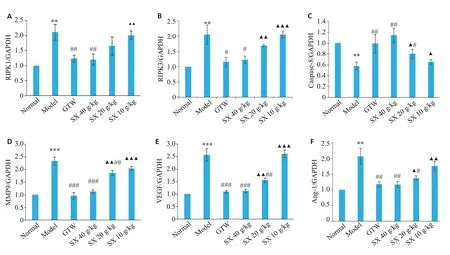
图4 SX对CIA大鼠中RIPK1、RIPK3、Caspase-8、VEGF、MMP9、Ang-1 mRNA表达水平的影响Fig.4 Effect of SX on mRNA expression levels of RIPK1,RIPK3,caspase-8,VEGF,MMP9,and Ang-1 in the synovium of the CIA rats(n=7).**P<0.01,***P<0.001 vs the Nor group;#P<0.05,##P<0.01,###P<0.001 vs the Mod group;▲P<0.05,▲▲P<0.01,▲▲▲P<0.001 vs GTW group.
2.7 SX对CIA大鼠中RIPK1、RIPK3、MLKL、p-MLKL、Caspase-8、VEGF、MMP9、Ang-1、STAT-3蛋白表达水平的影响
给药21 d后,取大鼠膝关节滑膜组织进行Westernblot实验,结果显示,与Nor组相比,Mod组中RIPK1、RIPK3、的蛋白表达水平增高(P<0.01、P<0.001),MLKL磷酸化水平增加(P<0.01),并降低Caspase-8 蛋白表达水平(P<0.01);而与Mod组相比,SX 40 g/kg组下调RIPK1、RIPK3 蛋白表达(P<0.01,P<0.001),MLKL磷酸化水平降低(P<0.01),并上调Caspase-8蛋白表达(P<0.001、P<0.01),SX 10 g/kg组RIPK1、RIPK3、Caspase-8、p-MLKL 的蛋白表达差异无统计学意义(图5A~D)。
而进一步检测促血管生长因子VEGF、MMP9、Ang-1、STAT-3蛋白表达,结果显示,与Nor组相比,Mod组中VEGF、MMP9、Ang-1、STAT-3蛋白表达水平增高(P<0.001、P<0.001、P<0.01、P<0.001);与Mod组相比,SX 40 g/kg、SX 20 g/kg组VEGF、MMP9、Ang-1、STAT-3表达均降低,其中,SX 40 g/kg组降低更显著(P<0.001),SX 10 g/kg中VEGF、MMP9、Ang-1、STAT-3蛋白表达差异无统计学意义(图5E~I)。
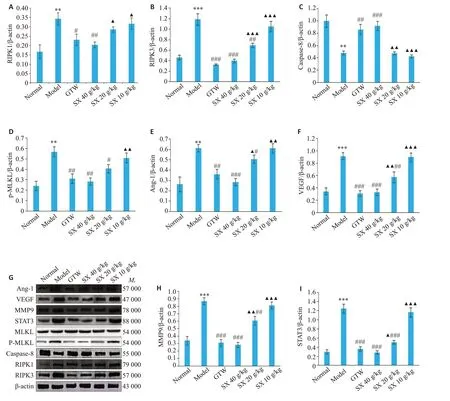
图5 SX对CIA大鼠中RIPK1、RIPK3、MLKL、p-MLKL、Caspase-8、VEGF、MMP9、Ang-1、STAT-3蛋白表达水平的影响Fig.5 Effect of SX on expression level of RIPK1,RIPK3,caspase-8,VEGF,MMP9,Ang-1,and STAT-3 proteins in the synovium of the CIArats(n=7).**P<0.01,***P<0.001 vs the Nor group;#P<0.05,##P<0.01,###P<0.001 vs the Mod group;▲P<0.05,▲▲P<0.01,▲▲▲P<0.001 vs GTW group.
3 讨论
RA是一种慢性、自身性免疫疾病,其发病机制尚未完全阐明[2],非甾体类抗炎药、糖皮质激素等治疗RA一线药物,虽能有效缓解临床症状,但毒副作用明显[12],而中草药具有多组分、多通路、毒副作用小的优势,已成为治疗RA的潜在药物[17]。贵州苗医药方“四大血”由鸡血藤、黑骨藤、见血飞、五花血藤四种藤本药材构成,是贵州苗族地区治疗RA的优势药物,但目前正处于经验用药阶段。课题组前期证明SX能够缓解CIA大鼠模型炎症反应和血管新生,但具体机制不清[13-15]。
RA主要病理特征为血管翳的形成[18],主要由新生微血管、持续增生肥大的RA 滑膜细胞、炎性细胞构成[19],最重要的特征就是新生血管呈“肿瘤样”浸润生长。滑膜血管生长机制目前尚不明确,普遍认为是由多种致炎因素诱导的细胞因子和生长因子浸润滑膜,滑膜增生肥大,需形成新血管提供营养和氧气,导致滑膜血管过度新生,促进血管翳形成[20]。
血管新生涉及内皮细胞迁移、微血管基底膜的破坏、ECM重构、发芽、管形成、血管稳定等复杂、多步骤、协调连续过程,受到各种细胞因子严密调节[21]。血管生成始于血管生长因子,如:VEGF,VEGF与内皮细胞同源受体VEGFR-2结合,刺激内皮细胞增殖、迁移和发芽[22],另外,STAT-3被各种细胞因子激活[23],与另一种STAT蛋白匹配形成同源二聚体或异源二聚体,此后,它们转移到细胞核中,与VEGF启动子结合,启动基因表达过程,从而直接影响VEGF 的表达。MMP9 作为MMPs家族中具有代表性成员,具有明胶酶的作用,可通过参与基底膜重构、降解ECM、刺激内皮细胞分泌相关血管生长因子等多种途径增加血管新生,对血管新生具有长期调控作用[24]。最后,血管被促血管生成因子(Ang-1)稳定,将外周细胞整合到新形成的底膜中,以促进血流过程[25]。
而在本实验研究中,通过检测VEGF、MMP9、Ang-1 mRNA和蛋白表达,结果显示,与模型组相比,SX能下调CIA大鼠滑膜组织中VEGF、MMP9、Ang-1 mRNA和蛋白表达水平。同时,使用WB检测STAT-3蛋白表达水平,与模型组相比,SX能下调CIA大鼠滑膜组织中STAT3蛋白表达水平。以上结果提示SX具有减缓血管新生的功效。
研究证实,持续的炎症是滑膜血管新生的启动阶段,而坏死性凋亡是炎症发生的内源性诱因[26]。坏死性凋亡是区别于凋亡、自噬和坏死后新发现的细胞死亡方式[27],由RIPK1、RIPK3执行,当细胞膜表面受体TNFR1与TNF-α结合后,募集TRAF2(TNFR 相关因子2)和RIPK1等形成复合体Ⅰ,复合体Ⅰ对RIPK1进行不同修饰,从而决定细胞死亡[28],此时,若Caspase-8被抑制,则促进RIPK1和RIPK3磷酸化形成复合物IIb,即坏死小体,坏死小体作为坏死性凋亡关键调节剂[29],可通过介导RIPK3募集MLKL使其磷酸化,使大量Ca2+和Na+内流、细胞器肿胀、细胞膜完整性破坏,部分细胞内含物将作为损伤相关分子模式(DAMPs)进入周围组织,释放内源性危险分子[30],诱导IL-17、TNF-α、IL-1β等促炎因子引起炎性细胞聚集,放大局部炎症反应[31],细胞因子募集血液中白细胞迁移至滑膜处,造成炎性细胞浸润,形成利于血管新生的炎性微环境[32]。
越来越多证据证明,坏死性凋亡在心血管疾病和炎症性疾病中扮演重要角色,如,动脉粥样硬化、糖尿病肾病等[33,34]。在本项研究中,我们在CIA模型大鼠中发现了坏死性凋亡的证据,与Nor组相比,Mod组大鼠滑膜组织中RIPK1、RIPK3 mRNA表达水平也显著增加,且Caspase-8 mRNA及蛋白表达水平较空白组显著下降,而与Mod 组相比,SX 治疗组的滑膜组织中RIPK1、RIPK3、p-MLKL蛋白表达水平较空白组显著减少,同时Caspase-8 mRNA及蛋白表达水平较空白组显著增加,提示SX可抑制CIA大鼠滑膜组织RIPK1/RIPK3/MLKL信号通路的激活,从而减少坏死性凋亡的发生。
另外,ELISA结果中显示,与Mod组相比,SX各剂量组大鼠血清中IL-1β、TNF-α、IL-17表达水平均下降;HE病理切片中发现,Mod组大鼠的滑膜明显增生,滑膜细胞排无规则列,并伴有大量炎性细胞浸润,而SX治疗组滑膜细胞排列整齐、视野内滑膜细胞增生减少。脾脏和胸腺是体内重要免疫器官,胸脾指数可以在一定程度上反映机体免疫水平高低,脏器指数结果显示,SX各剂量组胸脾指数较模型组均降低,同时,SX能降低大鼠关节炎指数、缓解大鼠足趾红肿。以上结果提示:SX可能通过抑制CIA 大鼠滑膜组织RIPK1/RIPK3/MLKL 信号通路的激活,减少坏死性凋亡的发生,从而缓解大鼠的炎性症状。
综上所述,本研究提示,SX可以改善CIA大鼠滑膜血管新生,其机制可能与抑制RIP1/RIP3/MLKL信号通路激活,阻止滑膜组织坏死性凋亡,减轻炎症反应,从而下调促血管生长因子VEGF、Ang-1、MMP9、STAT-3表达有关。提示SX有重大的药用价值,为寻找RA治疗提供思路,对开展SX药物的研发以及指导其临床运用具有重要意义。然而,坏死性凋亡与血管新生之间作用关系较复杂,后续,我们将继续深入探究坏死性凋亡与血管新生之间具体的调控机制以及SX在其中发挥的作用。
