组蛋白赖氨酸去甲基化酶家族在膀胱癌中的表达模式及其潜在作用:基于多组学分析
2022-02-03付小聪余光创郭艳芳
付小聪,余光创,郭艳芳
南方医科大学基础医学院生物信息学系,广东 广州 510515
膀胱癌是比较常见的一种恶性肿瘤,其发病率和死亡率都呈上升趋势[1,2]。膀胱癌的男性病例比女性病例更常见,男性的发病率和死亡率分别为9.5/10万和3.3/10万,大约是女性的4倍[3]。肿瘤基因组研究进展提示膀胱癌相比大多数其它癌症具有更为明显的表观遗传失调特征,这严重影响膀胱癌患者的预后,给治疗带来巨大挑战[4]。
编码蛋白质的染色质重塑基因常常是表观遗传学研究关注的焦点。赖氨酸组蛋白去甲基化酶(KDMs)家族,就是一类非常重要的表观遗传酶,它被定义为一组催化不同大分子(核酸和蛋白质)赖氨酸残基去甲基化的酶[5],既能去除抑制性组蛋白标志物,又能清除激活性组蛋白标志物[6]。KDMs的失调通常与人类癌症有关,例如,KDM6A[7,8]、KDM5C[9]被报道高度突变易促进肿瘤的发生;而KDM1A[10]、KDM3A[11]、KDM3B[12]、KDM4C[13]、KDM5B[14]和KDM7B[15]分别在相应肿瘤中的过表达促进癌细胞生长,并导致较差的预后;相反,KDM5D[16]的过表达显著抑制结直肠癌的生长和转移。尽管有诸多研究发现单个KDMs家族基因在不同肿瘤类型中发挥重要作用,具有组织特异性,但尚未有相关研究报道整个KDMs基因家族在膀胱癌中的表达是否具有共性或者特殊模式,以及对膀胱癌的诊断和治疗发挥着怎样的潜在作用。
因此,本研究使用多种生物信息学分析方法来全面评估KDMs在BLCA患者中多组学的表达模式及其潜在的影响,旨在为KDMs在膀胱癌的肿瘤发生、进展、诊断和预后治疗中的潜在作用提供理论参考。
1 材料和方法
1.1 材料
通过文献获取19个KDMs的相关信息:KDM1A/1B/2A/2B/3A/3B/4A/4B/4C/4D/5A/5B/5C/5D/6A/6B/7B/7C和UTY[5];其次获取来自TCGA 膀胱癌样本数据集,包括临床资料(n=404)和转录组(n=427)、甲基化(n=439)、体细胞变异(n=411)多组学高通量测序数据。
1.2 方法
本研究采用生物信息学分析方法以分析KDMs的表达模式,并构建生存预后、免疫浸润和药物敏感性模型,具体如下。
1.2.1 KDMs在膀胱癌中的转录表达、甲基化水平、体细胞变异分析 本研究使用UALCAN分析KDMs的转录表达和甲基化水平,使用GSCALite分析BLCA样本中KDMs的体细胞变异(包括单点突变和拷贝数变异)。UALCAN[17](http://ualcan.path.uab.edu/)和GSCALite[18](http://bioinfo.life.hust.edu.cn/web/GSCALite/)是两个用于分析和可视化TCGA数据的生物信息学在线分析平台。
1.2.2 KDMs在BLCA中的生存与预后价值分析 本研究使用Kaplan Meier-Plotter(http://www.kmplot.com/)探讨KDMs的表达对BLCA样本(n=404)的总生存率(OS)、无复发生存率(RFS)的影响[19]。利用每个KDMs家族基因表达水平的上下四分位数将患者样本分为高表达组和低表达组,绘制Kaplan-Meier生存曲线,并进行log-rank显著性检验,P<0.05为差异具有统计学意义。
为探讨多个KDMs的表达对BLCA患者的生存影响,进一步使用临床生物信息学助理(www.aclbi.com)构建综合预后模型分析模块研究KDMs对膀胱癌样本的综合预后影响[20]。分析针对408例BLCA患者数据进行降维,构建包含多个KDMs基因的Risk Score模型,采用LASSO回归与十倍交叉验证最小lambda值获得具有预后价值的基因,并利用模型对高风险组(n=203)和低风险组(n=204)样本进行风险评估预测生存期。
1.2.3 KDMs在膀胱癌中的免疫浸润与耐药分析 为探讨KDMs 的表达与免疫浸润的关系,我们利用Timer(http://timer.cistrome.org/)进行免疫浸润分析[21],探讨每个KDMs家族成员在BLCA(n=427)中的表达与多种免疫细胞浸润的相关性,包括B 细胞、CD8+T 细胞、CD4+T细胞、巨噬细胞、中性粒细胞和树突状细胞。
为进一步探索KDMs 的异常表达对膀胱癌患者(n=427)药物治疗的影响,我们对KDMs的耐药性进行分析。使用GSCALite[18]的药物敏感性分析模块研究KDMs 家族成员与抗癌药物敏感性的相关性,采用Pearson相关系数表征KDMs的表达与肿瘤药物敏感性基因组学中265个小分子的线性相关,P<0.05为差异具有统计学意义。
2 结果
2.1 KDMs在BLCA中的转录表达模式
KDMs在膀胱癌组织中并不是一致上调或者下调的表达模式(图1),差异表达分析结果显示,KDM1A(P=1.37×10-8)、KDM1B(P=4.74×10-3)、KDM2B(P=2.59×10-7)、KDM4A(P=3.24×10-4)、KDM4B(P=2.99×10-4)、KDM5B(P=1.59×10-4)、KDM5C(P=2.11×10-2)在BLCA中显著性过表达,其中KDM1A/2B过表达最为突出,而KDM3B(P=9.10×10-3)、KDM6B(P=2.88×10-2)、KDM7C(P=1.28×10-2)的表达则明显下调。
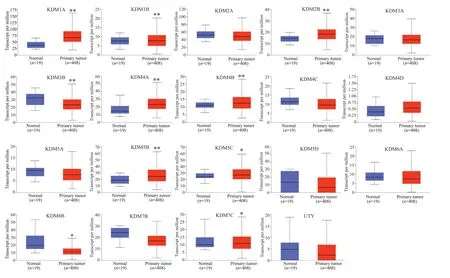
图1 KDMs在BLCA中的转录表达箱线图Fig.1 Box plots of KDMs transcription levels in BLCA.*P<0.05,**P<0.01.
2.2 KDMs在BLCA中的甲基化水平
KDMs在膀胱癌中的甲基化水平并非全都异常,但大部分KDMs具有明显的表观遗传失调现象(图2),其中KDM1A(P=5.45×10-9)、KDM3B(P=1.85×10-10)、KDM4A(P<1×10-12)、KDM4B(P=2.24×10-5)、KDM4C(P=1.12×10-6)、KDM5A(P=4.82×10-3)、KDM5B(P=3.27×10-2)、KDM5C(P=6.17×10-7)和KDM7B(P=2.08×10-3)在BLCA组织中表达下调,KDM7C(P=9.45×10-4)的表达明显上调。此外,相关分析显示,19个KDMs成员中,有14个基因(KDM1A/1B/2A/2B/3A/3B/4A/4B/4C/5A/5B/5C/6A/6B)的甲基化水平与转录水平呈显著性负相关(图3),尤其在KDM1A/4A/5B/4B中表现明显,它们在膀胱癌中甲基化水平程度较低,基因转录水平却高。
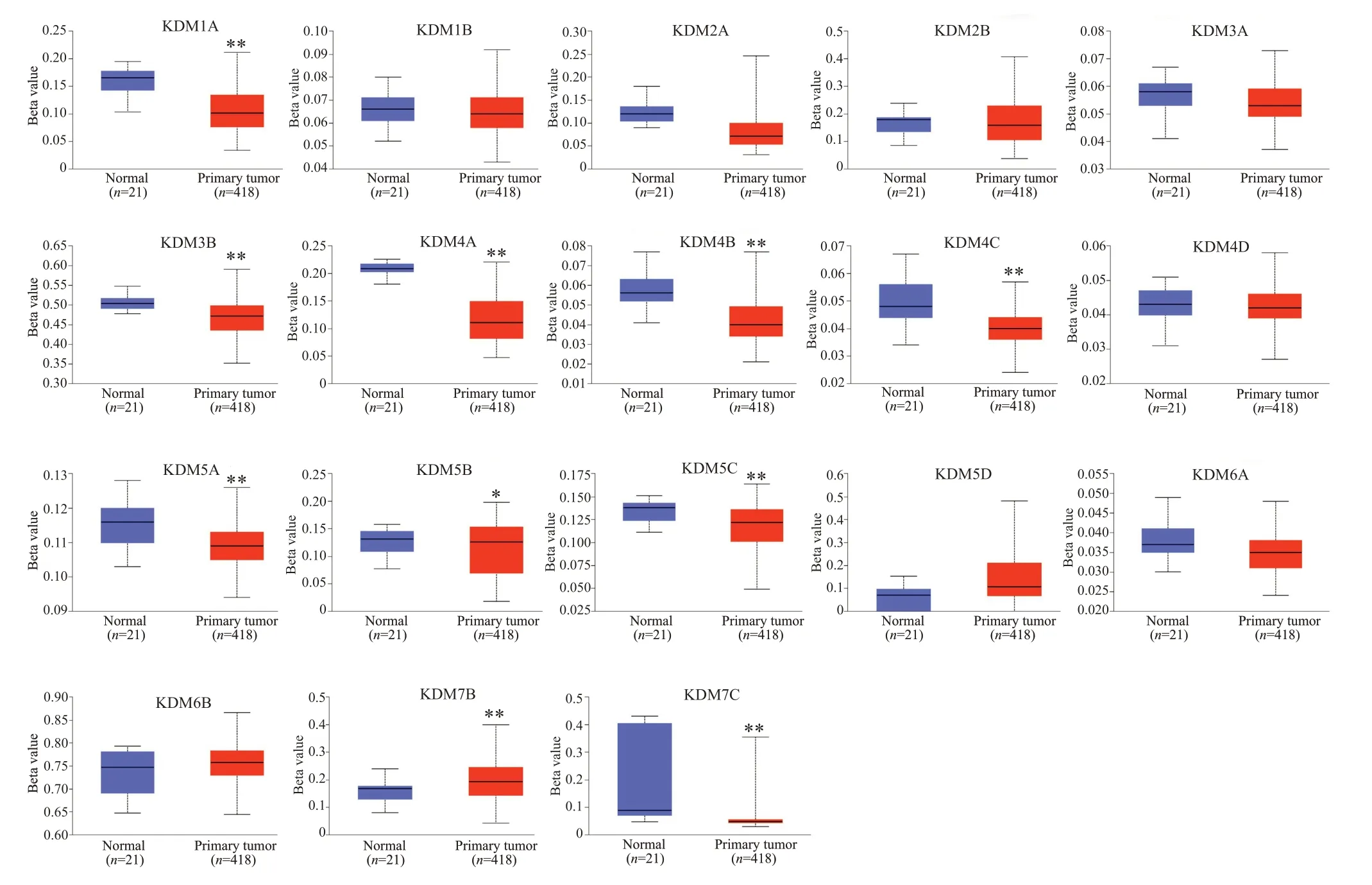
图2 KDMs在膀胱癌样本中的甲基化水平箱线图Fig.2 Box plots of KDMs methylation levels in BLCA.*P<0.05,**P<0.01.
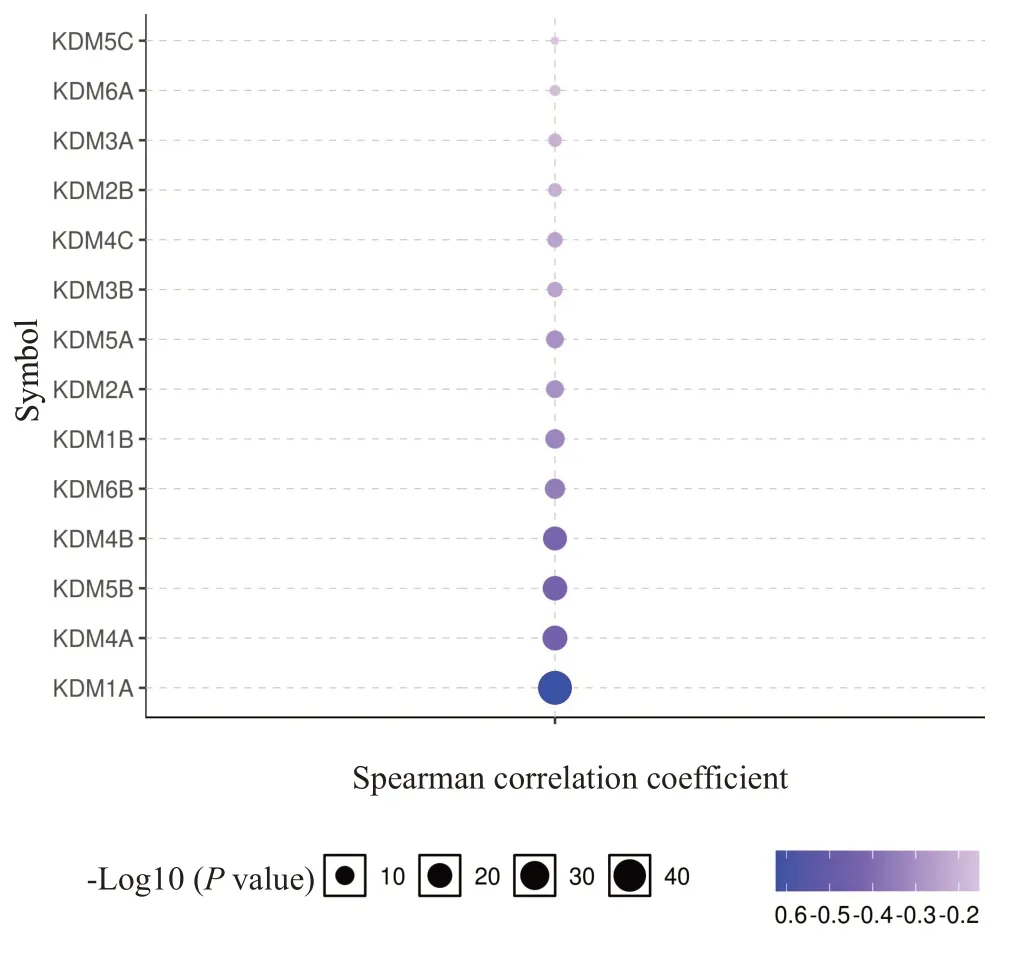
图3 KDMs在膀胱癌样本中基因表达与甲基化水平之间的相关性Fig.3 Correlation between transcription and methylation levels of KDMs in bladder cancer samples.
2.3 KDMs在BLCA中的变异模式
单点突变分析结果显示,KDMs基因的非同义突变集中在KDM6A/5A/3B/3A/5B/2B/4C/2A/4A 和UTY 10个基因(占KDMs总突变的91.26%),突变种类包括错义突变、无义突变、移码插入突变、框内缺失、剪接位点突变、多次突变和移码缺失突变(图4)。其中,KDM6A非同义突变频率最高(占总突变的25.79%),种类也最多,几乎覆盖了KDMs中所有突变种类,具有显著标志。并且,KDM6A与其他KDMs在BLCA样本中突变具互补性特征,在发生KDM6A突变的105个样本中,其它KDMs 基因突变相对较少;而在没有发生KDM6A突变的78个BLCA样本中,其它KDMs基因反而突变相对较多。
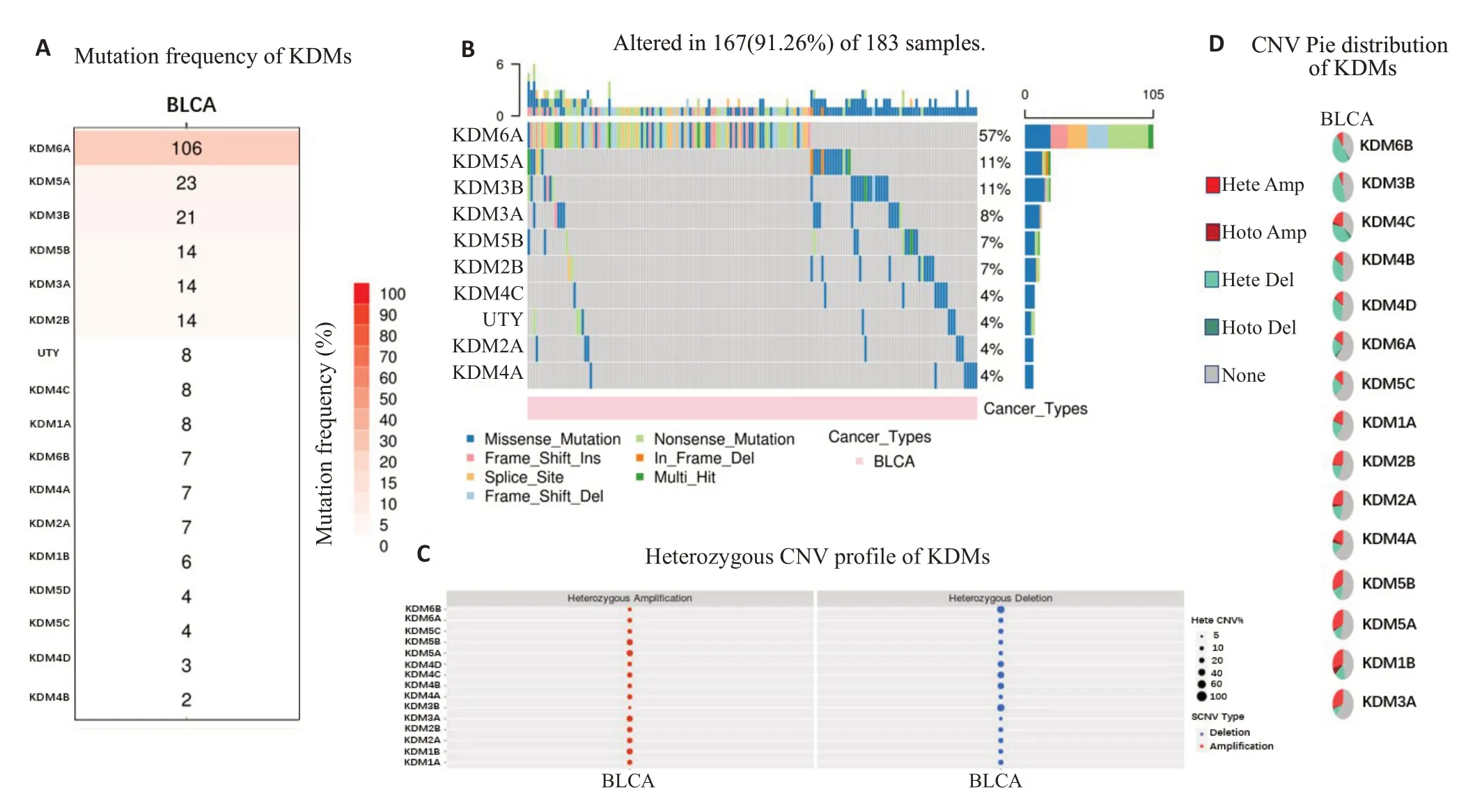
图4 KDMs在BLCA中体细胞变异分析Fig.4 Genetic alterations in KDMs in BLCA.A: The plot displays the nonsynonymous mutation frequency of KDMs in BLCA.B:Waterfall plot of the distribution and classification of nonsynonymous mutations in KDMs in BLCA.C:Heterozygous CNV profile of KDMs.D:CNV Pie distribution of KDMs.
进一步的拷贝数变异分析检测到KDMs家族基因几乎都有显著的结构突变,主要体现为杂合子扩增和缺失,除KDM1B外,没有检测到纯合子的扩增和缺失(检测标准CNV>5%)(图4)。KDM6A的杂合子扩增率和缺失率大约为10%,与其他KDMs相比并没有显示出独特的特征,这与体细胞突变分析结果不同。
2.4 KDMs在BLCA中的预后价值
生存分析显示(图5),仅有少数几个KDMs对膀胱癌患者生存期具有显著影响,其中KDM3A/4C/5D/6A/7B对BLCA患者的总生存期具有保护作用(KDM3A:HR=0.72,95%CI: 0.54~0.97,P=0.029;KDM4C:HR=0.62,95%CI:0.46~0.83,P=0.0013;KDM5D:HR=0.69,95%CI:0.5~0.94,P=0.0165;KDM6A:HR=0.73,95%CI:0.54~1,P=0.0489;KDM7B:HR=0.65,95%CI: 0.47~0.89,P=0.0065),而KDM3B/5B/5C对BLCA患者无复发生存期具有危险影响(KDM3B:HR=2.8,95%CI:0.97~8.07,P=0.0463;KDM5B:HR=2.52,95%CI:1.03~6.16,P=0.0359;KDM5C:HR=2,95%CI: 0.99~4.06,P=0.049),只有KDM4C在总生存期和无复发生存期分析中一致表现为保护性因素(KDM4C:HR=0.47,95%CI:0.23~0.96,P=0.0332)。
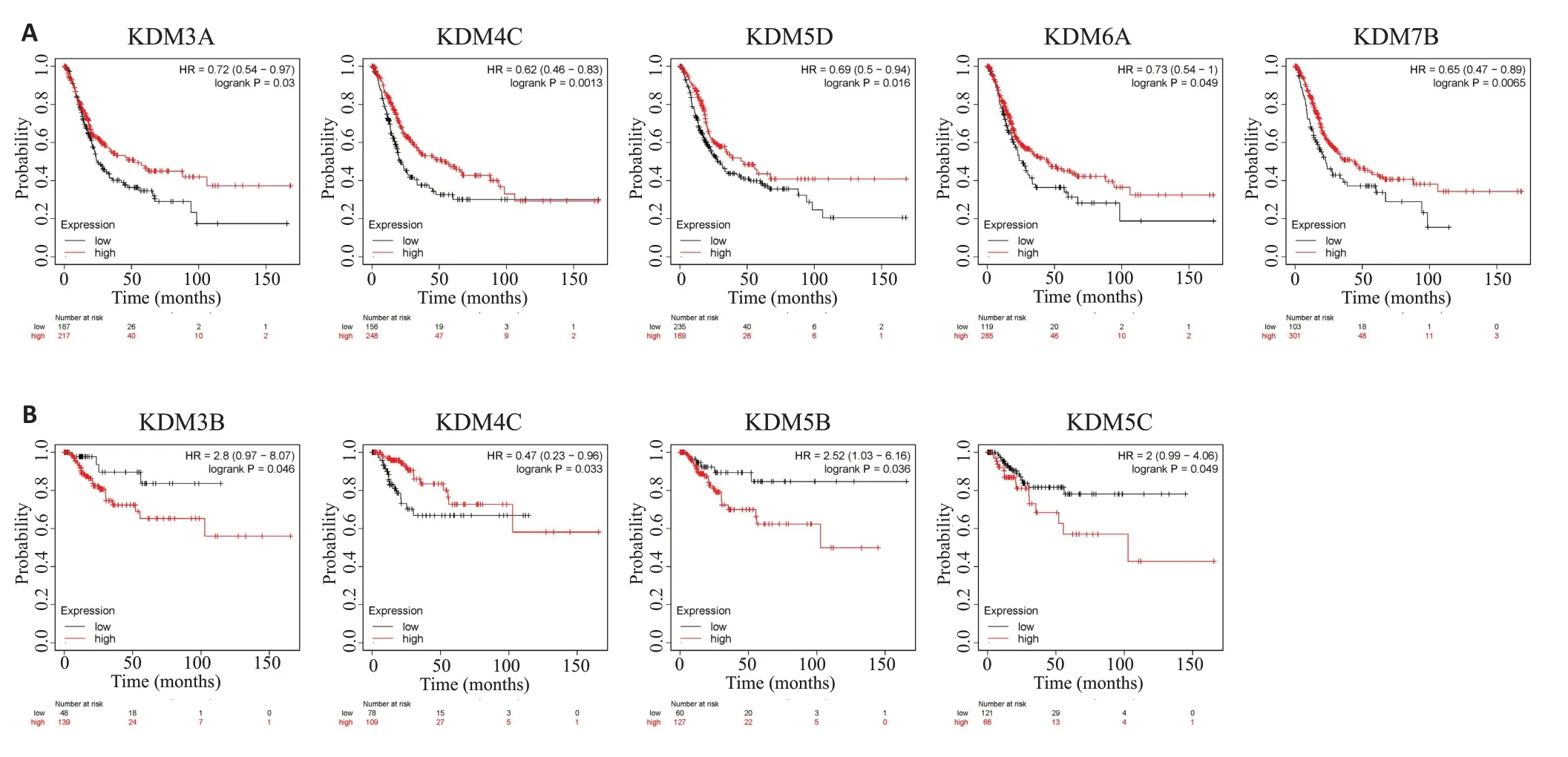
图5 KDMs在BLCA中的预后价值Fig.5 Prognostic value of KDMs in BLCA.A:OS curves for KDM3A/4C/5D/6A/7B in BLCA.B:RFS curves for KDM3B/4C/5B/5C in BLCA.
进一步分析构建的综合预后模型结果显示,KDM4C/6A/7B在BLCA患者中都是保护性基因,样本的KDM4C/6A/7B表达较低,它们的风险分数却较高(图6),预后情况较不理想。
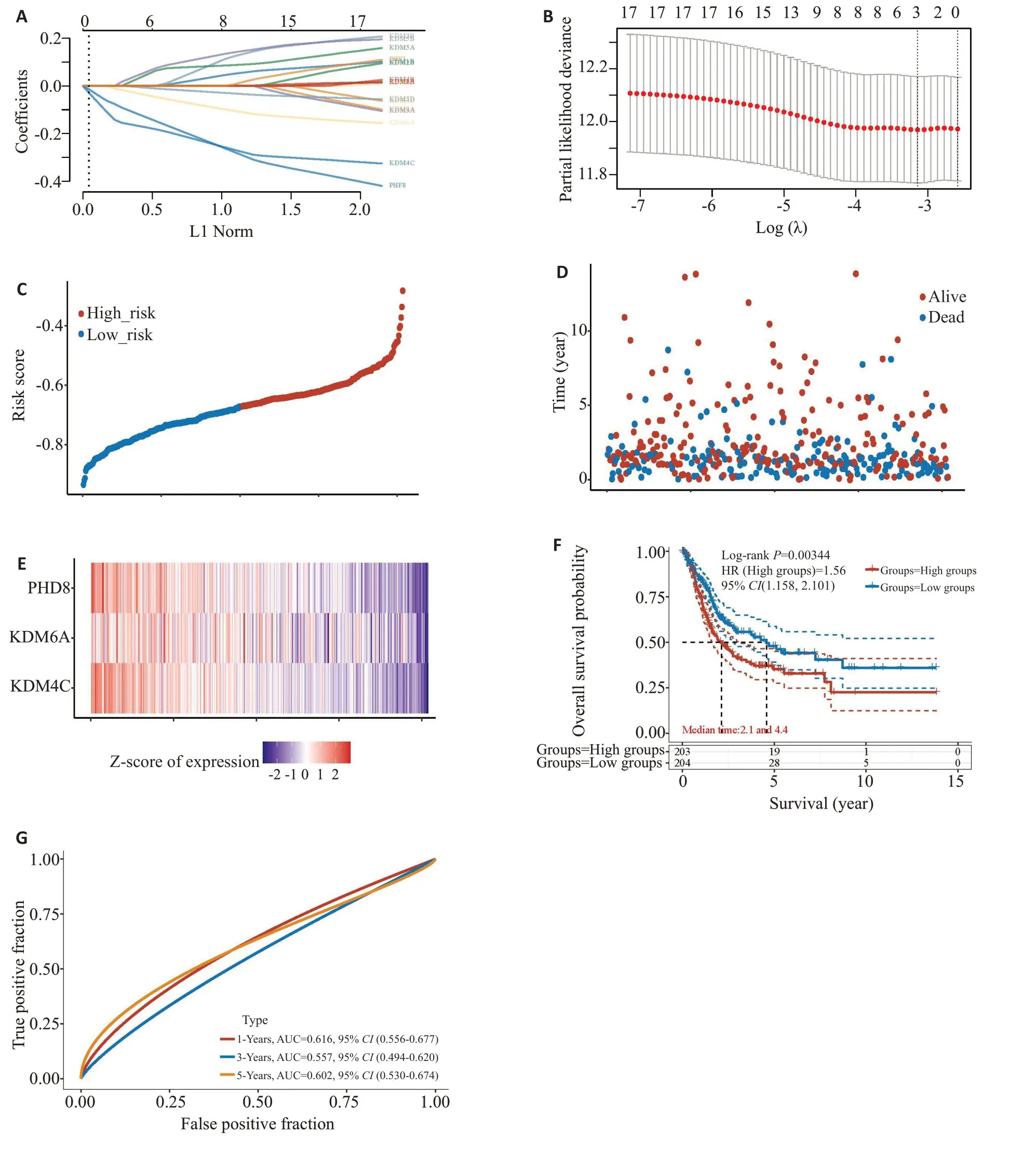
图6 KDMs在BLCA中的预后模型Fig.6 Prognostic model constructed by KDMs in BLCA.A:LASSO coefficient profiles of KDM genes.B: LASSO regression with tenfold cross-validation to obtain the prognostic genes.C:Scatter plot of risk scores.Different colors represent different risk groups.D:Scatter plot distribution of survival time and survival state corresponding to different sample risk scores.E:Expression heatmap of the 3 genes contained in the risk score model.F:Kaplan-Meier overall survival curves in high-and low-risk groups.G: ROC curves showing the efficiency of the model for predicting 1-,3-and 5-year survival rates of the patients.
2.5 KDMs在BLCA中的免疫浸润分析
免疫浸润分析结果显示,B 细胞的丰度与除KDM1A/4C/5C/5D/7C 外的大多数KDM 家族成员的表达呈正相关(表1)。CD8+细胞与KDM1B/2A/3A/4C/5A/5C/6A的表达呈正相关,与KDM4B的表达呈负相关(P<0.05)。此外,CD4+细胞的丰度与KDM2A/4C/7C的表达呈正相关,与KDM1A的表达呈负相关。巨噬细胞的丰富程度与KDM1A/2B/4A/4D/5A/5B/5C/6A/7B/7C 的表达呈正相关,中性粒细胞的丰度与KDM1B/2A/2B/3A/4C/4D/5A/5C/6A/7C 呈正相关(P<0.05)。树突细胞的丰度与KDM1B/2A/4C/4D/5A/5C/7B的表达呈正相关,与KDM4A/4B/6B的表达呈负相关(P<0.05)。
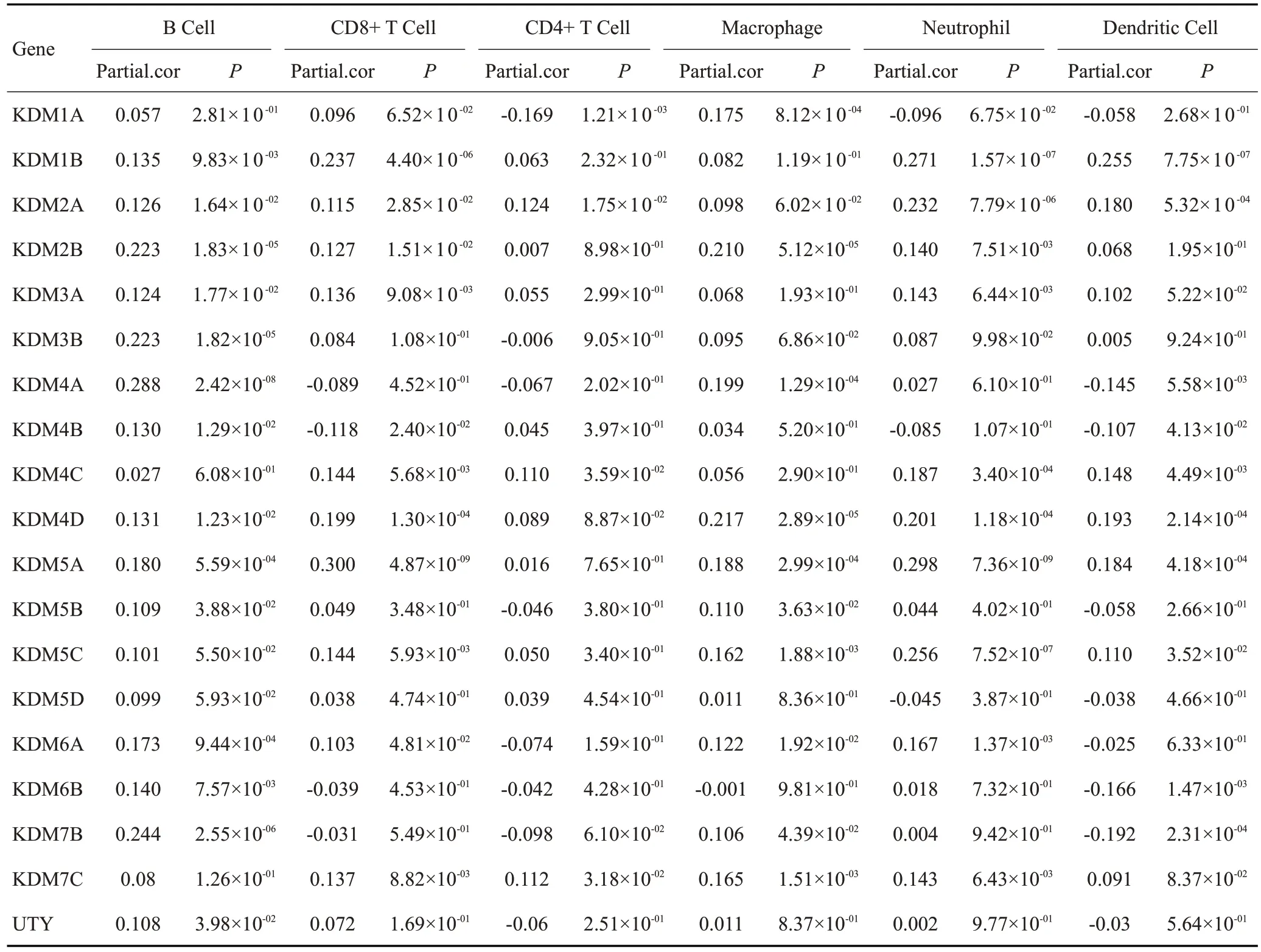
表1 KDMs在BLCA中的表达与免疫细胞丰度的相关性Table 1 Correlation between the expression of KDMs and the abundance of immune cells in BLCA
2.6 KDMs在BLCA中的药物敏感性分析
药物敏感性分析结果显示,KDM2B/3B/4B/4C/5A表达对大部分抗癌药物的敏感性呈负相关,它们在高表达的时候,对大部分抗癌药物没有耐药性(图7)。其中,KDM2B/4B表达对17-AAG(坦螺旋霉素)、多烯紫杉醇、曲美替尼、司美替尼、RDEA119(瑞法替尼)、PD-0325901(考比替尼)呈正相关,而KDMs表达分析结果显示KDM2B/4B在BLCA患者中是显著性高表达。
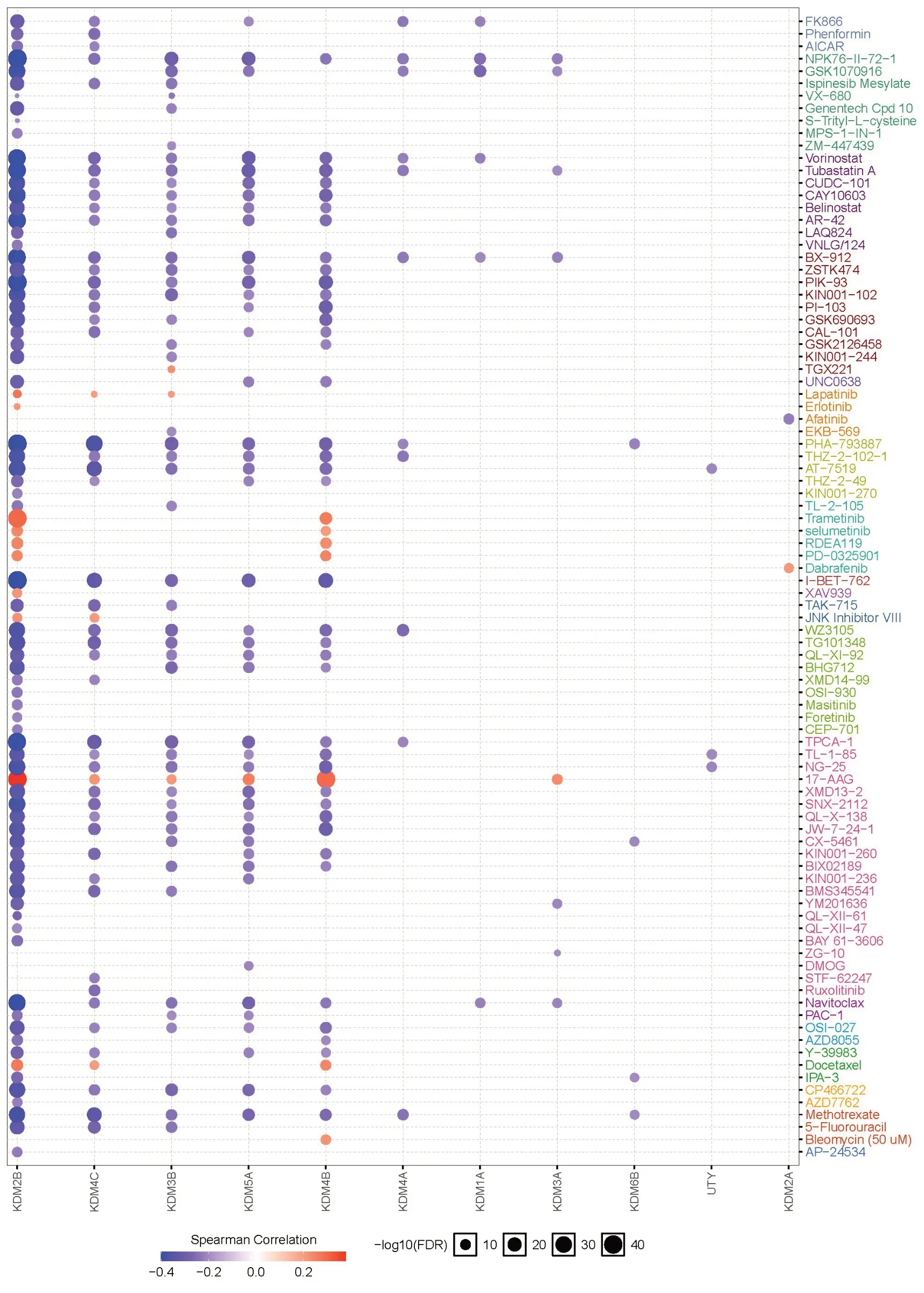
图7 KDMs药物敏感性分析中的作用Fig.7 Role of KDMs in drug sensitivity analysis.
3 讨论
KDMs是一类具有相似功能的非常重要的表观遗传酶,它们可以去除核小体组蛋白尾部赖氨酸甲基化标记,导致基因表达异常变化,进而影响肿瘤进展和治疗效果[22]。KDMs表达的改变与许多疾病呈正相关,例如肿瘤发生、神经系统疾病、炎症和免疫疾病、代谢疾病和再生疾病[6]。但是,它们在膀胱癌多组学中的表达情况及其潜在作用还不清楚。因此,本研究利用生物信息学分析方法对BLCA中KDMs的转录水平、甲基化水平、体细胞变异、生存分析、预后分析、免疫浸润情况、药物敏感性分析进行了探讨。本研究结果显示KDMs 在BLCA中的转录水平、甲基化水平、体细胞变异的整体表达模式并没有因为它们功能相似而具有一致的模式,各组学的表达模式各具特点且相互关联,并且有部分KDMs在膀胱癌中显示出预后价值影响治疗效果。
我们对KDMs在BLCA患者中的表达情况进行整体分析发现KDM1A/1B/2B/4A/4B/5B/5C在BLCA患者中表达显著上调,而KDM3B/6B/7C表达显著下调。这些基因表达的显著改变同样发生在不同肿瘤中,对肿瘤的发生发展都有着不同程度的潜在影响。在以往的研究中,KDM1A/1B已被证明在许多癌症类型中的表达都有显著性的改变,包括乳腺癌[23]、前列腺癌[24]、肝癌[25]、肺癌[26]和结直肠癌[27];KDM2B的过表达与几种癌症(例如B细胞和T细胞急性淋巴细胞白血病、乳腺癌和胰腺癌等)和精原细胞增殖受损有因果关系[28]。KDM4A/4B的过表达主要见于乳腺癌[29]、髓母细胞瘤[30]、淋巴瘤易位[31]、食道癌[32]和周围神经鞘瘤[33]。KDM5B的过度表达与肺癌、胃癌、乳腺癌、肝癌等[34]相关。
KDMs的异常转录表达可能与其DNA甲基化水平有关,这是因为DNA甲基化可通过直接抑制转录起始因子与启动子的结合,从而降低基因的表达[35]。我们进一步对KDMs的甲基化水平进行分析,发现KDM1A/3B/4A/4B/4C/5A/5B/5C/7B在BLCA患者中甲基化水平显著性降低,而KDM7C甲基化水平显著性提高。在转录水平与甲基化水平呈显著性负相关的14个KDMs中,最为显著的KDM1A是第一个被发现的组蛋白去甲基酶,其主要功能是作为转录抑制因子。有研究发现KDM1A 可以调节肿瘤细胞的代谢模式,通过增加H3K4甲基化抑制线粒体代谢酶的表达,促进葡萄糖摄取,并维持缺氧诱导的HIF-1α促进糖酵解[36]。
KDMs在BLCA中不仅在转录和甲基化水平变化明显,其在体细胞突变水平的显著变化也呈现出独特景象。KDM6A作为非同义突变频率最高、种类最多的基因与其他KDMs突变基因存在互补性,在发生KDM6A突变的BLCA样本中,其它KDMs基因却突变相对较少,而在没有发生KDM6A突变的BLCA样本中,其它KDMs基因却突变相对较多。研究表明KDM6A在多种癌症中也高度突变,包括B细胞淋巴瘤、肺鳞状细胞癌、头颈部鳞状细胞癌、胰腺癌和肾乳头状细胞癌[37],但这种高突变率并未显示出一一对应的显著表达差异。我们猜测该基因的突变位点并没有影响到基因的表达水平,亦或这种表达差异在现有的样本和分析方法中暂未被检测出来。据相关实验研究表明KDM6A的失活或缺失是膀胱癌进展的强有力的驱动因素[7]。同时,本研究结果提示除KDM6A以外的其他KDMs基因的突变对膀胱癌的影响亦不能忽视。因此,KDM6A频繁突变以及其与KDMs突变基因的互补性的识别或许有望用于膀胱癌的早期检测和治疗后疾病检测的尿液和血液检测,以及促进新的治疗方法。
以往有研究发现,KDMs的表达对肿瘤患者的预后影响似乎可以发挥双重作用[38]。同样,本研究也发现在BLCA 患者KDMs 的总生存期方面,KDM3A/4C/5D/6A/7B 具有保护性作用,而在无复发生存期方面,KDM3B/5B/5C具有危险性影响,KDM4C是保护性影响。综合预后模型进一步表明KDM4C/6A/7B可以作为膀胱癌的预后生物标志物。从上述的结果看,KDMs这个基因家族的成员在不同的肿瘤中既有保护性因素也有危险性因素,在膀胱癌中也不例外,同样显示出双重作用。值得注意的是,KDM5C/6A/7B 位于X 染色体,KDM5D位于Y染色体,这4个基因的改变都显著性的影响总生存率,并且都在性染色体上,或许这有助于解释导致膀胱癌的发生、发展和治疗过程中都表现出存在性别差异的现象。
本研究还揭示了KDMs的转录水平与免疫细胞浸润的关系,大部分的KDMs表达都与BLCA患者免疫浸润呈显著性正相关。关于KDMs家族和免疫浸润之间的联系的研究非常有限,需要更多的科学实验去探索和验证。目前有研究证明KDM1A的低表达可增强CD8+T细胞在不同肿瘤中的浸润,从而刺激T细胞免疫抑制肿瘤生长[39]。此外,KDM6A可以促进T细胞向肿瘤微环境募集,抑制肿瘤生长[40]。如果KDMs会影响免疫微环境,应用它们的抑制剂或联合免疫治疗可能更有利于膀胱癌的治疗。在进一步的药物敏感性分析中,本研究发现KDM2B/3B/4B/4C/5A与大多数抗癌药物是呈负相关的,没有耐药性;但是KDM2B/4B 与6 种抗癌药物(Tanespimycin、Docetaxel、Trametinib、Selumetinib、RDEA119、PD-0325901)呈正相关,高表达KDM2B/4B的患者对它们具有一定的耐药性。
综上所述,KDMs在膀胱癌患者中的转录水平、甲基化水平和体细胞变异这3种组学层面大部分都呈现出不同程度的变化,而且这些异常变化与免疫浸润非常密切相关,也影响着膀胱癌患者的免疫治疗以及预后。结合KDMs的研究现状,不难发现KDMs存在组织特异性。不同的KDMs家族基因在人类不同组织的表达水平不一样,所以在不同的肿瘤中KDMs的表达也存在差异,而这些差异对肿瘤的发生发展和患者的治疗产生不同程度的影响。当然,这些都还需要更多的科学实验来研究证实,为不同肿瘤患者的差异化治疗提供理论依据。
