金钱鱼孕激素受体基因的克隆、鉴定与表达研究
2022-01-26石红娟黄健旋朱晨阳吴佳钢何飞祥江东能朱春华李广丽
石红娟,黄健旋,朱晨阳,吴佳钢,何飞祥,江东能,黄 洋,朱春华,李广丽
( 1.广东海洋大学 水产学院,南海水产经济动物增养殖广东省普通高校重点实验室,广东 湛江 524088; 2.广东省名特优鱼类生殖调控与繁育工程技术研究中心,广东 湛江 524088; 3.湛江市海洋生态与养殖环境重点实验室,广东 湛江 524088 )
孕酮是一种孕激素[1],属于甾体激素(含甾体结构),在动物的生殖活动中具有重要作用,如调节性腺中生殖细胞的发育、雌性排卵、雄性排精等。孕激素主要通过其特异受体的介导来发挥其生理作用[2],目前,已知的孕激素受体包括两类:分别是膜受体(mPR)和核受体(Pgr)。其中,mPR介导的孕激素信号,不依赖基因的转录翻译过程[3];而Pgr介导经典的孕激素信号通路,依赖于下游基因的转录翻译[4]。Pgr由核受体亚家族3C组成员3(NR3C3)基因编码,隶属于核受体家族(NR)。Pgr是经典的NR家族成员,由以下5个结构域组成:不保守的N末端结构域、高度保守DNA结合结构域(DBD)、铰链区、配体结合结构域(LBD,其保守性仅次于DBD)和C末端结构域[5]。Pgr是配体活化型转录因子,能和DNA的特定序列结合,通过抑制或激活基因的转录翻译来调节动物的生命活动。
研究表明,哺乳动物Pgr在调节乳腺癌[6-7]、宫颈癌[8]、子宫内膜癌[9-10]、卵巢癌[11-13]等过程中具有重要作用。乳腺癌患者的病理特征表现为雌激素受体(ER)和Pgr阳性,利用孕激素受体阻断剂ZXH951能选择性地有效抑制Pgr阳性乳腺癌细胞[6-7]。此外,Pgr介导的孕激素信号在调控卵泡发育成熟、诱发排卵中也必不可少。在Pgr纯合敲除小鼠(Musmusculus)中,雌性卵泡正常生长,但排卵期前卵泡破裂失败,最终导致无法成功排卵和雌性不育[14-15]。近年来,核受体基因(pgr基因)相继在部分硬骨鱼类如斑马鱼(Daniorerio)、尼罗罗非鱼(Oreochromisniloticus)、大黄鱼(Larimichthyscroce)、青鳉(Oryziaslatipes)、半滑舌鳎(Cynoglossussemilaevis)、大西洋鲑(Salmonsalar)、鲤(Cyprinuscarpio)中被克隆。鱼类Pgr的功能研究表明,Pgr介导的孕激素信号在调节鱼类性腺分化、配子成熟、雌性排卵和雄性排精过程中发挥重要功能。在罗非鱼中,一方面,利用Pgr抑制剂米非司酮(RU486)处理性腺未分化的XX雌性罗非鱼,导致其卵巢分化受阻,雌、雄通路基因表达紊乱,雌激素E2水平降低,性腺雄性化[16]。而米非司酮处理未分化的XY雄性罗非鱼90 d后,导致精巢精子发生受阻,且外源孕激素成功回救[17],这些结果表明,Pgr在性腺的早期分化中具有重要功能。另一方面,在XY雄性罗非鱼纯合敲除pgr基因导致精巢的生精细胞减少、精巢细小,性腺成熟系数降低,排精量减少、精子活力降低[18]。在斑马鱼中,纯合敲除pgr基因导致雌鱼卵泡成熟后滤泡细胞破裂失败,因此排卵失败和雌性不育,但并未影响雄性的育性[19]。在鲤中,促产素处理能显著上调鲤精液、卵细胞以及受精卵中pgr mRNA的表达,暗示Pgr可能参与催产素诱导的排精和排卵反应[20]。综上所述,Pgr介导的孕激素信号在鱼类的生殖活动调控中具有重要的作用。
金钱鱼(Scatophagusargus)属鲈形目、金钱鱼属,主要分布于太平洋和印度洋,是我国东南沿海地区重要的经济鱼类。除了具有观赏价值外,金钱鱼肉质鲜嫩,富含多种营养物质,可为人体提供多种不饱和脂肪酸[21],因此深受消费者的喜爱。此外,金钱鱼食性广,适应性和抗病抗逆性强[22]。在金钱鱼人工养殖过程中,雌、雄鱼性腺发育不同步,卵泡不能充分发育成熟,需要施加适量催产素进行催产[23-24]。因此,笔者开展了金钱鱼pgr基因克隆、组织表达以及性腺发育过程中的表达模式研究,有助于深入探索金钱鱼的卵泡成熟和排卵机制,并为金钱鱼的人工养殖和催产奠定理论基础。
1 材料与方法
1.1 试验动物
试验所用金钱鱼购自湛江市东风水产批发市场,雌、雄成鱼各3尾,体质量260~310 g,体长19.5~22.4 cm。麻醉后,解剖,取下丘脑、垂体、鳃、肝脏、肠、肾脏、肌肉、精巢、卵巢等各组织,将其放入液氮中,操作结束后转移至-80 ℃保存,用于提取各组织RNA,进行基因克隆、基因表达分析等试验。不同性腺发育时期的金钱鱼样本均取自广东海洋大学东海岛生物研究基地,各期的雌、雄鱼各6尾,麻醉后,解剖,取卵巢和精巢样品,所有样品取2份。其中1份用于提取RNA,液氮中速冻后-80 ℃保存;1份置于波恩氏液过夜固定,用于组织学切片确定性腺发育时期,具体方法参照文献[25]。
1.2 提取总RNA和反转录合成cDNA
按照Trizol试剂盒(Invitrogen, 15596108,美国)说明书提取各组织和不同发育时期精巢、卵巢的总RNA[11]。取1 μL总RNA用于1%的琼脂糖凝胶电泳检测,另取1 μL总RNA,利用Nanodrop 2000超微量核酸蛋白测定仪(Thermo Scientific, 美国)测定浓度和质量,其余总RNA置于-80 ℃保存,备用。
分别取1 μg金钱鱼各组织和不同发育时期性腺样品总RNA,按照 PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒(TaKaRa, RR047A,日本)说明书反转录合成cDNA。
1.3 金钱鱼pgr基因的克隆和序列分析
从美国国立生物技术信息中心数据库中下载多个不同物种的pgr基因序列:如金头鲷(Sparusaurata)、大黄鱼、高体(Serioladumerili)、尼罗罗非鱼、青鳉和斑马鱼等。在实验室金钱鱼性腺转录组数据库中进行生物信息学分析和序列比对,分离金钱鱼pgr基因转录本。基于此设计引物,并委托生工生物工程(上海)股份有限公司合成,引物序列见表1。使用2× PCR Mix(东盛生物科技公司)进行基因扩增。PCR反应程序为:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,35个循环;72 ℃延伸10 min。使用含16 mg/mL的琼脂糖凝胶电泳检测PCR产物。将目的片段用DNA凝胶回收试剂盒(N1072,东盛生物科技公司)进行纯化。将纯化的片段连接到Peasy-T3载体(CT301,北京全式金生物技术有限公司)中进行亚克隆,将连接的产物转化到大肠杆菌(Escherichiacoli)DH5α感受态细胞中,并在含有氨苄青霉素的固体培养基中于37 ℃培养10~12 h,挑选克隆,经菌落PCR验证后,将筛选阳性克隆,送至生工生物工程(上海)股份有限公司测序。
利用美国国立生物技术信息中心在线预测金钱鱼pgr基因的开放阅读框(ORF)和蛋白序列。利用Lasergene 7.1.0软件包进行多重比对蛋白质序列和分析同源性。使用ClustalX 1.83和MEGA 6.0软件,并用邻接方法构建系统发育树。
1.4 反转录PCR(RT-PCR)
采用RT-PCR检测pgr基因在雌、雄金钱鱼各组织中的表达,金钱鱼β-actin作为内参基因。使用2× PCR MIX(东盛生物科技公司)进行PCR基因扩增,在PCR仪C1000TMTherm Cycler(BioRad,美国)上进行,设定程序如下:94 ℃预变性3 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,32个循环;72 ℃延伸10 min。使用2%琼脂糖凝胶电泳,再利用凝胶成像分析系统,分析条带并调节亮度,拍照,保存图片,进行分析。试验所用引物见表1。
1.5 实时荧光定量PCR(qRT-PCR)
采用qRT-PCR检测金钱鱼pgr基因在不同发育时期精巢和卵巢中的表达水平。反应在实时荧光定量PCR仪(Roche,瑞士)中进行,根据试剂盒说明书进行操作。反应体系(20 μL):两个引物各0.8 μL;cDNA模板2 μL,无菌水16.4 μL。设定程序为:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火10 s,72 ℃延伸15 s,40个循环;72 ℃延伸10 min。β-actin为内参基因。运用2-ΔΔCt方法计算pgr基因相对表达量。数据表示为平均值±标准差,6个生物学重复。采用SPSS 18.0进行单因素方差分析和Duncan多重比较,检验的显著性概率临界值为0.05。试验所用引物见表1。

表1 试验所使用的引物Tab.1 Primers used in the present study
2 结果与分析
2.1 金钱鱼pgr cDNA克隆和序列分析
金钱鱼pgr基因的开放阅读框(ORF)长度为2016 bp,共编码671个氨基酸,其编码的第302~373个氨基酸构成锌指C4型结构域,第458~622个氨基酸组成HOLI结构域(图1)。

图1 金钱鱼pgr基因开放阅读框序列Fig.1 Open reading frame sequence of pgr gene in spotted scat S. argus 第一部分红色标记部分氨基酸为锌指C4型结构域;第二部分红色标记部分氨基酸为HOLI结构域.The amino acid in the first part marked by red is zinc finger C4 type domain; in the second part, the amino acid marked by red is the HOLI domain.
2.2 金钱鱼Pgr氨基酸序列比对
序列比对结果显示,不同物种Pgr N末端氨基酸序列的保守性较差、高度可变,而DNA结合结构域保守性较高,其配体结合结构域和C末端氨基酸序列在不同物种间高度保守(图2)。
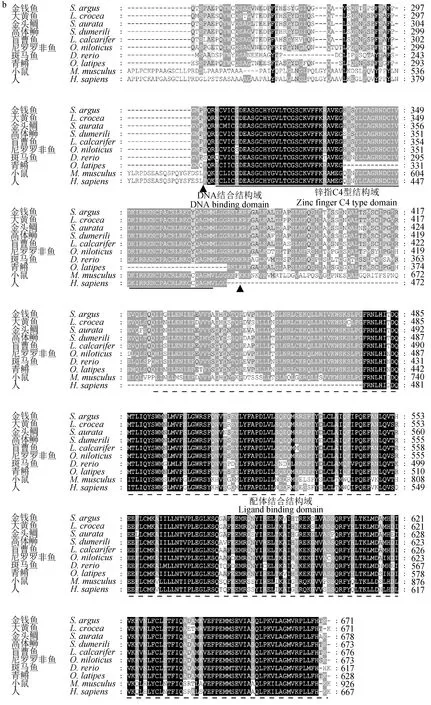
图2 金钱鱼Pgr与其他脊椎动物的氨基酸序列比对Fig.2 Comparison of pgr amino acid sequences between spotted scat S. argus and other vertebrates虚线所标记的序列为金钱鱼Pgr的配体结合结构域;实线所标记的序列为金钱鱼Pgr的锌指C4型结构域;▲所标记的序列为金钱鱼Pgr的DNA结合结构域. Ligand binding domain of spotted scat S. argus Pgr sequence is marked by the dotted line, Zinc finger C4 type domain is marked by the solid line and ▲ indicates the DNA binding domain.
2.3 金钱鱼pgr基因同源性分析及系统进化树分析
pgr基因同源性分析结果显示,在硬骨鱼类中,金钱鱼与大黄鱼同源性最高,为86.8%。其次,与金头鲷、高体、盲曹鱼(L.calcarifer)、尼罗罗非鱼和青鳉同源性分别为86.1%、85.6%、85.5%、78.8%和76.4%。而与斑马鱼的同源性较低,仅为61.6%。与哺乳类人和鼠的同源性分别为43.9%和42.8%(表2)。

表2 金钱鱼Pgr与其他物种的氨基酸序列相似性分析
与序列同源性分析结果相一致,根据邻位相连法构建的Pgr系统进化树结果显示,金钱鱼与同为鲈形目的大黄鱼、金头鲷、高体、盲曹鱼等同属一个分支,且具有较高同源性,而与另一分支的哺乳动物人和鼠的同源性较低(图3)。

图3 邻接法构建金钱鱼等脊椎动物Pgr系统进化树Fig.3 The phylogenetic tree constructed by neighboring-joining method of the Pgr of spotted scat S. argus and other vertebrates登录号:XP_010737027.1 金钱鱼;AFV61589.1 金头鲷;XP_010738016.2 大黄鱼;XP_022617230.1 高体;XP_018521030.1 盲曹鱼;XP_017271946.1 斑纹隐小鳉;XP_020490515.1 贝氏隆头鱼;AIE56465.1 尼罗罗非鱼;NP_001165515.1 青鳉;ALL41462.1 中华乌塘鳢;NP_001159807.1 斑马鱼;AAQ96833.1 人;NP_032855.2 鼠.Accession number:XP_010737027.1 S. argus; AFV61589.1 S. aurata; XP_010738016.2 L. crocea; XP_022617230.1 S. dumerili; XP_018521030.1 L. calcarifer; XP_017271946.1 Kryptolebias marmoratus; XP_020490515.1 Labrus bergylta; AIE56465.1 O. niloticus; NP_001165515.1 O. latipes; ALL41462.1 Bostrychus sinensis; NP_001159807.1 D. rerio; AAQ96833.1 H. sapiens; NP_032855.2 M. musculus.
2.4 金钱鱼pgr基因组织分布
组织分布结果显示,pgr基因在雌、雄金钱鱼各组织中均有表达。在雌鱼中,pgr基因在肠、卵巢、垂体和下丘脑中的表达量较高,而在心脏、肝脏、肾脏等组织有微弱表达;在雄鱼中,pgr基因主要在精巢、垂体和鳃中表达,在心脏、肝脏、肾脏等组织中表达量较低(图4)。
2.5 qRT-PCR检测金钱鱼pgr mRNA在不同发育时期性腺中的表达
组织学结果显示,在Ⅱ期卵巢中,生殖细胞以Ⅱ时相卵母细胞为主;在Ⅲ期卵巢中,生殖细胞以Ⅲ时相卵母细胞为主,此时卵母细胞中开始累积脂滴;在Ⅳ期卵巢中,生殖细胞以Ⅳ时相卵母细胞为主,且卵母细胞中积累了大量的卵黄颗粒和脂滴,趋于成熟(图5a~c)。在Ⅲ期精巢中,生殖细胞以次级精母细胞为主、开始出现精细胞;在Ⅳ期精巢中,除了次级精母细胞、精细胞外,在精小叶中充有大量的精子;在Ⅴ期精巢中,输精管中充满大量成熟的精子(图5d~f)。

图5 不同发育时期的金钱鱼性腺组织学观察Fig.5 Histological analysis of gonads in spotted scat S. argus at different developmental stagesa~c.卵巢组织学观察; Ⅱ~Ⅳ.Ⅱ~Ⅳ时相卵母细胞; LD.脂滴(▲); YG.卵黄颗粒(▲); d~f.精巢组织学观察; SSC.次级精母细胞(黄色虚线内); SPT.精细胞(黄色虚线内); SPZ.精子; ED.输精管.a—c.histological observation of the ovary. Ⅱ—Ⅳ.oocytes in phase Ⅱ—Ⅳ; LD.lipid drops(▲); YG.yolk granules(▲); d—f.histological observation of the testes; SSC.secondary spermatocytes (yellow dotted line); SPT.spermtids (yellow dotted line); SPZ. spermatozoa; ED.efferent ducts.
qRT-PCR结果显示,在雌鱼Ⅱ、Ⅲ期卵巢中pgr mRNA的表达无显著差异,Ⅳ期卵巢中其表达显著升高;雄鱼精巢中的pgr mRNA的表达量显著高于雌鱼各期卵巢,且在Ⅲ、Ⅳ和Ⅴ期精巢中持续高表达,在Ⅳ期精巢中表达最高,随后降低(P<0.05)(图6)。

图6 pgr mRNA在不同发育时期的金钱鱼性腺中的表达Fig.6 Expression levels of pgr mRNA in the gonads of spotted scat S. argus at different developmental stages数值为6尾金钱鱼性腺样本的平均值±标准差;误差线上的不同字母表示pgr基因在卵巢、精巢中的表达水平有显著差异(P<0.05),利用单因素方差分析进行差异分析;β-actin为内参基因.Data from six gonadal samples of S. argus are presented as mean±standard deviation (SD); different letters above the error bars indicate that the expression level of pgr gene in ovaries and testis is difference at 0.05 level determined by one-way analysis of variance (ANOVA); β-actin is the reference gene.
2.6 雌激素E2上调金钱鱼垂体中pgr基因的表达
基于前期开展了雌、雄金钱鱼活体注射外源雌激素E2[26],6 h后,转录组和qRT-PCR结果显示,与对照组相比,外源雌激素E2能显著升高雌、雄金钱鱼垂体中pgr基因的表达(P<0.05)(图7)。
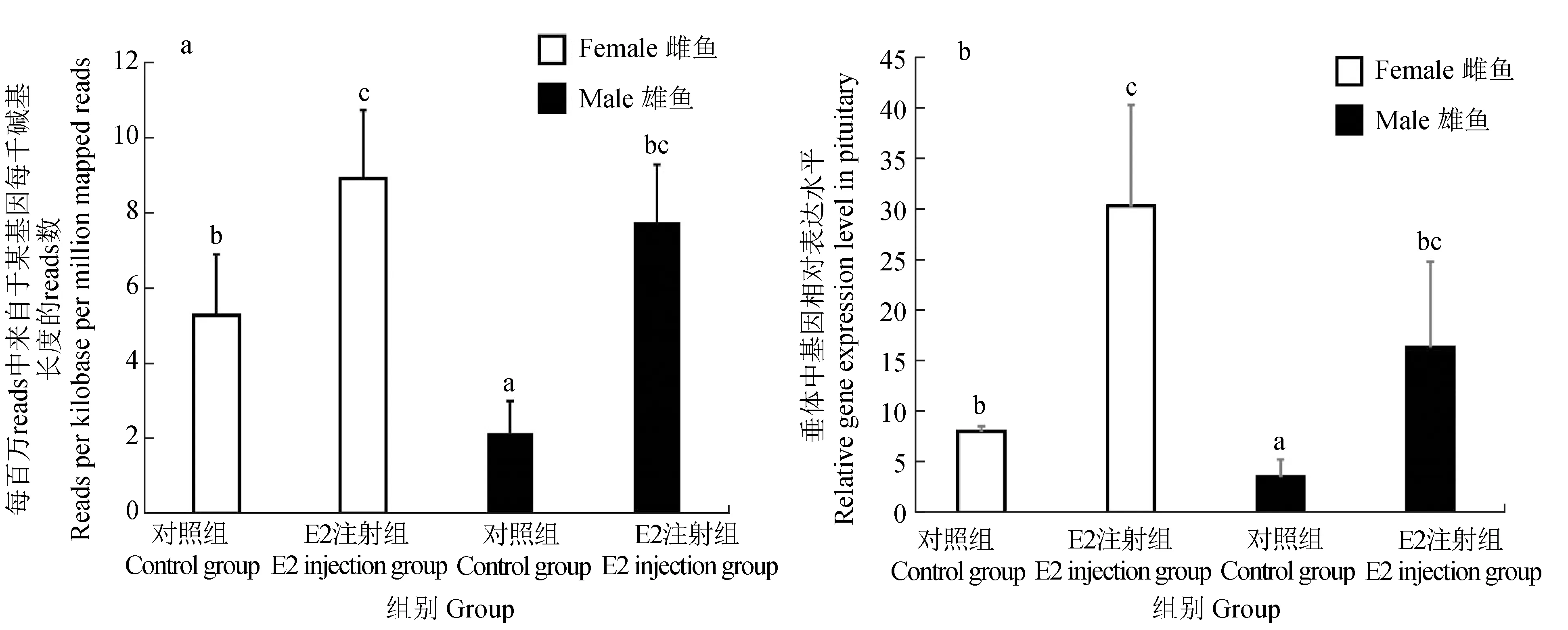
图7 雌激素E2对pgr mRNA在金钱鱼垂体中表达的影响Fig.7 Effects of E2-injection on pgr mRNA expression in the pituitary of spotted scat S. argusa.转录组(n=3); b.qRT-PCR结果(n=5);数值为金钱鱼垂体样本中pgr基因表达水平的平均值±标准差.误差线上的不同字母表示pgr基因在处理组和对照组垂体中的表达有显著差异(P<0.05),利用单因素方差分析进行差异分析; β-actin为内参基因.a.transcriptome data (n=3); b.qRT-PCR results (n=5); data from pgr gene expression level in pituitary samples of S.argus are presented as mean ± standard deviation (SD). Different letters above the error bars indicate that the expression level of pgr gene in treatment groups and control group in the pituitaries is difference at 0.05 level determined by one-way analysis of variance (ANOVA); β-actin is the reference gene.
3 讨 论
3.1 金钱鱼pgr cDNA克隆与生物信息学分析
金钱鱼pgr开放阅读框(ORF)长度为2016 bp,起始密码子为ATG,终止密码子为TGA,共编码671个氨基酸。其中,第301~378个氨基酸为DNA结合结构域,304~371个氨基酸构成锌指C4型结构域。它是DNA结合结构域的重要组成部分,是重要的转录调控区,广泛参与调节机体生理功能。此外,第424~671个氨基酸为配体结合结构域,其在不同物种间高度保守,且具有识别配体作用[4-5]。根据邻位相连法构建Pgr的系统进化树,同时进行氨基酸序列同源性分析,结果显示,金钱鱼Pgr与同为鲈形目、同属一支的大黄鱼、金头鲷、高体、盲曹鱼等鱼类同源性较高,为85.5%~86.8%,而与同属鲈形目的斑马鱼同源性较低,仅为61.6%。这主要是因为斑马鱼和其他鱼类的Pgr蛋白氨基酸序列存在较大差异。研究发现,虽然斑马鱼和其他脊椎动物Pgr蛋白的DNA结合结构域和配体结合结构域高度保守,同源性分别为83.3%~97.2%和65.3%~83.2%,但是,斑马鱼Pgr蛋白N末端的氨基酸序列高度可变,且为截断型,与其他脊椎动物的同源性仅为7.1%~23.9%,这导致斑马鱼与其他物种的同源性为43.6%~66.3%[27-28]。
3.2 金钱鱼pgr基因的表达模式与功能
组织分布结果显示,金钱鱼pgr mRNA在各组织呈泛表达模式,其中,pgr mRNA在卵巢、精巢、垂体和脾脏中高表达,在肠、鳃中的表达具有性别二态性,在心脏、肝脏、肾脏等其余组织中有微弱表达。在鲤中,成功克隆到2个pgr基因,分别命名为pgr1和pgr2。两种pgr基因的表达分析发现,pgr1基因和pgr2基因在各组织也呈现泛表达模式,其中,pgr1基因和pgr2基因在精巢、卵巢、脾脏、肌肉中高表达,在肠、肝脏、心脏、肾脏和皮肤中表达相对较低[20]。鱼类pgr基因的泛表达模式暗示,Pgr可能在多种组织中介导孕激素信号发挥其重要的生理功能。
Pgr属于配体激活的核转录因子,是核受体超家族中的一员。pgr基因表达除了受特异配体孕激素的调控外,还受到其他性类固醇激素如雌激素、雄激素的调控。在金钱鱼中,qRT-PCR和转录组结果表明,在体注射外源雌激素E2能显著上调雌、雄鱼垂体中pgr mRNA的表达。此外,前期研究发现,随着金钱鱼性腺发育,雌鱼血清中的雌激素E2和雄鱼血清中的雄激素11-KT水平逐渐升高[29],与此相一致,pgr mRNA在精巢、卵巢中的表达也逐渐升高。在金头鲷中,研究发现雄激素11-KT能显著上调精巢Sertoli细胞中pgr基因的表达。同样,雌激素E2离体孵育也能显著上调精巢Sertoli细胞和间质细胞中pgr基因的表达[30]。在金头鲷中,利用人胚胎肾细胞293进行双荧光素酶报告基因检测,结果显示,雌激素E2能剂量依赖地激活pgr基因的转录[31]。
近年来,硬骨鱼类Pgr的功能研究主要集中在精、卵巢中,在其他组织中的功能尚不清楚,有待阐明。在雌鱼卵巢中,Pgr主要参与早期卵母细胞的初级生长、卵母细胞成熟以及成熟后排卵。在雄性精巢中,Pgr主要调控精原细胞增殖和精子发生过程中生精细胞的发育[29]。此外,Pgr在雄鱼排精中也具有重要作用[18]。在金钱鱼中,pgr mRNA在早期精巢、卵巢中表达,配子成熟期达到最高值。这与Pgr在鱼类性腺发育过程中调控配子发生及成熟的功能相符合[16-19, 31-34]。在两栖类中,Pgr参与调控卵母细胞的成熟,注射pgr mRNA能显著提高卵母细胞响应孕激素的灵敏度和促进孕激素刺激下卵泡的成熟。相反,利用反义寡核苷酸抑制pgr基因的表达,则会阻滞部分卵母细胞的生发泡破裂[35-36]。在哺乳类中,Pgr在调控卵泡发育成熟、诱发排卵中也具有重要作用。在小鼠中,敲除pgr基因导致雌性小鼠排卵前卵泡无法破裂,进而导致排卵失败和雌性不育[14-15]。在猪中,利用卵泡刺激素和黄体生成刺激卵丘—卵复合物,pgr基因表达显著升高,进而影响卵丘细胞的增大和卵母细胞第二次减数分裂起始[37]。
此外,在斑马鱼、金钱鱼等硬骨鱼类的脑中,pgr mRNA呈现高表达。研究发现,在成年斑马鱼的端脑、视前叶、下丘脑腹侧和后隐窝等均检测到pgr mRNA的表达[38],暗示Pgr可能也参与鱼类脑的发育调控。对大鼠研究发现,Pgr参与调节新生大鼠的吸气神经元放电,介导海马体和大脑皮质中孕激素的核途径起到抗痫作用[39-40]。在人类,Pgr可能在星形细胞瘤向恶性转化及恶性生长过程中具有重要作用[41]。此外,在金钱鱼、鲤鱼的肝脏、肠等组织中检测到pgr mRNA的表达[20],然而其功能尚不清楚。研究发现,在大肠癌和肝门部胆管癌患者癌细胞中,pgr基因的高表达率有望成为检测癌症恶性程度的生物学指标之一[42-43]。在结直肠癌患者,虽然无法将pgr基因的表达作为结直肠癌恶性程度的指标,但癌症组织中pgr基因的表达高于正常组织[44]。这些结果说明,pgr基因表达与肝脏、肠等组织的正常生理活动密切相关。综上所述,Pgr除参与调控脊椎动物的生殖活动外,在脑、肝脏和肠等多种组织中具有重要的生理功能。
4 结 论
金钱鱼是我国东南沿海重要的经济品种,环境适应性和抗病抗逆性极强[7]。不仅具有观赏价值而且具有很高的食用价值。笔者克隆了金钱鱼pgr基因并分析了其表达模式,金钱鱼pgr mRNA在各组织中呈现泛表达,其中,在性腺和垂体中高表达。在不同发育时期性腺中,pgr mRNA的表达逐渐升高,性成熟时达到最高值,因此,Pgr可能参与调控金钱鱼性腺中生殖细胞发育成熟。这对研究金钱鱼性腺中Pgr的生理功能和指导配子发生具有一定的参考价值。
