急性氨氮胁迫和恢复后中华条颈龟主要器官组织结构的变化
2022-01-26黄祖彬梁龄月李维昊洪美玲
黄祖彬,梁龄月,李维昊,李 娜,丁 利,洪美玲
( 海南师范大学 生命科学学院,热带岛屿生态学教育部重点实验室,海南省热带动植物生态学重点实验室,海南 海口 571158 )
龟鳖养殖在21世纪初发展迅猛,大型养殖户及水产养殖专业合作社等各种养殖模式在国内快速发展,形成了多样化、规模化、数量集约化的产业模式[1]。中华草龟(Mauremysreevesii)与中华条颈龟(M.sinensis)是目前我国养殖产量较高的经济龟类[2],据不完全统计,目前在我国人工养殖的中华条颈龟约有6000万只,产量约3万 t[2]。但随着养殖规模的扩大、养殖密度的增加、养殖环境污染的加重,环境胁迫对养殖龟鳖健康的危害加剧,这严重制约了龟鳖养殖业的发展。
氨氮是水产养殖过程中最主要的环境污染物之一,主要来源于未消耗的饲料、粪便等有机废弃物的矿化过程[3-4]。氨氮在水体中通常以非离子氨(NH3)和离子氨(NH4+)的形式存在。非离子氨是氨氮毒性的主要来源,具有较高的脂溶性,极易穿透细胞膜,导致其在水产动物体内过度积累,使水产动物出现生长减缓、免疫系统被抑制和死亡率高[5-6]等情况。在高密度集约化养殖中,特别是当水的交换受到限制时,水中的氨氮会逐渐积累,导致水产动物受到持续性的氨氮胁迫,甚至水体中的氨氮含量可能会在短时间内急剧升高,从而对水产动物造成急性氨氮胁迫损伤[7-8]。
高浓度的非离子氨进入水生动物体内,可导致机体的组织器官受损。目前国内外关于氨氮胁迫对水生动物组织结构影响的报道多集中在鱼类、甲壳类和头足类,如尼罗罗非鱼(Oreochromisniloticus)[6]、虎斑乌贼(Sepiapharaonis)[9]、团头鲂(Megalobramaamblycephala)[10]、日本蟳(Charybdisjaponica)[11]、淇河鲫(Carassiusauratus)[12]、中华绒螯蟹(Eriocheirsinensis)[13]等。然而氨氮胁迫对水生龟类组织结构的影响尚未见报道。笔者通过观察急性氨氮胁迫对中华条颈龟脑、肝脏、心脏、肾脏和脾脏的组织结构影响以及胁迫后的恢复情况,揭示氨氮胁迫对中华条颈龟主要器官组织结构的影响程度及胁迫后各器官的恢复能力,以期评估环境水体污染对养殖龟类的危害。
1 材料与方法
1.1 试验动物和饲养条件
本试验在海南师范大学生命科学学院龟鳖养殖室进行。试验所用的中华条颈龟购自海口泓旺农业养殖有限公司。试验前,将体型较统一、活力好、健康的1龄个体[体质量(218.26±12.65) g],暂养2周以适应养殖室环境。暂养期间每周投喂2次,每日更换养殖用水,养殖水体pH 7.45±0.26,溶解氧(8.40±0.31) mg/L。正式试验时,分为胁迫前(自来水)和试验组(氨氮质量浓度200 mg/L),每组36只,分别在胁迫前、胁迫24 h、胁迫48 h和胁迫48 h后放入自来水中恢复48 h,在 4个时间点取样。采用氯化铵每日测定和调整总氨氮质量浓度为200 mg/L。试验期间停止投喂。
1.2 取样及固定
取中华条颈龟脑、肝脏、心脏、肾脏和脾脏,用0.01 mol/L磷酸缓冲盐溶液漂洗后放入多聚甲醛中固定。
1.3 苏木精—伊红染色
常规石蜡包埋、切片(厚度5 μm),50 ℃烘片,二甲苯脱蜡2次,并在连续的梯度乙醇(无水乙醇Ⅰ、无水乙醇Ⅱ、75%乙醇)中进行水合。脱蜡水合结束后用苏木精—伊红染色,中性树脂封片,光学显微镜(Nikon Eclipse E100)下观察和拍照。
2 结 果
2.1 氨氮胁迫对中华条颈龟脑组织结构的影响
氨氮胁迫前中华条颈龟脑结构完整,神经元、神经胶质细胞清晰可见(图1a);氨氮胁迫24 h脑组织间质增宽,少部分神经元出现核偏位现象(图1b);胁迫48 h部分神经元出现肿胀,细胞核偏位现象增加,部分细胞核溶解,仅剩细胞核轮廓,神经元变性、坏死,神经间质增宽、疏松(图1c);恢复48 h后神经间质增宽现象依旧存在,但神经元肿胀与细胞核偏位现象有所减少(图1d)。
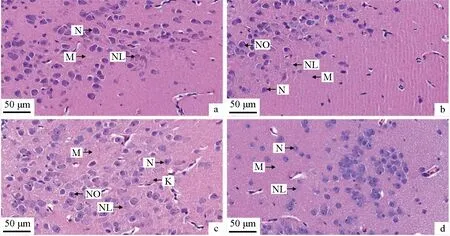
图1 氨氮胁迫对中华条颈龟脑组织结构的影响Fig.1 Effects of ammonia stress on histological brain structure of Chinese striped-necked turtle M. sinensisa.胁迫前; b.胁迫24 h; c.胁迫48 h; d.恢复48 h; 标尺为50 μm; N.神经细胞; NL.神经胶质细胞; M.神经组织间质; NO.核偏位; K.核溶解.a.before ammonia stress; b.ammonia stress for 24 h; c.ammonia stress for 48 h; d.48 hours of recovery; bar=50 μm; N.nerve cell; NL.neurogliocyte; M.mesenchyme in neural tissue; NO.nuclear offset; K.karyolysis.
2.2 氨氮胁迫对中华条颈龟肝脏组织结构的影响
氨氮胁迫前中华条颈龟肝脏中肝细胞和中央静脉清晰可见且结构完整,肝血窦中分布有少量的色素细胞(图2a);氨氮胁迫24 h少部分肝细胞出现体积增大、颗粒变性、水泡变性等病理现象(图2b);胁迫48 h肝细胞肿胀现象增多,颗粒变性及水泡变性更为严重,肝血窦缩小甚至消失,部分肝细胞核溶解甚至消失(图2c);恢复48 h后肝血窦基本恢复到胁迫前水平,肝细胞肿胀减少,但颗粒变性、水泡变性现象依旧存在(图2d)。
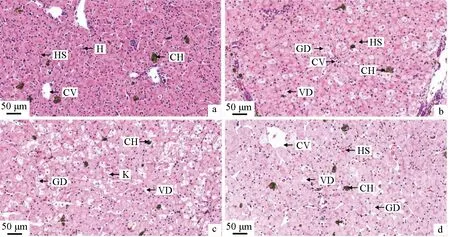
图2 氨氮胁迫对中华条颈龟肝脏组织结构的影响Fig.2 Effects of ammonia stress on histological liver structure of Chinese striped-necked turtle M. sinensisa.胁迫前; b.胁迫24 h; c.胁迫48 h; d.恢复48 h; 标尺为50 μm; H.肝细胞; HS.肝血窦; CH.色素细胞; CV.中央静脉; GD.颗粒变性; VD.水泡变性; K.核溶解.a.before ammonia stress; b.ammonia stress for 24 h; c.ammonia stress for 48 h; d.48 hours of recovery; bar=50 μm; H.hepatocytes; HS.hepaticsinusoid; CH.chromatophore; CV.central veins; GD.granular degeneration; VD.vesicular degeneration; K.karyolysis.
2.3 氨氮胁迫对中华条颈龟心脏组织结构的影响
氨氮胁迫前中华条颈龟心脏组织结构完整,可见心室肌细胞分支、椭圆形的心肌细胞核等结构(图3a);氨氮胁迫24 h心肌细胞间隙增宽,间质血管充血(图3b);胁迫48 h心肌细胞间隙持续增宽,间质血管扩张、充血更为严重(图3c);恢复48 h后心肌细胞间隙缩小趋于胁迫前水平,充血现象消失(图3d)。
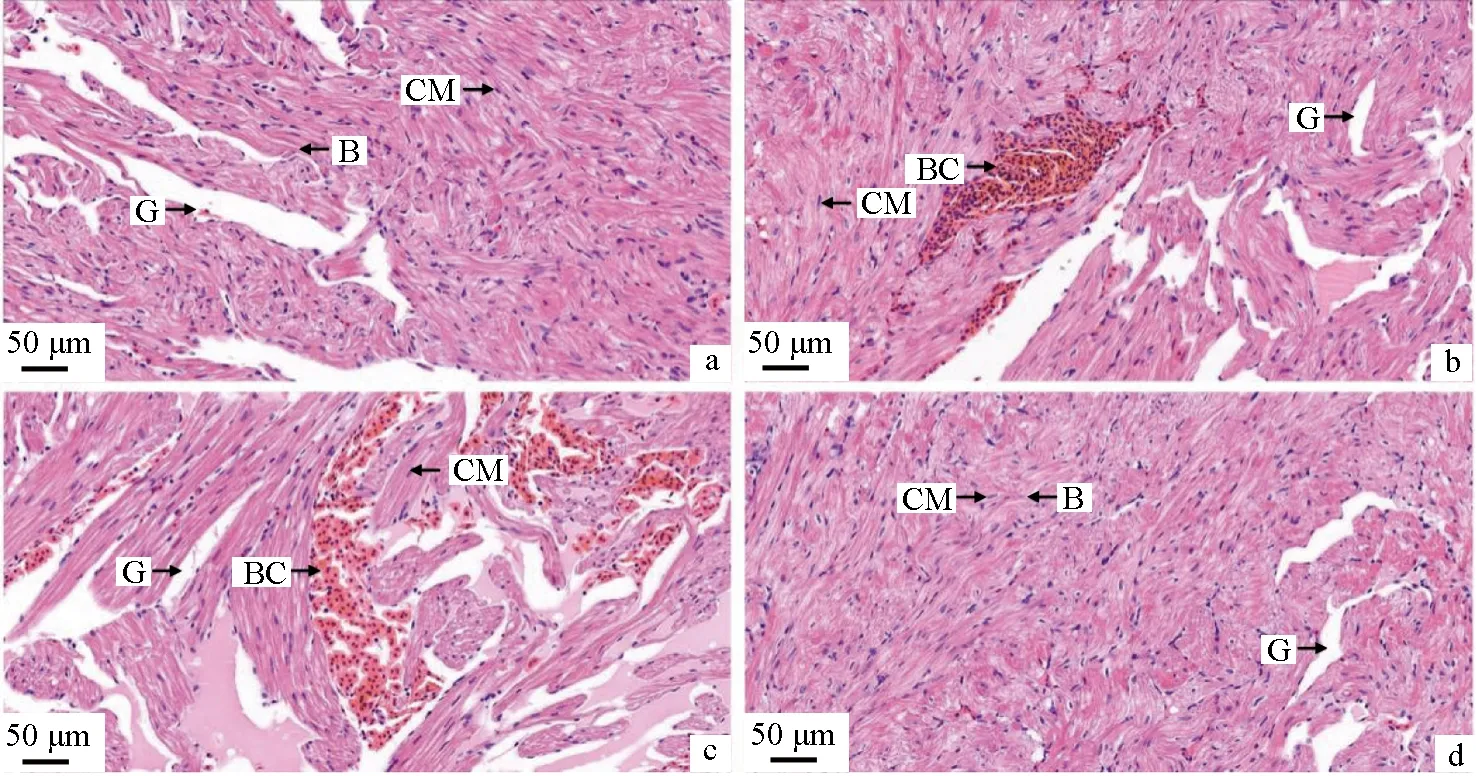
图3 氨氮胁迫对中华条颈龟心脏组织结构的影响Fig.3 Effects of ammonia stress on histological heart structure of Chinese striped-necked turtle M. sinensisa.胁迫前; b.胁迫24 h; c.胁迫48 h; d.恢复48 h; 标尺为50 μm; CM.心肌细胞; G.间隙血管; B.心肌细胞分支; BC.血细胞.a.before ammonia stress; b.ammonia stress for 24 h; c.ammonia stress for 48 h; d.48 hours of recovery; bar=50 μm; CM.cardiac muscle cell; G.interstitial blood vessel; B.branch of cardiomyocytes; BC.blood cell.
2.4 氨氮胁迫对中华条颈龟肾脏组织结构的影响
氨氮胁迫前中华条颈龟肾脏组织的肾小管和肾小体均完整正常(图4a);氨氮胁迫24 h肾小球体积增大,肾小球毛细血管网扩张,肾小管管腔缩小,肾小管上皮细胞发生颗粒变性,细胞膜破裂,管腔内出现红染物质,间质中有少量炎性细胞浸润(图4b);胁迫48 h肾小管上皮细胞轮廓不清,从基膜脱落,细胞膜破裂,核固缩甚至溶解消失,炎性细胞浸润加重(图4c);恢复48 h后炎性细胞基本消失,但肾小管管腔不规则和颗粒变性等病理现象依旧存在(图4d)。
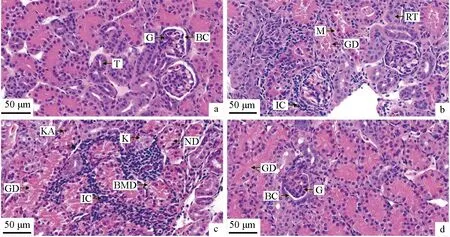
图4 氨氮胁迫对中华条颈龟肾脏组织结构的影响Fig.4 Effects of ammonia stress on histological kidney structure of Chinese striped-necked turtle M. sinensisa.胁迫前; b.胁迫24 h; c.胁迫48 h; d.恢复48 h; 标尺为50 μm; G.肾小球; T.肾小管; BC.肾小囊; GD.颗粒变性; IC.炎性细胞; RT.肾小管管腔缩小; M.肾小管上皮细胞细胞膜破裂; ND.细胞轮廓不清; K.核溶解; KA.核固缩; BMD.脱离基膜.a.before ammonia stress; b.ammonia stress for 24 h; c.ammonia stress for 48 h; d.48 hours of recovery; bar=50 μm; G.glomerulus; T.kidney tubules; BC.Bowman′s capsule; GD.granular degeneration; IC.inflammatory cells; RT.reduction in space inside renal tubules; M.membranolysis; ND.the cells are not well defined; K.karyolysis; K.karyopyknosis; BMD.basement membrane detachment.
2.5 氨氮胁迫对中华条颈龟脾脏组织结构的影响
氨氮胁迫前,中华条颈龟脾脏组织网状支架上分布密集的淋巴细胞,被膜下有由红髓和白髓交替分布形成的脾实质(图5a);氨氮胁迫24 h,中华条颈龟脾脏表现为白髓区域增大,淋巴细胞明显增多,红髓区域略有减小(图5b);胁迫48 h,中华条颈龟脾脏白髓区域持续增大,中央动脉内皮细胞肿胀,红髓区域面积明显减小(图5c);恢复48 h后,中华条颈龟脾脏组织白髓和红髓结构趋于正常(图5d)。
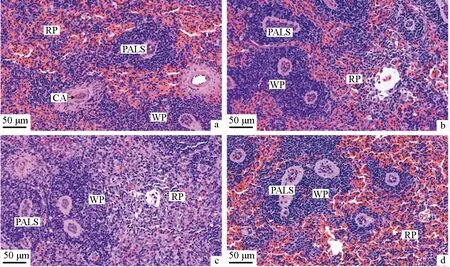
图5 氨氮胁迫对中华条颈龟脾脏组织结构的影响Fig.5 Effects of ammonia stress on histological spleen structure of Chinese striped-necked turtle M. sinensisa.胁迫前; b.胁迫24 h; c.胁迫48 h; d.恢复48 h; 标尺为50 μm; WP.白髓; RP.红髓; PALS.动脉周围淋巴鞘; CA.中央动脉.a.before ammonia stress; b.ammonia stress for 24 h; c.ammonia stress for 48 h; d.48 hours of recovery; bar=50 μm; WP.white marrow; RP.red marrow; PALS.periarterial lymphatic sheath; CA.central artery.
3 讨 论
3.1 氨氮胁迫对中华条颈龟脑组织结构的影响
爬行动物的脑组织可分为大脑、间脑、中脑、小脑及延脑5个主要部分。脑组织是机体的神经中枢,调控机体的各种生理机能。吴利敏等[12]对淇河鲫的研究表明,急性氨氮胁迫会导致其脑组织神经纤维被破坏,分泌细胞与支持细胞出现不同程度的坏死;而陈思涵等[9]对虎斑乌贼的研究表明,急性氨氮胁迫不会对其脑组织神经纤维、分泌细胞和支持细胞造成损伤。在本试验中,中华条颈龟大脑在氨氮胁迫后出现脑组织间质增宽,神经元肿胀,神经元细胞核偏位,甚至出现神经元变性、坏死等现象,说明氨氮胁迫会对中华条颈龟脑组织造成损伤,这种损伤可能与脑细胞中的神经递质γ-氨基丁酸合成受阻和谷氨酰胺大量合成导致神经系统平衡被打破有关[12]。恢复48 h后其神经元肿胀与细胞核偏位现象有所减少,说明脑组织具有一定的修复能力,但48 h恢复不足以完全修复氨氮胁迫造成的损伤。
3.2 氨氮胁迫对中华条颈龟肝脏组织结构的影响
肝脏是龟类重要的解毒器官,同时也是各种关键代谢途径的主要器官,化学物质的毒性作用主要出现在肝脏中[6]。王贞杰等[14]对圆斑星鲽(Veraspervariegatus)的研究表明,急性氨氮胁迫后会出现肝细胞肿胀和溶解,细胞轮廓模糊,细胞水样变性及空泡化等现象;郝小凤等[15]对泥鳅(Misgurnusanguillicaudatus)的研究表明,氨氮胁迫会使其产生肝细胞肿胀,线粒体数量减少,核膜破损等现象;而Liang等[5]对凡纳滨对虾(Litopenaeusvannamei)的研究表明,96 h氨氮胁迫后肝胰腺未出现明显的组织学损伤。中华条颈龟肝实质由许多肝小叶和极少量的间质构成,肝实质内结缔组织少,肝小叶分界不清楚[16]。在本试验中,中华条颈龟肝脏在氨氮胁迫后出现肝细胞肿胀,细胞变性,肝血窦缩小甚至消失,细胞核溶解甚至消失等现象,说明急性氨氮胁迫会对中华条颈龟的肝脏组织造成损伤,并且损伤与胁迫时间呈正相关,这可能与机体在高含量氨氮胁迫下超氧化物歧化酶和过氧化氢酶活性被抑制,机体抗氧化能力下降[13]有关;同时,机体免疫能力的下降可能会影响肝脏正常的解毒及代谢功能,进而导致有毒物质在体内积累,造成进一步的损伤。恢复48 h后肝脏肝血窦恢复到胁迫前水平,肝细胞肿胀减少,但颗粒变性、水泡变性现象依旧存在,说明肝脏具有一定的修复能力,但恢复48 h不足以完全修复胁迫造成的损伤。
3.3 氨氮胁迫对中华条颈龟心脏组织结构的影响
心脏是机体循环系统的重要组成部分,是促进血液流动的动力泵,通过其收缩和舒张将血液输入动脉。不同种类的应激或胁迫会对心脏产生一定程度的损伤,如雷雯雯[17]的研究表明,镉暴露会导致长江华溪蟹(Sinopotamonyangtsekiense)心脏出现心肌水肿、空泡变性、玻璃样变性和炎症细胞浸润等病理现象;王来等[18]对大鼠(Rattusnorvegicus)的研究表明,镉会引起心脏心肌细胞肿胀、心肌纤维增多、闰盘受到损伤等病理现象。中华条颈龟的心脏分为两心房和两心室,左右心室由不完全隔膜分开,心肌细胞呈束状,核椭圆形,相邻的心肌细胞连接处有闰盘结构[16]。在本试验中,中华条颈龟心脏在氨氮胁迫后出现心室肌细胞间隙增宽,间质血管扩张、充血等现象,说明氨氮胁迫会对中华条颈龟心脏组织造成损伤,可能导致心脏供血能力下降,影响营养物质的输送和吸收。恢复48 h后间隙缩小趋于胁迫前水平,充血现象消失,说明心脏组织面对氨氮胁迫造成的损伤具有较好的修复能力。
3.4 氨氮胁迫对中华条颈龟肾脏组织结构的影响
肾脏是龟类主要的排泄器官,也是解毒器官之一。机体新陈代谢的产物通过肾脏排出体外,同时肾脏还能调节体内渗透压和离子平衡。吴利敏等[12]研究发现,氨氮胁迫会导致淇河鲫肾脏组织出现淋巴细胞浸润、肾小管管腔缩小、肾小囊腔扩大等组织病变;张武肖等[10]研究发现,氨氮胁迫会造成团头鲂肾脏组织产生肾小球萎缩,肾小管上皮细胞肿大、坏死、空泡化,肾小管坏死等组织病变;Mishra等[19]研究发现,重铬酸钾导致翠鳢(Channapunctata)肾脏组织出现肾小管管腔缩小、肾小囊腔扩大、肾小管上皮细胞肿大等组织病变;Benli等[6]对尼罗罗非鱼的研究表明,氨氮胁迫后肾脏组织出现肾小球肾炎和充血等组织病变。本试验中,氨氮胁迫后中华条颈龟肾脏表现出肾小管管腔缩小,肾小管上皮细胞发生颗粒变性,核固缩甚至溶解消失,说明高含量氨氮作用于肾小管上皮细胞后,导致肾小管发生损伤,进而可能导致肾脏重吸收和排泄能力下降、破坏机体体液平衡及破坏机体的酸碱平衡;肾脏中炎性细胞浸润,说明氨氮诱发了肾脏发生炎症反应。恢复48 h后肾脏中炎性细胞基本消失,但肾小管管腔不规则、颗粒变性等病理现象依旧存在;说明肾脏有一定的修复能力,但48 h恢复不足以完全修复胁迫造成的损伤。
3.5 氨氮胁迫对中华条颈龟脾脏组织结构的影响
脾脏是机体最大的淋巴器官,在造血、免疫等方面发挥着重要作用。王晓杰等[20]研究发现,盐度胁迫下许氏平鲉(Sebastesschlegeli)脾脏组织中淋巴细胞明显增加,且呈聚集现象;王文博等[21]对草鱼(Ctenopharyngodonidellus)的研究表明,拥挤胁迫会导致脾脏出现明显萎缩;刘奇奇等[22]研究发现,运输胁迫会对四指马鲅(Eleutheronematetradactylum)幼鱼脾脏造成损伤,表现为白髓、红髓和边缘区区域变小,巨噬细胞中心数量减少。中华条颈龟的脾脏为棕褐色实质器官,较小,豆形;被膜较薄,由致密结缔组织组成,表面覆盖单层扁平上皮细胞;可分为白髓和红髓两部分[16]。中央动脉周围密集排列大量淋巴细胞,形成动脉周围淋巴鞘;动脉周围淋巴鞘和淋巴小结组成白髓。红髓由脾索和脾窦组成。氨氮胁迫后中华条颈龟脾脏白髓区域增大,淋巴细胞数量明显增加,说明氨氮胁迫促使中华条颈龟的免疫细胞增殖,其特异性免疫应答能力增强。恢复48 h后,白髓和红髓区域趋于正常,淋巴细胞数量恢复正常,说明机体内的有害物质减少,脾脏的免疫应答能力恢复到正常水平。
4 结 论
通过组织切片分析可知,急性氨氮胁迫下,脑、肝脏、心脏及肾脏组织都受到不同程度的损伤,从本试验来看,损伤相对严重的是肝脏和肾脏;脾脏作为机体的免疫器官,在胁迫发生后能够迅速启动特异性免疫反应,清除机体内出现的有害物质。胁迫后恢复试验表明,中华条颈龟脑、肝脏、心脏及肾脏等器官组织均表现出可恢复性,其中心脏恢复能力较好,脑、肝脏和肾脏恢复能力相对较差。综上所述,在养殖中应当注意水质的监测和管理,防止出现氨氮对中华条颈龟的毒性效应。
致 谢
感谢河南牧业经济学院动物医药学院康静静博士在组织病理读片中给予的指导和帮助。
