人源解旋酶样转录因子的表达、纯化和功能研究
2022-01-22龚晓昕沈苗苗李徐梓超向嵩
龚晓昕,沈苗苗,李徐梓超,向嵩
(天津医科大学基础医学院生物化学与分子生物学系,天津 300070)
准确而顺利的DNA复制对于细胞生存至关重要。大量的外源性和内源性因素,例如核苷酸耗竭、DNA二级结构、蛋白质-DNA复合物、DNA碱基损伤等都会对DNA复制造成压力,从而导致复制停滞[1-2]。停滞的复制叉是一种非常不稳定的DNA结构,容易导致DNA双链断裂和核溶解,从而导致基因组不稳定,最终造成细胞死亡[3-4]。细胞进化出复杂的机制来应对这些复制压力。其中,高度保守的真核生物DNA损伤耐受通路(DNA damage tolerance,DDT)通过易出错的跨损伤合成(translesionsynthesis,TLS)和无错误的模板转换DNA合成(template switch,TS)两条分支来恢复被中断的DNA复制[5-6]。解旋酶样转录因子(helicase-like transcription factor,HLTF)在人类细胞的DDT通路中起到关键作用。DDT中TLS分支与TS分支都是通过将增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)高度保守的Lys164泛素化修饰而启动的。泛素连接酶Rad18和泛素结合酶Rad6将该残基单泛素化修饰,启动TLS分支[7]。HLTF具有泛素连接酶活性,它可进一步使用Lys63相连接的泛素链标记PCNA,启动无错误的TS分支。这一反应以单泛素化的PCNA为底物,还需要泛素结合酶复合物Ubc13-Mms2的共同参与[8-10]。除此之外,HLTF还能通过催化ATP水解驱动复制叉退行[11]。在停滞的复制叉处,TS分支可通过复制叉退行实现;复制叉退行也能保护停滞的复制叉[2,12-13]。与HLTF在DNA复制压力应对中的关键功能一致,研究发现HLTF与早衰、神经系统疾病及多种癌症密切相关[1,14]。
HLTF的分子量为114 kD,是一个较为复杂的多结构域蛋白。它由HIRAN结构域、Snf2家族的DNA解旋酶结构域(Snf2结构域)和嵌在其中的RING结构域构成。Snf2结构域驱动复制叉退行;RING结构域编码泛素连接酶活性;HIRAN结构域在复制叉退行中发挥关键作用[8,13,15-17]。本课题组近期对HLTF的酵母同源蛋白Rad5的结构和功能研究为理解HLTF的功能机制提供了线索[18]。本研究表明,HLTF与Rad5催化差异巨大的PCNA的泛素化修饰及复制叉退行。因此,迫切需要对HLTF本身的结构和功能研究以理解它在人体细胞的DNA复制压力应对中发挥作用的机制。制备大量、高纯度且正确折叠的HLTF对该研究至关重要。虽然已有研究人员利用酵母表达系统表达并纯化HLTF[8],但该表达系统操作较为繁琐,蛋白产量也较为有限。与酵母表达系统相比,细菌表达系统通常耗时更短、蛋白产量更高。然而高等真核生物与细菌之间存在密码子偏好性差异,可能会阻碍高等真核生物蛋白在细菌中的表达。这些物种细胞中蛋白折叠环境的差异,也可能导致在细菌中表达的高等真核生物蛋白不能正确折叠[19-21]。本课题组在前期研究中发现,通过优化HLTF基因的密码子偏好性能够在大肠杆菌表达系统中表达HLTF[18]。本研究优化了HLTF的表达和纯化方式,获得了大量高纯度的HLTF。体外实验结果发现,重组HLTF具有完整的生化活性,提示它是正确折叠的。另外,结果发现HLTF在发挥泛素连接酶活性时对底物PCNA与泛素的连接方式不敏感。本研究提供了一种高效制备大量、高纯度且折叠正确HLTF的方法,并为深入理解其泛素连接酶活性提供了线索,为HLTF的进一步研究奠定了基础。
1 材料和方法
1.1 蛋白表达和纯化本研究对本课题组之前报道的HLTF的表达和纯化方法进行了优化[18]。HLTF基因的密码子偏好性优化有利于其在大肠杆菌中表达,由化学方法合成(生工生物技术)。HLTF的氨基酸残基46-1013对应的基因片段插入pET28a载体(Novagen),构建HLTF的表达质粒。将质粒转化大肠杆菌BL21 Rosetta(DE3)感受态细胞,在添加34 mg/L卡那霉素和25 mg/L氯霉素的LB培养基中培养,用终浓度为0.25 mmol/L的异丙基-β-D-硫代半乳糖苷(Bio Basic)在16℃诱导14 h。收集的细胞重悬在含有20 mmol/L Tris(pH 7.5)、300 mmol/L NaCl、10 mmol/L苯甲基磺酰氟和2 mmol/Lβ-巯基乙醇的缓冲液中,每克细胞使用50 mL缓冲液重悬,冷却到4℃,以50 mL/min的流速通过AH-2010高压破碎仪(ATS Engineering),破碎压力设为900磅每平方英尺。经过3次破碎循环后,细胞裂解液经过15 000×g离心50 min,上清部分经过镍-次氮基三乙酸纯化琼脂糖树脂(nickel-nitrilotriacetic acid,Ni-NTA,Smart-Lifesciences)、DEAE柱(Hitrap DEAE HP,GE Healthcare)、SP柱(Hitrap SP HP,GE Healthcare)和分子筛柱(Superose 6 10/300,GE Health care)依次纯化,得到纯度大于95%的HLTF蛋白。
从人乳腺癌MDA-MB-231细胞的cDNA文库(天津医科大学于林教授赠送)中扩增出泛素、PCNA的基因;从人乳腺癌T-47D细胞的cDNA文库(天津医科大学于林教授赠送)中扩增出Mms2基因。Ubc13基因密码子优化为利于在大肠杆菌中表达(生工生物技术)。将泛素基因插入pET28a载体;将Mms2基因插入pTYb2载体(New England Biolabs);将Ubc13基因插入pTXb1载体(New England Biolabs),构建表达质粒。将FLAG肽段寡核苷酸序列、泛素基因、连接肽段(VQIPGK)核苷酸序列和PCNA基因插入pET28a载体,构建His-FLAG-泛素-PCNA融合蛋白表达质粒。上述重组蛋白均在大肠杆菌BL21 Rosetta(DE3)细胞中表达。泛素和His-FLAG-泛素-PCNA融合蛋白均用Ni-NTA和分子筛柱纯化(泛素蛋白用Superdex 75 Increase 10/300,His-FLAG-泛素-PCNA融合蛋白用Superdex 200 Increase 10/300,均来自GE Healthcare)。Mms2和Ubc13用几丁质树脂(New England Biolabs)和分子筛柱(Superdex 75 Increase 10/300)进行纯化。
所有蛋白质在含有20 mmol/L Tris(pH 7.5)、200 mmol/L NaCl和2 mmol/L二硫苏糖醇的缓冲液中,用液氮速冻后保存在-80℃。
1.2 ATP酶活性实验ATP酶活性实验中使用的双链DNA是通过将互补寡核苷酸(ACCAGTGCCAGTGAT和ATCACTGGCACTGGT,生工生物技术合成)加热至95℃,随后缓慢冷却至4℃生成。实验采用丙酮酸激酶和乳酸脱氢酶耦联反应,通过监测NADH减少来测定ATP酶活性[22]。利用ultraspec 2100 pro分光光度计(GE Healthcare)来监测NADH在340 nm处吸收值的变化。反应体系包括2.5μmol/L HLTF、40 mmol/L Tris(pH 7.5)、50 mmol/L NaCl、0.5 mmol/L ATP(Sigma)、1 mmol/L磷酸烯醇式丙酮酸(Sigma)、0.2 g/L NADH(Sigma)、80单位/mL丙酮酸激酶(源叶生物)、100单位/mL乳酸脱氢酶(源叶生物)、10 mmol/L MgCl2和不同浓度的双链DNA。每次实验重复3次,数据用QTIPLOT分析(www.qtiplot.com)。
1.3 HLTF促进自由泛素链的形成实验反应体系包括20 mmol/L Tris(pH7.5)、50 mmol/L NaCl、10 mmol/L MgCl2、1 mmol/L ATP(Sigma)、0.02 mg/mL BSA、1 mmol/L DTT、33 nmol/L人源泛素激活酶(UBE1,R&D Systems)、667 nmol/L Ubc13、667 nmol/L Mms2、33μmol/L泛素和233 nmol/L HLTF。需要时,将单链DNA(序列为TTTTTTTCGTCTTCGGCAATTTTTTT,生工生物技术合成)或双链DNA(与ATP酶活性实验相同)加入反应体系中,终浓度为6.7μmol/L。
30℃孵育12 min后,加入SDS-PAGE上样缓冲液[20 mmol/L Tris-HCl(pH 6.8),40 mmol/L DTT,0.8%SDS,0.02%溴酚蓝,4%甘油]煮沸终止反应。通过SDS-PAGE分析反应结果。
1.4 HLTF催化PCNA的泛素链标记实验反应体系包括40 mmol/L Tris(pH7.5)、50 mmol/L NaCl、10 mmol/L MgCl2、1 mmol/L ATP(Sigma)、0.15μmol/L人源泛素激活酶(UBE1,R&D Systems)、2μmol/L Ubc13、2μmol/L Mms2、10μmol/L泛素、0.5μmol/L HLTF和0.05μmol/L His-FLAG-泛素-PCNA融合蛋白。30℃孵育30 min后,加入SDS-PAGE上样缓冲液煮沸终止反应。用抗FLAG抗体(a8592,Sigma-Aldrich)进行Western印迹分析反应结果。
2 结果
2.1 重组HLTF蛋白在细菌中的表达和纯化DEAE柱可去除Ni-NTA纯化HLTFec蛋白时残留的大量杂蛋白和错误折叠的蛋白。通过在纯化流程的Ni-NTA柱步骤后添加DEAE柱步骤可以有效地提高蛋白质的产量和纯化产物的纯度。优化的纯化流程可从7 L的大肠杆菌培养液中制备6 mg纯度大于95%的HLTFec蛋白(图1A)。蛋白从Supersose 6 10/300分子筛柱的16 mL处洗脱出来(图1B),与溶液中HLTF蛋白的单体形式一致(预期分子量为109 kD)。
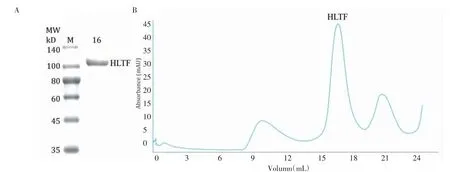
图1 HLTFec蛋白的纯化Fig 1 Purification of HLTFec protein
2.2 重组HLTF的ATP水解酶活性在没有双链DNA时HLTFec只有非常小的ATP水解酶活性,而当双链DNA存在时该活性被强烈地促进超过300倍(图2)。数据分析显示当双链DNA存在时,该活性的激活常数(Ka)为(81.4±14.1)nmol/L,该反应的最大反应比速率(定义为最大反应速率除以HLTF的浓度,Vmax)为(4.3±0.2)/min。这些数据表明,HLTFec具有强大的受双链DNA激活的ATP酶活性,与其催化复制叉退行的功能一致。
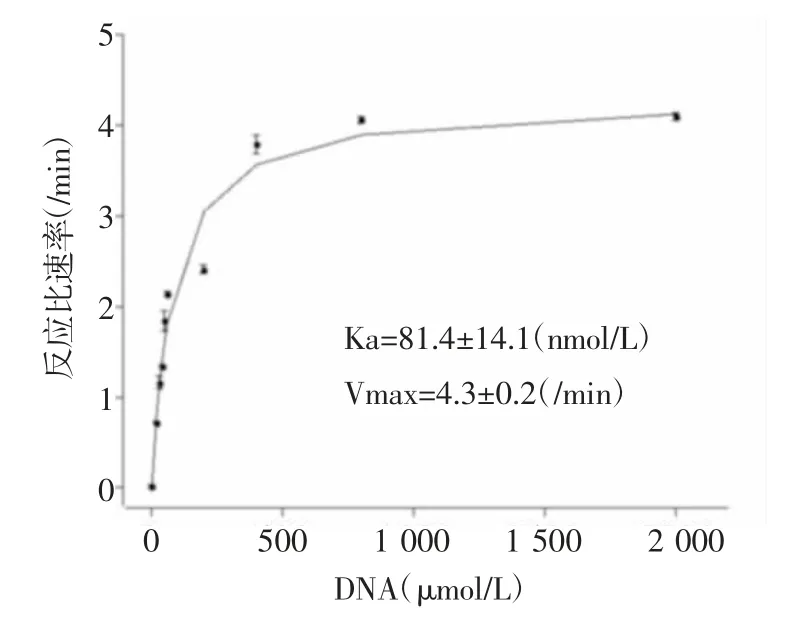
图2 DNA激活的HLTFec的ATP酶活性Fig 2 DNA-stimulated ATPase activity of HLTFec
2.3 重组HLTF的泛素连接酶活性HLTFec可强烈地促进泛素激活酶与Ubc13-Mms2复合物催化的自由泛素链的形成(图3),说明其具有很强的泛素连接酶活性。笔者发现加入双链DNA或单链DNA会进一步促进泛素链的形成。这些数据表明,HLTFec具有较强的泛素连接酶活性,且可被DNA激活。

图3 HLTFec促进Ubc13-Mms2复合物催化自由泛素链形成Fig3 Stimulation of free ubiquitin chain formation catalyzed by Ubc13-Mms2 complex through HLTFec
2.4 重组HLTF催化PCNA泛素链标记的活性该反应需要单泛素化的PCNA作为底物,在该底物中泛素以共价键连接在PCNA的164号位赖氨酸的侧链上。本研究使用类似的泛素-PCNA融合蛋白作为底物检测HLTFec是否能催化PCNA的泛素链标记。结果表明,HLTFec可与Mms2、Ubc13、泛素激活酶等蛋白协作,在泛素-PCNA融合蛋白底物上催化PCNA的泛素链标记(图4)。这些数据表明,HLTFec可催化PCNA的泛素链标记,且对底物中泛素与PCNA的连接方式不敏感。
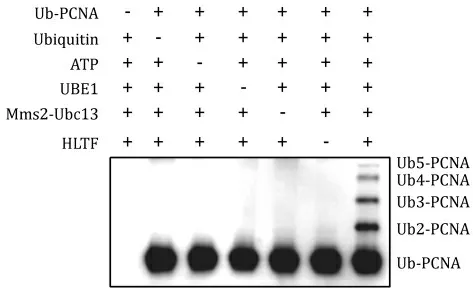
图4 HLTFec催化PCNA的泛素链标记Fig 4 PCNA-anchored poly-ubiquitination by HLTFec
3 讨论
在常用的蛋白表达系统中,细菌表达系统所需要的工作量和材料最少[23-24]。然而,由于真核生物和细菌在密码子偏好性上存在差异,真核生物的蛋白一般无法很好地在细菌中表达[20-21]。此外,由于细菌与真核细胞中的蛋白折叠环境有很大的不同,一些真核生物的蛋白即使能在细菌中表达,也可能无法正确折叠从而缺乏生物活性[19]。在细菌中表达来自高等真核生物的大分子量多结构域蛋白尤其困难。大分子量多结构域的人源HLTF蛋白在细胞的DNA复制压力应对中发挥关键作用,对它的结构和功能研究急需建立大规模制备高纯度、折叠正确的HLTF的方法。本课题组前期的工作表明,通过优化密码子偏好性可以在大肠杆菌中表达HLTF。本研究优化了从大肠杆菌中制备HLTF的方案,建立了一个有效的制备大量、高纯度的HLTF的方法。更为重要的是,体外实验表明制备的HLTF具有完整的生物活性,提示它是正确折叠的。已有报道表明HLTF可以使用酵母表达系统表达[8]。该系统较为耗时,转化、细胞培养及诱导蛋白表达需2周左右的时间。另外,研究人员仅利用该系统纯化了少量的HLTF进行功能实验,能否将该系统用于制备结构研究所需的大量、高纯度、正确折叠的HLTF还不清楚。与该方法相比,本研究建立的方法耗时更短,细胞培养和诱导蛋白表达仅需2 d。而且,此方法可以方便的制备5~6 mg的高纯度、正确折叠的HLTF。因此,本研究提供了一个有效的方案来制备正确折叠的HLTF蛋白,为该蛋白的结构和功能研究奠定了基础。
HLTF催化PCNA的泛素链标记反应以单泛素化的PCNA作为底物,其生成需要Rad18、Rad6、PCNA和复制因子C(replication factor C,RFC)将PCNA加载到双链DNA上[8,25]。HLTF的酵母同源蛋白Rad5催化类似的反应,也需要一组相似的蛋白因子[26]。然而,研究表明Rad5对泛素与PCNA之间的连接方式并不敏感,可以将泛素-PCNA融合蛋白作为底物来催化PCNA的泛素链标记。本研究发现HLTF同样对泛素与PCNA之间的连接方式不敏感,泛素-PCNA融合蛋白也可作为HLTF催化PCNA泛素链标记反应的底物。本课题组最近发现,Rad5和HLTF以截然不同的机制催化PCNA的泛素链标记。Rad5通过其HIRAN结构域招募PCNA并对其泛素化,而HLTF的HIRAN结构域与PCNA没有相互作用[18]。有意思的是,本研究表明,HLTF和Rad5催化的差异巨大的PCNA的泛素链标记反应对泛素-PCNA连接方式均不敏感。这一发现为深入理解Rad5和HLTF催化的PCNA泛素链标记反应的机制提供线索,也提供一种操作简便的实验体系来研究HLTF催化的PCNA泛素链标记反应。
