司美替尼对恶性周围神经鞘瘤细胞增殖和凋亡的影响
2022-01-22高雅赵洋朱香熹赵玉龙李光明杨吉龙叶帅朱泽
高雅,赵洋,朱香熹,赵玉龙,李光明,杨吉龙,叶帅,朱泽
(1.天津医科大学基础医学院病原生物学系,天津 300070;2.遵义医科大学珠海校区临床医学系,珠海 519090;3.天津医科大学肿瘤医院骨与软组织肿瘤科,天津 300060;4.天津医科大学总医院护理部,天津 300050)
恶性周围神经鞘瘤(malignant peripheral nerve sheath tumor,MPNST)是一种源于外周神经分支或鞘膜的恶性软组织肉瘤,约占软组织恶性肉瘤的10%,其中50%的MPNST患者是在Ⅰ型神经纤维瘤病(neurofibromatosis type 1,NF1)的背景下发展而来的。MPNST对放疗和化疗都具有抵抗性,敏感性相对较低,其复发转移率较高,现有的治疗方式都存在一定的局限性,往往预后较差,死亡率较高[1-2]。随着分子靶向研究和临床试验的不断发展,为其治疗带来新的突破。国内外研究显示,多梳抑制复合物2(polycomb repressive complex,PRC2)对组蛋白3上的第27位赖氨酸的三甲基化(trimethylation of lysine 27 on histone3,H3K27me3)这一表观遗传标志物具有一定的调控作用,其缺失在MPNST的发生和发展中发挥重要作用[3]。PRC2组分的缺失突变与异常的H3K27me3表达水平在不同肿瘤中都有所体现,也被认为是预后不良的预测指标和致癌驱动因素[4]。
本课题组前期研究显示,Harvery鼠肉瘤病毒基因Ras及其下游MEK-ERK丝裂原活化蛋白激酶级联通路在MPNST中异常活跃[5]。相关报道显示,与NF1相关的MPNST中PRC2核心组分Zeste12抑制因子(suppressor of zeste 12,SUZ12)的丢失可放大Ras的激活效应[6]。因此,本研究选择该通路相关的抑制剂司美替尼作为切入点进行研究。司美替尼作为一种非ATP竞争性和高效选择性的MEK1/2抑制剂,在多项体外实验研究中都显示其对肿瘤细胞的增殖能力具有抑制作用[7]。因此,本研究旨在通过观察司美替尼对MPNST细胞增殖、凋亡等的影响,探讨可能存在的分子机制,为抗肿瘤治疗提供更多的实验基础和理论指导。
1 材料与方法
1.1 材料及仪器人MPNST细胞株ST88-14、STS26T由天津医科大学肿瘤医院杨吉龙教授馈赠;Selumetinib(AZD6244)购自MedChemExpress公司;CCK-8试剂盒购自新赛美有限公司;SUZ12、EZH2、EED引物合成于金唯智有限公司;H3K27me3抗体购自Abcam公司;beta Actin抗体购自Abways公司;MEK1/2、p-MEK1/2、ERK1/2及p-ERK1/2抗体购自Wanleibio公司;荧光定量PCR仪购自Applied Biosyst公司;电泳仪和凝胶成像分析仪购自BIORAD公司。
1.2 方法
1.2.1 细胞培养 STS26T、ST88-14均采用含1%青链霉素混合液和10%胎牛血清培养基,37℃、7.5%CO2培养。
1.2.2 药物稀释 50 mg司美替尼溶于DMSO中,配制成10 mmol/L储存液,于细胞培养液中稀释至实验所需终浓度。
1.2.3 CCK-8实验测定药物对细胞的半数抑制浓度 实验分对照组(0.1%DMSO);不同浓度司美替尼给药组(0、2、4、6、8、10、12、14、16、18、20μmol/L)。每孔约10 000个细胞接种于96孔板,24 h后加入不同浓度的抑制剂。48 h后每孔加入10μL CCK-8试剂,孵育2 h,测定450 nm处各孔吸光度值,绘制IC50曲线。
1.2.4 平板克隆形成实验 实验分对照组;司美替尼给药组:根据半数抑制浓度分别处理ST88-14、STS26T。6孔板每孔接种约500个细胞,30%胎牛血清培养液培养24 h后,司美替尼给药组加入半数抑制浓度抑制剂,持续培养两周。去除培养液,PBS清洗,4%的多聚甲醛固定。然后加入结晶紫染液,常温放置10 min,PBS洗后拍照,记录实验结果。
1.2.5 细胞划痕实验 实验分组同1.2.4。6孔板底部每隔约1 cm画一条直线,每孔穿过3条横线,划痕与横线的交叉点为观察点。每孔接种约40万个细胞,过夜培养。用200μL枪头垂直板底横线划痕,加入含1%胎牛血清的培养液。司美替尼给药组加半数抑制浓度的抑制剂,继续培养,拍照记录0、3、6、12、24 h细胞迁移情况。
1.2.6 Transwell细胞迁移、侵袭实验 实验分组同1.2.4。Matrigel胶用DMEM培养液1∶8进行稀释,以每孔45μL铺于侵袭组上室底部,迁移组不加。待Matrigel胶凝固成膜。司美替尼给药组上室每孔加入250μL含3万个细胞且加有抑制剂的DMEM细胞悬液,下室加入750μL含20%胎牛血清的培养液。48 h后擦去上室内侧细胞,4%多聚甲醛固定,结晶紫染液染色10 min,拍照,记录实验结果。
1.2.7 流式细胞术 实验分对照组(0.1%DMSO);不同浓度司美替尼给药组(5、10、20μmol/L)。采用Annexin V-FITC/PI双染法进行检测。用不含EDTA胰酶消化收集细胞,将其保存在含2%BSA的PBS缓冲液中。PBS洗2~3次,每次2 000×g离心5 min。每个样品加入500μL Binding Buffer重悬细胞。染料瞬离5 s,分别加入单染管5μL。每组样品加5μL Annexin V-FITC,再加5μL PI,避光孵育15 min,流式细胞仪检测。最后用Flow Jo软件进行数据分析处理。
1.2.8 实时荧光定量PCR实验 实验分组同1.2.4。ST88-14、STS26T接种于6孔板,37℃培养24 h后司美替尼给药组加入半数抑制浓度抑制剂,对照组不加抑制剂。加药后分别于6、12、24、48 h,收取细胞进行实验。每孔加入500μLTrizol冰上裂解,提取总RNA逆转录成cDNA,以此为模板进行RTqPCR检测。
1.2.9 免疫印迹实验 实验分组同1.2.7。RIPA和PMSF以100∶1浓度配置细胞裂解液,每孔加入200μL。裂解完全后收集于离心管中,4℃,14 000×g,5 min。取上清测定浓度,进行等质量蛋白电泳,然后300 mA恒流转膜80 min,封闭2 h。一抗:MEK(1∶500)、p-MEK(1∶300)、ERK(1∶500)、p-ERK(1∶300)、H3K27me3(1∶1 000)、β-actin(1∶1 000)4℃摇床过夜孵育,二抗(1∶3 000)室温摇床孵育2 h,显色,曝光。
1.3 统计学处理采用GraphPad Prism 8.0和Flow Jo-V10软件进行数据分析和作图。数据符合正态分布,采用单因素方差分析和t检验进行差异分析,P<0.05视为差异具有统计学意义。
2 结果
2.1 司美替尼对ST88-14和STS26T细胞半数抑制浓度的测定实验结果显示,对于ST88-14细胞,司美替尼的半数抑制浓度为13.58μmol/L;对于STS26T细胞,司美替尼的半数抑制浓度为17.60 μmol/L(图1)。
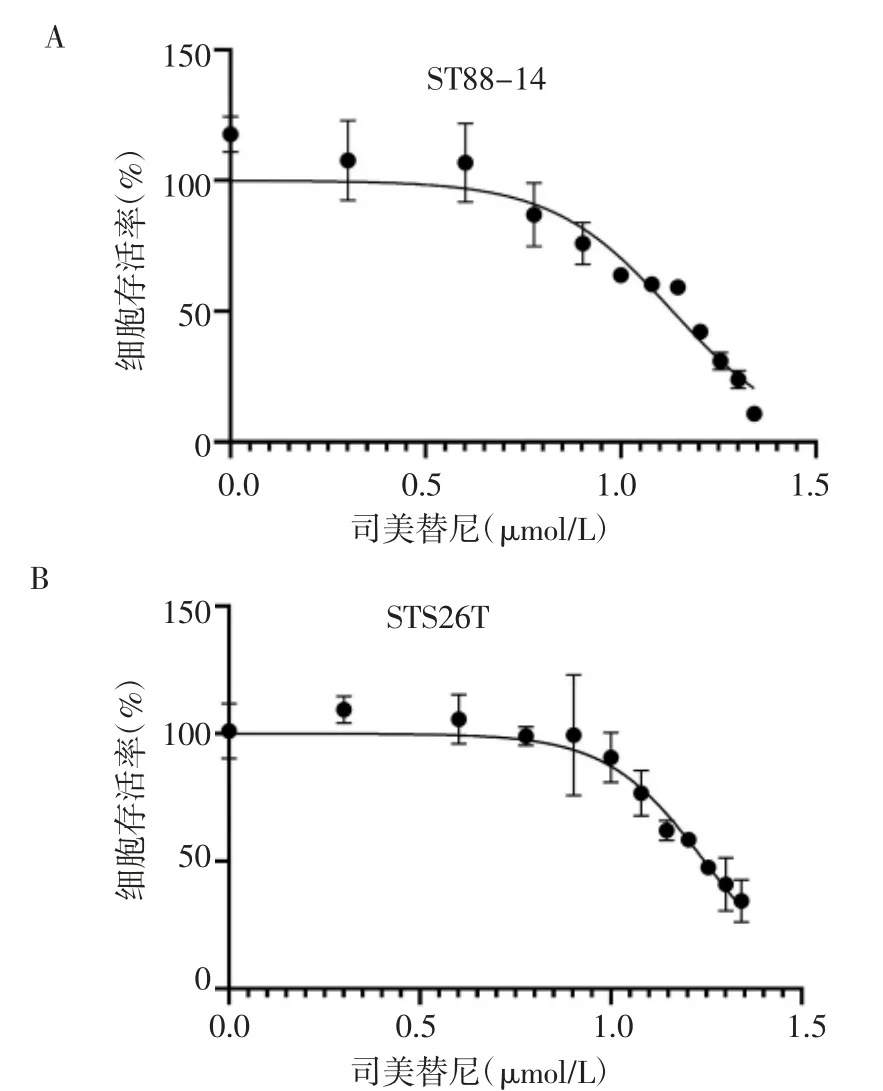
图1 司美替尼对细胞活性的影响Fig 1 Effect of selumetinib on cell viability
2.2 司美替尼对MPNST细胞系增殖能力的作用实验结果显示,与对照组相比,ST88-14细胞给药组克隆数量减少41.4%(t=16.44,P<0.05);STS26T减少30.4%(t=16.21,P<0.05)。与对照组相比,给药组形成更少且更小的细胞集落,见图2。
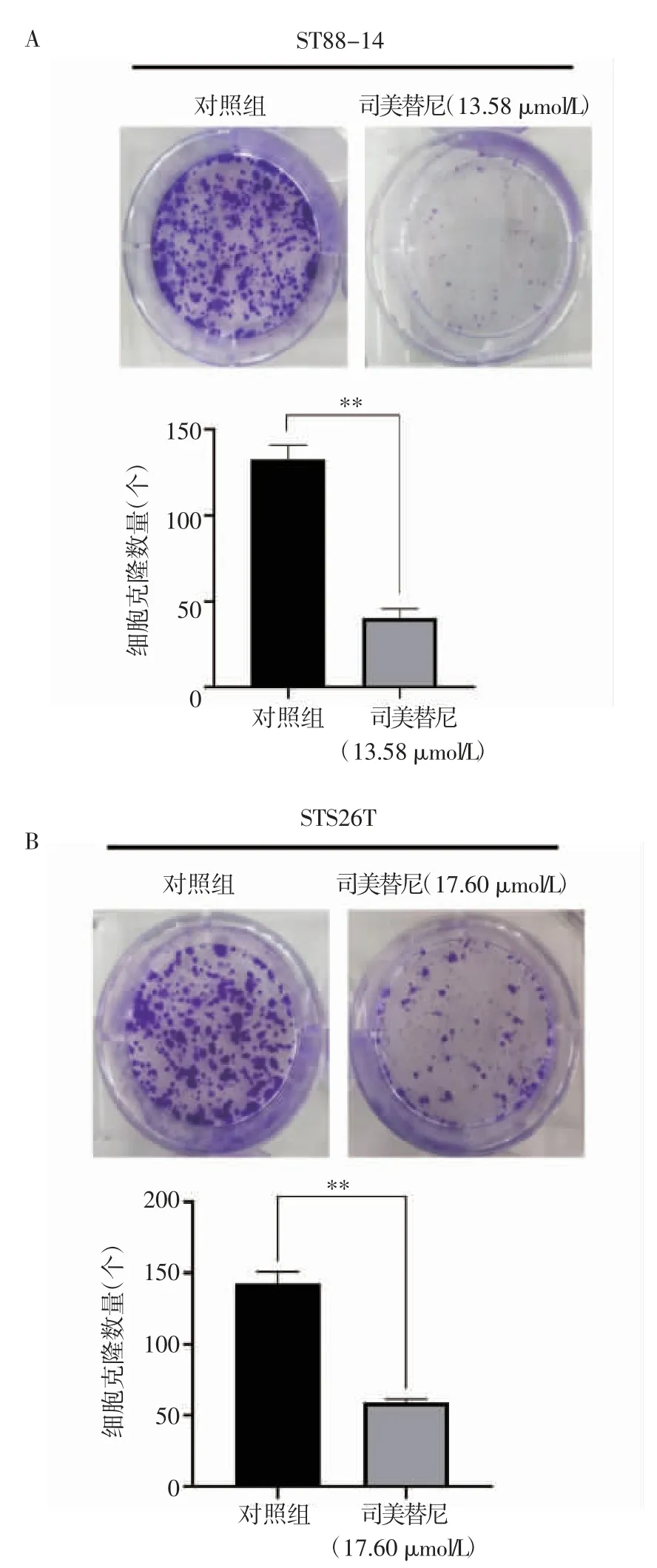
图2 司美替尼对细胞增殖能力的影响Fig 2 Effect of selumetinib on cell proliferation
2.3 司美替尼对MPNST细胞系迁移、侵袭能力的作用结果显示,随着时间的延长,与对照组相比,给药组两种细胞系的迁移率均逐渐降低。ST88-14细胞24 h总迁移率降低49.3%(t=13.98,P<0.05),STS26T细胞降低41.4%(t=14.4,P<0.05)(图3A、B)。经药物作用48 h,两种细胞的迁移和侵袭能力均降低。ST88-14细胞迁移率降低31.9%(t=4.02,P<0.05),侵袭率降低了31.3%(t=10.51,P<0.05);STS26T细胞迁移率降低31.8%(t=2.21,P<0.05),侵袭率降低了32.0%(t=8.44,P<0.05)(图3C、D)。
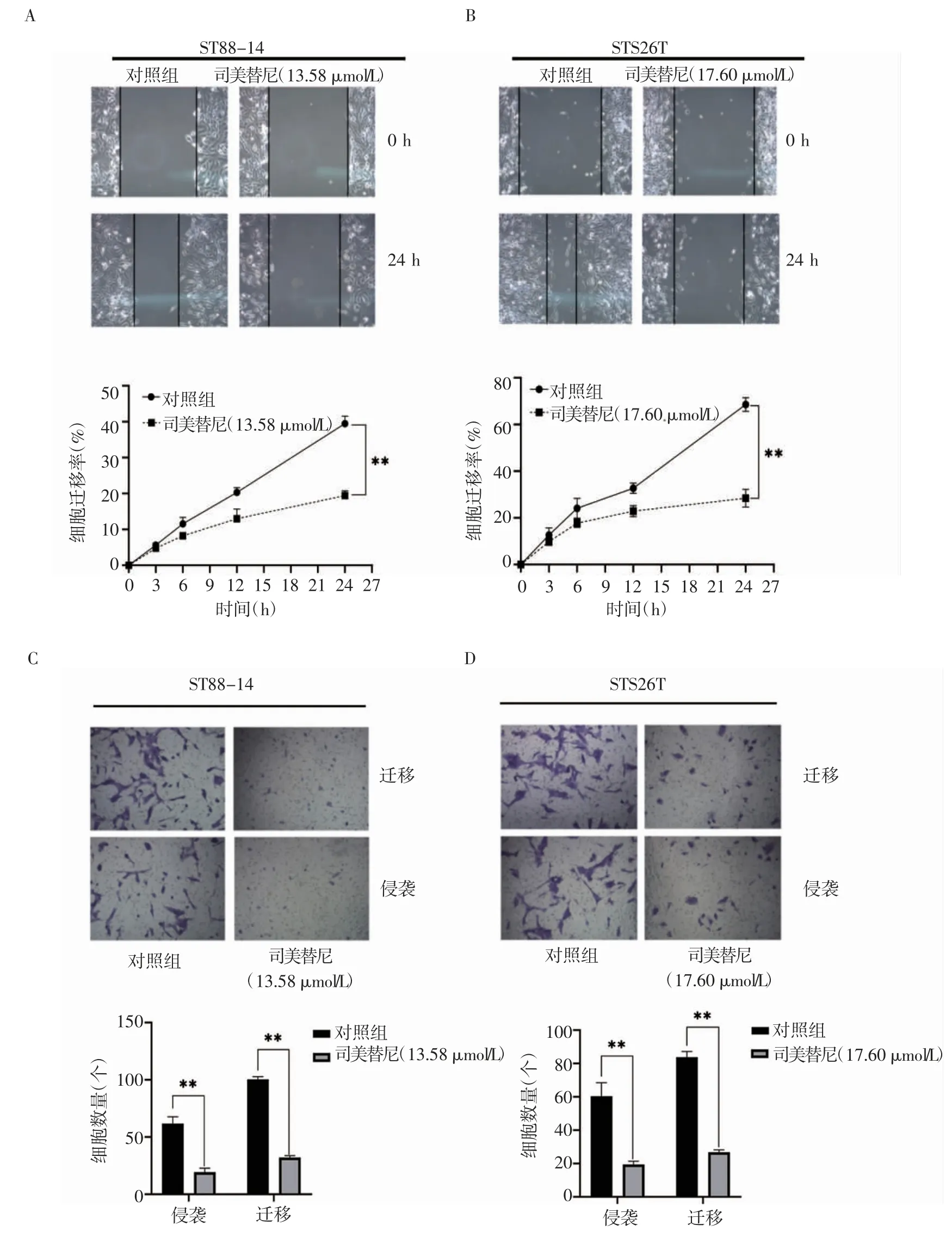
图3 司美替尼对细胞迁移、侵袭能力的影响Fig 3 Effect of selumetinib on cell migration and invasion
2.4 司美替尼对MPNST细胞凋亡的作用司美替尼作用48 h细胞凋亡结果显示(图4),与对照组相比,ST88-14和STS26T 10μmol/L和20μmol/L司美替尼给药组细胞凋亡差异具有统计意义(t=14.64、10.10,均P<0.05;t=3.06、13.10,均P<0.05)。
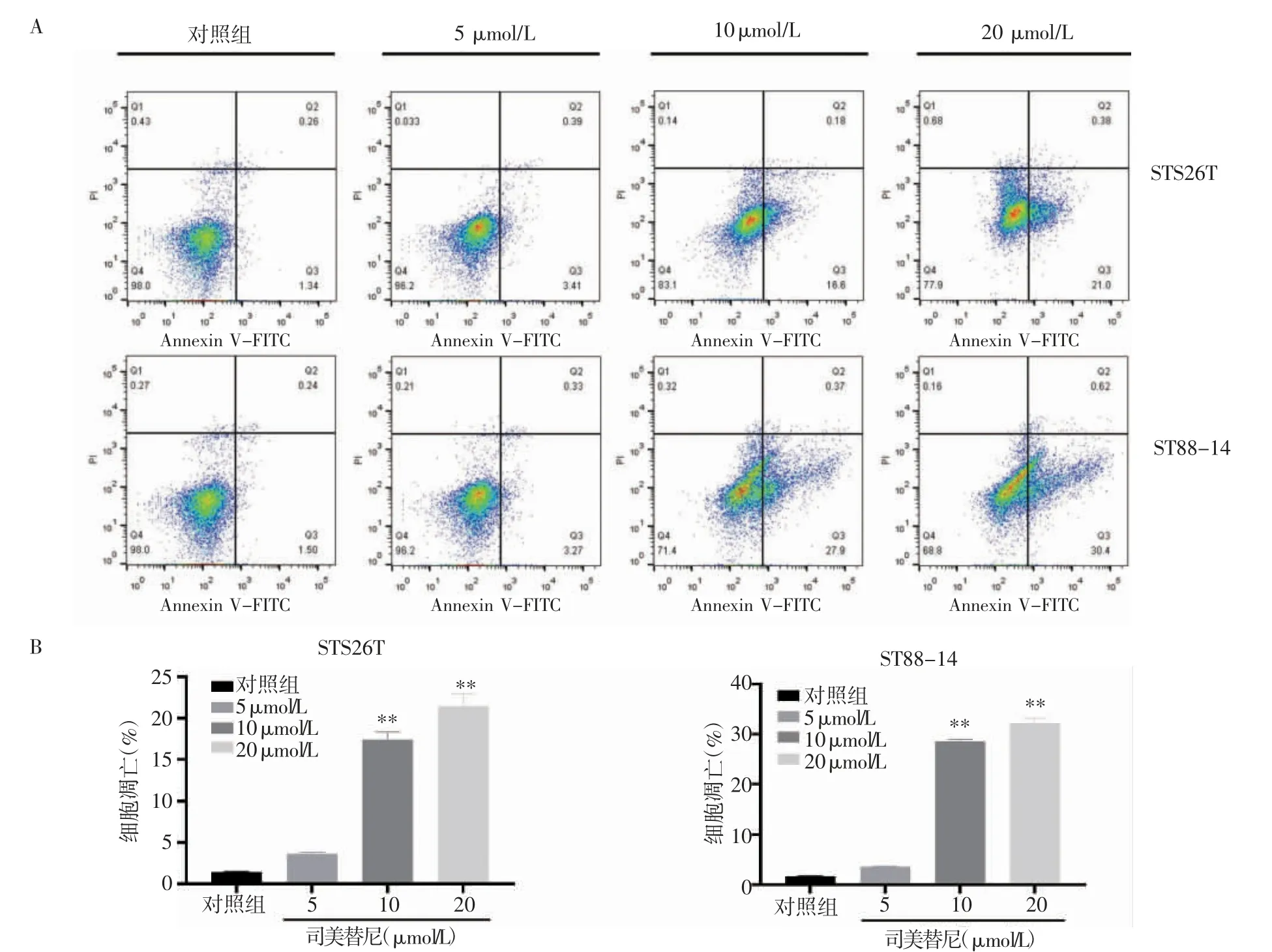
图4 流式细胞术检测细胞凋亡情况Fig 4 Flow cytometry for detection of apoptotic cells
2.5 司美替尼对PRC2各组分mRNA表达水平的影响结果显示,与各自的对照组相比,ST88-14司美替尼(13.58μmol/L)给药组和STS26T司美替尼(17.60μmol/L)给药组PRC2核心组分SUZ12和EZH2的表达水平在24 h(t=14.30、6.53,均P<0.05;t=4.13、4.70,均P<0.05)和48 h(t=13.39、16.84,均P<0.05;t=6.10、12.93,均P<0.05)均显著升高(图5)。
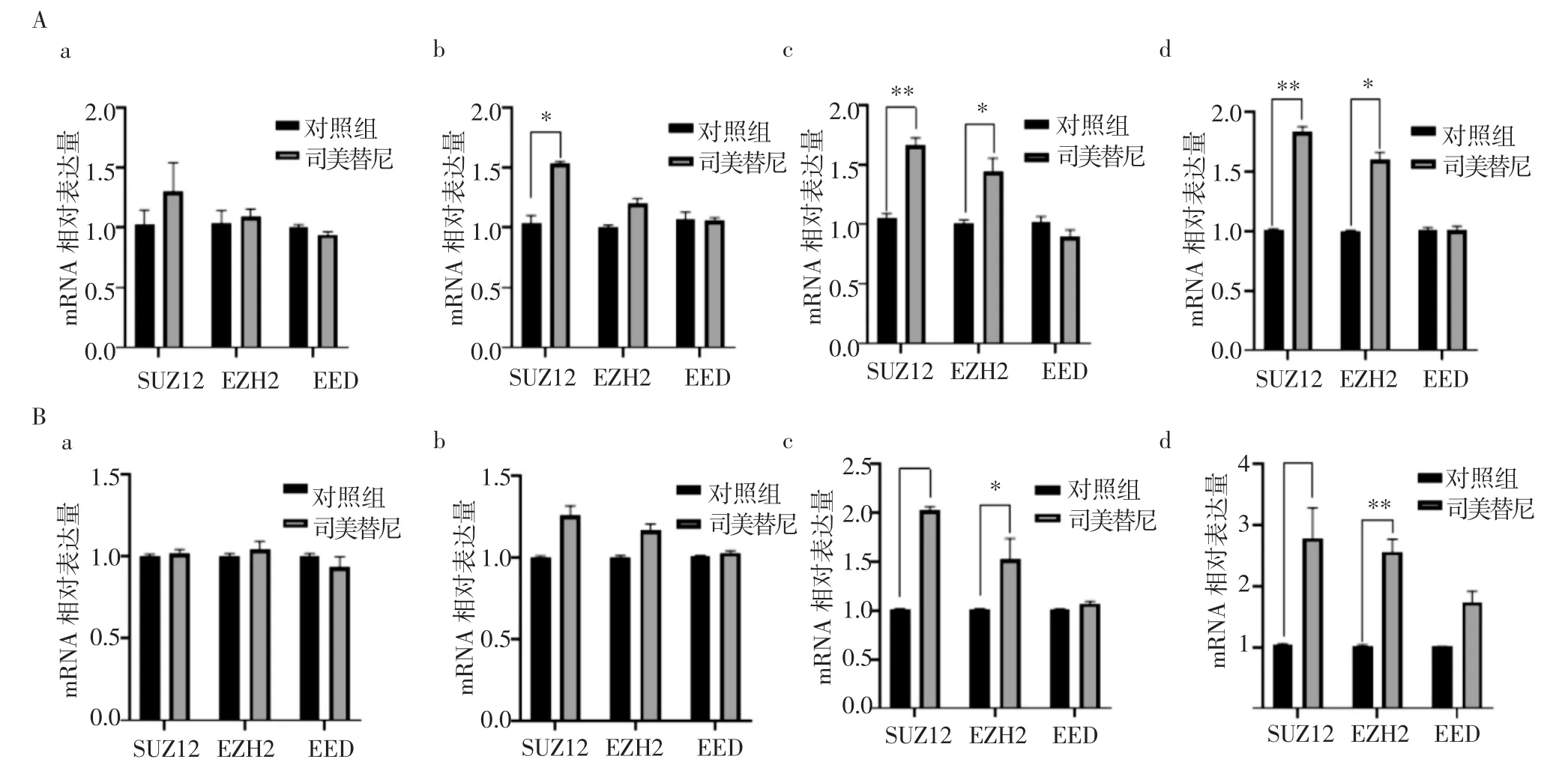
图5 司美替尼处理不同时间PRC2各组分mRNA表达水平Fig 5 mRNA expression levels of PRC2 components in different time of selumetinib treatment
2.6 司美替尼对H3K27me3表达的作用与对照组相比,ST88-14和STS26T细胞20μmol/L司美替尼给药组MEK1/2(t=8.76、6.59,均P<0.05)、ERK1/2(t=6.02、4.82,均P<0.05)磷酸化水平均显著降低且H3K27me3表达水平均显著升高(t=12.82、18.78,均P<0.05)(图6)。
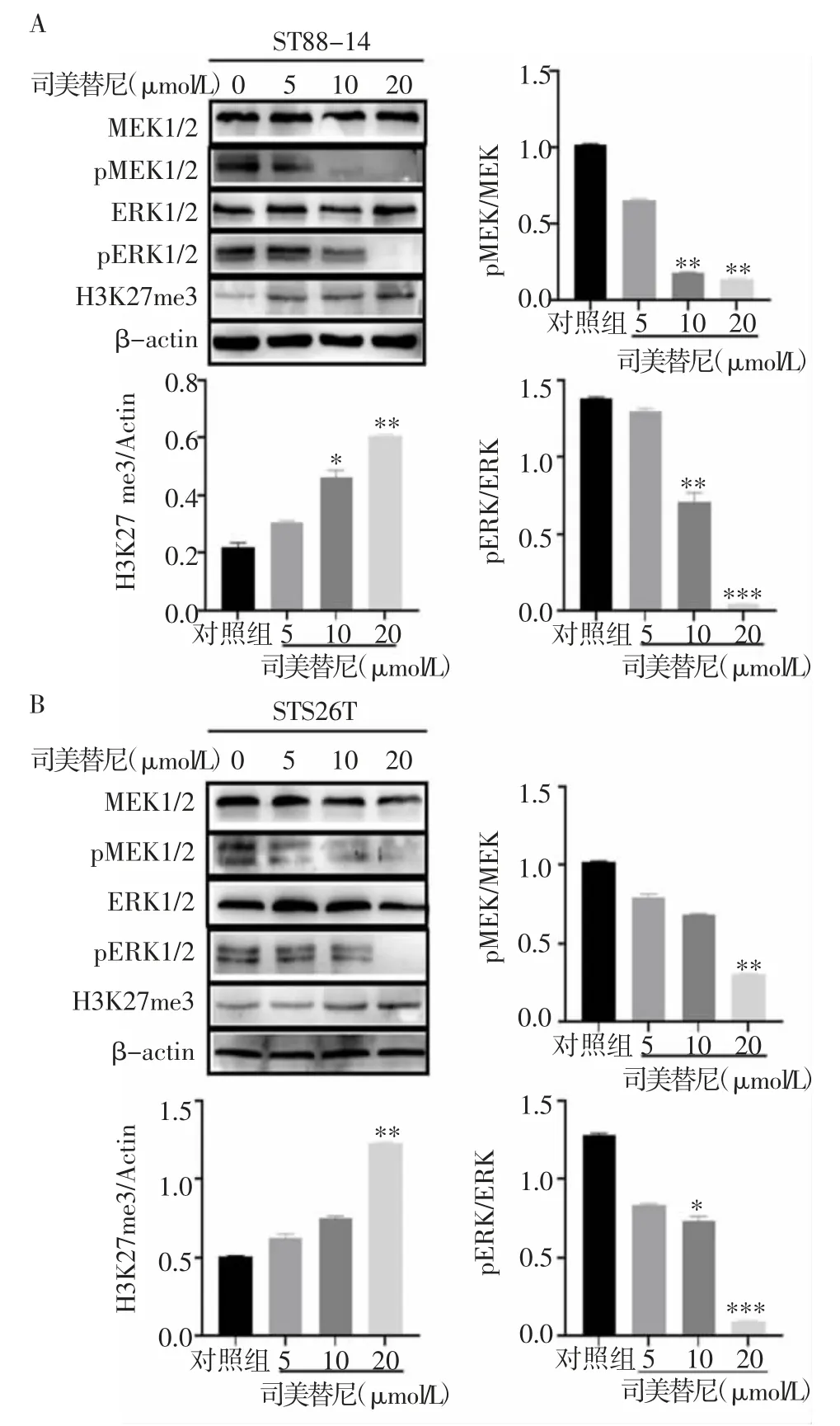
图6 司美替尼对H3K27me3表达水平的影响Fig 6 Effect of selumetinib on the expression of H3K27me3
3 讨论
随着抗肿瘤治疗的深入研究,RAS-RAF-MEKERK已经成为一条非常经典的信号转导通路,在肿瘤研究领域备受关注,且在多种肿瘤的发病机制中都有所体现。该通路存在于多数肿瘤细胞中,通过上下游关系对细胞的周期、增殖和迁移等多种生理功能进行调控,进而在肿瘤发病进程中发挥作用[8]。因此,该通路靶向抑制剂研制也备受关注。司美替尼作为一种MEK1/2抑制剂在许多实体瘤中进行了临床试验,表现出可观的安全性和有效性。在其他临床前研究中,司美替尼也显示出抗黑色素瘤、结直肠癌、胰腺癌、非小细胞肺癌、肝细胞癌等的活性[9-10]。国外临床研究数据显示,在一项Ras途径突变卵巢癌临床试验中,15%的患者对治疗表现出客观反应,65%的患者病情趋于稳定,表现出良好的耐受性[11]。2020年,司美替尼单克隆抗体(Koselugo)在美国上市且被评为孤儿药地位和突破性疗法,临床试验也在不断进行当中[12-13]。本课题组前期研究也显示,在51例MPNST样本中存在该通路的过度激活[5],说明该通路的异常表达与MPNST的演进存在一定的联系。因此,笔者提出假设MEK1/2抑制剂司美替尼也有可能在MPNST治疗中发挥一定作用。
MPNST由于其罕见的表现形式和相对有限的治疗手段,使其在临床治疗上面临严峻的挑战。随着分子靶向技术和转化研究的不断深入,也为该疾病在治疗上找到新的突破。2019年国内发布的病理学检测专家共识中也提出了可将H3K27me3作为MPNST的免疫组织化学标记检测分子指标[14]。基因表达调控是在蛋白翻译后修饰上进行的,H3K27me3作为抑制基因转录的重要表观遗传标志物,其由PRC2复合蛋白进行调控。PRC2的核心成分由有催化活性的SUZ12、Zeste基因增强子同源物2(enhancer of zeste homolog 2,EZH2)和负责变构激活的胚胎外胚层发育基因(embryonic ectoderm development,EED)组成[15]。国外有大量研究显示,H3K27me3丢失的MPNST患者在基因测序中发现多数伴随着SUZ12和EED的缺失突变[16-17]。课题组前期通过组织芯片技术对43例MPNST患者病理标本进行免疫组化检测,发现H3K27me3在65.11%的标本中存在不同程度的缺失[18]。由此可见,H3K27me3对MPNST的表观遗传调控及其调控元件在MPNST发病和演进中发挥着重要作用。
本研究通过观察司美替尼对MPNST细胞系的影响,探讨可能存在的分子机制。实验结果显示,司美替尼抑制MPNST细胞的增殖,促进其凋亡,且对细胞的侵袭和迁移产生了相应的抑制效果。ST88-14和STS26T细胞经司美替尼处理后,MEK1/2和ERK1/2蛋白磷酸化水平逐渐降低,MEK-ERK通路受到抑制,H3K27me3表达水平升高。因此,笔者得出结论司美替尼可通过促进H3K27me3的表达抑制MPNST细胞ST88-14和STS26T的增殖,促进其凋亡。随着药物作用时间的不断延长,PRC2各组分显示不同程度的变化,24 h和48 h给药组SUZ12和EZH2显著升高,EED没有差异性变化。国内外多项研究都显示MPNST中没有发现EZH2的显著缺失[2],但是笔者的实验结果显示随着H3K27me3的上调,不仅SUZ12显著升高,EZH2也显著升高,说明PRC2各组分对于MPNST的调控作用相对复杂,不是单纯的正反馈或负反馈调节机制,可能存在某种补偿效应,需通过进一步试验验证。
综上所述,本研究在证明司美替尼对MPNST细胞ST88-14和STS26T增殖抑制的同时,进一步证实了PRC2核心组分对H3K27me3表达存在一定的调控作用且H3K27me3在MPNST发生和发展中发挥着重要作用。这将有助于揭示MPNST的发病机制,为抗肿瘤治疗提供理论基础和数据参考。
