基孔肯雅病毒无血清培养及灭活病毒保护效果的分析
2022-01-19王嘉琪彭浩然何燕华赵兰娟任浩王文戚中田赵平唐海琳
王嘉琪,彭浩然,何燕华,赵兰娟,任浩,王文,戚中田,赵平,唐海琳
海军军医大学海军医学系生物医学防护教研室上海市医学生物防护重点实验室,上海 200433
基孔肯雅病毒(Chikungunya virus,CHIKV)属于披膜病毒科甲病毒属,是单股正链RNA 病毒,基因组全长约12 000 bp,是我国重要的输入性传染病病原体。CHIKV 最早于1953 年从非洲坦桑尼亚一位发热患者标本中分离得到[1],主要通过蚊媒传播。CHIKV 包括西非(West African)、东中南非(Eastern-Central-Southern African,ECSA)和亚洲(Asian)型3 种亚型,其中 ECSA 型 CHIKV 在 2005 年出现印度洋型分支(Indian Ocean Lineage,IOL)[2]。西非型CHIKV 主要在西非地区小规模流行,对人类危害小。ECSA 型CHIKV 在2004 年以前主要在东非、中非及南非地区流行,2004 年从肯尼亚传入印度洋法属留尼汪岛(Reunion island),并导致有史以来规模最大的一次暴发,病例超过26. 6 万例[3];在该次大暴发中,CHIKV 基因发生突变,传播能力增强,2005年12 月扩散至印度及东南亚国家,造成印度超过100 万人感染[4];2014 年继续扩散至南美巴西[5],当前仍在印度、东南亚、欧洲及南美等国家或地区流行[6-9]。亚洲型CHIKV 在1954 年首次发现于菲律宾并一直在东南亚国家流行,2013 年扩散至加勒比海地区,在中美洲大暴发,病例超过137. 9 万[10]。近年来,我国福建、浙江等地持续发生输入性病例,并导致本地病例[11-14]。
CHIKV 感染的临床表现为发热、关节痛、皮疹等,严重者发生中枢神经系统疾病,有严重后遗症,甚至死亡[15-16],目前国际上尚无特效药和疫苗。灭活疫苗技术成熟,安全性高,是疫苗研发优先选择的技术。灭活疫苗研发成功的前提是能够进行大规模病毒生产以及灭活病毒具有足够的免疫原性和保护效果。本文对无血清条件下CHIKV 的培养及其灭活病毒在小鼠模型上的保护效果进行研究。
1 材料与方法
1. 1 实验动物 60 只同系雌性清洁级 C57BL / 6 小鼠,6 周龄,体重16 ~ 18 g,购自江苏集萃药康生物科技有限公司,动物许可证号:SCXK(苏)-2018-0008。置生物安全三级实验室(P3 实验室)培育。本实验均以科研为目的进行对小鼠养殖和使用,符合国家动物伦理规定。
1. 2 病毒及细胞 感染性克隆Ross 毒株(AF49-0259)和 LR2006 毒株(EU224268)由本实验室构建[17]。Ross 毒株是 1953 年最早分离的毒株,将其滴鼻接种小鼠能导致小鼠发病,用于CHIKV 疫苗和药物作用评价。LR2006 毒株引起2005 年印度洋地区大流行,用于灭活病毒制备。所有操作均在P3 实验室进行。Vero 细胞购自上海富衡生物科技有限公司(编号:FH0374)。
1. 3 主要试剂及仪器 VP-SFM 和DMEM 培养基及胎牛血清购自美国 Gibico 公司;RNA 抽提试剂TRIzol、反转录试剂盒(PrimeScrip RT reagent Kit)和SYBR Premix Ex Taq 购自日本 TaKaRa 公司;鼠多抗CHIKV E1 和鼠抗GAPDH 购自美国RD 公司;兔多抗CHIKV E2 购自中国爱博泰克(Abclonal)生物科技有限公司;HRP 标记的兔抗IgG、鼠抗IgG 以及Alexa Fluor®488 标记的山羊抗小鼠 IgG 购自美国Invitrogen 公司;甲醛购自国药集团化学试剂有限公司;β-丙内酯、氢氧化铝佐剂、SDS-PAGE 凝胶制备试剂盒和RIPA 裂解缓冲液购自北京索莱宝科技有限公司;全自动细胞成像及分析系统购自美国BioTek公司;300 实时荧光定量PCR 系统购自美国Applied Biosystems 公司。
1. 4 Vero 细胞在含或无血清条件下的培养 VP-SFM使用前添加2 mmol / L L-谷氨酰胺。完全DMEM 培养基为含10% FBS 的DMEM 培养基,另添加非必需氨基酸、100 U / mL 青链霉素双抗和 2 mmol / L L-谷氨酰胺。用完全DMEM 培养基培养Vero 细胞,至细胞约90%汇合时,经0. 05%胰酶消化细胞,按2 × 105个接种 T75 细胞培养瓶,分别用 VP-SFM 和完全DMEM 培养基于37 ℃和5% CO2孵箱中培养,24、48 和 72 h 后进行细胞计数,重复 3 次。
1. 5 CHIKV 在Vero 细胞上的增殖培养及病毒灭活条件的确定 将Vero 细胞按1 × 104个接种T75 细胞培养瓶,待细胞在VP-SFM 中生长48 h 密度约达90%时,将 CHIKV 按 0. 1 MOI 感染细胞,置 37 ℃,5% CO2孵箱培养48 h,待细胞病变达70%时收集病毒上清,用直径0. 22 μm 过滤器过滤细胞残渣,-80 ℃待用。使用空斑法检测病毒滴度,然后分别采用不同浓度(0. 025%、0. 0125%)β-丙内酯灭活病毒不同时间(24、48 h),确定合适的灭活时间和浓度。采用0. 025%甲醛灭活21 d,再用3. 75%焦亚硫酸钠 1 ∶100 中和甲醛[18]。β-丙内酯在疫苗液体中完全水解,未进行残留处理。以未经灭活的CHIKV 作为对照组。
1. 6 含血清或无血清条件下Vero 细胞扩增CHIKV效果的比较 将CHIKV LR2006 毒株以0. 1、0. 01和0. 001 MOI 感染 Vero 细胞,在 VP-SFM 和完全DMEM 培养基中培养 24、48 和 72 h 后,分别收集病毒上清,空斑法检测病毒滴度。
1. 7 空斑法检测病毒滴度 将不同条件下扩增的CHIKV 以 1 ∶10 稀释 8 个梯度,各取 200 μL 加至预先种满Vero 细胞的24 孔板上,37 ℃孵育2 h;弃病毒液,加入含4%羧甲基纤维素钠覆盖液,1 mL / 孔,37 ℃培养72 h;弃覆盖液,4%甲醛结晶紫染色,干燥后计数。
1. 8 β-丙内酯和甲醛灭活CHIKV 的活性及抗原性检测 将0. 025% β-丙内酯灭活48 h 和0. 025%甲醛灭活21 d 的CHIKV 接种Vero 细胞。免疫荧光法检测病毒活性:感染 18 h 后,用甲醇于-20 ℃固定细胞 30 min;3% BSA 室温封闭2 h;加入鼠多抗CHIKV E1(1 ∶8 400 稀释),4 ℃孵育过夜;PBS 洗涤3 次,加入抗兔Alexa Fluor®488 标记的山羊抗小鼠IgG(1 ∶1 500 稀释),避光孵育 1. 5 h;用 DAPI 染细胞核15 min;PBS 洗涤1 次,全自动细胞成像及分析系统下观察。Western blot 法检测抗原性:将甲醛、β-丙内酯灭活病毒及对照病毒液分别加入RIPA 细胞裂解液,经15% SDS-PAGE 分离后,电转至 PVDF膜,分别加入鼠多抗CHIKV E1、鼠抗GAPDH 和兔多抗 CHIKV E2(分别 1 ∶1 000、1 ∶3 000 和 1 ∶1 000稀释),室温摇床孵育 2 h;PBS-T 洗涤 3 次,加入HRP 标记的兔抗 IgG 和鼠抗 IgG(均 1 ∶5 000 稀释),室温摇床 1 h;PBS-T 洗涤 3 次,加入 ECL 显色后,用化学发光仪进行检测。以未经灭活处理的CHIKV作为对照组。
1. 9 小鼠免疫及抗体中和试验 分别将甲醛、β-丙内酯灭活病毒(2 × 107PFU / mL)与等体积 2%明矾[Al(OH)3]混合,室温 1 h;皮下接种至 6 周龄C57BL / 6 雌性小鼠,1 mL / 只,共 15 只,为试验组,第1 次免疫14 d 后进行相同剂量的第2 次加强免疫。空白组为PBS 与等体积2%明矾混合,其他同试验组。免疫小鼠第28 天经眼球采血,分离血清,与500 PFU CHIKV 按 1 ∶80、1 ∶160、1 ∶320、1 ∶640、1 ∶1 280 和 1 ∶25 60 比例混合,37 ℃孵育 1 h;加至预先接种Vero 细胞的96 孔板中,每个梯度3 个复孔,37 ℃孵育 18 h;甲醇固定,加入兔抗 CHIKV E1(1 ∶8 400 稀释),100 μL / 孔;加入 Alexa Fluor®488 标记的山羊抗小鼠 IgG(1 ∶1 500 稀释),100 μL / 孔,避光孵育 1. 5 h;加入DAPI,利用全自动细胞成像及分析系统进行免疫荧光检测,对每个孔进行荧光计数,每个混合浓度重复3 孔。对照组为500 PFU CHIKV 与免疫 PBS 小鼠血清 1 ∶80 混合。
1. 10 两种灭活病毒对小鼠攻毒免疫效果的评价免疫后28 d,用异氟烷麻醉小鼠,滴鼻接种CHIKV Ross 毒株,剂量为 106PFU / 只,以未免疫小鼠作为对照组。接种当天及接种后每天称量小鼠体重,并在第6 天处死小鼠,取小鼠脑组织,采用组织研磨器将脑组织研磨充分。qPCR 法检测脑组织中CHIKV载量:用TRIzol 提取样本RNA,酶标仪检测RNA 浓度和纯度,按照SYBR Premix Ex Taq 试剂盒方法在7300 实时荧光定量PCR 系统进行扩增。CHIKV 上游引物:5′-ACGCARTTGAGCGAAGCAC-3′,下游引物:5′-CTGAAGACATTGGYCCCAC-5′;内参 GAPDH上游引物:5′-ATGCCTCCTGCACCACCAACTGCTT-3′,下游引物 5′-TGGCAGTGATGGCATGGACTGTGGT-3′。引物由Invitrogen 公司合成。反应条件:95 ℃预变性 30 s;95 ℃ 5 s,60 ℃ 31 s,共 40 个循环。不接种Ross 毒株小鼠作为空白组。
1. 11 小鼠脑组织病理检测 取石蜡包埋的小鼠脑组织切片,HE 染色。DHISTECH PANNORAMIC 全景切片扫描仪拍照观察组织形态变化。
1. 12 统计学分析 应用GraphPad Prism 7 软件进行数据处理和统计学分析。组间差异比较采用异方差双尾t 检验分析,RT-qPCR 定量值统计学差异分析前经取对数处理。多组间比较采用One-way ANOVA 检验。以P < 0. 05 为差异有统计学意义。
2 结 果
2. 1 Vero 细胞无血清培养的传代稳定性 Vero 细胞在VP-SFM 中培养至第4 和5 天,细胞变圆、聚集,部分漂浮;将漂浮细胞继续传代,细胞贴壁生长,3 d 后开始悬浮;继续传代3 次,细胞贴壁生长,不再悬浮;连续传至20 代,细胞形态在无血清和含血清培养基中无明显差异。见图1。VP-SFM 培养的Vero 细胞保持对数生长,72 h 细胞计数显示,无血清培养较含血清培养生长慢(t = 8. 222,P < 0. 01),见图2。
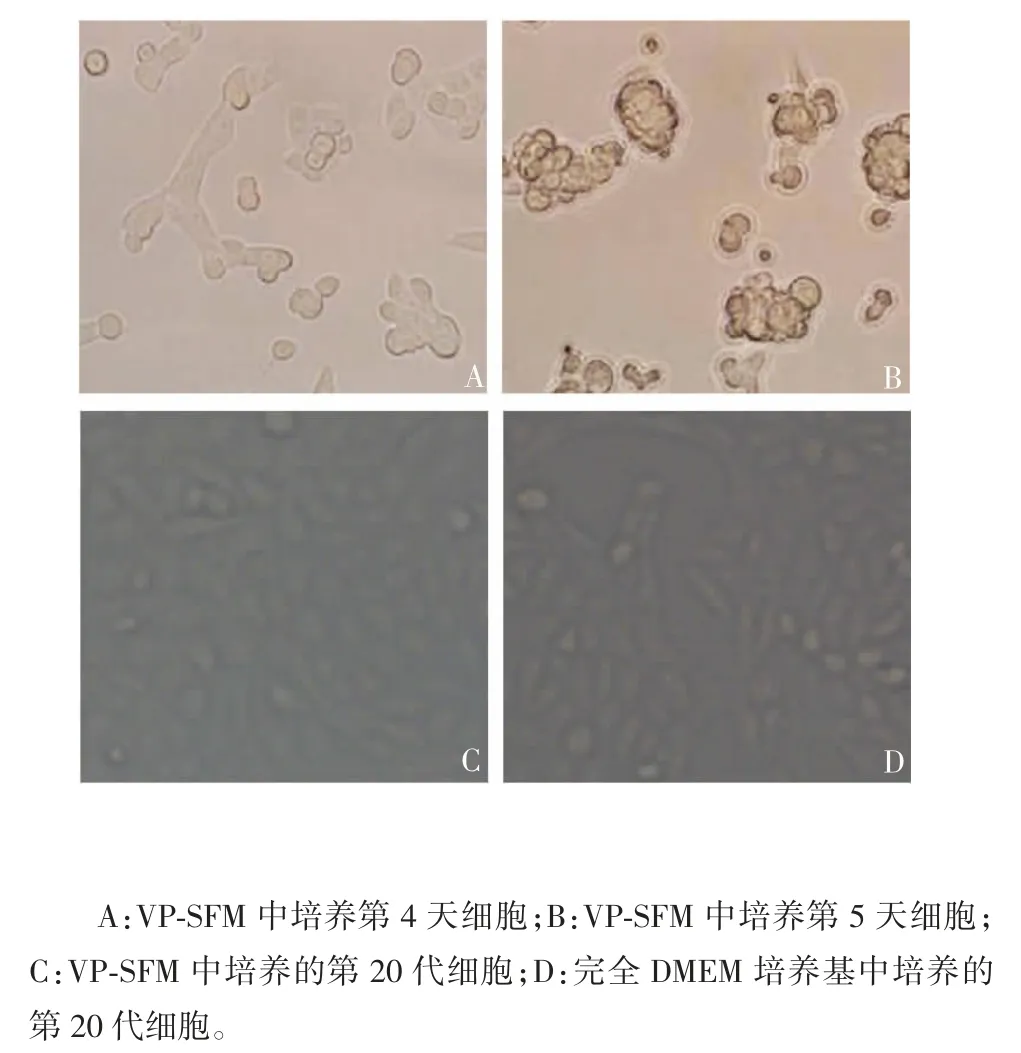
图1 Vero 细胞在VP-SFM 和完全DMEM 培养基中培养形态的显微镜观察(× 20)Fig. 1 Microscopy of morphology of Vero cells in VP-SFM and complete DMEM media(× 20)

图2 VP-SFM 和完全DMEM 培养基中培养的Vero细胞的生长曲线Fig. 2 Growth curve of Vero cells in VP-SFM and complete DMEM media
2.2 β-丙内酯和甲醛CHIKV 灭活效果 灭活24 h,0. 025%和0. 0125% β-丙内酯均能检出活病毒;灭活 48 h,0. 0125% β-丙内酯能检测出活病毒,而0. 025% β-丙内酯未检出活病毒;0. 025%甲醛灭活21 d 未检出活病毒。见图3。

图3 β-丙内酯和甲醛灭活CHIKV 的活性Fig. 3 Activity of CHIKV inactivated with β-propionolactone and formaldehyde
2. 3 含或无血清条件下Vero 细胞扩增CHIKV效果 在不同MOI 条件下,两种培养基中Vero 细胞扩增CHIKV 的滴度均能达到108FPU / mL,差异无统计学意义(t = 0. 86,P > 0. 05),相同代次的 Vero细胞在完全DMEM 培养基中更早出现病变,病毒扩增更快。见图4 和图5。

图4 感染48 h 的 Vero 细胞中CHIKV 的扩增效果(× 4)Fig. 4 Propagation of CHIKV in Vero cells 48 h after infection(× 4)

图5 CHIKV LR2006 毒株在Vero 细胞中的生长曲线Fig. 5 Growth curve of CHIKV LR2006 strain in Vero cells
2. 4 β-丙内酯和甲醛灭活CHIKV 的活性及抗原性 0. 025% β-丙内酯灭活48 h 和0. 025%甲醛灭活21 d 的CHIKV 接种Vero 细胞,未观察到细胞病变,也未观察到荧光,见图6。Western blot 分析显示,0. 025%甲醛灭活 21 d CHIKV 检测出E1 和E2 蛋白,而 0. 025% β-丙内酯灭活 48 h CHIKV 结构蛋白含量较低,见图7。为了比较两种灭活方式作用效果,后续采用0. 025% β-丙内酯灭活48 h 病毒和0. 025%甲醛灭活21 d 病毒进行小鼠免疫。

图6 免疫荧光法检测β-丙内酯和甲醛灭活CHIKV 的活性(× 4)Fig. 6 IFA of activity of CHIKV inactivated with β-propionolactone and formaldehyde(× 4)

图7 β-丙内酯和甲醛灭活 CHIKV E1 和 E2 抗原的Western blot 分析Fig. 7 Western blotting of E1 and E2 antigens of CHIKV inactivated with β-propionolactone and formaldehyde
2. 5 免疫小鼠血清抗体中和效果 甲醛和β-丙内酯灭活试验组小鼠血清荧光数显著少于对照组(F分别为 61. 78 和 34. 62,P 均 < 0. 001),有显著中和效果。血清与 CHIKV 1︰80、1︰160、1︰320、1︰640和1︰1 280 混合的甲醛灭活试验组小鼠血清荧光数小于对应的β-丙内酯灭活试验组(t = 7. 787,P均 < 0. 001)。见图8。

图8 甲醛(A)和β-丙内酯(B)灭活CHIKV 免疫小鼠血清抗体中和试验Fig. 8 Neutralization test of serum antibody in mice immunized with CHIKV inactivated with β-propionolactone (A) and formaldehyde(B)
2. 6 灭活CHIKV 对小鼠的保护效果 对照组小鼠接种CHIKV Ross 毒株第6 天体重平均下降13.98%,甲醛和β-丙内酯灭活试验组小鼠体重未下降,差异有统计学意义(t 分别为 18.51 和 8.461,P<0.001)。qPCR 法检测结果显示,空白组、甲醛灭活试验组和β-丙内酯灭活试验组小鼠脑组织中CHIKV 相对定量值显著低于对照组(t 分别为13.12、14.38 和7.210,P 均< 0. 01)。见图9。小鼠脑组织病理学检查结果显示,对照组小鼠脑组织存在严重炎性细胞浸润,β-丙内酯和甲醛组灭活试验组不明显,见图10。

图9 β-丙内酯和甲醛灭活CHIKV 对小鼠的保护作用Fig. 9 Protective effect of CHIKV inactivated with β-propionolactone and formaldehyde on mice

图10 小鼠脑组织病理检测(× 20)Fig. 10 Pathological examination of mouse brain tissue(× 20)
3 讨 论
近年我国跟非洲、南亚等地交流愈加频繁,而CHIKV 在非洲、南亚等地区高发,输入病例一直呈高位状态。2017 年9 月浙江衢州出现由输入性病例引发的本土病例,共确诊4 例,后因及时处置,疫情得到控制[13],2019 年9—11 月由缅甸输入云南的病例导致出现97 例本地病例[19],河南、湖南等多个省市也出现首例输入病例[20-21]。早期CHIKV 主要发生在非洲等经济相对落后地区,疫苗研究未受到足够重视,随着CHIKV 全球扩散,疫苗研究正受到广泛关注[6,22]。
灭活疫苗技术相对减毒、重组疫苗等其他技术相对成熟,是首要考虑的技术路线。灭活疫苗研发过程包括病毒培养、纯化、灭活和免疫原性、动物安全性、有效性评价,以及临床试验等多个环节。本研究重点关注病毒培养及灭活病毒对动物的保护效果。病毒在无血清培养基中复制,不含污染性血清蛋白,制备出的疫苗也不含任何动物源性潜在病原体,是灭活疫苗制备的发展方向。本研究首先比较含血清和无血清培养条件下CHIKV 扩增滴度,结果显示,CHIKV 在无血清培养基中经过48 ~ 72 h 复制,病毒滴度达到峰值(108PFU / mL),与含血清培养基中病毒滴度峰值无显著差别,可进行病毒的大量扩增。
甲醛和β-丙内酯是成熟的灭活剂,但不同病毒经过两种灭活剂灭活后是否仍然能够保持抗原性尚不确定。本研究分别采用甲醛和β-丙内酯灭活病毒,用氢氧化铝作为佐剂,两次皮下注射成年C57BL/6 小鼠,28 d 后用 20 倍最低致死剂量 CHIKV 对免疫后小鼠进行攻毒,结果显示,免疫后小鼠发病不明显,表明两种灭活病毒均能有效诱导抗体,保护小鼠免受CHIKV 感染。在本研究的实验条件下,甲醛灭活 CHIKV E1 和E2 蛋白抗原性比β-丙内酯灭活CHIKV 强,免疫后小鼠可诱导出更强的中和抗体。
病毒大量扩增及灭活病毒在小鼠模型上具有保护效果是CHIKV 灭活疫苗研发的前提。除此之外,未来还需在病毒纯化方法、免疫原性评价、安全性评价以及非人灵长类动物相关试验等方面开展研究。
