3D打印异烟肼载药微球支架及体外释药研究
2022-01-13周建平张旭婧
谭 浩,周建平,许 燕,张旭婧
(新疆大学 机械工程学院,新疆 乌鲁木齐 830047)
0 引言
骨组织工程是将成骨细胞种植在具有高生物相容性并且可降解的支架上,促进成骨细胞增殖分化为骨骼,同时支架材料逐渐被降解,达到治疗骨缺损的目的[1-3]。现阶段针对疾病性骨缺损,在骨组织工程的基础上,加入了对病灶处的药物精准、持续释放,既保证了骨骼的生长,也促进了疾病的治疗。异烟肼是骨结核治疗的亲水性药物,并常与组织工程骨支架结合使用,但该类药物存在一定的毒副作用,过多药物易使体内脏器受损[4-6],此类药物的控释对载药骨支架应用尤为重要。
3D打印是目前新兴的一种制造方法,利用3D打印技术结合不同患者病灶处的具体情况,能够制备出在外形上与骨缺损地带相匹配的骨支架,通过工艺调节将药物与支架材料相结合打印,实现在病灶处药物投放和缓释,提高药物利用率并大幅度提高治疗效果。湖南大学乔小银[7]通过3D打印的方法制备了负载阿霉素及顺铂双药物的抗癌缓释支架,通过体外以及体内实验,成功抑制原位乳腺癌小鼠的乳腺肿瘤生长,实现了对病灶处的精准靶向治疗。载药微球是可以实现药物缓释的载体,其对药物的包覆是控制药物缓释的重要途径。将微球与骨组织工程支架结合,能够进一步控制支架的药物释速度进而提高药物利用率,减少药物对人体的损伤。
羟基磷灰石(Hydroxy Apatite,HA)是打印骨支架常用的天然骨材料,结合具有良好的生物相容性丝素蛋白(Silk Fibroin,SF)制备支架,能够增加支架的骨诱导性和传导性,促进骨骼生长[8-10]。SF源于蚕丝脱胶而得的纤维状蛋白质,其二级构象以无规线团、α-螺旋及β-折叠形式存在。二级结构可在外界因素如温度、浓度、pH值、应力、离子的影响下由无规线团不稳定结构转化为β-折叠稳定结构。在微球的制备中,聚乳酸-羟基乙酸、壳聚糖、SF是最常用的材料。聚乳酸-羟基乙酸是人工高分子聚合物,微球在使用过程中能够较快降解,但同时会产生酸性环境。壳聚糖、SF同属于天然高分子聚合物,而改变β-折叠结构含量可以调整SF的亲疏水特性,能够进一步调整微球的载药、缓释以及力学性能,因此利用SF制备载药微球,可以在保证微球的生物相容性的同时,进一步优化支架的释药、力学性能。兰州大学的乔永杰、甄平等[11]利用聚乳酸聚羟基乙酸微球搭载了异烟肼以及链霉素药物制备了载药支架,结果表明支架和药物之间具有良好结合性,并具有良好的药物释放效果。燕山大学宋河儒等人[12]利用壳聚糖制备了核壳结构微球,提高了微球的缓释性能。太原理工大学吉立静等人[13]通过自组装的方法,成功制备了负载姜黄素的SF微球,并通过调整微球的大小和乙醇介质的体积分数,实现了对微球释药速率控制。现阶段微球探究已较为完备,通过微球能够很好地调节药物的释放速率,进一步完善药物的控释。
为了制备能够控释药物,并具有高生物相容性的载药微球骨支架,本文以异烟肼作为代表性药物,利用挤出沉积式3D打印法,将SF微球与支架材料混合制备载药骨支架。通过支架材料与药物的量效关系,计算出不同载药量下骨支架所需的总药量,并通过微球的释药机理,探究出微球对支架的缓释、降解、力学性能的影响,为制备可控释载药微球支架提供参考。
1 实验方法
1.1 试剂和仪器
SF(粒径350 nm,新天丝生物技术有限公司);HA(纯度96%,粒径40 nm,南京爱普瑞纳米材料有限公司);异烟肼(上海源叶生物科技有限公司);磷酸盐缓冲液(pH=7.0~7.2,0.006 7 M(PO4),HyClone公司);Span-80、溴化锂、聚乙烯醇(Poly Vinyl Alcohol,PVA)、碳酸钠(北京博奥拓达科技有限公司);数显恒温磁力搅拌器(常州越新仪器制造有限公司);紫外分光光度计(浙江力辰科技有限公司);恒温振荡器(浙江纳德科学仪器有限公司);微机控制电子万能试验机(WDW-20,方辰仪器设备公司),自主研制3D打印机。
1.2 异烟肼标曲
精准称量异烟肼药物50 mg加入100 mL磷酸盐缓冲液(Phosphate Buffer Saline,PBS),配置为500 μg/mL的缓冲液,将其分别稀释成0.1 μg/mL、0.5 μg/mL、1 μg/mL、5 μg/mL、10 μg/mL、15 μg/mL、20 μg/mL的异烟肼标准液,利用紫外分光光度计,得到异烟肼药物标准曲线,检测得到异烟肼药物标准试样溶液的吸光度。经实验测得最大吸光值在262.5 nm处,回归方程为y=0.343 97x-0.016 25,R2=0.994 9。
1.3 SF溶液制备
称取一定质量的蚕茧,以浴比为1∶50加入质量分数0.5%的碳酸钠溶液中,清洗烘干以浴比1∶4浸润于9.3 mol/L的溴化锂溶液中溶解,用去离子水在透析袋中透析4天,每7 h更换溶液,之后离心制备成SF溶液冷藏备用,通过干燥法测量得到SF溶液浓度为3%。
1.4 载药微球制备及性能测试
采用乳化法制备异烟肼微球。将Span-80与液体石蜡共混作为油相,以400 r/min磁力搅拌20 min至充分混匀,将SF溶液与异烟肼按比例混合作为水相。将水相缓慢滴入油相中,油相与水相比例在6∶1~14∶1之间,400 r/min持续搅拌乳化30 min,得到稳定均匀的油包水相(W/O)初乳液,将异丙醇滴入W/O初乳液中持续搅拌30 min。将混合乳液以3 000 r/min离心3次,每次10 min,再用异丙醇洗涤两次,超纯水洗涤一次。离心后收集沉淀物,真空冷冻干燥,获得粉末状异烟肼载药微球。微球形貌电镜图如图1所示,微球表面较为光滑,粒径均匀且成球效果较好。通过吸光度检测得知微球的载药率为3.2%。

图1 载药微球电镜图Fig.1 Electron microscopy of drug-loaded microspheres
1.5 PVA/SF水凝胶制备
通过加热法将PVA与蒸馏水按比例制备成15%浓度的PVA溶液,将SF溶液与PVA溶液按照1∶4质量比混合制备成PVA-SF凝胶。有研究表明SF与PVA结合,可增强水凝胶材料的生物相容性及增加孔隙率,加快支架内外物质的交换速度,促进支架内部药物的释放[14]。
1.6 载药支架制备
1.6.1药物含量计算
由于载药骨支架的药量通常需要根据打印支架的数量或浸泡载药等方式进行后处理计算,而材料遗留以及药物与支架结合方式不稳定将造成较大误差。为此本文采用质量控制法,基于单位材料与单个支架的质量比,得出实验时应加入的药物总质量My,具体计算公式为
(1)
式中,Mo为单个支架质量,Mu为1 g支架材料(HA+β-磷酸三钙)与PVA混合冷冻干燥后的质量,X0为单个支架中应载的药物量,Ma为实验时加入的材料(HA+β-磷酸三钙)总质量。
1.6.2 微球支架制备
按照式(1)和微球的载药率计算出应加入的药量和微球质量,制备成总药量均为18 mg的3组药物粉末。分别为异烟肼纯药物粉末,总药量的3%为微球的混合药物粉末,总药量的6%为微球的混合药物粉末。
将HA与β-磷酸三钙按照质量比3∶2制备成固体打印芯材,分别与3组药物粉末均匀混合加入PVA/SF水凝胶中,按照质量比5∶8均匀搅拌,制作成3种不同微球含量的3D打印芯材。在3D打印机中利用G代码控制机进行支架打印,制备成高1 cm,长、宽0.8 cm的载药支架,最后通过冷冻干燥的方式对支架进行定形处理,3种支架如图2所示。

图2 3D打印载药骨支架Fig.2 3D printed drug-loaded polymer scaffolds
1.7 载药骨支架药物释放性能测试
将3组载药支架放在PBS溶液中,在37 ℃恒温振荡器中累计释药84 d,分别在1 d、2 d、7 d、14 d、28 d、42 d、56 d、70 d、84 d更换并留存缓释液,通过紫外分光光度计分别测出每阶段的药物浓度,累加后得出累计释药率Q,具体计算公式为
(2)
式中,t为测样次数,n为测样总次数,Ct为第t次测得的药物浓度,Vt为第t次测样所取的液体体积,X0为每个支架的载药量。
1.8 载药骨支架体外降解研究
对载药支架采用模拟体液浸泡法对支架进行体外降解研究。将异烟肼载药支架放入PBS缓冲液中,并在恒温振荡器中,37 ℃条件下培养84 d。根据人体体液更换规律,设置每14 d更换一次,设置每2周更换一次PBS溶液,并取出支架进行干燥称重,持续观察支架形貌[15]。
1.9 力学性能测试
将制备的载药支架放在压缩试样机上进行压力测试,设置速度为2 mm/min,通过传感器得到压力数据,并用Origin软件绘制压力/应变曲线。根据压缩强度公式以及弹性模量公式分别计算3组支架的最大抗压强度σmax及弹性模量E:
式中,Fmax为破坏时的最大载荷,A为样本试验接触面面积,F为试验力,L为试样高度,ΔL为轴向变形,σ为正应力,ε为应变。
2 结果与讨论
2.1 载药骨支架药物分析
2.1.1异烟肼微球支架释药量分析
在3种载药支架中各取出3个缓释样品,计算得出3种载药支架前一周的累计药物释放量如图3所示。通过图3可以得出,在1 d及1~3 d时间段内,各组平行支架间药物释放量基本相同,药量误差在10~14 μg范围内,采用SPSS 2.0进行统计学分析,对数据进行组间多重比较,检验水准为α=0.05。经SPSS软件分析得出P>0.05,说明同种支架的差异性不显著。由于前期为支架表面药物释放,支架形貌和结构对药物释放的影响较大会造成较大误差,因此通过3D打印方法控形,结合药物计算,减少了同种支架药物释放的误差,确保了支架药量控制的准确性。2 d后,微球支架药物释放量开始小于纯药物支架。这是由于微球搭载药物存在于微球表面以及微球内部,当微球缓释时会将表面药物优先释放,随着微球的降解微球内部的传质通道逐渐增多、扩大,使微球内部药物缓慢释放,因此加入微球的支架释放速率更为缓慢[16]。

图3 各时间阶段内支架累计释药量Fig.3 Cumulative amount of drug released from stents in each time phase
2.1.2 异烟肼微球支架释药率分析
通过3D打印的方法,保证了支架间形貌的一致,减小了因支架的形貌不同造成的缓释误差。图4是根据式(2)计算出的3种支架的药物累计缓释率,图4(a)为纯药物支架中取出的3个平行支架的累计药物释药率,图4(b)为含有3%药物量微球的平行支架累计药物释药率,图4(c)为含有6%药物量微球的平行支架累计药物释药率。通过图4可以看出,平行支架间的累积释药率趋势基本相同。由于支架结构相同,内部的材料分布情况不同,支架降解、胀大后造成的传质通道不同,药物释放量在后期存在一定的差异,但平行组误差都在1%~2%之间,误差较小,经统计学计算其中(a)、(b)、(c)三组数据均为P>0.05同组间差异性不显著,保证了试验的可重复性。因此通过3D打印的方法制备载药支架可以稳定控制支架中的药物含量和支架的药物释放量,一定程度上减少了相同支架的药物释放误差。
微球通过球壁的传质通道并利用内外药物浓度梯度减缓药物释放,因此可以通过改变微球含量达到减缓支架药物释放速率目的[16]。对3组支架的平行样求均值后数据如图4(d)所示。1~3 d左右3种支架的药物释放量基本相同,在3 d后搭载微球的支架释放速率明显慢于纯药物支架,并且微球的含量越多,缓释速率越缓慢,6%微球支架相比于纯药物支架释药降低了2.27%,由于其释药趋势基本相同,因此推断微球支架可以延长载药时间2.27%,经统计学计算3组支架间的P<0.01,不同组间差异性极其显著,可以说明微球对支架释药性能造成了根本性改变,具有统计学意义。支架的药物释放率和释放模式是由药物扩散以及支架的降解共同决定的[17]。异烟肼为亲水性药物,前期支架表面的药物会大量释放溶解。后期由于支架中PVA与HA的交联致密,结晶程度高,对内部药物释放起到一定的阻碍作用,阻挡了液体在支架内的流动与交换,在支架降解、溶胀时传质通道扩大,药物才能大量释放到支架外;同时基于微球的释药机理,将支架部分药物转化为微球内药物同样减缓了药物的释放[12]。微球以及支架本身的共同影响造成了微球支架释药慢的现象。

图4 载药支架累积释药率Fig.4 Scaffolds cumulative release rate
2.2 载药骨支架体外降解分析
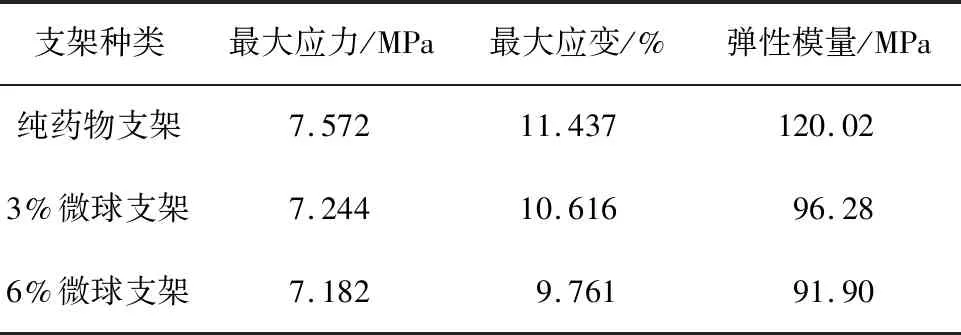
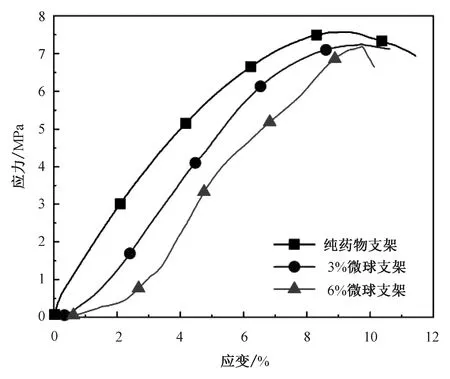
HA作为磷酸钙盐类自然矿化物,其降解主要是溶解、水解、沉淀和相变共同作用的结果[18]。体外缓释主要是水解的方式,由于HA、PVA是难以降解的材料,因此水解作用中体降解速度大于面降解速度,渗水的速率大于水解的速率,使支架的表面降解速度大于内部的降解速度[19-20]。由于支架材料搅拌过程中并不能保证材料均匀分布,因此在降解时会造成一定误差,每次取样从每组支架中取出3个作为平行样,经过统计学分析得平行样间P>0.05,同组间差异性不显著,保证了平行支架的可重复性;对不同实验组间重量进行统计学分析得0.01 表1 载药支架12周降解率Tab.1 Degradation rate of drug-loadedscaffolds at 12 weeks 图5 载药支架质量变化曲线Fig.5 Curve of mass change of drug-loading scaffolds 如表2所示,纯药物支架的最大抗压强度为7.572 MPa,而加入SF微球支架的最大抗压强度分别只有7.244 MPa和7.182 MPa,结合图6所示的应力-应变曲线图,可以看出弹性模量也随微球含量的增加降低,支架的力学性能出现了一定的降低。可能由于微球由SF构成,力学强度低且分子空间体积较大,从而使支架内部孔隙率增加,降低了支架的弹性模量,使支架在同等受力情况下应变扩大[21]。 表2 载药支架压缩性能Tab.2 Compression performance of drug-loaded scaffolds 图6 载药支架应力-应变曲线Fig.6 Stress-strain of drug-loaded scaffolds 本文采用挤出沉积式3D打印技术,选取生物性能较好的HA、SF以及PVA作为支架主体材料,在控制总药量的基础上,制备了纯异烟肼药物支架、3%载药微球支架和6%载药微球支架。通过缓释、降解和力学实验可以得出,SF微球的加入可以减缓支架的释药速率,增加HA支架的降解速率,并在一定程度上降低支架的力学性能。因此,在使用微球的同时需要注意微球对支架力学性能的影响,使微球支架力学性能控制在许用范围之内。通过SF微球改变异烟肼载药支架的释药速率,有利于降低异烟肼药物的毒副作用,对载药微球骨支架的制备以及应用具有一定的借鉴意义,使支架降解速度与骨生长速度相匹配,更好地促进骨骼生长,治疗骨结核等骨缺损性疾病。下一步,需要对支架中的形貌以及降解后支架内部微球形貌进行分析,深度揭示微球对支架的影响机理。

2.3 载药骨支架力学强度分析
3 结论
