电化学氮气还原反应催化剂研究进展
2022-01-13路金伟白浩洋王雪飞
胡 婕,于 洁,路金伟,白浩洋,王雪飞
(1.燕山大学 环境与化学工程学院,河北 秦皇岛 066004;2.燕山大学 河北省应用化学重点实验室,河北 秦皇岛 066004)
0 引言
随着社会的蓬勃发展,化石燃料的消耗日益增多,探索可再生能源、寻找化石燃料的替代物受到了各界学者的广泛关注。氨(NH3)是重要的无碳能源中间体之一,具有氢含量大、能量密度高、零碳排放等优点[1],并被广泛用于化肥、树脂、染料、药物、炸药、合成纤维和各种其他有机和无机化合物的制造[2-5],以满足世界人口日益增长的需求。目前,NH3的生产有两种方法,一种是固氮细菌通过固氮酶进行固氮的自然固氮,另一种是采用传统的Haber-Bosch工艺进行固氮的工业固氮。然而,目前自然固氮已不能满足世界工业快速增长的需求,同时,工业生产氨气仍以H2和N2为原料进行高温高压(20~25 MPa,400~500 ℃)反应为主,需要大量的能源(约世界每年化石能源产出的1%~2%)并且产生大量的二氧化碳(约400 Mt)[6-8]。所以,设计和开发一种可持续的、绿色的固氮方法来替代传统耗资耗能的Haber-Bosch工艺,有着十分重要的意义。
近几十年来,人们一直致力于研究温和条件下的固氮方法,如使用电化学或光化学系统来催化N2的还原。其中,电化学氮气还原反应(nitrogen reduction reaction,NRR)在可再生电力驱动下以水为氢源产生NH3,是最理想的方法之一[9]。然而,这种方法仍然有许多问题没有得到解决。首先,N2分子的吸附能力较差,且其中包含的惰性氮氮三键的裂解能较高(941 kJ/mol)[10],导致反应的动力学缓慢,因此NH3产率非常低。其次,NH3生产的选择性较差,主要是因为在水溶液中,较低过电位下易发生竞争性析氢反应(hydrogen evolution reaction,HER)[11]导致法拉第效率较低。因此,为了降低惰性反应物的活化能障碍,加快电化学NRR过程,设计和合成各种具有NRR活性的电催化剂成为了诸多学者的研究热点。
本文从电化学NRR的反应机理、NRR电催化剂以及相关催化剂的设计策略方面综述了电化学NRR的研究进展,最后对本领域所面临的挑战以及今后的研究发展方向做了总结和展望,以期能给NRR电催化领域的学者一些启发。
1 电化学氮气还原反应机理
到目前为止,已经有很多团队从实验和密度泛函理论(density functional theory,DFT)计算的角度来研究水溶液中非均相催化剂的电化学NRR机制。有人提出,电化学NRR过程是一个复杂的质子耦合电子转移(proton-coupled electron transfer,PCET)过程[12],所以它的反应机理也非常复杂。一般来说,电催化NRR过程有两种基本机制,即解离机制(dissociative pathway)和缔合机制(associative pathway),这两种机制涉及的中间体不同(图1)。对于解离机制,吸附的N2分子首先要经过氮氮三键的断裂,这个过程需要吸收大量的能量,这就解释了为什么遵循解离机制的Haber-Bosch过程需要非常苛刻的条件。
在缔合机制中,在第一个NH3分子形成之前,被吸附的N2分子中两个N原子保持相互结合的状态,并在这种状态下进行加氢过程[13]。根据N2分子吸附在催化剂表面的状态以及加氢的顺序,缔合机制又可分为远端加氢路径、交替加氢路径和酶机制。对于远端加氢路径和交替加氢路径,N2分子垂直吸附在催化剂活性位点上,一个N原子与活性位点结合;酶机制则是N2分子水平吸附在催化剂活性位点上,两个N原子都与活性位点结合。远端加氢路径中,远离吸附端的远端N原子优先氢化直到远端NH3分子释放,剩下的另一个N原子重复同样的氢化过程产生第二个NH3分子。而交替加氢路径则是两个N原子伴随PCET过程轮流交替加氢,两个NH3分子在该路径的最后一步连续释放[14-15]。一般情况下,电化学NRR的限速步骤是加第一个H原子的过程,即由*N2转化为*N2H(*表示N2吸附的活性位点)的过程,而有的催化剂能够改变限速步骤[16],从而减小限速步骤的能垒,相应地,催化剂的性能就好。
最近,Abghoui和Skúlason提出了Mars-van Krevelen (MvK)机制,这种机制只适用于过渡金属氮化物(transition metal nitrides,TMNs),比常规的解离机制和缔合机制更有利于电化学NRR。在MvK机制中,TMNs表面的一个晶格氮原子还原为NH3,随后电解液中的N2分子填充进产生的氮空位中,接着进行加氢过程。DFT计算结果证明,在洁净的过渡金属氮化物表面通过解离机制生成氨气的活化障碍较大,且通过MvK机制预测的过电势比通过缔合机制预测的小[17]。Ren等[18]合成的氮化钼(Mo2N)纳米棒就是通过MvK机制进行电化学NRR的。在氮化钼纳米棒上进行的电化学NRR反应中,电位决定步骤(potential-determining step,PDS)所需的最大自由能(0.66 eV)比在二氧化钼上所需的最大自由能(1.26 eV)小,因此,在相同的条件下氮化钼作为NRR的电催化剂比二氧化钼活性更强。
综上所述,从电化学NRR机理推测,影响NRR电催化剂性能的关键因素为:1)催化剂表面N2分子的吸附与活化;2)电化学NRR的选择性和HER;3)电化学NRR过程中催化剂表面的加氢过程。因此合成能够促进N2分子的吸附与活化、抑制析氢反应并能够降低电化学NRR过程中反应能垒的催化剂是使电催化NRR能够替代Haber-Bosch工艺的关键。
2 电化学氮气还原反应催化剂
常温常压条件下NRR的各种电催化剂,根据其使用成本和稀缺程度一般分为两种:贵金属基催化剂和非贵金属基催化剂。本节讨论了这两种电催化剂在常温常压条件下的电催化NRR性能。表1和表2给出了不同NRR电催化剂的性能总结[19-25]。

表1 贵金属催化剂的电化学NRR性能Tab.1 Performance of noble metal catalyst for electrochemistry NRR

表2 非贵金属催化剂的电化学NRR性能Tab.2 Performance of non-noble metal catalyst for electrochemistry NRR
2.1 贵金属催化剂


图2 SA-Ag/NC上*N2和*NNH的端吸附构型Fig.2 End-on configurations of *N2 and *NNH on SA-Ag/NC
2.2 非贵金属催化剂
贵金属储量低、价格高,严重限制了其应用。相比之下,过渡金属储量丰富,价格低廉。而且,由于过渡金属具有特定的电子结构:具有未占据的d轨道、具有适当能量和对称性的已占据轨道,因此可以作为合成NH3的电催化剂。

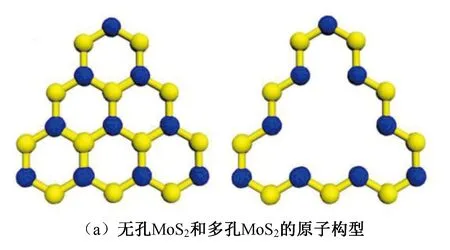
图3 MoS2的原子构型以及N2吸附中间体的结构Fig.3 The atomic configuration of MoS2 and the structures of adsorbed intermediates of N2
除了钼基催化剂,学者们还对Fe基催化剂[38-40]、Cu基催化剂[41]、Bi基催化剂[42]、MXene材料[43-44]等进行了研究,并取得了一定的成果。
过渡金属基催化剂在实际应用中存在一些固有的缺陷:1)大多数过渡金属催化剂由于与N2的结合较弱,对N2的激活能力不够强;2)过渡金属对析氢反应(HER)也有利;3)催化过程中可能会释放过渡金属,造成一些环境问题[45]。近年来,无金属电催化剂由于其对质子的吸附能力弱,产氢性能低,在电化学NRR中引起了广泛关注。目前研究较多的非金属催化剂有碳基催化剂、磷基催化剂等。
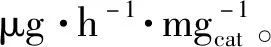

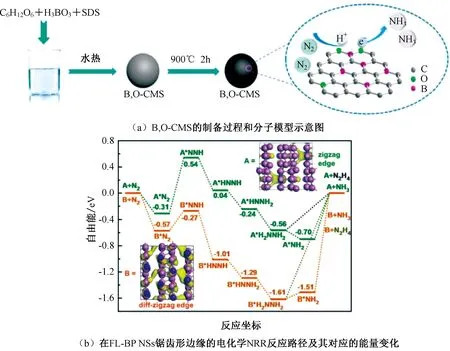
图4 B,O-CMS的制备过程和分子模型示意图以及在FL-BP NSs锯齿形边缘的NRR反应路径及其对应的能量变化Fig.4 Schematic illustration of the fabrication process and molecular model of B,O-CMS,reaction pathways and the corresponding energy changes for the NRR on the zigzag-edge of FL-BP NSs
3 催化剂的设计策略
目前,常温常压条件下电催化NRR存在过电位高、法拉第效率低、NH3产率低等问题,严重阻碍了其发展。克服这些障碍的有效方法是设计高活性、耐用的NRR电催化剂。目前,常用的催化剂设计策略包括表/界面工程(构建异质结、形貌尺寸调控)、晶面调控与非晶化、缺陷工程(空位调控、杂原子掺杂)、构建仿生位点等[51-56]。
3.1 表/界面工程
电化学NRR还原反应通常发生在催化剂表面,所以催化剂的表面性质对其催化活性有较大的影响。通过表/界面工程调控催化剂的外观形貌和电子结构来改善其表面性质是提高催化剂活性的有效策略。
3.1.1 形貌尺寸调控

3.1.2 构建异质结


图5 CoPi/NPCS和CoPi/NPC的扫描电镜图以及MoS2/C3N4的高分辨透射电镜图Fig.5 SEM images of CoPi/NPCS and CoPi/NPC,HRTEM image of MoS2/C3N4
3.2 晶面调控与非晶化
合理调控晶面的原子排列和配位,最大限度地暴露活性位点是一种提高电催化剂活性的有效策略。研究表明,阶梯式晶面是催化剂上良好的活性位点,电化学NRR过程中的中间体与阶梯上的活性位点的结合比与平面上的更强。Bao等[61]发现由{730}晶面族(由(210)和(310)晶面组成)围成的二十四面体金纳米棒具有一定的电化学NRR性能,该催化剂暴露的阶梯{730}晶面族提供了丰富的活性位点(图6(a)),促进了N2的吸附和解离。在-0.2 V vs.RHE电位下得到了1.648 μg·h-1·cm-2的氨产率。
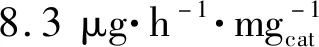
3.3 缺陷工程
3.3.1空位工程
营造空位使催化剂结构含有缺陷,是改善催化剂性能的有效策略之一。研究表明,各种空位的存在可以有效地调节电子结构、电荷输运和表面吸附容量等催化剂的固有性质。因此,这些空位作为多相催化的主要吸附和活性位点,降低了活化能垒,促进了催化反应的进行。目前报道较多的空位有氮空位(nitrogen vacancies,NVs)、硫空位(sulphur vacancies,SVs)、氧空位(oxygen vacancies,OVs)等[65]。



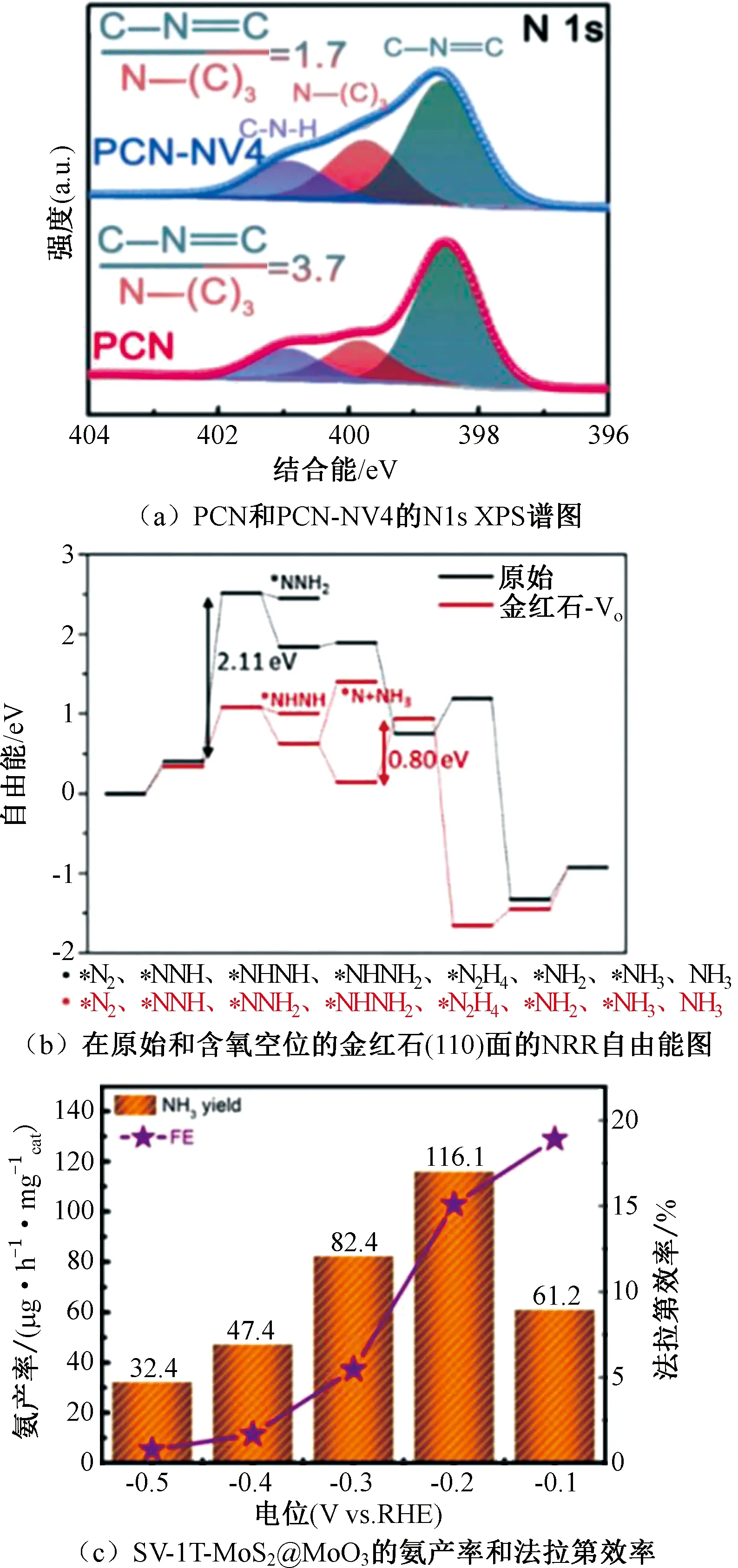
图7 XPS谱图、自由能图以及NH3产率和法拉第效率图Fig.7 XPS spectra、free energy diagram and the picture of NH3 yields and Faradaic efficiencies
3.3.2 杂原子掺杂
杂原子掺杂被认为是调整催化剂电子结构、使催化剂富含缺陷的另一种方法。该方法可以调节催化剂的电荷分布从而调节反应物、中间体和产物在催化剂表面的吸脱附过程。掺杂剂一般可分为两类:非金属掺杂剂和金属掺杂剂。
研究表明,非金属元素硼是一种重要的掺杂元素,Yu等[70]通过将硼酸和氧化石墨烯一起退火合成了硼掺杂石墨烯,掺杂硼原子的石墨烯保留了原来的sp2杂化和共轭平面结构,且硼的掺杂诱导石墨烯形成了电子缺陷,从而大大提高了其电催化NRR活性。DFT计算结果显示,硼元素与石墨烯形成的BC3键既有利于N2的固定,也有利于NH3的脱附,是主要的活性位点(图8(a))。该催化剂表现出较好的催化活性,其NH3产率和法拉第效率分别为9.8 μg·h-1·cm-2和10.8%。除此以外,Liu等[71]制备的硼掺杂金刚石、Lan等[72]制备的纳米多孔硼、Yu等[73]制备的B、S共掺杂铑膜都具有较好的电化学NRR活性。除硼元素外,碳元素、氮元素、磷元素以及硫元素也经常作为掺杂剂对NRR电催化剂进行改性[74-78]。

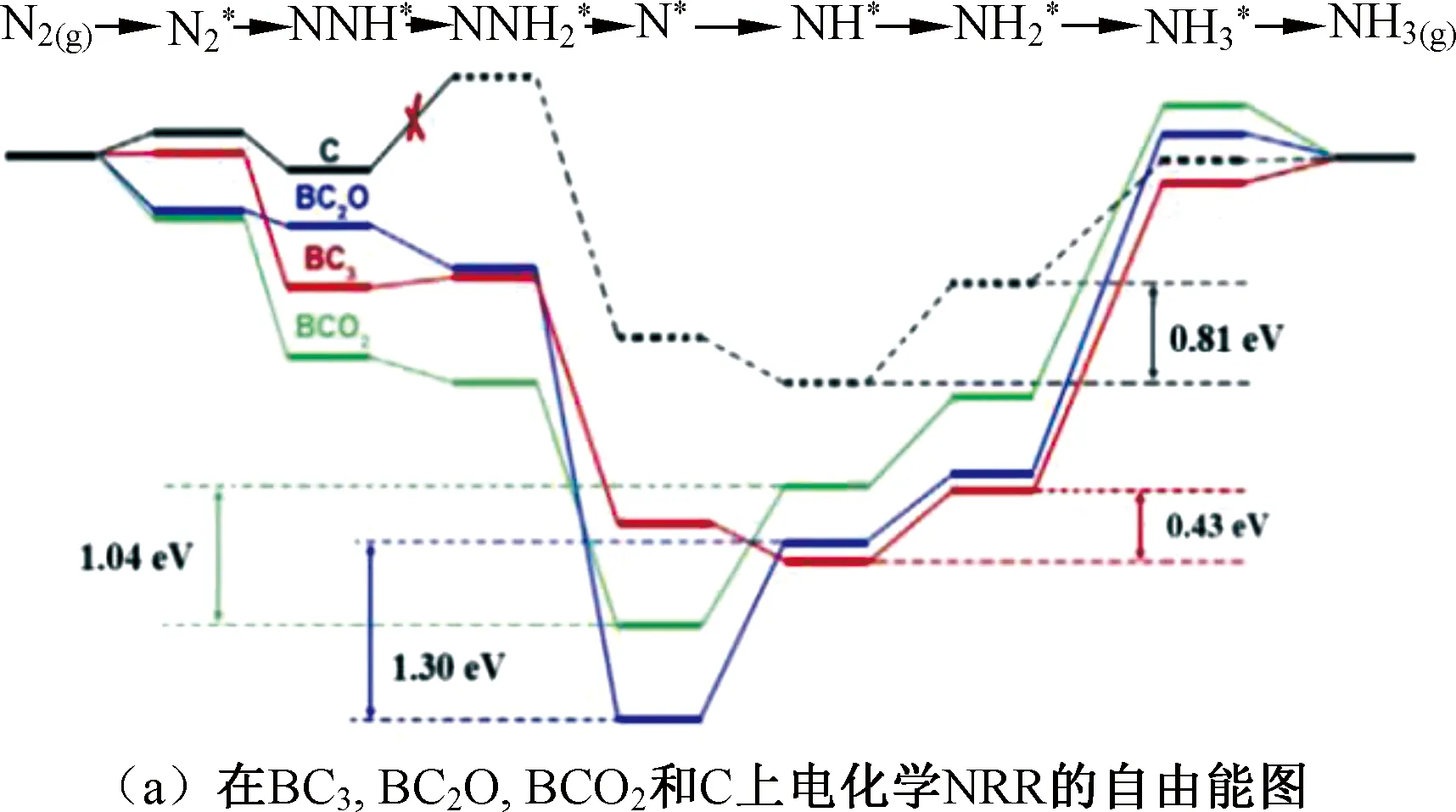
图8 电化学NRR的自由能图以及机理图Fig.8 Free energy and mechanism diagrams of electrochemistry NRR
3.4 构建仿生位点
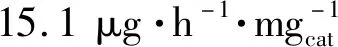


图9 仿生电极-电解质设计的原理图Fig.9 Schematic representation of the biomimetic electrode-electrolyte design
4 总结与展望
电化学NRR作为传统Haber-Bosch工艺的替代无疑具有巨大的潜力,它具有反应条件温和、成本低、零碳排放等优点,能有效缓解能源危机以及二氧化碳大量碳排放导致的全球变暖等问题。然而该方法依然存在一些问题需要解决,如催化剂活性低导致的NH3产率和法拉第效率低、催化剂的稳定性差等。因此,可以从以下几个方面展开工作:
1)提升已有催化剂的催化活性。结合表/界面工程、晶面调控与非晶化、缺陷工程等方法增加催化剂表面的活性位点,改善N2的吸附与活化从而改善催化剂的催化活性。
2)开发新型电化学NRR催化剂。通过仿生、计算等策略有目标地进行催化剂的设计与合成,开发适合电化学NRR的新型催化剂。
3)提高NRR电催化剂的稳定性。一方面可以通过催化剂的设计与调控改善其物理化学性能,从而提高催化剂的稳定性;另一方面,明确催化剂的失活机制,确保活性位点的有效暴露也可以提高催化剂的稳定性。
