蓝莓花色苷对H2O2诱导A549细胞氧化损伤的保护作用
2022-01-10杨兆艳胡红娟王玲丽田艳花
杨兆艳,胡红娟,李 新,王玲丽,田艳花
(1 山西药科职业学院食品工程系 太原 030031 2 山西省食品工业研究所 太原 030031 3 运城学院生命科学系 山西运城 044000)
机体在正常生长代谢过程中产生自由基,而自由基具有多种生理功能,如激活细胞活性,参与信号传导,排除细胞毒素并维持生命所需能量[1]。当体内产生过量的自由基时会导致机体正常细胞组织发生病变,引起氧化应激反应,并促进炎症、癌症和糖尿病等疾病的病理学发展[2-4]。当机体受到内源性损伤和外源性氧化物质刺激时,机体内自由基产生和清除的动态平衡被打破,造成活性氧(Reactive Oxygen Species,ROS)在机体内大量堆积,引起细胞产生毒性作用[5-6]。此外,过量自由基会导致细胞膜发生过氧化,增加膜的通透性[7],同时降低细胞内抗氧化酶系活性,损伤蛋白质和DNA 等物质,并诱导细胞加速凋亡[8]。大量研究表明,通过膳食补充天然抗氧化成分,一方面可以调节机体内自由基水平[9-10];另一方面可增强机体对外界的防御能力,进而有助于维持机体的氧化动态平衡[11-12]。开发具有天然抗氧化活性的功能性食品和药物已成为当前研究的热点。
蓝莓又名越橘,属于杜鹃花科越橘属(Ericaceae Vaccinium.spp)[13],其果实呈现诱人的蓝色,风味独特,主要种植于北美、俄罗斯和中国东北地区。其果实中富含丰富的花色苷、多酚、黄酮、维生素(A,C,E)、必需氨基酸和超氧化物歧化酶等多种活性成分,具有较高的医学和营养价值,深受人们的喜爱[14],其中蓝莓花色苷(Blueberry anthocyanins,BA) 是蓝莓中重要的活性成分之一,被广泛用于保健品和药品等领域。大量研究表明BA 具有抗氧化、抗炎、抗肿瘤、增强视力和防衰老等功效[15]。此外,罗春丽等[16]研究发现紫薯花青素对H2O2引起的HepG2 细胞氧化损伤具有保护作用。林清华[17]研究结果表明BA 可通过提高细胞内抗氧化酶活性,降低CCl4诱导小鼠肝损伤。张震等[18]研究发现BA 能显著降低BGC-823 细胞内ROS 水平,同时细胞内GSH-Px 和CAT 活性显著增加,降低H2O2引起BGC-823 细胞氧化损伤。Tang 等[19]研究发现枸杞花色苷提取物通过促进细胞增殖,减轻脂质过氧化和调节内源性细胞抗氧化酶活性(GSH-Px、SOD 和CAT)来抑制H2O2诱导的PC12 细胞氧化损伤。刘玲玲等[20]研究结果表明花青素通过减少细胞内ROS 含量和抑制H2O2对JNK 的激活,从而减轻阿尔茨海默症模型细胞的氧化损伤。目前关于BA 对H2O2诱导A549 细胞氧化损伤保护作用及机制尚不明确。
鉴于此,本研究采用H2O2诱导A549 细胞来构建氧化损伤模型,采用MTT 法检测细胞存活率,确定H2O2浓度、处理时间及BA 浓度范围。采用流式细胞分析仪测定细胞内ROS 水平及凋亡率。ELISA 法检测胞内抗氧化酶(GSH-Px、SOD、CAT)活性及MDA 水平。RT-PCR 技术测定细胞内抗氧化酶和凋亡相关蛋白的mRNA 表达量,Western blot 法检测凋亡相关的蛋白表达量。通过上述研究评价BA 对H2O2诱导A549 细胞氧化损伤的保护作用及机制,为蓝莓功能性食品开发和抗氧化药物研究提供理论依据。
1 材料与方法
1.1 材料与试剂
蓝莓,2019年5月购于东北小兴安岭;BA,实验室经超声提取获得;人肺癌A549 细胞,北京协和细胞库;H2O2,国药集团化学试剂有限公司。MTT,北京碧云天生物科技研究所;二甲基亚砜(DMSO),上海莱昂生物科技有限公司;DMEM 和双抗(青霉素/链霉素),日本同仁公司;胎牛血清(FBS),美国Sigma 公司;胰蛋白酶消化液,美国HyClone 公司;谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)、丙二醛(MDA)、过氧化氢酶(CAT)和活性氧(ROS)试剂盒,南京建成生物工程研究所;磷酸盐缓冲液(PBS)、蛋白浓度测定试剂盒(BCA)、细胞裂解液(RIPA),北京佛博生物科技有限公司;TRIzol 试剂,赛默飞世尔科技(中国)有限公司;Bcl-2、Bax、Cytochrome c、Caspase-3/9 和GADPH 抗体,美国CST 公司;其余试剂均为分析纯。
1.2 仪器与设备
ZE5 流式细胞分析仪,美国BIO-RAD 公司;FV3000 激光共聚焦显微镜,美国Thorlabs 公司;DHP-9402 CO2恒温培养箱,杭州俊升科学器材有限公司;EVOS M7000 倒置显微镜和电泳仪,赛默飞世尔科技(中国)有限公司;FD-1A-50 真空冷冻干燥机,江苏天翎仪器有限公司;SHZ-D(Ⅲ)型循环水式真空泵,巩义仪器有限责任公司;RE-52AA 型旋转蒸发仪,上海亚荣生化仪器厂;TG18K-Ⅱ型高速冷冻离心机,上海赵迪生物科技有限公司;JC-1086C Pro 全自动酶标分析仪,青岛聚创环保仪器有限公司。
1.3 方法
1.3.1 BA 制备 采用超声辅助提取法提取BA。具体操作如下:准确称取2 kg 蓝莓,将其打浆冻干成果粉,提取工艺参数设置为:超声功率350 W,乙醇体积分数60%,提取时间25 min,提取温度50 ℃,料液比1∶30 g/mL。在此条件下进行提取,BA 提取率86.15%,将提取液真空抽滤冻干,制得BA 粉末,备用。
1.3.2 细胞培养 将A549 细胞接种于DMEM 培养基(10% FBS 和1%双抗)中,然后将其置于37℃、5% CO2恒温培养箱中培养。当细胞铺满培养皿底70%~80%时,将细胞进行传代,本研究均采用对数期细胞进行后续试验。
1.3.3 H2O2诱导A549 细胞氧化损伤模型的建立按照6×103个/孔的细胞密度将对数期A549 细胞接种于96 孔板中,每孔200 μL,在37 ℃、5% CO2条件下培养24 h,待细胞完全贴壁时,弃去上清,加入用DMEM 培养基配制的不同浓度(0,50,100,200,400,800,1 600 μmol/L)H2O2溶液,分别处理3,6,9,12,24,48 h,每个浓度设置6 个复孔,随后弃上清,用PBS 洗涤2 次,然后每孔加入200 μL DMEM 和20 μL(5 mg/mL)MTT,培养4 h,弃上清,每孔再加入150 μL DMSO,振荡15 min,使蓝色结晶溶解,置于酶标仪中在490 nm 处测定其吸光值。依据式(1)计算细胞存活率[21]。
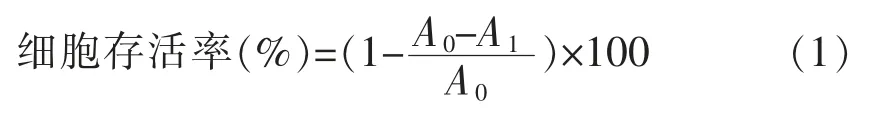
式中:A0——空白组的平均吸光度;A1——不同浓度H2O2处理组的平均吸光度。
1.3.4 BA 剂量的筛选 细胞培养操作同1.3.3节,仅将加入的不同浓度H2O2,换成用DMEM 培养基配制的不同质量浓度(0,30,60,90,180,360 mg/mL)BA,依据式(1)计算细胞存活率。
1.3.5 BA 对H2O2诱导A549 细胞存活率的影响采用MTT 方法测定细胞存活率。将对数期A549细胞(6×103个/孔)接种于96 孔板中,在37 ℃、5%CO2条件下培养12 h,然后每孔加入400 μmol/L H2O2溶液处理24 h,随后每孔加入用DMEM 培养基配制的不同质量浓度 (0,30,60,90 mg/mL)BA干预24 h,后续操作同1.3.3 节,依据式(1)计算细胞存活率。
1.3.6 BA 对H2O2诱导A549 细胞内ROS 的影响利用DCFH-DA 荧光探针检测BA 对H2O2诱导A549 细胞内ROS 的影响。按照细胞密度5×104个/孔将对数期A549 细胞接种于6 孔板中,培养12 h,每孔加入400 μmol/L H2O2培养24 h,然后每孔用不同质量浓度 (0,30,60,90 mg/mL)BA 干预24 h,最后每孔加入终浓度5 μmol/L DCFHDA 荧光探针,在4 ℃条件下,避光反应20 min,吸取探针,细胞用PBS 洗涤2 次,随后利用胰蛋白酶将其消化,离心弃上清液,PBS 重悬,并采用流式细胞分析仪测定每孔样品的荧光强度。
1.3.7 BA 对H2O2诱导A549 细胞MDA 水平的影响 利用南京建成生物工程研究所提供的试剂盒检测BA 对H2O2诱导A549 细胞的MDA 水平的影响。选取对数期A549 细胞(5×104个/孔)接种于6 孔板中,在37 ℃、5% CO2条件下培养12 h,随后每孔加入400 μmol/L H2O2培养24 h,然后每孔用不同质量浓度(0,30,60,90 mg/mL)BA 干预24 h,最后每孔加入100 μL 细胞裂解液,在4 ℃、1 600 g 离心15 min,取上清液作为样本,利用试剂盒检测样品中MDA 含量。
1.3.8 BA 对H2O2诱导A549 细胞内抗氧化酶系的影响 采用试剂盒检测BA 对H2O2诱导A549细胞内抗氧化酶系的影响。将对数期A549 细胞(5×104个/孔)接种于6 孔板中,在37 ℃、5% CO2条件下培养12 h,在每孔中加入400 μmol/L H2O2培养24 h,然后加入不同质量浓度(0,30,60,90 mg/mL)BA 干预24 h,弃去培养液,用预冷的PBS洗涤2 次,刮下细胞置于1.5 mL 离心管中,加入RIPA 细胞裂解液,在4 ℃、12 000 g 离心15 min,取上清液作为样本。利用试剂盒检测上清液中GSH-Px、SOD 和CAT 活性。
1.3.9 BA 对H2O2诱导A549 细胞凋亡的影响取对数期A549 细胞 (2.5×105个/孔) 接种于60 mm 细胞培养皿,在37 ℃、5% CO2条件下培养12 h,在每个皿中加入400 μmol/L H2O2培养24 h,然后加入不同质量浓度(0,30,60,90 mg/mL)BA 干预24 h,弃去培养液,用胰蛋白酶消化,收集细胞,用PBS 洗2 次,采用Annexin V-FITC/PI 双标记染色法流式检测细胞凋亡。同时利用Hoechst 33342 对细胞核进行染色,利用激光共聚焦显微镜观察细胞核形态。
1.3.10 RT-PCR 法检测BA 对H2O2诱导A549 细胞 内GSH-Px、SOD、CAT、Bcl-2、Bax、Cytochrome c 和Caspase-3/9 mRNA 表达水平的影响 按照细胞密度为5×104个/孔将对数期A549 细胞接种于6 孔板中,在37 ℃、5% CO2条件下培养12 h,随后每孔加入400 μmol/L H2O2培养24 h,然后每孔用不同质量浓度 (0,30,60,90 mg/mL)BA 干预24 h。利用TRIZOL 试剂提取每组细胞的RNA。根据Primer 5.0 设计引物序列,引物序列如下表所示。
按照反转录试剂盒说明进行逆转录,然后RT-PCR 检测GSH-Px、SOD、CAT、Bcl-2、Bax、Cytochrome c 和Caspase-3/9 转录水平表达。选取GAPDH 作为内参,以GSH-Px、SOD、CAT、Bcl-2、Bax、Cytochrome c 和Caspase-3/9 与GAPDH 的mRNA 表达含量比值作为待测基因相对mRNA 表达水平。反转录程序如下:95 ℃保持5 min;94 ℃保持15 s;55 ℃保持20 s;72 ℃保持20 s,40 个循环;设定收集荧光,每个处理重复3 次,2ΔΔct法计算待测基因的相对含量。

1.3.11 BA 对H2O2诱导A549 细胞内相关凋亡蛋白表达量的影响 采用蛋白印迹法测定BA 对H2O2诱导A549 细胞内相关凋亡蛋白表达量的影响。将对数期A549 细胞接种于60 mm 细胞培养皿(2.5×105个/孔),在37 ℃、5% CO2条件下培养12 h,每皿中加入400 μmol/L H2O2培养24 h,然后加入不同质量浓度 (0,30,60,90 mg/mL)BA 干预24 h,随后加入100 μL RIPA 细胞裂解液提取细胞总蛋白,利用BCA 试剂盒测定总蛋白含量。蛋白测定后,取20 μL 蛋白样品上样于5%~10%SDS-PAGE 凝胶,电泳分离,冰浴下将其转移至PVDF 膜上,采用5%脱脂奶粉25 ℃摇床封闭1 h,加入对应的一抗4 ℃孵育过夜。次日换为HRP标记的二抗孵育1 h,采用ECL 化学发光显影,通过凝胶成像检测Bcl-2、Bax、Cytochrome c、Caspase-3/9 和GADPH 的蛋白表达水平。结果利用Image Lab 软件对相应蛋白表达水平进行定量分析。

表1 内参及目的基因引物序列Table 1 Primer sequence of target genes involved
1.3.12 数据处理 每组试验重复3 次,结果用平均值±标准差表示;采用Statistix8.0 软件对每组试验数据进行方差分析(ANOVA);采用SAS8.0 软件分析结果的显著差异;Origin9.0 进行绘图。
2 结果与分析
2.1 H2O2 浓度和处理时间的确定
采用H2O2诱导A549 细胞建立氧化损伤模型,其结果如图1所示。由图1可知,在不同处理时间下,不同浓度的H2O2均对A549 细胞的生长产生一定的抑制作用,且细胞的存活率均随H2O2浓度增加和处理时间的延长而降低。与空白对照相比,不同浓度H2O2和处理时间均显著抑制A549 细胞存活率(P<0.05)。当H2O2浓度和处理时间分别在400 μmol/L 和24 h 时,细胞存活率达到(50.86±3.06)%。H2O2浓度过高和处理时间过长时,A549 细胞损伤越严重;但当H2O2浓度过低和处理时间较短时,A549 细胞损伤不明显。熊存全等[22]研究发现细胞存活率约为50%时,对应的H2O2浓度及处理时间作为氧化损伤模型的最适条件。因此,本研究选择H2O2浓度和处理时间分别为400 μmol/L 和24 h 来构建细胞氧化损伤模型,并用于后续试验。
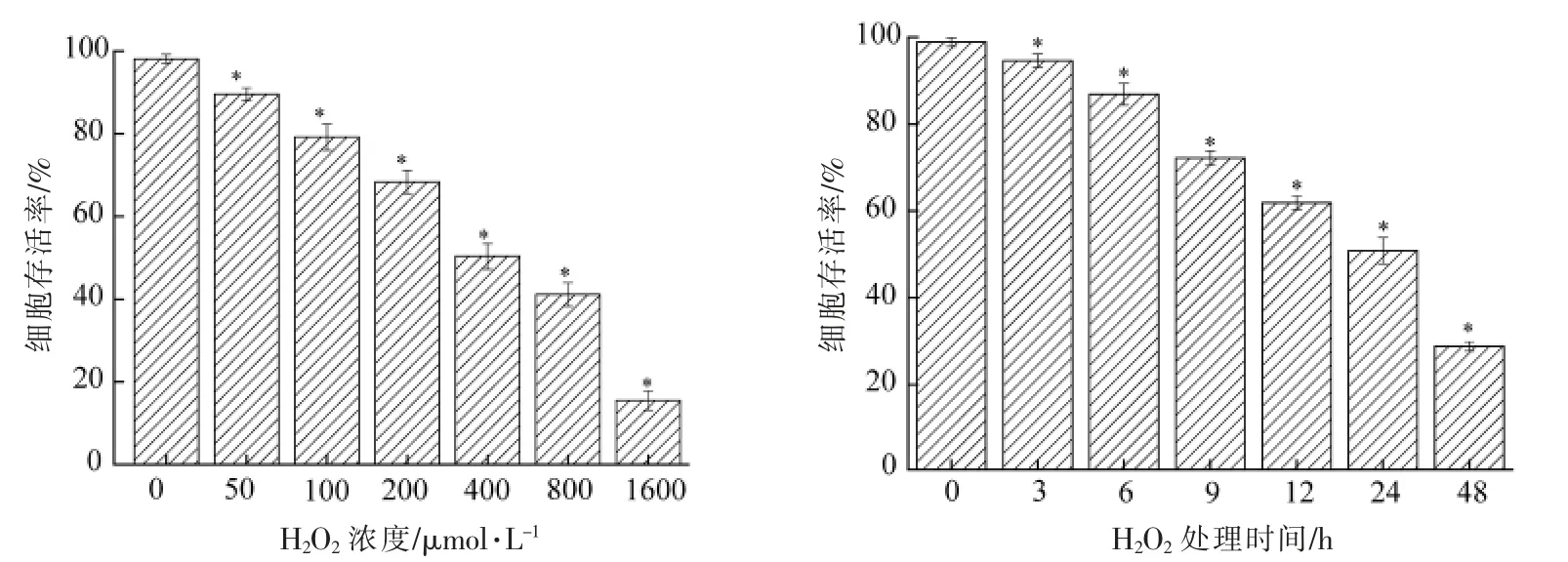
图1 H2O2 浓度(a)和处理时间(b)对A549 细胞存活率的影响Fig.1 Effect of H2O2 concentration (a) and treatment time (b) on the survival rate of A549 cells
2.2 BA 浓度的筛选
不同质量浓度(0,30,60,90,180,360 mg/mL)BA 作用A549 细胞24 h 后,由图2a 观察可知,当BA 质量浓度在0~90 mg/mL 时,细胞完全贴壁,紧密相连,且细胞数目无显著变化。由图2b 可知,在此浓度范围内,随BA 浓度增加A549 细胞存活率无显著变化(P>0.05)。结果表明BA 质量浓度在0~90 mg/mL 时对A549 细胞无毒性作用。当BA质量浓度在180~360 mg/mL 范围内,随BA 浓度增加A549 细胞数目显著降低,漂浮细胞增多,同时细胞存活率显著降低(P<0.05)。由此说明高浓度BA 对A549 细胞具有毒性作用。故选择BA 质量浓度为30,60,90 mg/mL 进行后续试验。

图2 不同浓度BA 对A549 细胞形态(a)和存活率(b)的影响Fig.2 Effects of different concentrations of BA on morphology (a) and survival rate (b) of A549 cells
2.3 BA 对H2O2 诱导A549 细胞存活率的影响
细胞存活率能直观反映外界环境对细胞损伤程度的影响。当细胞受到氧化应激时,导致细胞内活性氧水平增加,对A549 细胞造成氧化损伤,进一步诱导其凋亡[23]。因此,细胞存活率的降低是成功建立氧化损伤模型的重要标志之一。H2O2性质稳定,是一种重要的活性氧分子,通常用于建立体外氧化损伤模型。因此,本研究利用H2O2诱导A549 细胞建立体外氧化损伤模型,其结果如图3所示。由图3可知,与空白对照相比,H2O2诱导组A549 细胞存活率显著降低 (P<0.05)。结果表明H2O2诱导A549 细胞建立氧化损伤模型成功。与模型组相比,低剂量(30 mg/mL)BA 对细胞存活率无显著影响(P>0.05),中剂量(60 mg/mL)和高剂量(90 mg/mL)BA 均能显著提高细胞存活率(H2O2<0.05)。结果表明BA 对A549 细胞具有一定的保护作用,能缓解H2O2对A549 细胞的氧化损伤。

图3 BA 对H2O2 诱导A549 细胞存活率的影响Fig.3 Effect of BA on the survival rate of A549 cells induced by H2O2
2.4 BA 对H2O2 诱导A549 细胞内ROS 的影响
活性氧(ROS)包含羟自由基、单线态氧和超氧阴离子等,在正常生理状态下,ROS 的产生和清除处于动态平衡过程,适量ROS 能提高巨噬细胞的吞噬能力和机体的免疫能力[24-25]。但在外界刺激时,细胞内产生大量的ROS,过量的ROS 对细胞的细胞膜、蛋白质和核酸造成氧化损伤,最终导致细胞凋亡[26]。利用DCFH-DA 荧光探针检测BA 对H2O2诱导A549 细胞内ROS 的影响,其平均荧光强度大小直观反映ROS 水平。由图4可知,与正常对照组相比,模型组ROS 水平显著增加(P<0.05)。进一步表明H2O2诱导A549 细胞的氧化损伤模型建立成功。与模型组相比,BA 低、中和高剂量组均能显著降低细胞内ROS 水平(P<0.05),且呈剂量效应。试验结果表明BA 能有效抑制H2O2引起A549 细胞内ROS 水平升高,降低ROS对细胞膜和胞内物质的氧化损伤,进一步发挥抗氧化应激的保护作用。

图4 BA 对H2O2 诱导A549 细胞内ROS 水平的影响Fig.4 Effect of BA on ROS levels in A549 cells induced by H2O2
2.5 BA 对H2O2 诱导A549 细胞MDA 水平的影响
机体自身存在抗氧化调控系统,在一定程度上能抵抗外界氧化应激导致的机体损伤[27]。但当机体发生强烈的氧化应激,且抗氧化体系无法修复机体损伤时,则首先引起细胞膜上不饱和脂肪酸发生过氧化,其主要的代谢产物为MDA。因此,MDA 水平的高低直接反映细胞膜受到自由基氧化损伤的严重程度[28]。本研究利用试剂盒检测BA对H2O2诱导A549 细胞MDA 水平的影响,其结果如图5所示。由图5可知,与正常组相比,模型组中MDA 水平显著升高(P<0.05);与模型组相比,BA 低、中、高剂量组均能显著降低MDA 水平(P<0.05),且呈剂量效应。试验结果表明H2O2导致A549 细胞发生严重的氧化损伤,而BA 能显著缓解活性氧对细胞膜脂质氧化损伤的影响,同时能抑制自由基对机体的氧化损伤。

图5 BA 对H2O2 诱导A549 细胞的MDA 水平的影响Fig.5 Effect of BA on MDA level of A549 cells induced by H2O2
2.6 BA 对H2O2 诱导A549 细胞内抗氧化酶系的影响
机体自身存在两大抗氧化体系(酶抗氧化体系和非酶抗氧化体系) 来共同抵御外界氧化应激原[29]。其中GSH-Px、SOD 和CAT 是抗氧化酶的重要组成部分。SOD 和CAT 是抵御外界氧化应激刺激的第一道防线;GSH-Px 在机体内作为一种重要的过氧化物分解酶,能催化GSH 和过氧化物还原成无毒的羟基化合物和GSSG,从而有效抑制过氧化物的损伤。机体抗氧化物酶系在发挥机体抗氧化和调节氧化应激动态平衡中起到至关重要的作用,抗氧化酶活力的高低直接反映出机体对外界氧化应激损伤的调控能力。为探究BA 是否通过提高细胞内抗氧化酶活性来降低H2O2诱导A549细胞氧化损伤,本研究利用抗氧化酶试剂盒测定BA 对H2O2诱导A549 细胞内GSH-Px、SOD 和CAT 活性的影响,其结果如图6所示。由图6可知,与空白对照组相比,模型组中GSH-Px、SOD和CAT 活性均显著降低(P<0.05);与模型组相比,BA 低、中和高剂量组均能显著提高GSH-Px、SOD和CAT 活性(P<0.05)。试验结果表明H2O2破坏A549 细胞的氧化调节系统,降低细胞内抗氧化酶的活力,使得A549 细胞内氧化动态被打破和胞内MDA 水平增加,导致细胞发生不可逆的氧化损伤,进一步说明H2O2诱导A549 细胞氧化损伤模型构建成功。而经过BA 干预后,能有效抑制H2O2造成的胞内抗氧化酶活性的降低,并降低胞内MDA 水平,对氧化损伤具有较好的保护作用,同时能提高机体对外界氧化应激的调控能力。该结果与BA 能缓解H2O2所引起的细胞存活力降低和ROS 水平增加的结果一致。

图6 BA 对H2O2 诱导A549 细胞内GSH-Px(a)、SOD(b)和CAT(c)活性的影响Fig.6 Effect of BA on GSH-Px (a),SOD (b)and CAT (c) activities in A549 cells induced by H2O2
2.7 BA 对H2O2 诱导A549 细胞内抗氧化酶系mRNA 表达量的影响
通过2.6 节研究发现BA 能显著抑制H2O2所导致A549 细胞内GSH-Px、SOD 和CAT 活性降低。为从基因层面上进一步探究BA 是否能提高A549 细胞内GSH-Px、SOD 和CAT 活性,来抵御H2O2诱导A549 细胞氧化损伤。本研究通过RTPCR 技术检测GSH-Px、SOD 和CAT 相对mRNA表达量,其结果如图7所示。由图7可知,与空白对照组相比,经H2O2处理A549 细胞,细胞内GSH-Px、SOD 和CAT 相对mRNA 表达量显著降低(P<0.05)。与H2O2处理组相比,BA 试验组均能显著提高GSH-Px、SOD 和CAT 相对mRNA 表达量(P<0.05),且呈浓度依赖性。该试验结果与试剂盒检测结果一致。进一步证明BA 是通过提高胞内抗氧化酶活性,抵御H2O2诱导A549 细胞氧化损伤。

图7 BA 对H2O2 诱导A549 细胞内GSH-Px(a)、SOD(b)和CAT(c)mRNA 表达量的影响Fig.7 Effect of BA on the expression of GSH-Px (a),SOD (b) and CAT (c) mRNA in A549 cells induced by H2O2
2.8 BA 对H2O2 诱导A549 细胞凋亡的影响
在正常情况下,氧化应激在机体内是存在的,且是机体内不可避免的一种状态。机体自身的适应机制保护细胞免受不同程度的氧化损伤,外界的各种刺激往往能破坏氧化应激的平衡状态,促使细胞凋亡甚至导致各种疾病的发生[30]。本研究首先通过Hoechst 33342 染色观察BA 对H2O2诱导A549 细胞核荧光强度的影响,其结果如图8a所示。由图8a 可知,未经H2O2处理的对照组A549 细胞核呈淡蓝色;在模型组中,H2O2处理A549 细胞能增加细胞核的荧光强度;而经低、中、高剂量的BA 干预A549 细胞后,细胞核的荧光强度逐渐降低。结果表明BA 能抑制H2O2诱导的细胞凋亡。为进一步探究BA 对H2O2诱导A549 细胞凋亡率的影响,本试验采用流式细胞仪进行分析研究,其结果如图8b 和8c 所示。由图8c 可知,与对照组相比,H2O2处理A549 细胞使细胞凋亡率显著增加(P<0.05);而经低、中、高剂量组的BA干预后,细胞凋亡率显著降低(P<0.05),且呈显著的剂量关系。结果表明H2O2处理显著增加A549细胞凋亡率,而BA 能有效抑制H2O2诱导的细胞凋亡,从而保护细胞免受氧化损伤。

图8 BA 对H2O2 诱导A549 细胞凋亡的影响Fig.8 Effect of BA on apoptosis of A549 cells induced by H2O2
2.9 BA 对H2O2 诱导A549 细胞内凋亡相关基因表达的影响
由2.8 节研究结果可知BA 能显著抑制H2O2所导致A549 细胞凋亡,为探究BA 保护H2O2诱导A549 细胞氧化损伤机制,本研究首先采用RTPCR 技术探究BA 对H2O2诱导A549 细胞内凋亡相关基因表达的影响,其结果如图9所示。H2O2处理A549 细胞24 h 后,Bcl-2/Bax 相对mRNA 表达量显著低于空白对照组 (P<0.05),而Cytochrome c、Caspase-9 和Caspase-3 相对mRNA表达量显著高于空白对照组 (P<0.05)。采用高、中、低剂量的BA 干预H2O2诱导A549 细胞,研究发现BA 显著增加Bcl-2/Bax 相对mRNA 表达量和降低Cytochrome c、Caspase-9 和Caspase-3 相对mRNA 表达量(P<0.05),呈剂量效应。研究结果表明BA 通过上调Bcl-2/Bax 相对mRNA 表达量,下调Cytochrome c、Caspase-9 和Caspase-3 相对mRNA 表达量,来抵抗H2O2诱导A549 细胞氧化损伤。

图9 BA 对H2O2 诱导A549 细胞的Bcl-2/Bax(a)、Cytochrome c(b)、Caspase-9(c)和Caspase-3(d)相对mRNA 表达量的影响Fig.9 Effect of BA on the expression mRNA levels of Bcl-2/Bax (a),Cytochrome c (b),Caspase-9 (c)and Caspase-3 (d) in A549 cells induced by H2O2
2.10 BA 对H2O2 诱导A549 细胞内相关凋亡蛋白表达的影响
在真核生物中,线粒体作为能量和代谢的中心,为细胞的生命活动提供必要的基础能量,同时参与细胞的代谢调控。许多外界因素(死亡受体信号、生长因子抑制剂、抗癌药物等)会造成线粒体功能损伤,引起细胞凋亡[31]。线粒体直接决定细胞的生存与死亡,在各种信号通路中起着关键性作用,其功能作为凋亡途径上游与天冬氨酸特异性的半胱氨酸蛋白水解酶、下游死亡执行器之间连接[32]。大量研究表明H2O2可以激活“内源性凋亡”或线粒体凋亡途径,导致细胞氧化损伤,或启动内源性凋亡途径和激活Bcl-2 家族。线粒体通路上的Bcl-2 家族在细胞凋亡中发挥“主开关”作用,并且Bcl-2/Bax 的比值大小直观反映细胞受到凋亡刺激时的生存状态,其中抗凋亡蛋白Bcl-2 可通过抑制Bax 激活,阻止Bax 破坏线粒体外膜完整性并抑制Cytochrome c 的释放和Caspase 前体激活,最终抑制细胞的凋亡[33-34]。为进一步探究BA对H2O2诱导A549 细胞的保护作用机制,本试验在2.9 节结果的基础上,进一步采用Western blot检测BA 对相关凋亡蛋白表达量的影响,其结果如图10所示。由图10可知,与对照组相比,模型组Bcl-2/Bax的比值显著下调(P<0.05),Cytochrome c、Caspase-9 和Caspase-3 相对蛋白表达量均显著上调(P<0.05);与模型组相比,BA 低、中、高剂量组均能显著上调Bcl-2/Bax 的比值,显著下调Cytochrome c、Caspase-9 和Caspase-3 相对蛋白表达量,且呈剂量效应(P<0.05)。结果表明H2O2激活线粒体凋亡通路和Caspase-3 凋亡通路,导致A549 细胞存活率降低,而BA 可显著抑制H2O2诱导A549 细胞内凋亡相关蛋白表达。进一步说明BA 可通过协助细胞抵御氧化应激对线粒体和DNA 的损伤,降低细胞氧化损伤和提高机体抗氧化应激的调控能力。
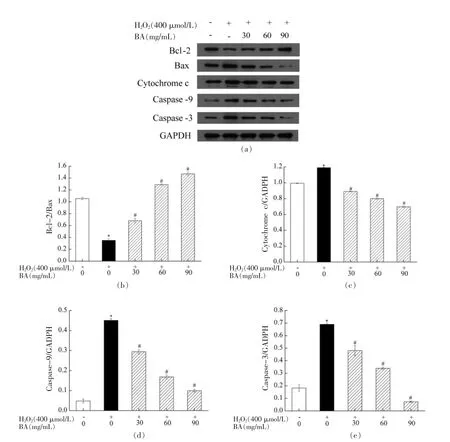
图10 BA 对H2O2 诱导A549 细胞的Bcl-2/Bax(b)、Cytochrome c(c)、Caspase-9(d)和Caspase-3(e)相对蛋白表达量的影响Fig.10 Effect of BA on the relative protein expression levels of Bcl-2/Bax (b),cytochrome c (c),caspase-9 (d)and caspase-3 (e) in A549 cells induced by H2O2
综合以上的研究结果可知,当A549 细胞受到氧化应激原刺激后,首先会引起细胞内的ROS 增加,使细胞膜脂质过氧化产生大量的MDA 产物。为抵抗外界氧化应激原刺激和维持细胞正常的生长,机体的抗氧化酶系发挥作用,但当外界刺激程度过强时,自身的抗氧化酶系无法弥补外界刺激造成的细胞损伤,就会导致大量的抗氧化酶消耗和活性降低,氧化动态平衡被打破,导致细胞膜的通透性增强,并对线粒体和DNA 造成损伤,引起线粒体通路中的Bcl-2/Bax 的比值下调,Cytochrome c、Caspase-9 和Caspase-3 的mRNA 和蛋白表达量上调,诱导其凋亡,最终使细胞的存活率降低和凋亡率增加。本研究结果显示,BA 能提高A549 细胞存活率,降低MDA 和胞内ROS 水平,抑制H2O2所引起的抗氧化酶活力降低和相关凋亡蛋白的表达水平。这与Zhang 等[35]、Tang 等[19]和Isaak 等[36]的研究结果一致。
3 结论
试验以BA 为研究对象,以H2O2诱导A549细胞建立氧化损伤模型,分别从细胞存活率、凋亡率、MDA 和胞内ROS 水平、抗氧化酶活性及其基因表达、凋亡相关基因和蛋白表达量来探讨BA对H2O2诱导A549 细胞氧化损伤的保护作用及其作用机制。结果表明,BA 能显著抑制H2O2引起的A549 细胞存活率降低,同时降低细胞凋亡率、MDA 和胞内ROS 水平,提高抗氧化酶系酶活力和抗氧化酶相对mRNA 表达,并上调Bcl-2/Bax的比值和下调Cytochrome c、Caspase-9 和Caspase-3 相对mRNA 和蛋白表达量。进一步说明BA 能通过抑制细胞凋亡通路蛋白的表达,提高细胞的抗氧化酶活性,清除胞内过量ROS,从而达到缓解H2O2对A549 细胞造成的损伤。
