固相萃取/气相色谱-串联质谱法测定水产品中莠去津及其代谢物残留
2022-01-09甘欣甜张蓉蓉孙爱丽
甘欣甜,薛 颖,张蓉蓉,孙爱丽*
(1.宁波大学 海洋学院,浙江 宁波 315823;2.宁波大学 食品与药学学院,浙江 宁波 315823)
莠去津(ATR)又称阿特拉津,是一种人工合成的三嗪类除草剂,由于其价格低和持久稳定等特点,已成为世界产量最大的除草剂之一,也是世界玉米种植产业中使用量最多的除草剂之一。目前已在全球超70多个国家注册使用,年消耗量高达7~9万吨[1-2]。自20世纪80年代初被引进以来,我国的ATR使用量已超过1 万吨,且以年均增长率超过20%的速率递增。ATR 类除草剂的广泛使用在带来较高经济效益的同时,由于其具有化学性质稳定、难以分解、水溶性较高等特点,近年来在水生生物中被频繁检出[3]。孔祥吉等[4]采用气相色谱-质谱联用(GC-MS)法对中华圆田螺体内的ATR 及其代谢物脱乙基莠去津(DEA)、脱乙基脱异丙基莠去津(DDA)和脱异丙基莠去津(DIA)进行检测,结果表明ATR 及DIA 的检出率为100%,含量分别为6.93~8.06µg/kg 和7.06~10.53µg/kg;范广宇等[5]对贝类样品中22 种农药进行测定,结果显示ATR 的检出率达65.0%,含量为0.1~3.7µg/kg,对贝类具有较高的风险残留;Carafa 等[6]对北亚德里亚海域养殖场中文蛤体内的农药进行测定,ATR 的检出量为1.5µg/kg,相对于同一站点的表层沉积物而言(0.26µg/kg),文蛤对ATR 存在蓄积行为,富集系数约为5;Fu等[7]采用液相色谱-串联质谱(LC-MS/MS)对东北地区鱼类样品中多种农药进行测定,发现辽宁省鱼类样品中ATR的平均含量为2.3µg/kg,远高于其他农药,表明应重视水产品中ATR的潜在风险。因此,加强对ATR及其代谢物残留的监测对于保障水产品安全及人类健康具有重要意义。
目前,ATR 及其代谢产物的检测方法主要有气相色谱法(GC)、气相色谱-串联质谱法(GC-MS/MS)、气相色谱-质谱联用法(GC-MS)、高效液相色谱法(HPLC)、高效液相色谱-质谱联用法(HPLC-MS)、免疫吸附检测法、电化学传感器法、毛细管电泳法和原子荧光光谱法等[8-19]。其中,检测ATR 的最常用方法是色谱法及色谱-质谱联用法。然而,ATR 及其代谢产物的性质差异大,常规提取和净化技术易导致部分分析物的灵敏度低等问题。同时,水产品基质成分复杂、污染物浓度较低,单纯依靠色谱-质谱联用技术易导致离子源受污染、仪器灵敏度降低等[20]。因此,本文通过对不同提取溶剂、净化方式等前处理条件进行优化,结合GC-MS/MS具有灵敏度高、分离效果好、成本低的优点,采用多反应监测模式(MRM),在有效降低背景干扰的同时,提高了待测组分的信噪比和灵敏度,实现了对ATR 及其代谢产物的精确定性、定量测定。所建方法可为水产品中ATR 及其代谢物的残留监测提供技术支持。
1 实验部分
1.1 试剂与仪器
莠去津(纯度99.0%)、脱乙基莠去津(98.5%)、脱异丙基莠去津(99.5%)、脱乙基脱异丙基莠去津(99.0%)、ATR-D5(内标99.0%)标准品购自Sigma-Aldrich 公司。色谱级丙酮、甲醇购于Tedia 公司;二氯甲烷(≥99.99%)、乙酸乙酯(≥99.9%)、乙腈(≥99.9%)、甲苯(≥99.9%)等购于国药集团化学试剂有限公司;GCB/NH2固相萃取柱(500 mg/6 mL)购自上海安谱实验科技股份有限公司。
7890B-7000C气相色谱-三重四极杆串联质谱仪(美国Agilent公司);固相萃取仪(美国Supelco公司);HSC-12B氮吹仪(天津市恒奥科技发展公司);旋转蒸发仪(德国IKA公司);UPR纯水仪(四川优普超纯科技公司)。
1.2 标准工作溶液的配制
精确称取适量ATR 及其代谢物的标准品,用丙酮配制成100.0 mg/L的标准储备液,于-20 ℃保存备用;用丙酮稀释标准储备液,配制成质量浓度为1 mg/L 的混合标准溶液,再用丙酮逐级稀释成系列质量浓度的混合标准溶液(0.5、1.0、5.0、10.0、20.0、50.0、100.0µg/L),并加入20.0µL 质量浓度为1.0µg/mL的内标,于4 ℃保存备用。
1.3 样品前处理
SPE 步骤:称取2.00 g 经冷冻干燥后的样品置于50 mL 离心管中,然后向该离心管中迅速加入20.0 mL乙腈,涡旋1 min,超声提取20 min后,以5.0×103g/min离心10 min,收集上清液;重复上述步骤2次,合并上清液,40 ℃旋转蒸发至近干,加入2.0 mL乙腈复溶,待净化。用4.0 mL乙腈-甲苯(3∶1,体积比)溶液活化GCB/NH2固相萃取柱,上样完成后,用8.0 mL 乙腈-甲苯(3∶1)溶液淋洗,收集淋洗液,于40 ℃用氮气吹至近干,以1.0 mL丙酮复溶,待检测。
QuEChERS 步骤:称取2.00 g样品置于50 mL 离心管中,依次加入2 mL 蒸馏水、5 mL 乙腈、0.6 g氯化钠和1.0 g无水MgSO4,涡旋1 min,超声分散10 min,以3.0×103g/min离心5 min;然后将收集的上清液转移至含有50 mg C18或PSA 或GCB 的15 mL 离心管中,涡旋混匀30 s,以3.0 × 103g/min 离心5 min;取上清液置于10 mL玻璃离心管中,40 ℃水浴中用氮气吹至近干,以1.0 mL丙酮复溶,待检测。
1.4 仪器条件
1.4.1 气相色谱条件色谱柱:DB-5MS 型毛细管色谱柱(30 m × 0.25 mm × 0.25µm);载气:氦气;恒流模式;柱流量:2.25 mL/min;进样口温度:280 ℃;进样体积:1µL;进样方式:不分流进样;程序升温:初始温度为70 ℃,保持1 min,以10 ℃/min 升至180 ℃,保持6 min,再以40 ℃/min 升至310 ℃,保持1 min。
1.4.2 质谱条件电子轰击离子源(EI)电压:70 eV;离子源温度:280 ℃;传输线温度:280 ℃;溶剂延迟时间:5.8 min;扫描范围:50~500 amu;扫描模式:质谱多反应监测(MRM),碰撞气N2流速:1.5 mL/min。表1为MRM 模式下,ATR及其代谢物的气相色谱-串联质谱参数。
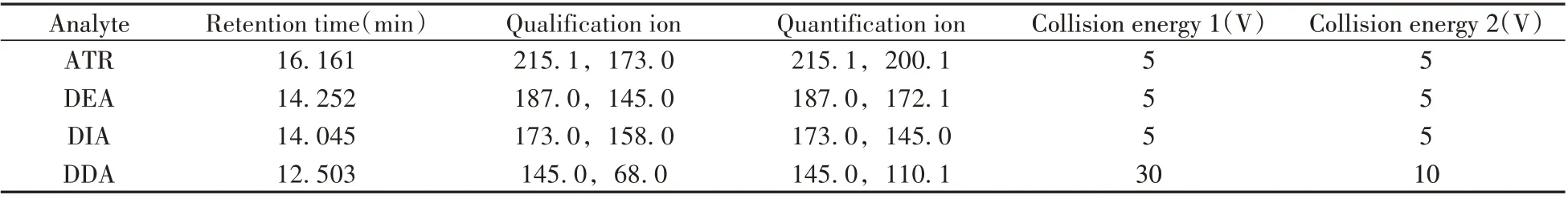
表1 ATR及其代谢物的气相色谱-串联质谱参数Table 1 GC-MS/MS parameters of ATR and its metabolites
2 结果与讨论
2.1 质谱条件的选择
在全扫描模式下确定ATR 及其代谢产物的保留时间,根据质谱图离子对的峰形及响应,选取合适的母离子;其次,在子离子扫描模式下,对子离子及轰击电压进行优化,确定最佳定性定量离子对和碰撞能(表1)。利用优化的质谱参数通过MRM 分析,ATR 及其代谢产物(100µg/L)的总离子流与子离子色谱图如图1所示。结果显示,ATR及其代谢产物具有良好的色谱行为和质谱响应。
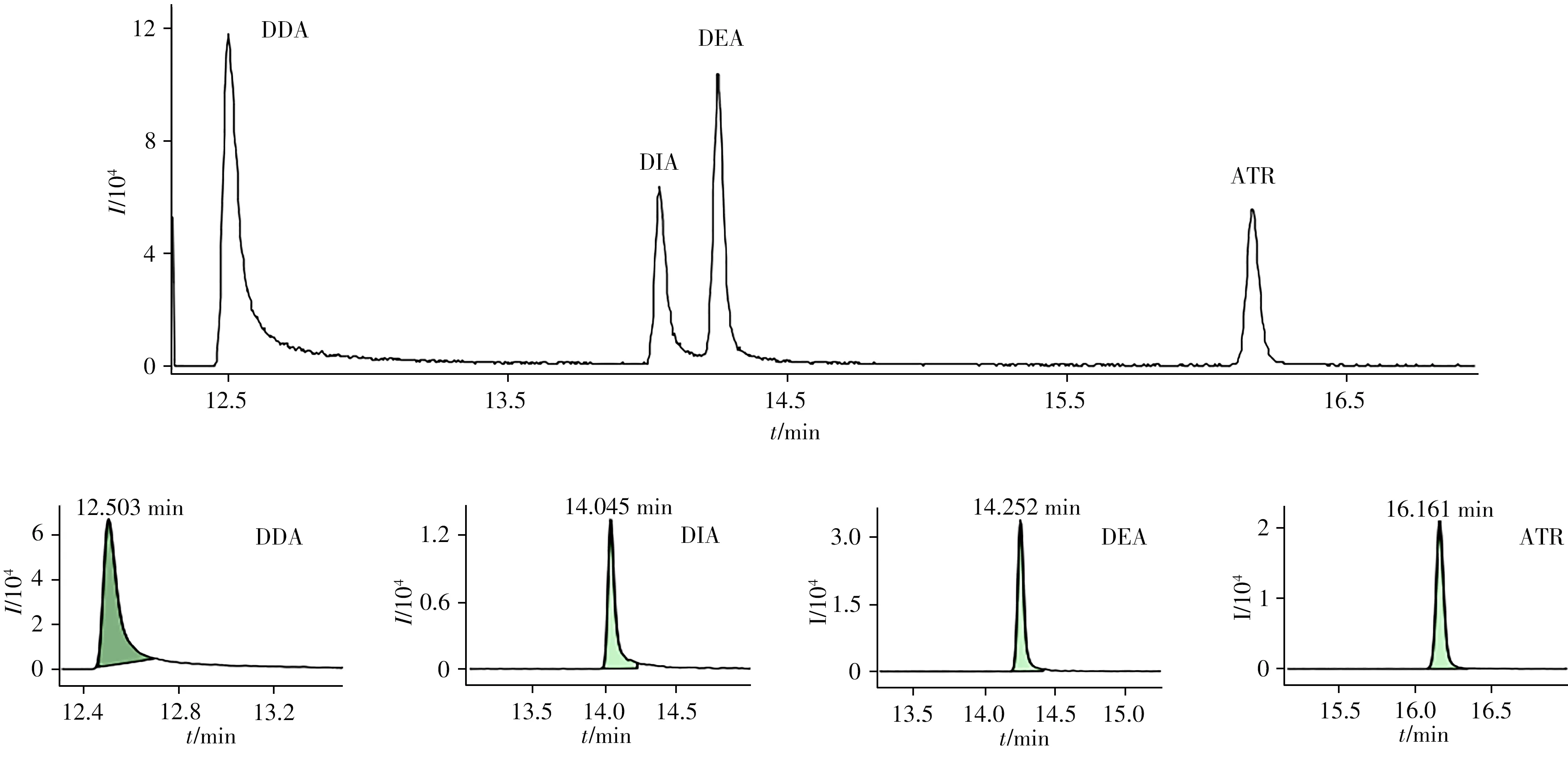
图1 ATR及其代谢产物(100µg/L)的总离子流及子离子色谱图Fig.1 Total ion flow and ion chromatograms of ATR and its metabolites(100µg/L)
2.2 提取溶剂的选择
生物样品基质中除草剂的提取主要使用二氯甲烷、乙酸乙酯、乙腈、甲醇及其混合溶剂。由于ATR 及其代谢产物的极性相差较大,根据相似相溶原理,本研究选择极性中等或较强的溶剂进行提取。加标浓度为50.0µg/kg时,比较了二氯甲烷(DCM)、乙酸乙酯(EA)、乙酸乙酯-甲醇(EA-MeOH,4∶1)以及乙腈(ACN)4种溶剂对水产品中4 种目标物的提取效果,每组样品平行测定3 次。结果表明(图2),以二氯甲烷为提取试剂时,仅ATR 的回收率满足要求;乙酸乙酯对ATR、DEA、DIA 的提取效果较好,但DDA 的回收率无法满足要求。后2 种溶剂的提取效果均能满足要求,然而弱极性溶剂占主导时,提取液中油脂、多糖等含量会增大,造成基质干扰且损伤仪器,因此本研究选用乙腈作为提取溶剂。
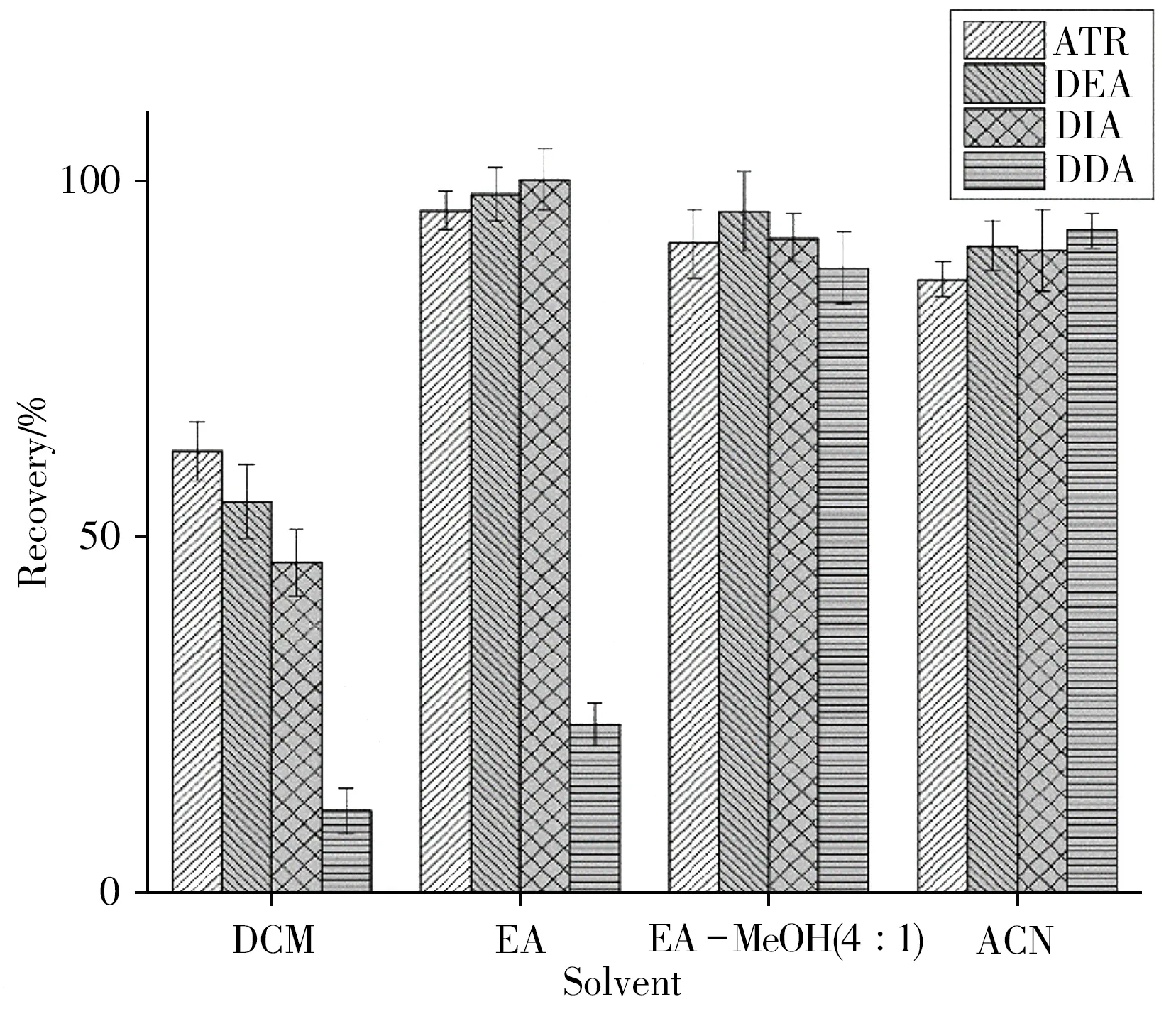
图2 不同提取溶剂对ATR及其代谢产物的回收率Fig.2 Recoveries of ATR and its metabolites in different extraction solvents
2.3 净化方式的优化
由于水产品基质复杂,检测过程中会产生严重的干扰峰,影响目标物的灵敏度和准确度。因此,净化方式对于检测结果的灵敏度和准确度至关重要。按照“1.3”条件,本文比较了QuEChERS 和固相萃取柱的净化效果。结果表明,ATR 及其代谢产物采用QuEChERS 法的回收率为50.4%~83.1%,表明C18、PSA 和GCB 吸附剂对目标物具有一定的吸附。进一步比较了GCB/NH2、C18、HLB、MCX 4 种固相萃取柱对ATR 及其代谢产物的回收率,如图3所示,GCB/NH2固相萃取柱具有最佳的萃取效率,对4 种目标物的回收率为83.1%~94.6%。因此,实验选择GCB/NH2固相萃取柱进行样品净化。
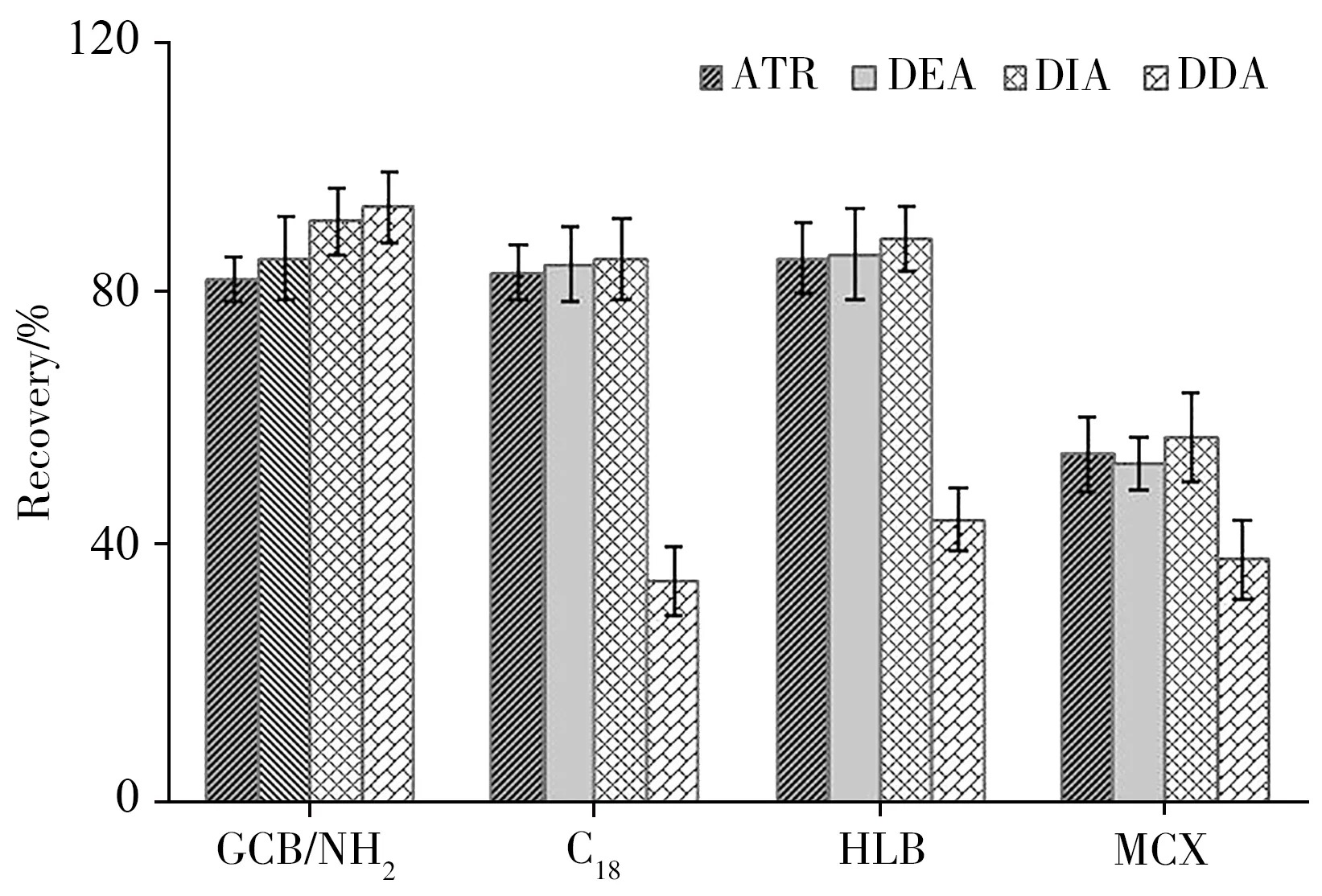
图3 不同SPE柱对ATR及其代谢产物(50.0µg/kg)的萃取效果比较Fig.3 Comparison of extraction effects for ATR and its metabolites with different SPE cartridges(50.0µg/kg)
2.4 基质效应
由于水产品中通常含有较多的脂肪及蛋白等杂质,在质谱分析过程中易受到基质增强或基质抑制效应的影响,从而影响检测结果的准确度。因此,本文采用基质效应(Matrix effect,ME)进一步对其净化效果进行评价。其中,基质标准工作溶液采用前处理步骤净化空白样品配制。计算公式:ME(%)=100%×(基质标准曲线斜率/溶剂标准曲线斜率-1)。结果显示,ATR 及其代谢物均无明显的基质效应(ME<20%),表明建立的前处理方法可以有效消除基质干扰。
2.5 方法学验证
2.5.1 线性关系与检出限将含有质量浓度为1.0µg/mL 内标的ATR 及其代谢物混合标准溶液(0.5、1.0、5.0、10.0、20.0、50.0、100.0µg/L)依次进样至GC-MS/MS,再以目标分析物与内标物的质量浓度之比为横坐标,以目标分析物与内标物的响应值之比为纵坐标绘制标准曲线。结果如表2 所示,ATR、DEA、DIA 和DDA 在0.5~100.0 µg/L 质量浓度范围内具有良好的线性关系,相关系数(r2)为0.999 1~0.999 9。以信噪比(S/N)为3 时的质量浓度作为方法的检出限(LOD),4 种目标物的LOD 为0.02~0.13µg/kg。

表2 ATR及其代谢物的线性范围、线性方程、相关系数和检出限Table 2 Linear ranges,linear equations,correlation coefficients and detection limits of ATR and its metabolites
2.5.2 准确度与精密度比较了5种不同种类水产品(缢蛏、海鲫鱼、金鲳鱼、黄鱼、黑鲷)的加标回收率,分别称取不同种类冷冻干燥后的水产品2.0 g,加标水平为10.0、20.0、50.0µg/kg,每个水平进行3 组平行实验。表3 结果表明,4 种目标分析物的平均回收率为83.6%~98.4%,相对标准偏差(RSD)为3.6%~8.1%,表明建立的方法具有较好的准确度和精密度。
2.6 方法对比
进一步将本文建立的检测方法与已有文献方法进行对比(表4)。结果表明,本方法具有更好或相当的灵敏度、准确度和精密度,可满足水产品中ATR及其代谢产物的检测要求。
2.7 实际样品分析
从象山西沪港养殖区采集6种水产样品,采用本方法进行检测,目标物的检出量见表5,代表性样品的总离子流图见图4。结果显示,6 种水产样品均检出ATR、DEA 和DIA,检出量分别为1.55~30.63µg/kg、0.48~4.96µg/kg、0.34~3.57µg/kg;DDA 未检出。ATR、DEA 及DIA 在海鲫鱼中的检出含量最高,其次是黑鲷鱼,含量最低的为金鲳鱼。生物体对ATR 的代谢能力会受到生物种类、觅食习惯以及生存年龄等多种因素影响,在该海域生物体中,ATR 仍占据主导位置,其次是DEA 和DIA。海鲫鱼、黑鲷鱼以及缢蛏等属于底栖养殖生物,因此在摄食过程中更易富集ATR,较该海域海水中浓度[23]而言,本实验测得海鲫鱼、黑鲷和缢蛏的富集系数约为400。鉴于水产样品中ATR 及其代谢产物的检出率较高,其带来的环境及水产品安全风险需重点关注。

图4 实际样品中ATR及其代谢产物的总离子流色谱图Fig.4 Total ion chromatograms of ATR and its metabolites in real samples

表5 水产品中ATR及其代谢产物的含量(µg/kg,n=3)Table 5 Contents of ATR and its metabolites in aquatic products(µg/kg,n=3)
3 结 论
本文建立了测定水产品中ATR及其代谢物的固相萃取/气相色谱-串联质谱方法,水产样品经乙腈提取,GCB/NH2固相萃取柱富集、净化。结果表明,4 种分析物的LOD 为0.02~0.13µg/kg;在10.0、20.0、50.0µg/kg加标浓度下的平均回收率为83.6%~98.4%,RSD 为3.6%~8.1%。采用该方法在6种水产样品中均检出ATR、DEA 和DIA,检出量分别为1.55~30.63 µg/kg、0.48~4.96 µg/kg、0.34~3.57µg/kg。本文研究结果为进一步探究ATR 及其主要代谢产物在近岸养殖环境及水产品中的污染状况和风险控制提供了技术支撑。
