沙芥幼苗叶片小热激蛋白基因的克隆与表达
2022-01-07于晓婧王萍武兆昕杨永升许珂尚鹏
于晓婧,王萍,武兆昕,杨永升,许珂,尚鹏
(内蒙古农业大学园艺与植物保护学院,内蒙古 呼和浩特 010019)
植物响应逆境及发育信号合成相对分子质量(15 000~30 000)较低的小热激蛋白(smal heat shock proteins, sHSPs)[1],它们可以稳定蛋白质膜结合部分变性的蛋白质并防止不可逆的聚集[2-3]。通过此过程维持细胞体内稳态并保护植物。小热激蛋白通常含有保守的由β 折叠构成的ACD 结构域[4]。根据序列同源性以及亚细胞定位,认为sHSPs 基因家族至少可分为 17 个亚类,分布于细胞质、叶绿体、内质网、线粒体和质膜上[5-6]。有研究表明,植物受到高温胁迫后,sHSPs 的表达量显著上升,耐热性提高;另外寒冷、重金属、干旱、盐胁迫等也能诱导sHSPs 的表达[7],且表达量可提高几十到几百倍,但其表达强度与胁迫强度及时间相关。植物受胁迫后sHSPs 的表达有半周期,说明小热激蛋白可能对植物胁迫后的修复起重要作用[8]。花楸树SpHSP17.3和SpHSP23.8在高温、NaCl 及干旱胁迫下相对表达量均显著升高,且存在组织特异性,在茎中的相对表达量最高,其次为果实和根,而花中的相对表达量最低[9-10]。匍匐翦股颖AsHSP26.8a在拟南芥中过表达后加强了转基因拟南芥对激素 ABA 的敏感性[11];拟南芥AtHSP17.4CI会受热、冷、盐、干旱和强光的诱导,且在胁迫早期就可以迅速表达[12];辣椒CaHSP16.4的沉默会降低植株对热胁迫和干旱胁迫的耐受性[13];灰岩皱叶报春PfHSP17.2在拟南芥中过表达后使其具有更强的抵御高温、寒冷与盐胁迫的能力[14]。沙芥(P.cornutum(L.)Gaertn.)为十字花科沙芥属(PugioniumGaertn.)二年生草本旱生植物,是中国的特有种,也是沙芥属植物的模式种,具有宽翅短角果的特化形态特征,是适应荒漠沙地严酷气候环境的进化类群[15]。沙芥根系发达,是沙地先锋植物,极耐沙埋,可有效阻止沙丘前移,因此也是一种很好的治理水土流失的沙生植物。沙芥属的栽培技术[16]、植物学特征[17]、生理生化[18]、病虫害防治[19]、加工利用[20]等研究都取得了进展。笔者前期通过对干旱胁迫下沙芥转录组与蛋白组的联合分析,共找到6639 个差异表达基因和795 个差异表达蛋白,定量分析发现其中有109 个基因/蛋白在这2 个组学水平上均受到调节;进一步对这109 个基因/蛋白进行分析,结果小热激蛋白的占比最多,通过联合分析各小热激蛋白在两个组学中的差异倍数,筛选出PcHSP26.5和PcHSP17.8进行克隆与分析;对沙芥进行不同逆境胁迫,分析这2 个基因的表达情况,旨在为后续的小热激蛋白基因功能验证及沙芥品种选育提供依据。
1 材料与方法
1.1 材料
采集内蒙古自治区鄂尔多斯市鄂托克前旗毛乌素沙地的沙芥果实,挑选去除果皮后饱满的种子,用2%次氯酸(HClO)消毒2 min,于智能培养箱中催芽。将发芽种子分为2 份:其中1 份均匀播种在花盆(内径18 cm、高15 cm)内,置于温室中,白天温度28 ℃、光照14 h、光照度30 000 lx,夜晚15 ℃培养;另外1 份播种于规格为8 cm×8 cm 的营养钵内,置于光照培养箱内,白天温度28 ℃、光照16 h、光照度18 000 lx,夜晚23 ℃培养。
1.2 方法
1.2.1 试验设计
温室中沙芥幼苗长至六叶一心时,通过自然干旱法进行干旱胁迫,利用称重法控制土壤水分含量。以土壤相对含水量为田间持水量的70%~75%为对照;以土壤相对含水量分别为田间持水量的40%~45%和30%~35%为中度胁迫和重度胁迫。干旱处理10 d(重度干旱胁迫的沙芥叶片出现严重萎蔫)结束试验,取样进行液氮速冻,置于-80 ℃保存,备用。
对播种于光照培养箱中的沙芥幼苗进行高温、低温、NaCl、ABA 和干旱胁迫处理:①将沙芥幼苗分别放置于42 ℃和4 ℃的培养箱内处理24 h;②将沙芥幼苗从培养钵中取出洗净, 将根部浸泡于含有200 mmol/L NaCl 的1/2MS 培养基溶液中处理24 h;③将沙芥幼苗从培养钵中取出洗净,将根部浸泡于含有100 μmol/L ABA 的1/2MS 培养基溶液中处理24 h,分别于处理后0.5、1、2、3、6、12 和24 h 取叶片和茎段部分用于RNA 提取,置于-80 ℃保存,备用;④考虑到外界环境中下土壤水分流失过程缓慢,未选择通过PEG 进行模拟干旱,而是在给沙芥幼苗充分浇水后采用自然干旱持续处理9 d 后复水,复水后3、6、9、12 d 取叶片和茎段部分用于RNA 提取,置于-80 ℃保存,备用。
1.2.2 生物信息学分析
采用试剂盒提取沙芥幼苗叶片的基因组DNA与总RNA,用微量分光光度计检测其浓度与质量,琼脂糖凝胶电泳检测DNA 与RNA 的完整性与稳定性。利用pEASY-Blunt Simple Cloning Kit试剂盒(北京全式金生物)进行 cDNA 第 1 链的合成,用于基因克隆与荧光定量分析。
对沙芥进行干旱胁迫得到的转录组和蛋白组数据进行联合分析,筛选并获得差异显著表达的2个基因(序列号c30518 和c46759)的开放阅读框序列。运用Primer Premier 5 设计各自特异性引物(表1),以沙芥叶片gDNA 与cDNA 为模板进行 PCR扩增:98 ℃预变性 5 min;98 ℃ 变性30 s,Tm 退火30 s,72 ℃延伸 min,35 个循环;72 ℃再延伸10 min。PCR 产物经凝胶电泳后回收目的条带,并与pEASY-Blunt Simple Cloning Vector 载体连接,转化进 DH5α 感受态细胞,涂板、挑菌后送上海生工生物科技有限公司测序。

表1 采用的引物及序列Table 1 Primers used in this study
运用 NCBI 中的 Blast 工具对获得的基因及其编码蛋白进行同源比对和保守结构域分析;用ExPASy ProtParam tool(https://web.expasy.org/cgibin/ protparam/ protparam)预测蛋白质相对分子质量与理论等电点;运用ProtScale(http://web.expasy.org/cgi-bin/protscale/protscale.pl)进行氨基酸亲/疏水性分析;利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat. pl? page=npsa_sopma.html)预测蛋白二级结构;用Netphos 3.0 Serve(http://www.cbs.dtu.dk/services/NetPhos/)预测蛋白质磷酸化位点;用 TMPRED(http://www.ch.embnet.org/software/TMPREDform.html)预测跨膜结构;用SignalIP(http://www.cbs.dtu.dk/ services/SignalP/)在线网址预测信号肽;用WoLF PSORT(https://wolfpsort.org/)进行亚细胞定位预测;用SWISS-MODEL(http://www.swissmodel.expasy.org/)预测编码蛋白的三维结构;用Clustal Omega 进行多序列氨基酸同源性比较并用 MEGA 7.0 构建系统发育树。
1.2.3 实时荧光定量 PCR(qRT-PCR)分析
根据克隆得到的基因序列设计定量引物,以β-肌动蛋白(R2_Unigene_BMK.22570)基因用作为内参基因[21],按 SYBR® Premix ExTaqI(ITaKaRa,大连,中国)使用说明进行 qRT-PCR 分析。使用Roche480 进行荧光定量 PCR 反应:95 ℃预变性30 s;95 ℃ 变性5 s;60 ℃退火 30 s,循环 40次;95 ℃延伸 5 s,60 ℃再延伸1 min。每个样品均设置 3 次重复,采用 2-ΔΔCt法分析结果。运用SPSS 23.0 对数据进行统计学分析。
2 结果与分析
2.1 沙芥幼苗小热激蛋白基因 cDNA 和 gDNA 序列
根据沙芥转录组与蛋白组联合分析数据,以沙芥 cDNA 为模板进行PCR 扩增,连接载体并进行测序。结果显示,其开放阅读框长度分别为 699和462 bp,分别编码232 和153 个氨基酸 ;通过Blast 比对,发现该片段为沙芥小热激蛋白20 家族基因,根据预测蛋白相对分子质量的大小,分别命名为PcHSP26.5和PcHSP17.8。以沙芥gDNA为模板的 PCR 产物碱基序列与PcHSP26.5和PcHSP17.8基因ORF 碱基序列进行比较,发现PcHSP26.5基因gDNA 序列共包含851 个碱基,在281 至433 位点插入1 个长度为152 bp 的内含子,PcHSP17.8基因则不含内含子。
2.2 沙芥小热激蛋白基因的生物信息学
2.2.1 蛋白性质预测
NCBI Blast 对比结果表明:PcHSP26.5 和PcHSP17.8 均含有小热激蛋白典型的ACD 结构域;利用ExPASy Prot Param tool 分析PcHSP26.5和PcHSP17.8基因编码蛋白的基本理化性质,可以得知PcHSP26.5 和PcHSP17.8 的分子式分别为C1153H1842N338O364S7、C776H1239N211O238S5,相对分子质量分别为26 480、17 490,理论等电点分别为6.36、5.99,不稳定系数分别为52.69、49.44,说明皆为不稳定蛋白;脂肪系数分别为 74.78、73.73,平均亲水系数分别为-0.812、-0.625,说明都具有亲水性。利用 ProtScale 对PcHSP26.5 和PcHSP17.8 进行亲/疏水性分析,可以得知,PcHSP26.5 中氨基酸含量较丰富的是Glu(E),有20 个,为所有氨基酸含量的8.6%;Asn(N)有19个,Leu(L)有19 个,二者均为所有氨基酸含量的8.2%;PcHSP17.8 中氨基酸含量较丰富的是Glu(E),有17 个,Lys(K)、Ser(S)、Val(V)也各有17 个,均为所有氨基酸含量的11.1%。PcHSP26.5和PcHSP17.8 中带负电荷的氨基酸残基(Asp+Glu)总个数分别为36、29,带正电荷的氨基酸残基(Arg+Lys)总个数分别为35、26。PcHSP26.5 多肽链第213 位分值最高(1.522),第221 位分值最低(-3.067)。PcHSP17.8 多肽链第135 位分值最高,为1.522;第96 位分值最低,为-3.067。根据负值越大,亲水性越高;正值越大,疏水性越高的标准来判断,二者皆为亲水蛋白。
利用SOPMA 对PcHSP26.5 和PcHSP17.8 的二级结构进行预测,结果(图1)显示,PcHSP26.5蛋白由36.21%的无规则卷曲、40.95%的α-螺旋、16.81%的延伸链和 6.03%的 β 转角构成;PcHSP17.8 蛋白则由 54.90%的无规则卷曲、20.26%的α-螺旋、19.61%的延伸链和5.23%的β转角构成。

图1 沙芥小热激蛋白二级结构预测Fig.1 Prediction for secondary structures of small heat shock protein genes in Pugionium cornutum (L.) Gaertn.
利用 Netphos 3.0 Serve 预测 PcHSP26.5 和PcHSP17.8 蛋白的磷酸化位点,结果PcHSP26.5 有16 个丝氨酸、5 个苏氨酸、4 个酪氨酸磷酸化位点,PcHSP17.8 有10 个丝氨酸和5 个苏氨酸磷酸化位点,没有酪氨酸磷酸化位点。
利用TMPRED 对PcHSP26.5 和PcHSP17.8 的跨膜结构进行预测,发现二者均不含跨膜结构;利用SignalIP 对PcHSP26.5 和PcHSP17.8 信号肽进行预测,结果二者都不具有信号肽。用 SWISSMODEL 对PcHSP26.5 和PcHSP17.8 进行三级结构预测,可看出二者均含大量的无规则卷曲与α-螺旋(图2),与二级结构预测的结果相符。
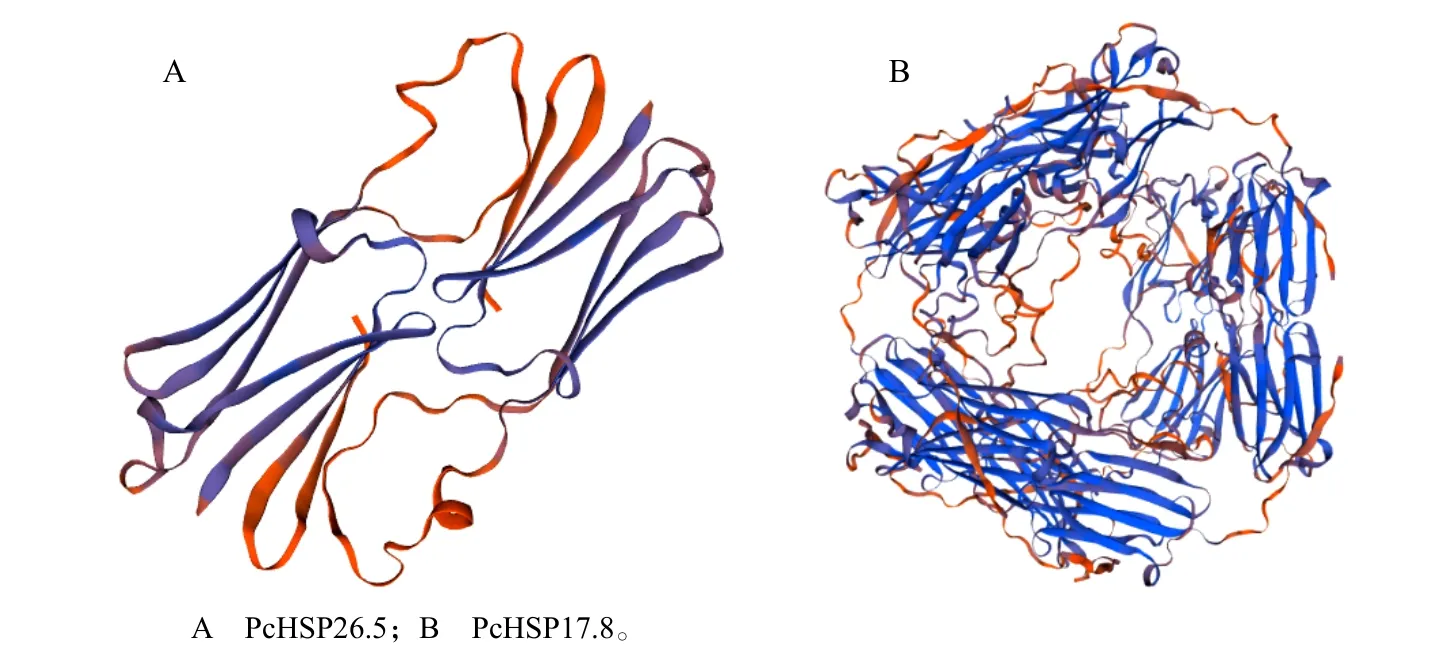
图2 沙芥小热激蛋白的三维结构预测Fig.2 Three-dimensional structure prediction for small heat shock protein genes in Pugionium cornutum (L.) Gaertn.
图 3 基于氨基酸序列的PcHSP26.5 和PcHSP17.8 蛋白与其他植物 HSP20 蛋白的同源性比对Fig.3 Homologous alignment between PcHSP26.5(A) and PcHSP17.8(B) protein with HSP20 protein in other plants based on amino acid sequence
2.2.2 同源性比对与分子系统进化树
利用 MEGA 7.0 来了解沙芥 PcHSP26.5 和PcHSP17.8 的进化关系,选择拟南芥、水稻和大豆小热激蛋白不同亚族的氨基酸序列构建系统进化树。结果PcHSP26.5 与拟南芥AtHSP26.5 进化关系最近,同属于 MⅡ亚族;而 PcHSP17.8 与AtHSP17.6A 和AtHSP17.8 进化关系较近,同属于CⅠ亚族。推测PcHSP26.5 和PcHSP17.8 蛋白分别定位于沙芥的线粒体和细胞质中,与WoLF PSOR预测结果相似。
利用Clustal Omega 进行同源性比对,结果(图3)显示:PcHSP26.5 与甘蓝型油菜(Brassicanapus)BnHSP26.5D 蛋白(登录号XP_013700958. 1:28-232)的相似性最高,为 84.8%;与芥菜(Capsella rubella)CrHSP26.5 蛋白(登录号XP_0063033 34.1:17-232)的相似性为 81.86%;与拟南芥(Arabidopsis thaliana)AtHsp26.5 蛋白( 登录号Q9SSQ8.1)的相似性为78.02%。PcHSP17.8 与芥菜CrHSP17.8 蛋白(登录号 XP_006303386.1:1-156)的相似性最高,为86.93%;与拟南芥AtHsp17.6A 蛋白(登录号Q9XIE3.1)和甘蓝型油菜BnHSP17.6 蛋白(登录号XP_013748895.1:1-156)的相似性分别为86.58%和85.62%。
2.3 非生物胁迫下沙芥小热激蛋白基因的表达
为了进一步了解沙芥PcHSP26.5、PcHSP17.8对逆境胁迫的响应情况, 对沙芥幼苗进行42 ℃高温、4 ℃低温、200 mmol/L NaCl、100 μmol/L ABA 胁迫和自然干旱再复水处理,利用实时荧光定量PCR 技术对沙芥PcHSP26.5、PcHSP17.8的表达模式进行分析。结果(表2)表明,高温处理下,PcHSP26.5和PcHSP17.8相对表达量均在高温胁迫1 h 后达到顶峰,分别为对照的42 000 倍和18 000倍。4 ℃低温处理下,PcHSP26.5相对表达量在0.5 h 后达到对照的15 倍,之后开始下降;至胁迫后12 h ,PcHSP17.8的相对表达量均低于对照,24 h 时相对表达量升高,达到对照的1.7 倍。NaCl处理下,PcHSP26.5相对表达量在1 h 时达到顶峰,随后骤然下降,3 h 恢复至对照的30 倍,6 h下降,随后持续上升;PcHSP17.8相对表达量在3 h 达到顶峰,此后开始持续下降。ABA 处理下,PcHSP26.5 和PcHSP17.8相对表达量均在2 h 时达到顶峰,随后开始下降,24 h 时有所回升,区别在于PcHSP26.5相对表达量在1 h 时开始上升,而PcHSP17.8相对表达量1 h 内下降。干旱胁迫9 d时,PcHSP26.5相对表达量达到最高,复水3 d后,表达量下降至对照的2.9 倍;PcHSP17.8相对表达量在干旱9 d 后达到对照的111 倍,复水后下降至对照的20 倍。

表2 非生物胁迫下PcHSP26.5 和PcHSP17.8 的相对表达量Table 2 Relative expression level of PcHSP26.5 and PcHSP17.8 under abiotic stress
3 结论与讨论
小热激蛋白是细胞应对外界高温、干旱、缺氧、重金属等胁迫的第一道防线,具有分子伴侣功能[22],能在不依赖ATP 的情况下阻止逆境胁迫下变性蛋白的累积以及保护蛋白的正确折叠[23]。基于前期沙芥转录组数据克隆得到的2 个小热激蛋白基因PcHSP26.5和PcHSP17.8,均含有sHSPs家族典型的ACD 结构域,证实这2 个基因属于沙芥小热激蛋白,同时也推测由于这一结构的存在,才使得PcHSP26.5 和PcHSP17.8 具有sHSPs分子伴侣的功能。系统进化树结果显示,PcHSP26.5 和 PcHSP17.8 分别属于小热激蛋白MⅡ亚族和 CⅠ亚族。同源性比对结果显示,PcHSP26.5 和PcHSP17.8 与芥菜、拟南芥、甘蓝型油菜的亲缘性较近,推测这主要缘于沙芥与拟南芥、甘蓝型油菜和芥菜均属于十字花科。PcHSP26.5 和PcHSP17.8 分别包含6.03%和5.23%的β 转角,有助于PcHSP26.5 和PcHSP17.8 蛋白形成反向平行结构,进而形成二聚体等发挥功能[24]。蛋白质磷酸化是蛋白质翻译后修饰过程中较为重要和普遍的调节方式之一, PcHSP26.5 和PcHSP17.8 分别包含25 和15 个磷酸化位点,表明逆境胁迫下,PcHSP26.5 和PcHSP17.8 蛋白在翻译后可能通过磷酸化修饰发挥抗性作用[25]。
大量研究表明,小热激蛋白在植物正常生长过程中几乎不表达,但在逆境胁迫后表达量发生成倍变化[26]。沙芥PcHSP26.5和PcHSP17.8基因在不同胁迫下的表达量有所不同,推测这可能是由于二者分属于sHSPs 不同亚族的缘故[27]。已有研究发现,沙芥对高温胁迫有一定耐受力,本研究中,42 ℃高温胁迫 0.5 h 时,PcHSP26.5和PcHSP17.8基因的相对表达量即出现显著性变化,胁迫1 h 时,PcHSP26.5和PcHSP17.8基因的相对表达量达到峰值,这与前人研究的结果[10,28]相似。在遭遇高温胁迫后,短时间内沙芥PcHSP26.5基因表达量的增加倍数均高于PcHSP17.8基因,这与SANMIYA 等[29]的研究结果相一致,当植物遭遇热胁迫时,相比于定位在其他细胞器中的小热激蛋白,线粒体的小热激蛋白作用更显著,会加快表达并发挥其功能。
低温胁迫下,沙芥PcHSP26.5表达量在0.5 h时达到顶峰,之后下降,而PcHSP17.8表达量在胁迫后的24 h 内变化幅度微弱; NaCl 和ABA 胁迫下,PcHSP26.5和PcHSP17.8表达量均出现上调,表明沙芥PcHSP26.5和PcHSP17.8对低温胁迫响应较弱,但对高盐和脱落酸胁迫响应较强。PcHSP26.5和PcHSP17.8的表达均受外源ABA 诱导,表明二者均属于依赖于ABA 的胁迫响应基因。干旱胁迫下,PcHSP26.5和PcHSP17.8表达量均呈现出干旱下逐渐上升、复水后下降的趋势,其中PcHSP17.8在干旱9 d 后的表达量成百倍上升,表明PcHSP26.5和PcHSP17.8均可以响应干旱胁迫,但PcHSP17.8对干旱胁迫的响应程度更高。这表明生长在沙漠地带、经常同时遭受高温和干旱胁迫的沙芥总群在进化过程中可能已经产生了一定的抵御能力。
