发酵十字花科蔬菜中硫代葡萄糖苷代谢研究进展
2022-01-06赵吉春谭正卫颜鑫艺周海燕雷小娟
赵吉春,余 洁,谭正卫,颜鑫艺,周海燕,雷小娟,明 建,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市渝北中学校,重庆 401120)
大白菜(Brassica rapaspp.Pekinensis)、甘蓝(Brassica oleraceaL. var.capitata)、紫甘蓝(Brassica oleraceavar.capitataf. rubra)等十字花科蔬菜是制作四川泡菜、东北酸菜、德国酸菜和韩国泡菜等各种发酵蔬菜制品的主要原材料[1-4]。这些蔬菜不仅含有丰富的膳食纤维、维生素、钙、铁、锌等矿物元素,还具有能够促进人体健康的各类植物化学物质,例如硫苷、黄酮和花青素等[5-8]。
蔬菜的发酵依赖于原材料携带的乳酸菌以及人工接种发酵剂的生长繁殖活动。在异型发酵乳酸菌和同型发酵乳酸菌交替作用下,蔬菜中糖类被转化为乳酸、乙酸等代谢产物,降低了体系pH值。一方面,发酵抑制腐败菌生长,延长蔬菜产品的保质期;另一方面,发酵可产生有机酸、氨基酸等营养成分以及特征性风味和滋味[8]。此外,乳酸菌发酵也促进了植物化学物质的生物转化。
硫苷是十字花科蔬菜中一类重要的特征性含硫化合物,但自身活性较低,能够在黑芥子酶催化下发生降解。蔬菜发酵过程中,硫苷被降解生成异硫氰酸盐、腈类、环腈类等活性代谢产物,且不同产物的生理活性存在较大差异,其中异硫氰酸盐的活性最高。研究显示乳酸菌对硫苷具有转化能力,且存在菌株差异性,并受到多种外在因素影响。本文总结了硫苷及其代谢产物生理功能的最新研究进展,重点研究分析了各类发酵蔬菜中乳酸菌对硫苷的代谢作用,比较不同种属乳酸菌对发酵蔬菜硫苷代谢产物的影响差异,并讨论了盐含量、pH值、金属离子以及加热处理等因素对硫苷代谢的影响,为调控发酵蔬菜中硫苷向高活性的代谢产物方向转化提供理论依据。
1 硫苷概述
硫苷是一类水溶性含硫的次生代谢产物,其结构主要由β-D-硫葡萄糖基、硫化肟基和可变氨基酸衍生侧链R基团构成(图1)。目前,已从十字花科蔬菜中鉴定出多达137 种硫苷化合物[9]。根据R基团结构不同,硫苷可以分为脂肪族硫苷(R基团为甲硫氨酸、丙氨酸、撷氨酸、亮氨酸和异亮氨酸)、芳香族硫苷(R基团为苯丙氨酸和酪氨酸)和吲哚族硫苷(R基团为色氨酸),其中第一类约占已发现硫苷的50%[10]。十字花科蔬菜中常见硫苷有3-丁烯基硫苷、2-羟基-3-丁烯基硫苷、萝卜硫苷、黑芥子苷和4-羟基-3-吲哚甲基硫苷等,具体到特定蔬菜,其硫苷组成与含量因栽培品种、栽培条件、采后贮藏条件以及蔬菜部位而异[7,11]。例如,大白菜硫苷以3-丁烯基硫苷和4-戊烯基硫苷为主,而西兰花的主要硫苷有新葡萄糖芸苔素、芸苔葡糖硫苷和萝卜硫苷[7,12](表1)。
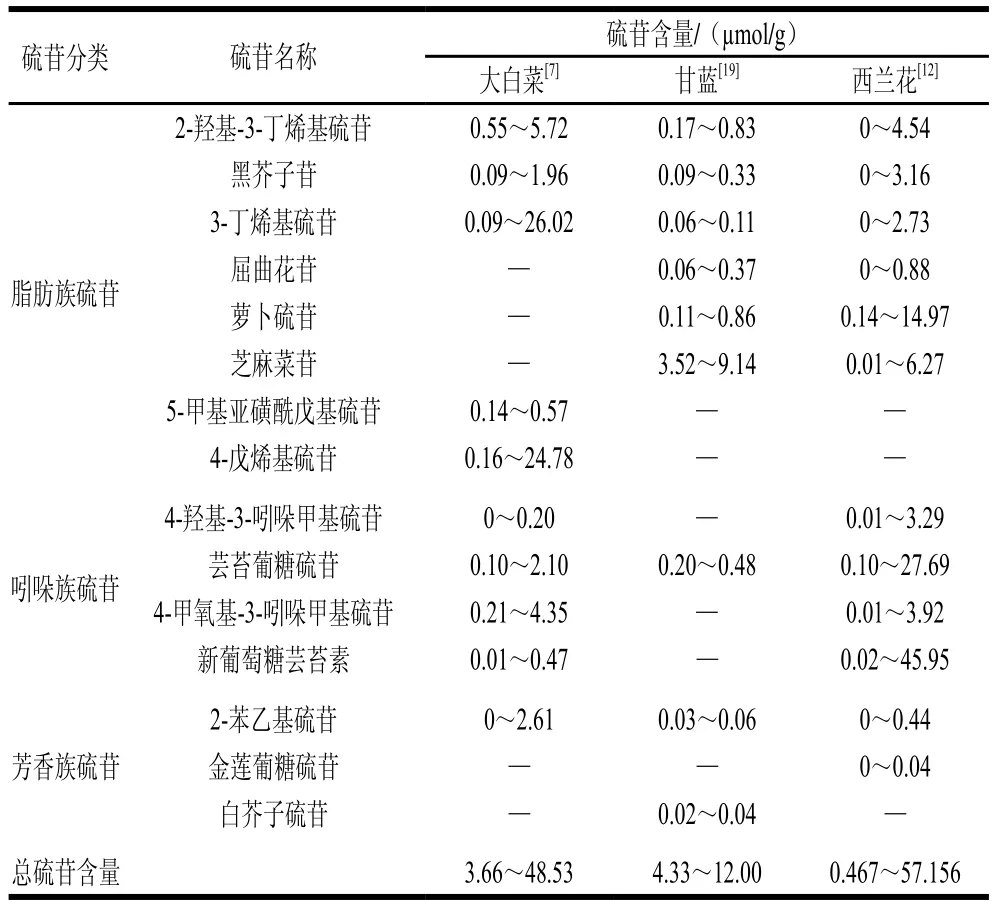
表1 大白菜、甘蓝和西兰花中硫苷种类与含量Table 1 Types and contents of glucosinolates in Chinese cabbage,cabbage and broccoli
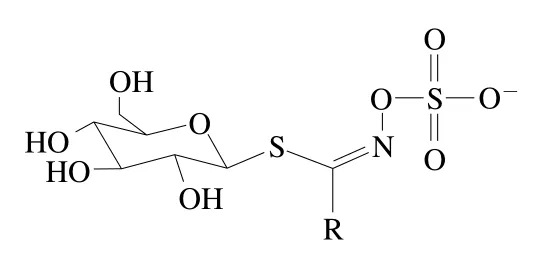
图1 硫苷基本结构Fig. 1 Basic structure of glucosinolates
黑芥子酶存在于所有含有硫苷的植物组织中,可以特异性地裂解硫连接的糖苷。在完整蔬菜组织中,硫苷存在于S细胞,而黑芥子酶位于相邻的芥子酶细胞,彼此相互分隔。当蔬菜遭受切割、咀嚼等机械损伤时,完整组织结构被破坏,黑芥子酶和硫苷相互接触发生反应。硫苷自身难以被人体直接吸收代谢,摄入体内后,绝大多数硫苷以完整形式通过上消化道而进入大肠,被肠道微生物代谢利用[13]。在发酵蔬菜中乳酸菌也可以代谢硫苷,提高硫苷化合物的生物活性。硫苷及其代谢产物也是发酵蔬菜中辛辣味、苦味等特征性风味的主要物质基础之一[14-15]。众多研究已表明硫苷主要代谢产物异硫氰酸盐具有抗炎、提高抗氧酶活性、调节肠道菌群、降低罹患癌症风险、降低糖尿病风险、缓解肥胖等多种生理功能[16-18]。
2 硫苷生理功能
目前,关于硫苷及其代谢产物生理功能的研究主要集中于抗癌和抗肿瘤作用,特别是拮抗结直肠癌研究报道最多。其次,硫苷的抗氧化作用及其机制也受到人们关注。另外,硫苷在调节肠道菌群、应对肥胖、糖尿病等慢性疾病中发挥的积极作用近年来也逐渐被人们重视。
2.1 抗氧化活性
Maryati等[20]在西兰花提取液中接种保加利亚乳杆菌(Lactobacillus bulgaricus)、嗜热链球菌(Streptococcus thermophilus)、嗜酸乳杆菌(Lactobacillus acidophilus)和两歧双歧杆菌(Bifidobacterium bifidum)混合发酵剂,20%发酵剂接种量发酵24 h,发酵西兰花的抗氧化活性达到最大,此时总酚含量降低,提示发酵产物抗氧化能力的物质基础可能不是多酚,而是与西兰花硫苷等活性物质具有相关性。Lee等[7]测定了62个大白菜品种提取物的总硫苷含量与抗氧化能力,结果发现硫苷粗提物的1,1-二苯基-2-三硝基苯肼自由基清除能力、羟自由基清除能力和铁还原能力均呈现浓度依赖关系,但与总硫苷含量不具有显著相关性。芥蓝的植物活性物质与抗氧化能力相关性分析结果显示芥兰的抗氧化能力与屈曲花苷、萝卜硫苷和芸苔葡糖硫苷等硫苷含量具有高度正相关性,提示特定硫苷对芥兰总抗氧化能力具有贡献[21]。
现在普遍认为绝大多数硫苷不具有清除自由基、中断氧化链式反应等直接氧化性,其抗氧化能力主要表现在间接抗氧化性。例如,萝卜硫苷是西兰花中含量最高的硫苷之一,其代谢产物萝卜硫素是一种重要的异硫氰酸盐,通过激活核转录因子2(nuclear transcription factor 2,Nrf2)信号通路而诱导II相酶,例如谷胱甘肽-S-转移酶、谷胱甘肽还原酶和NAD(P)H:醌氧化还原酶(NAD(P)H: quinone oxidereductase,NQO1)、环氧化物酶和血红素加氧酶,这些酶有助于细胞抵御亲电试剂的攻击从而缓解氧化损伤[22]。萝卜硫素通过核转录因子2-Kelch样环氧氯丙烷相关蛋白1(nuclear transcription factor 2-Kelch-like ECH-associating protein 1,Nrf2-keap1)系统增强了抗氧化酶活性,从而缓解幽门螺旋杆菌感染诱导的胃黏膜氧化损伤[23-24]。芝麻菜苷及其代谢产物4-甲硫基丁基异硫氰酸酯(erucin,ERN)除了具有间接抗氧化性外,还可以有效分解过氧化氢和烷基氢过氧化物,可被视为过氧化物清除能力型抗氧化剂[25]。
Cedrowski等[26-27]对萝卜硫素和ERN可以通过诱导II相细胞保护酶而调节细胞氧化还原状态但却不具备自由基捕获能力的原因进行了研究。研究结果发现,在100 ℃以下,萝卜硫素和ERN均不能抑制亚麻酸的氧化,但是在150 ℃以上却能增加大豆卵磷脂的氧化稳定性。结合气相色谱-质谱检测结果,作者推断ERN的甲基磺酰基和萝卜硫素的甲基亚磺酰基经140 ℃以上高温转化为次磺酸,与过氧自由基发生反应,阻断自由氧化链式反应。甲基亚磺酰基还可能经热降解释放出亚磺酰基自由基,从而与烷基过氧自由基发生反应。次磺酸与过氧自由基反应也会产生亚磺酰基自由基。
2.2 调节肠道菌群
硫苷以及富含硫苷的西兰花对肠道菌群具有调节作用。一项探索性研究显示摄食富含硫苷的酸菜使得受试人群肠道菌群组成发生变化,与酸菜发酵相关的乳酸菌(例如植物乳杆菌(Lactobacillus plantarum)和短乳杆菌(Lactobacillus brevis))丰度显著上升[28]。在Yanaka等[29]开展的一项安慰剂对照半开放标签干预实验中,慢性功能性便秘人群每日摄食20 g富含硫苷的西兰花嫩芽或不含硫苷的苜蓿芽,持续4 周。与食用苜蓿芽相比,摄食西兰花嫩芽可以显著降低便秘评分系统得分,提高排便频率,缩短排便用时,并且提高了肠道菌群中产丁酸的双歧杆菌属(Bifidobacterium)和ClostridiumXVIa的比例。萝卜硫素干预结肠癌的研究也显示摄入西兰花芽持续2 周,能提高人体肠道菌群中双歧杆菌属和ClostridiumXVIa的比例[30]。
摄入萝卜硫苷可以降低高脂膳食小鼠粪便菌群的厚壁菌门(Firmicutes)与拟杆菌门(Bacteroidetes)之比,减少与高脂饮食呈正相关的菌群丰度,例如毛螺菌科(Lachnospiraceae)和脱硫弧菌科(Desulfovibrionaceae)[31],这与富含硫苷的西兰花对健康人群肠道微生物的影响一致[32]。此外,小鼠喂养西兰花实验也显示摄入西兰花可以显著提高肠道菌群厚壁菌门和拟杆菌门的相对丰度,降低变形菌门(Proteobacteria)丰度,提高盲肠和结肠内容物类黑芥子酶活性以及异硫氰酸盐含量[33]。萝卜硫苷摄入可以恢复N-丁基-N-(4-羟基丁基)-亚硝胺诱导的膀胱癌小鼠模型肠道菌群紊乱,显著增加脆弱拟杆菌(Bacteroides fragilis)和Clostridium cluster I的比例,提高结肠中丁酸水平,并通过上调紧密连接蛋白和胰高血糖素样肽2(glucagon-like peptide 2,GLP2)的表达来修复结肠和盲肠黏膜上皮的损伤[34]。
2.3 抗癌作用
流行病学调查显示摄入富含硫苷的十字花科蔬菜与肺癌、膀胱癌、结肠癌、前列腺癌等癌症发生率存在负相关关系,摄入高含量的十字花科蔬菜可以将结直肠癌、胃癌罹患风险分别降低8%和19%[35-38]。一项超过8 000 例样本的文献荟萃分析也显示十字花科蔬菜摄入与结肠腺瘤发生风险降低存在相关性[39]。在拮抗癌症方面,硫苷对结直肠癌的作用尤为受到研究者的关注。
通过给予小鼠化学致癌剂氧化偶氮甲烷(15 mg/kg)进行3~6 次造模,同时每日饲喂萝卜硫苷,连续24 周,结果显示萝卜硫苷抑制了氧化偶氮甲烷诱导的异常隐窝病灶(aberrant crypt foci,ACF)和结肠肿瘤的形成。患有结肠腺瘤的病人每两天摄入一次富含硫苷的50 g生西兰花芽,持续6个月,减少了结肠ACF数量[30]。Ho等[18]通过质粒将源于辣根的黑芥子酶基因导入肠道共生菌Escherichia coliNissle 1917,并经由YebF蛋白分泌标签将黑芥子酶分泌至胞外,从而将黑芥子苷转化为异硫氰酸烯丙酯(allyl isothiocyanate,AITC)。同时,该工程菌被导入了源于解没食子酸链球菌(Streptococcus Gallolyticus)的类组蛋白(histone-like protein A,HlpA)基因,获得与结肠癌细胞表面的硫酸乙酰肝素蛋白聚糖特异性地结合的能力,并在细胞表面分泌黑芥子酶将宿主摄入的硫苷转化为异硫氰酸盐,从而进入癌细胞。工程菌和硫苷组合在体外实验中可以将超过95%的鼠源和人源结直肠癌细胞系杀死,而对人源胃癌细胞系、乳腺癌细胞系和食管平滑肌细胞系没有抑制作用。工程菌和西兰花/黑芥子苷膳食联合喂养显著降低了结直肠癌小鼠模型的肿瘤发生的风险,结直肠区域的肿瘤数量减少了75%以上。
2.4 缓解代谢综合征
近年来,十字花科蔬菜硫苷及其活性代谢产物在降低脂肪积累、提高胰岛素敏感性、降低炎症等方面表现出良好特性,因而在缓解代谢综合征方面的潜力得到了研究者的关注[40]。Xu Xinxing等[31]在饲料中添加西兰花冻干粉或萝卜硫苷,喂养高脂膳食小鼠8 周,发现萝卜硫苷喂养可以有效地抑制小鼠体质量、肝脏质量增加,减少附睾脂肪、肠系膜脂肪和肾周脂肪脂质积累,同时降低了氧化应激水平,上调肝脏中与脂质代谢相关的过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPARα)、肉碱棕榈酰转移酶-1(carnitine palmitoyl transterase-1,CPT1)、过氧化物酶体酰基辅酶A氧化酶(acyl-coenzyme A oxidase,ACOX)基因表达,而饲喂西兰花对高脂膳食小鼠脂质代谢的改善作用要弱于饲喂萝卜硫苷的作用。Liu Yaoli等[41]将萝卜硫素(10 mg/kg)以腹腔注射方式每日给予高脂膳食诱导的肥胖小鼠,连续30 d后,减少了小鼠体质量增加和脂肪细胞增大,并且抑制了脂肪形成关键基因表达和脂质在前体脂肪细胞C3H10T1/2中积累。同时,萝卜硫素也促进了肥胖小鼠白色脂肪组织棕色化,降低了细胞和线粒体氧化应激,提高了胰岛素敏感度。
此外,在肥胖诱导的炎症反应中,Toll样受体(Toll-like receptors,TLR)-骨髓样分化因子88(myeloid differentiation primary response 88,MyD88)信号通路居于中心位置。两种硫苷物质异硫氰酸苯乙酯(phenethyl isothiocyanate)和3,3’-二吲哚甲烷(3,3’-diindolylmethane)膳食饲喂高脂高胆固醇膳食的肥胖小鼠,显著降低了小鼠脾脏TRR2/4、MyD88、IL-6、NF-κB和环氧化酶2(cyclooxygenase 2,COX-2)mRNA表达水平,即两种硫苷物质通过调节TLR-MyD88信号通路缓解了脾脏炎症[42]。
硫苷虽然具有诸多生理功能,但其潜在安全问题同样也应受到重视。硫苷自身不具有毒性,但其降解产物并非如此。例如,菜籽粕中硫苷代谢产物噁唑烷硫酮会损伤甲状腺对碘的吸收能力,导致血液甲状腺素浓度下降;硫氰酸盐会竞争性抑制甲状腺吸收碘,导致甲状腺功能减退;腈类会增加肝脏抗氧化酶和脱毒酶的代谢活性,导致肝脏发生肿大增生[43]。菜籽粕含有丰富蛋白质,是一种理想的动物饲料。然而,硫苷是菜籽粕的抗营养因子,因此需要对菜籽粕进行脱毒处理。Latimer等[44]考察了5 种不同硫苷的代谢产物腈对人和牛肝细胞毒性,受试化合物最大浓度为2 mmol/L,孵育24 h条件下,没有影响HepG2细胞和牛干细胞活性,也没有抑制三磷酸腺苷结合盒转运体(ATP-binding cassette transporter)G2转运荧光基质的能力。蔬菜中硫苷含量较低,对其硫苷的安全问题目前关注较少,在未来研究中需要加强发酵蔬菜中硫苷安全性的研究。
3 发酵蔬菜中硫苷的代谢
十字花科蔬菜组织完整时,硫苷与黑芥子酶彼此相互隔离,植物组织中硫苷处于惰性状态[45]。制作发酵蔬菜时,蔬菜组织经受切割、加工,硫苷与黑芥子酶接触,硫苷在黑芥子酶作用下转化成异硫氰酸盐、硫氰酸盐、环腈类、腈类、噁唑烷等代谢产物[46]。在发酵过程中,除了蔬菜内源性黑芥子酶代谢作用,蔬菜自身携带的乳酸菌以及添加的发酵剂同样在硫苷代谢方面发挥着重要的作用。
截至目前,已知具有硫苷代谢能力的微生物主要来源于土壤、人体粪便和发酵食品[47-51]。其中,来自发酵蔬菜的乳酸菌主要有乳杆菌类(敏捷乳杆菌(Lactobacillus agilis)、格式乳杆菌(Lactobacillus gasseri)、嗜酸乳杆菌、干酪乳杆菌(Lactobacillus casei)、植物乳杆菌、副干酪乳杆菌(Lactobacillus paracasei))、肠膜明串珠菌(Leuconostoc mesenteroides)、双歧杆菌(假小链双歧杆菌(Bifidobacterium pseudocatenulatum)、青春双歧杆菌(Bifidobacterium adolescentis)和长双歧杆菌(Bifidobacterium longum))、乳酸乳球菌(Lactococcus lactis)和肠杆菌(阴沟肠杆菌(Enterobacter cloacae)和大肠杆菌(Escherichia coli))[46-47,52-55]等。
乳酸菌对十字花科蔬菜硫苷的代谢作用,可以促进植物组织硫苷物质的释放,也提高硫苷向异硫氰酸盐等活性代谢产物的生物转化。乳酸菌利用蔬菜碳水化合物代谢产生乳酸、乙酸等,降低了体系pH值,也会影响硫苷的代谢以及代谢产物的生成。
3.1 乳酸菌发酵促进蔬菜中硫苷释放
经过微生物发酵,某些硫苷从十字花科蔬菜植物组织中释放,从而增加了含量。西兰花泥经121 ℃、3 min高温灭酶灭菌处理后,屈曲花苷、2-羟基-3-丁烯基硫苷和萝卜硫苷含量低至无法定量,经植物乳杆菌和肠膜明串珠菌不同菌株接种发酵15 h,屈曲花苷、2-羟基-3-丁烯基硫苷和萝卜硫苷的含量分别增加至16.1~56.2、24.5~65.9、54.8~358.7 μg/g,且不同菌株之间存在显著差异[54]。这种现象出现可能原因是在高温灭酶时,游离态硫苷也被降解,因此几乎无法检出,而经过乳酸菌发酵,某些微生物代谢酶可以改变西兰花基质的理化特性,比如裂解植物细胞壁,提高了发酵西兰花中硫苷的可提取性,使得检出硫苷含量显著增加。
3.2 乳酸菌发酵促进蔬菜中硫苷生物转化
研究显示自然发酵或乳酸菌接种发酵后,西兰花、甘蓝等十字花科蔬菜中硫苷转化为抗坏血酸原、异硫氰酸盐和腈类等代谢产物[53,56-57]。甘蓝中主要硫苷为黑芥子苷、萝卜硫苷、屈曲花苷和3-丁烯基硫苷,经自然发酵后,代谢形成吲哚-3-甲醇、吲哚-3-乙腈和抗坏血酸原[56]。Palani等[49]研究发现,经过5 d自然发酵,甘蓝中90%硫苷降解成活性物质抗坏血酸原和吲哚-3-甲醇。芸苔葡糖硫苷被代谢成吲哚-3-甲醇,在酸性环境下,吲哚-3-甲醇与抗坏血酸结合形成抗坏血酸原[58]。Tolonen等[57]报道在发酵2 周内,甘蓝硫苷全部降解为异硫氰酸盐、吲哚-3-甲醇、噁唑烷硫酮、烯丙基腈和腈类。此外,也有研究报道甘蓝发酵还会形成3-甲基亚磺酰基丙基异硫氰酸酯(iberin,IBR)、烯丙基腈、异硫氰酸烯丙酯和萝卜硫素等挥发性代谢产物[59](表2)。
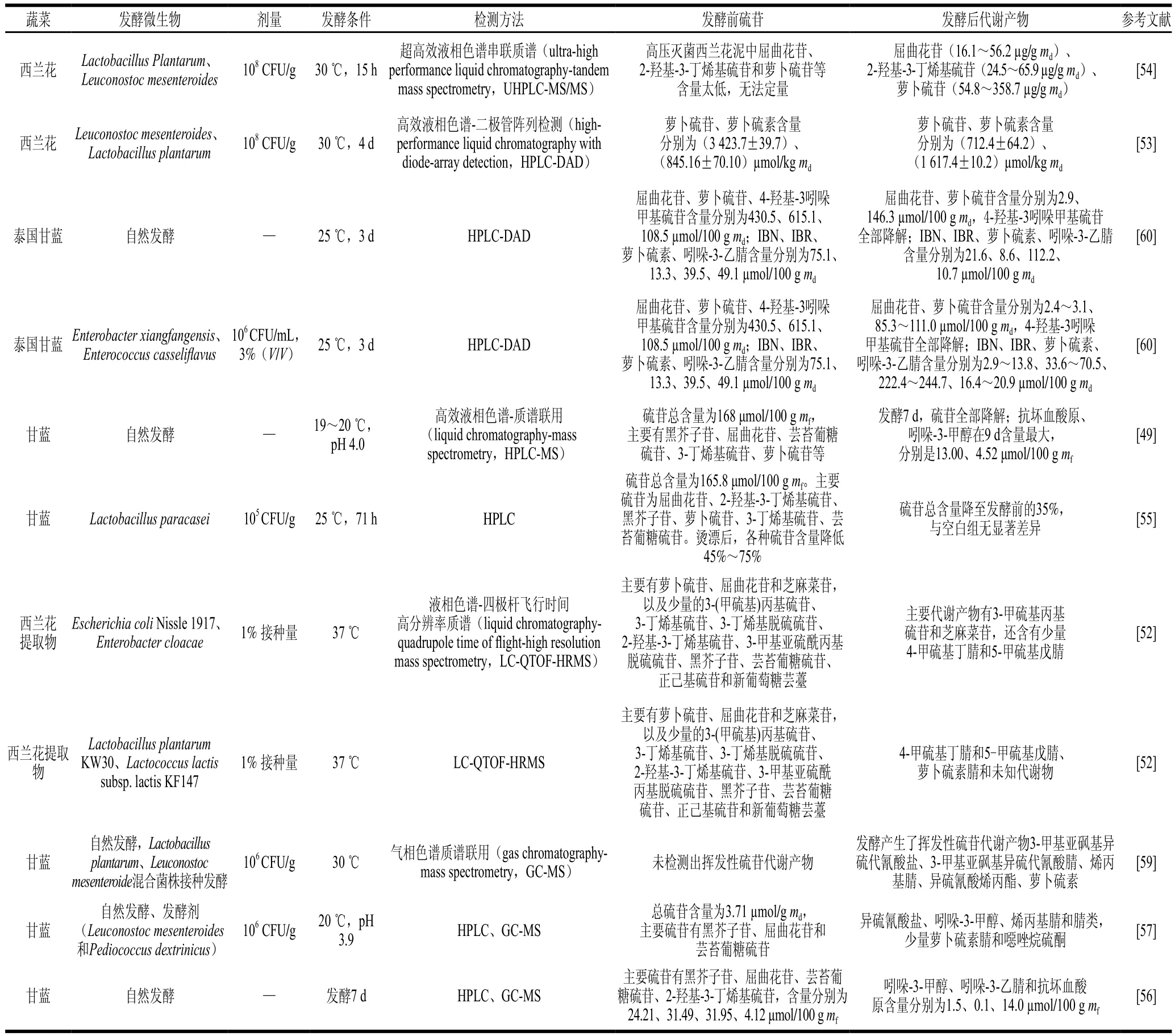
表2 发酵蔬菜中硫苷的代谢变化Table 2 Metabolism of glucosinolates in fermented vegetables
Mullaney等[52]研究发现肠杆菌科发酵将大部分西兰花屈曲花苷和萝卜硫苷转化为3-甲硫基丙基硫苷和芝麻菜苷,以及少量的4-甲硫基丁腈和5-甲硫基戊腈;而植物乳杆菌、乳酸乳球菌发酵产生4-甲硫基丁腈、5-甲硫基戊腈、萝卜硫素腈,并使其进一步代谢为未知物质,这提示微生物种属是影响硫苷代谢产物的一个重要因素。肠膜明串珠菌作为发酵剂时,酸菜中萝卜硫素含量显著高于以植物乳杆菌为发酵剂的泡菜中含量[59]。香坊肠杆菌(Enterobacter xiangfangensis)4A-2A3.1(EX)和酪黄肠球菌(Enterococcus casseliflavus)SB2X2(EC)发酵泰国甘蓝,硫苷代谢为4-甲基亚磺酰基丁腈(iberin nitrile,IBN)、IBR、萝卜硫素和吲哚-3-乙腈。其中EX组IBR含量显著高于EC组[60]。近期,一项研究显示,肠道微生物多形拟杆菌(Bacteroides thetaiotaomicron)具有特殊操纵子是将硫苷转化为异硫氰酸盐的一个重要的条件,进一步说明微生物在代谢硫苷方面具有菌株特异性[46]。
4 影响发酵十字花科蔬菜硫苷代谢的因素
十字花科蔬菜硫苷代谢既与蔬菜自身硫苷种类和丰度相关,也受到发酵蔬菜体系pH值、金属离子和特定蛋白等因素影响,同时也与蔬菜原材料前处理方法有关。
4.1 蔬菜中硫苷种类和含量差异
大白菜、甘蓝、西兰花等十字蔬菜的硫苷在种类和含量存在较大差异(表1)。即使同一物种,不同栽培品种之间的硫苷差异也十分明显。例如,62个大白菜品种的总硫苷含量最大可相差13 倍,而具体到特定种类硫苷,差异更为明显。以吲哚-3-甲基硫苷含量为例,80个西兰花品种中最高含量是最低含量的270 倍。
除了蔬菜品种,蔬菜栽培条件也会造成蔬菜组织中硫苷含量的差异。Martinez-Villaluenga等[61]报道屈曲花苷、黑芥子苷和吲哚-3-甲基硫苷是甘蓝中主要的硫苷,且与栽培季节(夏季或冬季)无关,但冬季收获甘蓝的吲哚-3-甲基硫苷(抗坏血酸原前体物质)含量要高于夏季甘蓝。
4.2 氯化钠含量
发酵蔬菜中氯化钠浓度对硫苷代谢产物以及含量具有重要影响。Martinez-Villaluenga等[61]发现添加了0.5%氯化钠的酸菜发酵一周后,抗坏血酸原含量显著高于添加了1.5%氯化钠的酸菜,无论甘蓝栽培季节是夏天还是冬天、自然发酵还是发酵剂发酵,趋势均一致。Peñas等[62]研究也发现无论是自然发酵还是接种了植物乳杆菌和肠膜明串球菌混合菌株发酵7 d的酸菜,0.5%氯化钠组酸菜的吲哚-3-甲醇和吲哚-3-乙腈的含量均显著高于1.5%氯化钠酸菜中的含量。东北酸菜发酵30 d,与高盐发酵组(2.5%和3.5%)相比,低盐发酵组(0.5%和1.5%)的4-戊烯基异硫氰酸酯、1-异硫代氰酸丁酯、3-丁烯基异硫氰酸酯等挥发性异硫氰酸盐含量降速更快,随着异硫氰酸盐含量降低,硫苷的另一类代谢产物腈类含量同时增加[51]。异硫氰酸盐和腈类的形成与体系pH值密切相关,而盐含量会影响微生物种群的类型,进而影响其产酸能力[8]。此外,高浓度氯化钠对黑芥子酶活性的抑制作用可能是其影响硫苷代谢的另一个途径[63]。
在自然发酵和接种乳酸菌发酵甘蓝的研究中发现,只有植物乳杆菌作为发酵时,更高盐含量(1.5%与0.5%相比)发酵体系的IBR、烯丙基腈、萝卜硫素等挥发性硫苷代谢产物含量会显著增加,这可能与菌株耐受渗透压的能力有关[59]。植物乳杆菌接种发酵的酸菜,0.5%氯化钠组的微生物数量(包括好氧嗜常温菌和乳酸菌)显著高于1.5%氯化钠的酸菜,而肠膜明串珠菌发酵酸菜的微生物数量在不同盐含量组别间没有差异[64]。
4.3 特殊蛋白
硫苷在黑芥子酶催化下先裂解释放β-D-葡萄糖,生成不稳定的糖苷配基。然后,糖苷配基通过洛森重排形成异硫氰酸盐,或者分解为腈类和环腈类等代谢产物。在黑芥子酶催化降解硫苷过程中,某些特殊蛋白起到了重要调控作用,这些蛋白主要有表皮特异硫蛋白(epithiospecifier protein,ESP)[65]、腈特异性蛋白(nitrile specifier protein,NSP)[66]、硫氰酸盐形成蛋白(thiocyanate-forming protein,TFP)[67]和表皮特异修饰蛋白(epithiospecifier modifier protein,ESM)[68]。ESP作为黑芥子酶的非催化性辅酶因子,促进不饱和脂肪族糖苷配基形成环腈类和腈类,而TFP的存在促进生成硫氰酸盐。NSP和TFP也会通过与不稳定糖苷配基结合生成腈类。特殊蛋白对硫苷代谢产物的影响往往与pH值相关,例如ESM在中性条件下会抑制环腈类和腈类形成,而形成异硫氰酸盐。
4.4 金属离子
研究表明在pH 3.5~7.5范围内,铁离子存在不会抑制黑芥子苷释放葡萄糖。然而,在pH 4.5和5.5条件下,铁离子会强烈抑制异硫氰酸盐的形成,在pH 6.5条件下,这种抑制效应明显降低,最终在pH 7.5条件下抑制作用完全消失[69]。现已证实,TFP蛋白会影响硫苷代谢产物的结构,它会催化糖苷配基转化为异硫氰酸酯或腈类,而二价铁离子是TFP蛋白的辅酶因子[70]。此外,铁离子也会影响ESP和NSP的活性,诱导形成腈类。铁离子对硫苷代谢影响研究主要见于植物体系中硫苷酶解反应,目前在发酵蔬菜硫苷代谢中作用尚待证实。在制作发酵酸菜时加入亚硒酸钠,结果表明硒元素主要以硒甲基硒代半胱氨酸形式存在于酸菜中,酸菜中抗坏血酸原略有下降,而吲哚-3-甲醇和吲哚-3-乙腈含量大幅增加,与对照组相比分别增加74%和13%[71],然而,硒对硫苷代谢的作用机制尚待进一步研究。
4.5 pH值
蔬菜发酵过程中,其中微生物存在动态变化过程。例如,酸菜发酵开始往往是以异型发酵乳酸菌占主导,主要是肠膜明串珠菌,随着这些乳酸菌生长,产生大量乙酸和乳酸,发酵体系pH值随之降低,当酸质量分数达到0.7%~1.0%、pH值低于4.5时,明串珠菌被酸耐受性更强的同型发酵乳酸菌所替代,主要是植物乳杆菌和短乳杆菌。同型发酵乳酸菌继续产生乳酸,pH值进一步下降到3.4~3.7[72-73]。硫苷被降解时,首先与硫相连的糖苷被打开,生成葡萄糖与不稳定的糖苷配基,环境pH值与特殊蛋白共同作用对糖苷配基的下游产物形成具有重要的影响。一般来说,pH值接近中性时,糖苷配基容易发生结构重排;pH值较低时会抑制洛森重排。ESP存在会促进腈类形成,但是酸性(pH 4)或碱性(pH 8)下,ESP活性被抑制,反而有利用生成更高含量的异硫氰酸盐[74]。然而,不同ESP亚型的最适pH值有所差异。Witzel等[75]从甘蓝中鉴定出3 种不同亚型ESPs:BoESP1、BoESP2和BoESP3。BoESP1和BoESP2活性的最适pH值在6~7,而BoESP3在pH 4~7之间活性都保持稳定。
4.6 加热处理
Sarvan等[55]研究发现在发酵之前沸水烫漂处理甘蓝5 min,再接种副干酪乳杆发酵71 h,总硫苷含量为发酵前的35%,与传统发酵方式相比,烫漂预处理起到了灭酶作用,使得发酵甘蓝中保留了较多含量硫苷。西兰花泥经过121 ℃高压灭菌3 min,只检测出屈曲花苷、2-羟基-3-丁烯基硫苷和萝卜硫苷等几种硫苷,且含量十分微少;而在西蓝花中已被发现报道的5-甲基亚磺酰戊基硫苷、4-羟基-3-吲哚甲基硫苷、芝麻菜苷、芸苔葡糖硫苷、4-甲氧基-3-吲哚甲基硫苷和新葡萄糖芸苔素等硫苷在西兰花泥中均未发现,可能是由于耐热性差,硫苷经高压处理已经被降解[54]。由此可见,加热温度会影响发酵蔬菜硫苷含量。ESP作为一种热敏感蛋白,在室温下会促进萝卜硫苷更多形成萝卜硫素腈,而不是萝卜硫素。当新鲜西兰花的芽或花在均质前于60 ℃下加热,形成的西兰花泥中萝卜硫素含量增加,而萝卜硫素腈降低,并且与ESP活性降低趋势一致。在70 ℃及以上温度下加热,西兰花中萝卜硫素和萝卜硫素腈含量均降低[76]。
5 结 语
硫苷及其代谢产物具有多种生理功能,因此受到人们广泛关注。本文重点阐述了它们在抗氧化、抗癌、调节肠道菌群、缓解代谢综合征等方面的最新研究进展。硫苷从惰性状态转化为具有生理功能的活性代谢产物,除了可以借助黑芥子酶的催化作用,微生物同样也具有相似功能。在发酵十字花科蔬菜中,乳酸菌不仅可以代谢糖类,产生乳酸、乙酸等,也可以降解硫苷等植物化学物质,形成发酵蔬菜的特征性风味。乳酸菌对硫苷代谢作用具有菌株特异性,此外,与黑芥子酶作用类似,硫苷代谢还受到体系pH值、盐含量、金属离子等外在因素的影响。
然而,关于发酵蔬菜中硫苷代谢目前仍有许多问题亟待解决,主要体现在以下几个方面:1)某些乳酸菌具有代谢硫苷的能力,但是相关的类黑芥子酶系仍未发现;2)发酵蔬菜中硫苷代谢往往是植物源黑芥子酶和乳酸菌共同作用的结果,两者作用关系尚不明确;3)发酵蔬菜硫苷代谢受到盐含量、金属离子、pH值等因素影响,其作用机制也需要进一步明确;4)考虑到噁唑烷硫酮、腈类等硫苷代谢产物具有一定的毒性,发酵十字花科蔬菜硫苷的潜在安全问题需要得到重视。
