乳清蛋白改性研究进展
2022-01-06刘培玲张晴晴高增丽曹文慧母智深
刘培玲,张晴晴,高增丽,杨 岚,乌 云,曹文慧,母智深,*
(1.内蒙古蒙牛乳业(集团)股份有限公司,内蒙古 呼和浩特 011500;2.内蒙古工业大学食品与生物工程系,内蒙古 呼和浩特 010051)
乳清是一种年产量很高的干酪副产物[1]。乳清蛋白是乳清的主要成分,含有多种组成物质,主要包括β-乳球蛋白、α-乳白蛋白、免疫球蛋白和牛血清白蛋白等[2](表1)。乳清蛋白含有丰富的必需氨基酸,易被生物体消化吸收[3],有“蛋白之王”的美誉,因此被作为功能性食品、营养制品等的重要原料和成分,广泛应用于食品生产中。目前主要通过超滤技术或透析过滤技术制备乳清蛋白产品,依据蛋白质含量的不同,可将浓缩乳清蛋白分为4 类,分别为WPC34、WPC50、WPC75、WPC80,而分离乳清蛋白是指蛋白质相对含量高于90%的乳清蛋白产品。

表1 牛乳清蛋白的组成及功能[2]Table 1 Composition and functions of whey protein from cow’s milk[2]
乳清蛋白中的一些成分容易引发过敏反应,β-乳球蛋白和α-乳白蛋白是其中主要的过敏原,能够使机体产生免疫应答,从而表现出强致敏性[4]。乳清蛋白自身性质也不稳定,在加工生产过程中高级结构容易被破坏,致使其物理、化学及生物功能发生改变,限制了乳清蛋白的应用。通过对乳清蛋白进行改性处理能够改变其疏水基团分布、空间排列构象以及氨基酸的组成等,进而改善乳清蛋白的功能性质或开发新的功能特性[5]。
本文主要综述了国内外学者们对乳清蛋白的改性技术,总结了乳清蛋白物理化学及酶法改性技术的应用及对乳清蛋白结构及功能影响的研究进展,以期为提高乳清蛋白资源的高效利用和经济价值提供参考。
1 物理改性
物理改性是通过物理方法(如机械能、热能和声能)来修饰蛋白质的一种改性方法,主要使蛋白质的高级结构和分子凝集模式发生改变。和化学改性相比,物理改性具有一定的优势,其不需要添加食品以外的其他化学成分,改性后的产品也不具有化学残留物,具有很好的安全性。物理改性乳清蛋白的方法主要包括热处理、高压处理、微波处理、超声波处理、超临界二氧化碳流体处理和等离子体处理。
1.1 热变性
1.1.1 温度对乳清蛋白物理改性的影响
乳清蛋白在加热过程中,会改变β-乳球蛋白和α-乳白蛋白的结构。β-乳球蛋白常温状态以自然二聚物形式存在,当温度高于60 ℃时,球状折叠结构打开伸展,内部巯基(—SH)暴露,在二硫键(S—S)的作用下分子间重新折叠,形成热变性聚集物;当温度高于85 ℃时,聚集物中的S—S发生断裂,β-乳球蛋白进一步伸展[6]。虽然α-乳白蛋白不含游离—SH,但其中的S—S遭到破坏后与其他含有游离—SH的蛋白质聚合进一步形成蛋白复合物[7]。
由于加热过程中乳清蛋白的固有结构发生改变,因此其理化性质也会发生改变。例如,当加热温度控制在60 ℃以上时,乳清蛋白的起泡性变差,泡沫稳定性却被改善,主要由于β-乳球蛋白的展开暴露了游离—SH,促进了S—S的形成,蛋白质发生交联从而造成起泡性变差。然而泡沫一旦形成,温度升高,伴随着S—S数量的增多,增加了形成泡沫的强度[8]。85 ℃加热处理能够提高浓缩乳清蛋白和分离乳清蛋白的乳化稳定性,乳清蛋白聚合物通过S—S的作用折叠生成,85 ℃加热处理后聚集物中的S—S发生断裂,β-乳球蛋白进一步伸展,有利于分子有序重排,从而使蛋白的亲水亲油性增强,更容易分散在乳化界面中[6]。Glibowski等[9]将质量分数10%的乳清蛋白分散液分别进行单次加热(pH 7.0、80 ℃下加热30 min)和二次加热(pH 8.0、80 ℃下加热30 min,pH 7.0、80 ℃下加热30 min),结果发现二次加热影响乳清蛋白的凝胶特性,乳清蛋白成胶速度快,具有较低的剪切应力和剪切应变,黏度增加。因此,升高温度可使乳清蛋白的乳化稳定性、凝胶性及黏度增强。
1.1.2 时间对乳清蛋白物理改性的影响
乳清蛋白的变性程度和功能性质受热处理时间的影响。吴丹阳等[10]发现乳清蛋白的变性程度和乳清蛋白-酪蛋白的结合程度随着热处理时间的延长明显增大。刘翠平等[11]发现乳清蛋白在75~95 ℃的温度变性区间内热稳定性随热处理时间的延长而逐渐增加,这可能是因为热处理时间过长乳清蛋白的结构被破坏。韩宛君等[12]发现延长热处理时间会导致乳清蛋白的黏度增加,这可能是因为加热过程使乳清蛋白分子链发生热运动,进而暴露了内部的疏水基团,疏水键和S—S的共同作用使疏水基团凝集。
1.1.3 金属离子对乳清蛋白物理改性的影响
对于热诱导乳清蛋白形成凝胶的过程,添加金属离子后蛋白质构象会发生改变。分子间的静电屏蔽作用和氢键的作用使得蛋白质的分子展开,二级结构中β-折叠的含量升高,α-螺旋、β-转角及无规卷曲含量降低,有序性降低,蛋白分子间的相互作用增强,促进更多分子的聚集和交联,从而诱导蛋白聚合物的形成[13]。一般用来诱导乳清蛋白凝胶的金属离子有钠离子和钙离子。当体系pH值为7、NaCl浓度为50 mmol/L或者CaCl2浓度为10 mmol/L时,在较低浓度乳清蛋白条件下加热即可形成热诱导凝胶[14]。钠离子和钙离子的添加能够缩短乳清蛋白凝胶的形成时间,加快聚合速度,改变聚集体尺寸[14]。钠离子主要依靠静电屏蔽作用使蛋白质分子聚集,形成的凝胶结构致密、光滑,孔隙小,凝胶切口呈纤细丝状;钙离子除了静电屏蔽作用还可以与带负电的—COOH形成离子桥[15]。钙离子形成的凝胶结构疏松多孔,形成由单一颗粒链节交联而成的“串球状”胶束,凝胶胶束比钠离子粗且不均匀。
低浓度的钠离子不能使乳清蛋白形成凝胶,在pH 6.7、温度90 ℃下反应20 min,只有盐离子浓度增至40~60 mmol/L时才能形成凝胶。当浓度继续增加至60~100 mmol/L时,凝胶的弹性模量、黏弹恢复性、持水力随着浓度的升高而升高,此时亮度较低;当浓度为150~200 mmol/L时,凝胶弹性模量和黏弹恢复性降低,持水力和亮度升高;当浓度为200 mmol/L时凝胶强度最大;当浓度大于200 mmol/L时,只有加热温度在60 ℃以上时,β-乳球蛋白才能发生不可逆的变性作用[16-18]。
乳清蛋白溶液只有加热到70 ℃才能对钙离子产生一定的敏感性,从而诱导形成凝胶[19]。低浓度钙离子使乳清蛋白形成的凝胶是透明的线性结构,随着浓度的升高会逐渐形成块状(不透明)凝胶。当钙离子浓度为10~20 mmol/L时,凝胶硬度迅速增加,20~30 mmol/L时凝胶硬度最大,继续增加浓度凝胶硬度下降,50 mmol/L之后凝胶硬度变化较小;当钙离子浓度为50 mmol/L时凝胶弹性最大,60 mmol/L时内聚性最大。钙离子浓度较高时,凝胶强度无明显变化,但凝胶率增加。钙离子浓度增加至180 mmol/L的过程中,剪切应力逐渐变大,剪切应变逐渐变小[20-21]。
1.1.4 乳清蛋白浓度对乳清蛋白物理改性的影响
当乳清蛋白浓度偏高时,变性后的蛋白质分子先是呈线状或颗粒状的聚合物,进而聚集为无定型的簇状聚合体,当浓度继续增加时,这种聚合体会产生凝胶或者沉淀,此时的浓度为蛋白质的临界质量分数,一般为9%~12%[22]。质量分数10%分离乳清蛋白以及β-乳球蛋白分别经80、85、90 ℃处理后乳清蛋白逐渐形成凝胶,黏度随温度的升高而增加[22]。
1.1.5 其他成分对乳清蛋白物理改性的影响
Beaulieu等[23]研究发现将乳清蛋白和果胶混合体系加热会形成以果胶和乳清蛋白络合物形式存在的凝胶。乳清蛋白呈三维网络结构,液体果胶存在于三维网络的空隙中。Line等[24]在pH 7、85 ℃条件下加热β-乳球蛋白悬浮液45 min制备乳浊液,后与向日葵油混合制备冷凝胶,发现形成的乳浊液冷凝胶性质受到向日葵油含量的影响,提高向日葵油含量,得到的凝胶具有较高的储能模量和持水力。Nikolaidis等[25]在pH 7.0下加热(80 ℃、15 min)乙醇和乳清蛋白,利用差示紫外光谱分析共混产物,结果发现乙醇体积分数在20%~50%范围时,乳清蛋白变性程度急剧增加。Schmitt等[26]研究了矿物质和乳清蛋白成分对蛋白微凝胶形成的影响,发现脱矿质后的α-乳白蛋白和β-乳球蛋白在pH 5.7下以质量比2∶8或在pH 5.8下以纯β-乳球蛋白的形式85 ℃加热15 min可以制得微凝胶。但单独利用α-乳白蛋白不能形成凝胶,这是因为α-乳白蛋白会降低参与微凝胶形成的疏水吸引力,从而使平衡向可溶性聚集体方向转移。
1.1.6 乳清蛋白来源对乳清蛋白物理改性的影响
骆驼奶中的乳清蛋白相对耐热,具有较高的变性温度。90 ℃热处理5 min后,骆驼奶中有67%的α-乳清蛋白未变性,而牛乳中仅有5%的α-乳清蛋白未变性。为了保证食品安全性,某些国家或地区会干预奶酪的制作过程,强制性要求对制备奶酪的牛奶进行热处理,但较高温度的热处理会影响奶酪质量与风味,前人优化骆驼奶干酪工艺条件后,建议采用65 ℃、30 min或72 ℃、30 s的热处理工艺[27]。
水牛奶中的乳清蛋白热稳定性较差,研究发现,延长提取时间或升高提取温度均会降低水牛奶的单体乳清蛋白和总乳清蛋白的提取率,进而影响乳清蛋白热稳定性效果。乳清蛋白的4 种主要成分中,α-乳白蛋白热稳定性最好,免疫球蛋白热稳定性最差,4 种成分的热稳定性由高到低依次为α-乳白蛋白、β-乳球蛋白、血清蛋白、免疫球蛋白[28],这与牛乳中各成分的热稳定性是一致的。
1.2 高压诱导变性
高压处理方法包括高静水压(high hydrostatic pressure,HHP)处理、高压均质和动态高压处理。高压一般被用于食品中微生物和芽孢的灭活,此外还可以利用高压制备乳清蛋白凝胶。
1.2.1 高压诱导变性机理
高压作用主要影响和破坏蛋白质三级结构和四级结构中的离子键和氢键等非共价键,S—S和—SH发生断裂和重排,增强疏水相互作用,而对共价键的影响很小。蛋白分子经高压处理后解聚为一些较小的颗粒亚基单位,随后亚基单位开始伸展,极性和疏水基团原来包裹在球状蛋白分子内部,在亚基单位伸展后暴露出来,增强了蛋白颗粒表面的电荷分布,当超过临界压力后,之前解聚的蛋白质会再次聚集。高压作用对蛋白质二级结构也有一定的影响,研究发现蛋白质二级结构中的α-螺旋、β-折叠和β-转角含量减少,转化为无规卷曲结构,但是高压不会影响其一级结构[29-30]。He等[31]采用相分离理论和原位光散射技术研究了高压诱导的乳清蛋白凝胶化的动力学过程,发现成胶时间随乳清蛋白浓度的升高而缩短,散射光强度与时间的对数遵循线性关系,表明在高压作用下乳清蛋白的凝胶化过程出现了相分离现象。
1.2.2 高静水压对乳清蛋白物理改性的影响
HHP技术是指在室温或温和条件下利用100~2 000 MPa的静水(油)压力处理物料,以杀菌、提取、蛋白改性(酶)等为目的的非热处理技术[32]。HHP处理会破坏蛋白质的非共价键(如离子键、氢键和疏水键等),但不改变共价键结构[33]。单糖、寡糖、氨基酸和维生素等小分子物质和一些风味组成物质不会受HHP影响[34]。
van Camp等[35]利用高压处理乳清蛋白,当压力为400 MPa、时间为30 min时,乳清蛋白形成较多孔隙的网络结构凝胶。经流变学振荡实验发现,高压诱导的凝胶有较低的消耗模量、储能模量及较高的凝胶强度[36]。Lim等[37]针对HHP处理后乳清蛋白的功能特性进行了研究,发现经过处理的乳清蛋白溶解性和起泡性增强。Keim等[38]在600 MPa、30 ℃和0~30 min条件下研究了高压诱导乳清蛋白凝胶的形成,发现延长HHP处理时间,乳清蛋白中β-乳球蛋白和α-乳白蛋白含量降低,分子间S—S数量增多,形成的凝胶弹性与硬度变大,说明S—S数量直接影响高压诱导乳清蛋白凝胶的质构特性。Dumay等[39]研究了乳清蛋白浓度对HHP改性过程的影响,发现30 min、400 MPa下浓缩乳清蛋白的质量分数至少达到11%才能形成凝胶,降低压力到200 MPa时,浓缩乳清蛋白的质量分数至少为22%才能形成凝胶。
1.2.3 高压均质对乳清蛋白物理改性的影响
高压均质是一种利用高速运动和高压能的释放将颗粒粗大的液体物料粉碎成颗粒细微的稳定乳浊液或悬浊液的新型乳品加工技术[40]。高压均质能够使乳清蛋白二级结构中的α-螺旋以及β-折叠含量降低,导致乳清蛋白的伸展和疏水基团的暴露,进而提高溶解度;同时乳清蛋白的柔韧性增强,从而以更快吸附速率聚合[41-42]。
Kuhn等[43]研究发现乳清蛋白乳液在较低压力(20 MPa)下均质化后粒度减小,乳液颗粒呈窄尺寸单峰分布,形成稳定的亚微米乳液,可以阻止液滴聚集和抑制脂质氧化。当压力增加到80 MPa时,乳液颗粒分布呈双峰型,表明液滴发生聚结。当增加均质化循环次数时,形成的高分子质量聚集体有利于增加乳液黏度和初级氧化产物含量。Yan等[44]研究发现高压均质化能够增加乳清蛋白乳液的亮度,淡化乳液的颜色,改善乳清蛋白的起泡特性及稳定性,增加乳液的糖度。Bouaouina等[45]发现高压均质使乳清蛋白聚集体发生解聚,造成分子内的疏水基团暴露,能够增强乳清蛋白疏水作用,增加乳清蛋白界面黏度,增强起泡性及泡沫稳定性。
1.2.4 动态高压微射流对乳清蛋白物理改性的影响
动态高压微射流是近年来才兴起的高压均质技术,通过高频振动、空穴爆炸、强烈剪切及连续操作等改变大分子结构,影响蛋白质的构象,从而改变蛋白质的性质[46]。
Zhong Junzhen等[47]发现使用动态高压微射流处理β-乳球蛋白时,超过80 MPa会明显改善β-乳球蛋白致敏性,同时提高β-乳球蛋白溶液的起泡性及乳化稳定性。钟俊桢等[48]研究了动态高压对乳清蛋白性质的影响,结果发现动态高压可以提高乳液起泡性及泡沫稳定性。压力升至120 MPa后,加大剪切速率,乳清蛋白溶液出现剪切稀化现象。
1.3 微波处理对乳清蛋白物理改性的影响
微波是一种频率在300~3 000 MHz的电磁波。微波作用蛋白质时,蛋白质分子内的极性侧链和偶极分子发生高频振荡,从而改变蛋白质的二级结构,使β-折叠的含量上升,α-螺旋的含量下降[49-50]。
邢绍平[51]研究微波对乳清蛋白凝胶质构特性的影响时发现,当温度60 ℃、功率500 W、时间60 s、蛋白质量分数18%、酸碱中性时乳清蛋白凝胶的质构特性最佳。Kaya等[52]在微波参数为700 W、2 450 MHz条件下对乳清蛋白膜的影响进行了研究,结果发现5 min就可以实现乳清蛋白膜的干燥,而传统室温下干燥需要18 h,微波处理不仅缩短了干燥时间,同时使膜的断裂伸长率和拉伸强度增加,因此微波处理可以改善膜的弹性等和机械强度。
1.4 超声波处理对乳清蛋白物理改性的影响
超声波是一种频率在20~500 kHz的声波。超声处理可以使蛋白质三级结构展开,使具有荧光发色团的氨基酸在进入蛋白质的疏水区域后发生相互作用[53],二级结构中α-螺旋转化为β-折叠[54],进而影响蛋白质的构象。
Stanic-Vucinic等[55]发现高强度超声可以提高表面疏水性并改变β-乳球蛋白的二级结构。Zisu等[56-57]探究了超声对乳清蛋白理化特性的影响,结果发现超声处理显著增加了热诱导的乳清蛋白凝胶强度,提高了乳清蛋白溶液的持水性和凝胶强度。Chandrapala等[58]研究了超声处理后乳清蛋白的热性质和结构的变化,结果表明乳清蛋白经5 min超声处理后,变性焓值降低,长时间的超声处理会导致蛋白质重新聚集,从而影响乳清蛋白的聚合度。
1.5 超临界二氧化碳流体处理对乳清蛋白物理改性的影响
超临界二氧化碳因其高效、绿色的特点被广泛应用于食品加工等方面[59]。可用于分离乳清蛋白,改善其品质和风味[60]。超临界二氧化碳处理能够改变乳清蛋白的结构和构象,使β-折叠含量增加,α-螺旋含量减少[61]。
Xu Duoxia等[61]发现经30~60 ℃、20 MPa超临界二氧化碳处理1 h,分离乳清蛋白溶液的浊度与粒度增加。在60 ℃下用超临界二氧化碳处理的分离乳清蛋白荧光强度增加,表明疏水区域暴露,蛋白已部分变性。Afizah等[62]发现90 ℃下超临界二氧化碳处理变性的蛋白质对1-苯胺基-萘-8-磺酸盐的亲和力增强,对反式-十八碳四烯酸的亲和力减弱,表明蛋白质结构发生变化。Mustapha等[63]在室温下进行浓缩乳清蛋白的水分散实验,结果显示,超临界二氧化碳处理后的浓缩乳清蛋白表面疏水性增强,稠度增加,乳液具有假塑性及良好的热稳定性,颗粒的分散性增强。
1.6 低温等离子体处理对乳清蛋白物理改性的影响
低温等离子体技术是一种气态原子和衍生物质激发产生的用于食品杀菌和灭酶的新兴物理加工技术[64]。低温等离子体的自由基和其他活性成分可以从等离子体内部产生[65],无需使用溶剂,是一种绿色技术。低温等离子体改性过程中,一方面可以直接或间接在分子表面引入惰性官能团,利用H2、N2、Ar、NH3、CO和O2等非聚合性气体等离子体与分子表面相互作用,在分子表面形成自由基或—COOH、—NH2和—OH等官能团,这些基团可以连接或键合其他分子或聚合物,进而获得所需的表面性能;另一方面,低温等离子体可以直接利用其产生的离子、电子、光子、自由基以及激发态分子等活性粒子促使分子直接聚合,使得有机分子的共价键打开,实现等离子体聚合[66]。
Zhang Hao等[67]研究发现等离子体会引发蛋白二级结构的改变以及肽链的聚合。等离子体作用的增强会导致β-折叠和随机序列含量增加,α-螺旋含量减少。在等离子体作用下蛋白质功能性质发生改变,该结果有助于理解等离子体改性蛋白质的作用机制,并从分子角度提供了理论解释。
2 酶法改性
酶法改性是通过蛋白质和某种酶发生相互作用,导致蛋白质交联或水解,蛋白结构发生改变,进而改善蛋白质的功能性[68]。对乳清蛋白进行酶法改性的方式主要有两种,酶法水解和酶法交联。乳清蛋白经酶法水解后多肽链降解,能够实现乳清蛋白分子内或分子间的重新连接,进而改善功能特性。酶法交联的实质是人为地引入交联键使乳清蛋白发生类蛋白质反应,产生流变学性质较好的物质[69]。
2.1 酶法水解
乳清蛋白含有许多天然的免疫调节肽,其是乳清蛋白一级序列的一部分,这些肽可以在肠道消化过程中释放,也可以通过体外酶水解产生特异性和非特异性免疫应答。乳清蛋白的多肽骨架通过蛋白酶分解后稳定性得到增强[64]。用于水解的蛋白酶专一性很强,不同蛋白酶具有不同的水解位点[70]。
2.1.1 碱性蛋白酶对乳清蛋白酶法水解的影响
碱性蛋白酶是一种非特异性蛋白质肽链内切酶,作用底物十分广泛[70]。碱性蛋白酶可以作用于羧基侧链上的所有疏水性和芳香族氨基酸羧基端的酰胺键,催化蛋白质分子内的肽键水解产生具有较小分子质量的肽,这个过程中蛋白分子内的抗原结合位点被破坏,蛋白质的过敏性得到有效改善[71]。与其他蛋白酶水解乳清蛋白的效果相比,碱性蛋白酶具有更好的水解效果,更高的水解速率[72],且β-乳球蛋白仅能够被碱性蛋白酶彻底水解[71],这是因为乳清蛋白在酸性和中性环境下溶解效果不好,但在碱性环境下具有良好的溶解性。
刘利军等[73]利用响应面分析法获得了碱性蛋白酶水解乳清蛋白的最佳条件,在pH 8.5、反应温度55 ℃、水解时间3 h条件下,水解度可达19.34%。沈小琴[74]和Wroblewska[75]等的研究也证实了碱性蛋白酶能够有效降低乳清蛋白的抗原性。不同蛋白酶处理的乳清蛋白抗原性具有明显差异,经碱性蛋白酶处理后,α-乳白蛋白的抗原性甚至降低了99.72%,β-乳球蛋白抗体的抗原性也降低了50.02%[74]。因此可以将该方法应用于低敏牛奶的制备。
2.1.2 中性蛋白酶对乳清蛋白酶法水解的影响
中性蛋白酶是一种催化蛋白水解的内肽酶。中性蛋白酶主要酶解疏水性高分子氨基酸的羧基端肽键,获得低分子质量肽,但中性蛋白酶的水解特异性不强,能够在中性、弱酸或弱碱环境下酶解蛋白质,最适pH值范围为6.0~7.5[76]。中性蛋白酶水解乳清蛋白的效果不如碱性蛋白酶[70],为了使乳清蛋白得到良好的水解效果,一般采用双酶复合法(碱性蛋白酶复合中性蛋白酶)进行同步酶解。
由于中性蛋白酶水解乳清蛋白的效果不明显,目前大部分工作还停留在探究中性蛋白酶水解方法和优化水解条件上。徐洪军等[76]利用甲醛滴定法测定中性蛋白酶酶解后β-乳球蛋白氨基酸态氮的含量,得到中性蛋白酶处理β-乳球蛋白的最优条件:水解温度50 ℃、水解时间6 h、pH 7.2。吴明楼等[77]以中性蛋白酶水解乳清蛋白制备乳清蛋白水解液,对水解乳清蛋白工艺条件进行了正交试验优化,最终水解度可达20.31%。韩仁娇等[78]探寻了乳清蛋白的双酶水解技术,优化了β-乳球蛋白水解工艺,结果发现55.2 ℃条件下同时添加F中性蛋白酶与G中性蛋白酶,β-乳球蛋白水解率可达(58.99±0.02)%,其中51.76%是分子质量分布在1 000~180 u之间的肽段,游离氨基酸相对含量为2.34%,明显优于市售的同类乳清蛋白产品。
2.1.3 地衣芽孢杆菌蛋白酶对乳清蛋白酶法水解的影响
地衣芽孢杆菌蛋白酶是一种芽孢杆菌属细菌分泌的胞外蛋白酶。地衣芽孢杆菌蛋白酶水解乳清蛋白后形成由小聚集体组成的微粒状态软凝胶[79-80]。有研究表明β-乳球蛋白水解产生的聚集体由一系列中等大小的肽(2~6 kDa)组成,这些肽通过非共价键(主要是疏水和静电相互作用)连接在一起[80],使乳清蛋白形成聚集体,改善乳清蛋白的凝胶性,提高乳清蛋白的凝胶速率和凝胶强度。
Otte等[81]利用比浊法、体积排阻色谱法、动态光散射法和流变学法揭示了地衣芽孢杆菌蛋白酶诱导乳清蛋白聚集和凝胶的现象,结果表明地衣芽孢杆菌蛋白酶水解乳清蛋白导致了肽聚集体的形成,并在40 ℃、pH 7.0下形成颗粒状凝胶。纯化的β-乳球蛋白制剂水解后也会形成聚集体,并且在质量浓度低至70 mg/mL条件下仍然能够形成凝胶。Otte等[82]鉴定了在中性条件下地衣芽孢杆菌蛋白酶水解β-乳球蛋白过程中形成聚集体的肽,结果表明聚集体由6~7个主要肽组成,其中4个肽被初步鉴定,分别为β-乳球蛋白的f75-89、f75-108、f135-157和f135-158。β-乳球蛋白f135-158肽段的正电荷和负电荷簇与疏水区域交替,这表明聚集是通过疏水相互作用和静电作用形成的。
2.1.4 胃蛋白酶对乳清蛋白酶法水解的影响
胃蛋白酶是一种由胃黏膜细胞分泌出的胃蛋白酶原激活得到的外肽酶。胃蛋白酶催化蛋白氨基端或羧基端芳香族氨基酸(酪氨酸、色氨酸和苯丙氨酸)的肽键[83],对氨基酸序列要求很高,特异性非常强,尤其是pH值在1.3附近时,只酶解多肽链内部苯丙氨酸的肽键。胃蛋白酶属于酸性蛋白酶,最适pH值为3,在中性或碱性环境下活性丧失,而乳清蛋白在酸性环境下溶解度较差,且胃蛋白酶具有强特异性,导致其水解效果极差。含苯环的芳香族氨基酸很多都是疏水氨基酸,当胃蛋白酶作用乳清蛋白时,会暴露疏水性氨基酸末端,增加最终产物中疏水性氨基酸含量,进而提高乳清蛋白的疏水性[70]。由于胃蛋白酶是外肽酶,造成分子内肽键得不到充分水解,大量过敏位点被保留,不能有效降低蛋白质抗原性,所以胃蛋白酶对β-乳球蛋白(主要过敏原蛋白)的水解作用不强[74]。
许女等[84]研究了胃蛋白酶对乳清蛋白抗氧化活性的影响,发现在2 h内水解产物的总还原能力和1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力均随时间的延长而增强,并都在2 h达到最大值。Pintado等[85]发现胃蛋白酶可以快速水解α-乳白蛋白,但水解β-乳球蛋白的速度很慢。贾建等[86]优化了胃蛋白酶水解乳清蛋白的条件,得到最佳水解条件为酶解时间187 min、温度40.5 ℃、pH 2.5,未优化时的水解度不足10.00%,优化后水解度高达16.98%。
2.1.5 胰蛋白酶对乳清蛋白酶法水解的影响
胰蛋白酶是一种从动物胰脏提取的外肽酶[74]。只催化精氨酸或赖氨酸羧基端肽键,得到以精氨酸或赖氨酸为C-末端残基的肽段,胰蛋白酶作为最常用的蛋白水解酶,催化特异性也最强。胰蛋白酶和胃蛋白酶性质相似,都属于外肽酶,但胰蛋白酶对乳清蛋白的作用效果稍强,胰蛋白酶同样不易水解β-乳球蛋白,不能有效降低其抗原性。酶解过程中乳清蛋白的疏水性较稳定,这是由于胰蛋白酶的特异性催化位点是碱性氨基酸(精氨酸和赖氨酸)羧基端肽键,水解产物中疏水氨基酸的含量不高,疏水性不会发生较大变化。
Chobert等[87]用胰蛋白酶处理乳清蛋白,结果发现乳清蛋白水解产物在所有pH值下的溶解度均高于对照乳清蛋白,在碱性环境下乳化能力增强,水解产物的乳化活性远高于乳清蛋白。Guo等[88]研究了β-乳球蛋白对胰蛋白酶水解的敏感性,结果发现β-乳球蛋白溶液在90~100 ℃下热处理5 min或10 min可以增强胰蛋白酶对蛋白的水解程度,这是因为天然β-乳球蛋白致密的球状结构对胰蛋白酶具有抗性,而加热处理使蛋白质构象发生变化,使乳清蛋白更易于水解。高学飞等[89]探究了胰蛋白酶水解乳清蛋白的最优条件,通过建立水解参数与乳清蛋白水解度之间的回归模型,得到最佳水解条件为水解时间12 h、温度52.3 ℃、初始pH 8.37、乳清蛋白质量分数6%。
2.1.6 木瓜蛋白酶对乳清蛋白酶法水解的影响
木瓜蛋白酶是一种从木瓜果实中提取得到的纯天然生物酶。木瓜蛋白酶是仅有一条单链的内切酶,共含有212个氨基酸,同时具有酯酶和蛋白酶的活性,底物特异性十分广泛[90]。木瓜蛋白酶可以水解多肽、酰胺以及酯中的赖氨酸、精氨酸和甘氨酸羧基端的肽键,对多种物质具有很强的水解能力,如蛋白、多肽、酰胺、酯等,除此之外,其还能够将蛋白水解物合成蛋白类物质。木瓜蛋白酶在酸性、中性和碱性条件下均能水解乳清蛋白,其对乳清蛋白抗原表位的破坏效果仅次于碱性蛋白酶,具有很好的抗原性。为使乳清蛋白获得最大水解度,一般利用木瓜蛋白酶和碱性蛋白酶进行双酶解,这是由于碱性蛋白酶是非特异性的蛋白质肽链内切酶,且作用底物十分广泛,能够水解所有羧基端具有疏水性或芳香族的氨基酸,而木瓜蛋白酶与碱性蛋白酶催化的肽键具有互补性,从而能够最大程度地水解乳清蛋白。
Kim等[91]研究了木瓜蛋白酶对乳清蛋白水解的影响以及水解产物肽的铁结合能力,结果发现乳清蛋白中的主要抗原部分β-乳球蛋白在50 ℃下60 min内可被完全水解,水解产物的铁溶解度为87%。Weerasinghe等[92]发现乳清蛋白可以抑制木瓜蛋白酶的活性,使木瓜蛋白酶的最低残留活性为8.7%,乳清蛋白中的高分子质量成分比低分子质量成分抑制效果更明显,然而乳清蛋白中的主要成分β-乳球蛋白和α-乳白蛋白对木瓜蛋白酶没有抑制作用。曲杜娟等[93]发现经木瓜蛋白酶处理的乳清蛋白酶解物对于酸奶的发酵有明显的促进作用,酶解物中小于5 000 u的肽段可能有利于乳酸菌的生长繁殖,添加酶解物可以明显增加贮藏期酸奶的表观黏度。
2.1.7 无花果蛋白酶对乳清蛋白酶法水解的影响
无花果蛋白酶是一种存在于无花果的乳胶及花托蛋白质中的纯天然生物酶。无花果蛋白酶可以作用于多种物质(如蛋白质、多肽等的苯丙氨酸和酪氨酸)的肽键,其水解特异性广泛,水解能力很强。无花果蛋白酶稳定性好,是一种耐热性较强的蛋白酶,其内部含有—SH基团,具有凝乳作用,最适凝乳温度高达85 ℃[94]。无花果蛋白酶和木瓜蛋白酶虽然都是植物蛋白酶,但无花果蛋白酶的适宜pH值范围比木瓜蛋白酶更宽,木瓜蛋白酶对底物的亲和性更高[95]。
肖安乐[96]利用无花果蛋白酶水解热变性乳清蛋白,结果发现经35 h的水解,无花果蛋白酶对热变性乳清蛋白的水解度为16.88%,乳清蛋白的乳化稳定性下降。邱业先等[97]对无花果蛋白酶水解牛血清白蛋白进行了研究,发现无花果蛋白酶对牛血清白蛋白具有水解作用。
2.2 酶法交联
蛋白酶通过类蛋白反应使乳清蛋白发生交联,将氨基酸从一条肽链转移到另一条肽链上实现对肽链的改造,使小分子质量肽链转变成分子质量高的肽链,增强流变性。这个过程β-乳球蛋白具有很高的参与度,能够形成分子内或分子间交联。
2.2.1 谷氨酰胺转氨酶对乳清蛋白酶法交联的影响
谷氨酰胺转氨酶(transglutaminase,TGase)是一种转移酶,经常被用于蛋白质的酶法改性研究。TGase主要催化酰基转移反应,包括3 种反应机理,分别为交联聚合、脱酰胺化和引入伯胺。以蛋白质链上游离氨基酸的ε-氨基、赖氨酸残基的氨基等为受体,酰基供体为谷氨酰胺残基上的γ-羟基酰胺基,在分子内和分子间形成ε-(γ-谷氨酰胺)赖氨酸交联链[69](图1),进而改善乳化性和起泡性等性质。
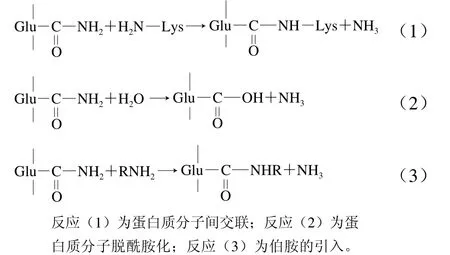
图1 TGase催化反应示意图[69]Fig. 1 Schematic diagram of TGase-catalyzed reactions[69]
Foegeding等[98]利用TGase使β-乳球蛋白和酪蛋白发生反应,以实现分子内或分子间的交联,结果发现对聚合物黏度影响由高到低的因素依次为反应温度、pH值、反应时间、加酶量,当温度50 ℃、pH 8.00、反应时间60 min、加酶量5 U/g时,所得的聚合物黏度适宜、稳定且具有高凝胶性。Agyare等[99]研究发现TGase显著提高了β-乳球蛋白的变性温度,共价交联后降低了蛋白质的表面疏水性,赖氨酰残基上的正电荷被消除,交联蛋白呈现U型pH值稳定性分布,在pH 4.0~4.5时具有最大浊度。Gauche等[100]的研究表明,当Tgase添加量增加到50 U/g时,聚合物含量和溶液的稠度指数增加,有利于非牛顿行为。Sayadi等[101]研究低脂伊朗白奶酪发现,将TGase加入到奶酪乳中能够获得更高的蛋白质回收率和硬度指数。Hernàndez-Balada等[102]向质量分数10%的分离乳清蛋白中加入明胶,结果引起体系黏度和弹性模量的同时增加,表明通过TGase处理含有少量明胶的乳清蛋白和蛋白质混合物可以开发新型生物聚合物。Truong等[103]将TGase生物素化并吸附到抗生物素蛋白亲和基质上,使其与质量分数为8%的乳清蛋白溶液作用,结果表明乳清蛋白发生有限交联,随着作用时间的延长凝胶强度增加,该方法中酶能够再循环利用[104]。Shao Shengnan等[105]将TGase交联乳清蛋白后用乙醇去溶剂化制备乳清蛋白-锌纳米微粒,所得纳米微粒具有较好的稳定性和较高的装载率,可以用作递送锌的良好载体。
2.2.2 漆酶对乳清蛋白酶法交联的影响
漆酶是一种单电子的氧化还原酶,属于多酚氧化酶,含有铜元素,作用底物十分广泛,除了可以催化氧化酚,还可以作于芳胺类化合物及其衍生物,能够使蛋白质和氧化产物醌与酚发生交联,增强凝胶性[106]。蛋白质与漆酶作用后形成底物自由基,与漆酶中的铜离子发生协同作用,可以将蛋白中的—SH氧化成S—S,将酪氨酸残基氧化成醌,醌与伯胺等活性氨基发生席夫碱加成或迈克尔加成,实现蛋白质交联[107]。
Jiang Zhanmei等[108]探究了在阿魏酸的存在下漆酶对α-乳白蛋白的催化交联作用,结果发现经漆酶和阿魏酸处理后形成聚合物,其抗氧化活性、凝胶强度和保水能力增强,且与反应时间呈正相关。随着反应时间的延长,漆酶催化的α-乳白蛋白-阿魏酸共轭物的粒径明显变大,固有荧光强度、表面疏水性、DPPH自由基清除活性和亚铁离子还原能力显著增加。
2.2.3 酪氨酸酶对乳清蛋白酶法交联的影响
酪氨酸酶是一类复杂的多亚基氧化还原酶,属于单酚氧化酶,也含有铜元素,当催化蛋白反应时,首先一元酚邻位羟基化为二元酚,再氧化成具有较高活性的苯醌,苯醌进一步与蛋白质中的游离氨基酸和—SH发生加成反应,最终形成酪氨酸-赖氨酸、酪氨酸-半胱氨酸、二酪氨酸[109],而在交联反应过程中必需氨基酸的含量减少[110]。有研究表明可以利用酪氨酸酶诱导α-乳白蛋白和β-乳球蛋白形成凝胶,并指出酪氨酸酶替代传统TGase的可行性[111-112]。
Thalmann等[111]探究了咖啡酸对酪氨酸酶交联乳清蛋白的影响,结果发现咖啡酸存在时β-乳球蛋白和α-乳白蛋白均可以发生聚合,当咖啡酸不存在时只有α-乳白蛋白发生聚合,而且反应过程中还有大于300 kDa的聚合体生成。Ercilicura等[113]使用酪氨酸酶交联β-乳球蛋白,通过圆二色光谱、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳、表面压力和界面流动性分析对交联蛋白进行了研究,结果发现常温下酪氨酸酶不能作用于β-乳球蛋白,当温度升高至40 ℃时,β-乳球蛋白发生交联。
2.2.4 辣根过氧化物酶对乳清蛋白酶法交联的影响
辣根过氧化物酶是一种利用过氧化氢氧化无机物和有机物的血红素酶,属于氧化还原酶,包括一条单一肽链和一个铁卟辅基,发生氧化还原反应时以过氧化氢为电子受体作用底物,可以催化无机离子、杂环化合物、胺类化合物、氧化酚类和过氧化氢。
Dhayal等[114]使用过氧化氢和辣根过氧化物酶诱导α-乳白蛋白生成蛋白纳米颗粒,与其他酶诱导的蛋白纳米颗粒相比,由于加入了过氧化氢,可以通过控制过氧化氢加入量来调控蛋白质凝胶纳米颗粒的形貌与尺寸,结果表明经辣根过氧化物酶诱导的蛋白质凝胶颗粒尺寸适中,形貌大小均匀。
3 化学改性
化学改性是利用化学试剂对蛋白质的作用,断裂某些肽键或者引入带负电荷基团、二硫基团和亲水亲油基团等功能性基团进行蛋白改性的方法。化学改性具有非常广泛的应用,不仅操作简单,改性效果也十分显著。蛋白质的化学改性主要涉及磷酸化、糖基化(美拉德反应)、酰化、去酰胺化和酸调改性等方法。
3.1 磷酸化对乳清蛋白化学改性的影响
蛋白磷酸化是由蛋白质激酶将三磷酸鸟苷或三磷酸腺苷γ位磷酸基催化转移到酪氨酸、苏氨酸和丝氨酸等底物蛋白质上的过程[115]。化学磷酸化改性方法具有试剂价格低廉、磷酸化效率高、易于工业化等优点,常用的磷酸化试剂有磷酰氯、三聚磷酸钠、磷酸、五氧化二磷、环状磷酸三钠等[116]。磷酸化作用实质上是蛋白质中酪氨酸、苏氨酸和丝氨酸—OH中的O,赖氨酸ε-NH2中的N,精氨酸—CN3H4中的末端N和组氨酸C3H4N2中的1、3位N与磷酸化试剂提供的Pi发生的—C—N—Pi—或—C—O—Pi—酯化反应[117]。引入磷酸根基团增加了蛋白质的电负性和蛋白分子间的静电斥力,使蛋白体系变得分散,分子间互相排斥,提高了溶解度,进而改善体系起泡性和乳化性[118]。
Sitohy等[119]研究了β-乳球蛋白的磷酸化作用,结果发现化学磷酸化可以破坏β-乳球蛋白的二级结构,在加热条件下磷酸化β-乳球蛋白时其二级结构没有发生改变,表明高温抑制磷酸化反应。Li Canpeng等[120]对磷酸化对乳清蛋白功能特性的影响进行了探究,结果发现磷酸化是改善乳清蛋白功能特性的有效方法。核磁共振光谱结果显示乳清蛋白的丝氨酸被磷酸化。圆二色光谱结果显示乳清蛋白的无规卷曲结构变化很小,但乳清蛋白经磷酸化后的色氨酸荧光强度降低,表面疏水性增强。此外,磷酸化还提高了乳清蛋白的稳定性、乳化性、发泡性、吸水能力和吸油能力。
3.2 糖基化改性对乳清蛋白化学改性的影响
糖基化是利用碳水化合物中的C=O与蛋白质分子上的—NH2(主要是赖氨酸上的α-或ε-NH2)以共价键形式结合的一种化学改性方法[121],也称美拉德反应。相较于其他化学改性方法,糖基化的反应条件更加温和,较低温度(60 ℃)下在低水分条件或水溶液中即可发生。
糖基化改性对蛋白质凝胶化的影响较为显著,蛋白质和碳水化合物主要形成3 种类型的混合胶,分别为联合型、镶嵌型和相分离型。联合型是指发生相互作用的两种多聚物分子形成共价交联的网络结构,镶嵌型是指两种多聚物形成的凝胶网状结构为连续状态,相分离型是指热力学不相容时,由于两种多聚物之间的斥力或对溶剂的吸附性不同形成各自的凝胶结构[19]。糖基化根据反应体系是否有溶剂分为干法糖基化和湿法糖基化。
3.2.1 干法糖基化对乳清蛋白化学改性的影响
干法糖基化是在干热条件下发生的糖基化反应。Kato等[122]首次提出了干法糖基化的概念,虽然糖基化过程需要很长的反应时间,但后续检测反应产物十分便捷。芦晶等[123]研究了多糖与乳清蛋白的反应,并对改性后蛋白最终的功能性质进行了研究,结果发现在45 ℃、68%的相对湿度条件下乳清蛋白与壳聚糖进行17 h的美拉德反应,糖基化产物的溶解性以及乳化稳定性得到了明显提高。Jimenez-Castano等[124]研究了乳清蛋白中3 种蛋白质(α-乳白蛋白、β-乳球蛋白和牛血清白蛋白)与葡聚糖(分子质量10 kDa和20 kDa)的干法糖基化改性,结果发现分子质量10 kDa的葡聚糖能够赋予乳清蛋白比20 kDa更高的凝胶强度,改性使牛血清白蛋白和β-乳球蛋白的热稳定性以及3 种蛋白质的溶解性得到了显著的提高。Kika等[125]在乳清蛋白中加入羧甲基纤维素,并探究了乳化稳定性的变化,结果发现加入羧甲基纤维素的乳清浓缩蛋白乳化稳定性更好。
3.2.2 湿法糖基化对乳清蛋白化学改性的影响
湿法糖基化适用于小分子的糖类反应,有反应周期短、反应速度快等优点,但也容易发生褐变[126]。Zhu Dan等[127]选择葡聚糖进行湿法糖基化,当pH 6.5、反应时间24 h、温度60 ℃且乳清蛋白和葡聚糖的质量分数分别为10%和30%时,可以明显提高样品的热稳定性和乳化性。Chevalier等[128]将葡萄糖、阿拉伯糖、乳糖、半乳糖、鼠李糖以及核糖分别与β-乳球蛋白进行湿法糖基化反应,结果发现与对照组相比,湿法糖基化增强了乳清蛋白-糖接枝物的热稳定性,提高了乳清蛋白-核糖接枝物与乳清蛋白-阿拉伯糖接枝物的乳化性和乳清蛋白-半乳糖接枝物与乳清蛋白-葡萄糖接枝物的起泡性,说明糖的种类和性质会影响β-乳球蛋白的功能性质。
3.3 酰化对乳清蛋白化学改性的影响
酰化是酸酐通过亲电子基团(C=O)与蛋白分子的亲核基团(ε-NH2)相互作用引入酸性亲水基团,又利用催化剂引入长碳链亲油基团,最终使蛋白质获得双极性基团,成为高分子表面活性剂。常用乙酸酐或琥珀酸酐酰化改性蛋白质,变性过程中蛋白质的ε-NH2被酰化,这个过程改变了蛋白质分子的表面净电荷,酰化试剂与蛋白质的反应过程见图2。利用乙酸酐进行酰化改性时,乙酸酐的中性CH3CO—与蛋白中的—NH2连接,减少了正电荷的数量,提高了溶解性;利用琥珀酸酐进行酰化改性时,琥珀酸酐的琥珀酰阴离子连到蛋白质赖氨酸中的—NH2上,代替了蛋白分子中的正电荷而增加了一个负电荷,多肽链伸展开,分子柔韧性增强,提高了蛋白质的持水性、持油性、乳化性和起泡性[129-130]。在蛋白质酰化改性中,琥珀酸酐酰化更常用,其作用效果更显著。
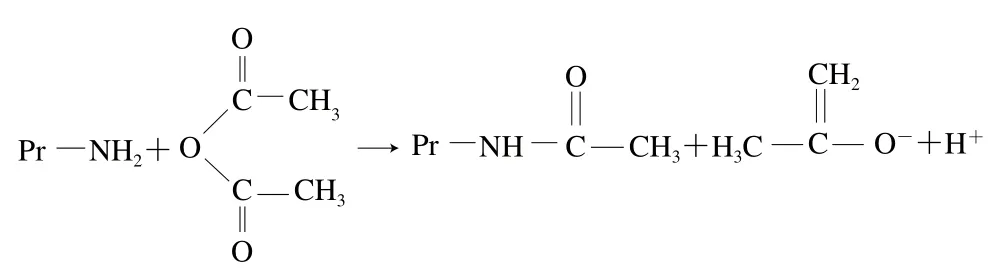
图2 酰化试剂与蛋白质的反应过程Fig. 2 Reaction route between acylating reagent and proteins
Thompson等[131]使用琥珀酸酐酰化改性乳清蛋白,并将其应用于即食布丁和冰激凌中,结果发现加入琥珀酸酐酰化改性的乳清蛋白使冰激凌黏度增加,凝固时间缩短且更耐融化,在不添加乳化剂和稳定性的情况下冰激凌的状态仍能保持稳定。Stanic-Vucinic等[132]利用乙酸酐酰化和琥珀酸酐酰化改性牛血清白蛋白,牛血清白蛋白作为乳清蛋白中的重要组成部分,其结构的改变直接导致乳清蛋白理化性质的改变,结果发现酰化改性影响其二级结构和三级结构,并增加了无规卷曲和β-折叠结构的含量,使蛋白质的疏水性显著降低。
3.4 去酰胺化对乳清蛋白化学改性的影响
去酰胺化是指把蛋白质富含酰胺基的氨基酸(谷氨酸和天冬氨酸)进行脱酰胺基作用,因此也称为脱酰胺化。蛋白质的一级结构和二级结构不受脱酰胺改性的影响,酰胺基团大量存在于蛋白质中[133-134],主要通过—COOH中的O和H发生质子化作用,释放亚氨基,将蛋白质中的谷氨酰胺和天冬酰胺脱去酰胺基生成谷氨酸和天冬氨酸,即—CONH2脱酰胺形成—COOH,此过程的介质一般为碳化二亚胺。蛋白质去除酰胺基团后,电负性增加,等电点降低,溶解性、起泡性和乳化性提高。蛋白脱酰胺作用除对谷氨酸和天冬氨酸有影响外,对其他氨基酸的含量和组成没有影响[135]。
李丹等[136]通过单因素试验探究了反应温度、反应时间和pH值对乳清蛋白限制性脱酰胺的影响,并以脱酰胺度为评价指标确定了pH 7,温度36 ℃,反应时间1、4、8 h条件下,乳清蛋白的脱酰胺度分别为1.5%、2.3%、2.9%;限制性脱酰胺不同程度地改变了乳清分离蛋白的理化特性,乳清蛋白脱酰胺后起泡性、乳化稳定性及对Fe3+、Zn2+的螯合能力均得到提高,且随脱酰胺度的增大而升高。
3.5 酸调改性对乳清蛋白化学改性的影响
水溶液中的蛋白质属于两性离子,在其等电点处自由电荷最低,容易产生聚集,并从水溶液中沉淀出来,这时存在最低的水合度。根据这一特点,多种酸(硫酸、盐酸、磷酸、丙酸、柠檬酸、醋酸等)都具有酸调改性的作用。在变性过程中蛋白质打开分子结构,分子更大限度地相互靠近,蛋白质发生聚集进而形成小分子聚合物。在不同pH值条件下,β-乳球蛋白形成的聚合物形状发生不同程度的变化。β-乳球蛋白等电点约为5.1~5.3,当临近等电点时,蛋白质分子间具有最弱的静电作用力,参与作用的蛋白质能够最大限度地发生碰撞,从而生成球状微米级聚集体[22,137],当pH值超过6时产生无序形状的聚合物,pH值调低至3时,产生纤维网状结构的聚合物[138-139]。
在不同pH值下,乳清蛋白具有不同的凝胶性质,van Camp等[140]的研究表明当pH 2~3时浓缩乳清蛋白形成软凝胶,pH 4~6时浓缩乳清蛋白形成凝乳状凝固物,pH 7~9时浓缩乳清蛋白形成坚固的凝胶。酸度也会影响乳清蛋白表观黏度,Tang Qingnong等[141]研究发现当pH值为3~7时乳清蛋白具有最低的表观黏度,pH值为1和11时有最高的表观黏度,表观黏度整体呈现先下降后平缓再升高的趋势。此外,酸度会影响乳清蛋白的稳定性,Schong等[142]发现在高于中性pH值下乳清蛋白具有最高的热变性率。
4 乳清蛋白的基因工程改性技术
除上述物理改性、酶法改性和化学改性技术之外,近年来,还出现了一些新兴的乳清蛋白改性技术,如基因工程改性。目前,乳清蛋白的基因工程改性主要是对相关基因进行定点整合转移,并对乳清蛋白基因进行检测与分析。然而外源基因整合机制还不是很清楚。基因工程改性方法目前尚未攻克一些技术上的问题,还处于实验室研究阶段[143-145],整个改性过程的周期漫长、见效慢。借鉴其他领域基因工程改性经验,未来可通过基因工程改性改变乳清蛋白组成,以提高其营养价值,也可以应用于抗营养因子的研究。
5 协同改性
协同改性是指利用物理、化学、酶法中的两种或两种以上相同或不同手段对蛋白质进行复合改性。食品行业的快速发展对蛋白质品质有了更高的要求,蛋白质协同改性比单一手段改性更能满足当前社会对不同功能蛋白的需求,蛋白质经协同改性后,功能性质有了进一步的提高,从而可以适应不同产品的需要。目前主要通过化学协同、酶法协同或物理酶法协同对乳清蛋白进行协同改性。
5.1 化学协同改性
化学协同主要是利用两种化学手段改性乳清蛋白,它具有操作简单、应用广泛和改性效果显著等优点,虽然蛋白质的功能性质得到了进一步的提高,但化学协同改性比单一化学改性加入的试剂更多,使得最终产品中未参与反应试剂的去除变得尤为困难,目前主要利用磷酸化和糖基化协同对乳清蛋白进行改性。Enomoto等[146]研究了磷酸化和糖基化反应在干热条件下对α-乳白蛋白结构和功能的影响,结果发现麦芽五糖和α-乳白蛋白进行干法糖基化反应后加入焦磷酸盐,其乳化性、热稳定性以及在磷酸钙溶液中的溶解性得到明显提高。
5.2 酶法协同改性
酶法协同是利用两种酶对乳清蛋白进行处理,酶法改性的专一性强、条件温和、反应速度快、易于被人体消化,但价格高昂,若应用于大规模工业化生产,则需要数量庞大的低廉微生物酶。Ena等[147]利用胃蛋白酶和Corolase PP(胰酶的混合物)消除乳清蛋白的致敏性。使用来自对牛奶蛋白过敏患者的血清,通过理化和免疫学技术对水解产物进行表征,结果发现胃蛋白酶和Corolase PP的结合可完全消除乳清蛋白β-乳球蛋白和牛血清白蛋白的抗原性位点。
5.3 物理酶法协同改性
物理酶法协同改性是结合物理方法和酶法改性乳清蛋白。物理酶法协同改性优势明显,与化学协同改性相比较,物理酶法协同改性无毒副作用,安全性更高,与酶法协同改性相比较,其费用更低,更适合应用于大规模批量生产。因此,物理酶法协同改性成为最热门的协同改性乳清蛋白的方法。Chicon等[148]在HHP条件下用胰蛋白酶和胃蛋白酶处理乳清分离蛋白,结果表明水解产物的抗原性和与人体免疫球蛋白的结合能力较低,水解物接近乳清蛋白等电点时可以提高热稳定性,当pH值为7时,改性乳清蛋白的乳化性升高。Ahmadi等[149]研究发现超声波预处理和微生物转谷氨酰胺酶的协同作用使乳清蛋白浓缩物表现出非牛顿剪切稀化行为,能够更好地改善乳清蛋白系统的各种性质。
6 改性乳清蛋白的性质变化
6.1 凝胶性
乳清蛋白经过一定程度的变性会产生三维网络结构,这个过程称为胶凝过程,常用凝胶性对其进行表征。交联过程中二硫键的数量增多,疏水相互作用增强,导致凝胶性增强。增强凝胶性可以改善乳清蛋白的黏稠性、持水性以及组织状态,在糕点和肉品制作中起到重要作用,尤其是在酸奶运输过程中,可以有效改善脱水收缩和乳清蛋白的析出。
Spotti等[150]比较了酶解和热处理诱导乳清蛋白凝胶化的蠕变和恢复行为,应用于蠕变数据分析的分数导数模型显示,酶诱导凝胶比热诱导凝胶弹性模量更大,更具弹性;但是通过显微观察发现酶诱导凝胶比热诱导凝胶比具有较大的孔径、较疏的网络,可能是由于酶处理增加了凝胶的断裂应变和应力[151]。da Silva等[152]的研究表明镁离子可以改善乳清分离蛋白的凝胶性。Rabiey等[153]探究了乳清蛋白浓度对凝胶性的影响,结果发现增大乳清蛋白的浓度可以得到质地更好的凝胶。
6.2 流变性
乳清蛋白在凝胶化过程中会表现出流变特性,常用表观黏度对其进行表征。增强流变性可以显著改善半固体食品(如牛奶、酸奶、果酱等)的黏稠状态,以达到良好的感官品质。
Tang Qingnong等[154]使用流变仪在稳定剪切条件下研究了乳清蛋白浓缩物溶液的流变性,结果发现在22 ℃、pH 7条件下,质量分数10%的乳清蛋白溶液表现出牛顿流体行为,10%~30%之间表现为假塑性行为,剪切稀化在乳清蛋白质量分数为35%以上时不明显,此时老化效果更为明显。Sağlam等[155]研究发现两步乳化和热诱导结合处理能够形成平均尺寸为0~10 μm的乳清蛋白颗粒(蛋白质量分数20%),将颗粒分散在乳清蛋白或阿拉伯胶溶液中90 ℃加热30 min,当使用质量分数1%阿拉伯胶作为稳定剂时,热处理后没有观察到溶液黏度的变化,当使用α-酪蛋白酸盐或乳清蛋白作为稳定剂时,在低剪切状态下溶液黏度增加,在高剪切状态下观察到溶液增稠。由于溶胀颗粒的尺寸在加热后增加,热处理没有显著改变颗粒的ζ电位,结果表明颗粒的溶胀在分散体的热稳定性和流变性质中起重要作用。
6.3 溶解性
蛋白质溶解性是指蛋白质在溶剂中的溶解能力。亲水性强的蛋白质分子更有利于溶解。乳清蛋白的溶解性提高,起泡性和乳化性也会相应提高,而起泡性和乳化性在食品加工中的作用非常显著。
Klarenbeek等[156]发现乳清分离蛋白结构受加热的影响,温度为60 ℃时会影响乳清分离蛋白的起泡性和溶解性,且这种影响是可逆的。Jambrak等[157]研究了超声对乳清蛋白溶解性的影响,利用超声分别处理乳清蛋白水解物15 min和30 min,结果发现经超声处理后pH值无明显变化。超声对乳清蛋白在高温下的溶解性和发泡性等功能特性具有显著影响,且处理15 min的效果优于处理30 min的效果。
6.4 起泡性及泡沫稳定性
起泡性是指蛋白质产品搅打起泡的能力,其泡沫维持稳定的能力称为泡沫稳定性。乳清蛋白在起泡过程中会被吸附到气-液界面,形成一层膜,界面张力降低,产生的许多小气泡群会最终形成泡沫。乳清蛋白的起泡性可以赋予食品精美的形态和良好的口感。
Phillips等[158]发现加热和pH值会影响乳清分离蛋白的起泡性,pH值为5时未受热乳清蛋白的泡沫稳定性最好。赵艳丽等[159]研究发现离子强度会影响体系表面张力和起泡性。Ching等[160]为改善乳清蛋白的起泡性能,研究了超声对100、150、200 g/kg乳清蛋白悬浮液起泡性等的影响。结果发现经超声处理的200 g/kg乳清蛋白悬浮液的起泡性提高了18%,泡沫稳定性提高了35%,稠度指数提高了18%,储能模量提高了17%,损耗模量提高了26%,黏度提高了10%。与未处理的乳清蛋白相比,使用超声处理的样品悬浮液泡沫的分布更加均匀,细小气泡的数量最多增加46%。
6.5 乳化性及乳化稳定性
乳化性是指蛋白中的油和水形成乳化液的能力,维持稳定乳化性的能力称为乳化稳定性。乳清蛋白含有亲水基团和疏水集团,由于亲水基团分布于蛋白质表面,使乳清蛋白具有很好的水溶性。在乳化的过程中,油相为蛋白质的疏水区,水相为蛋白质的亲水区,均质时,脂肪球和乳清蛋白分子相互依附,形成十分稳定的蛋白/脂肪膜,同时避免了脂肪球产生聚集现象,从而实现均相乳液的目的。牛奶、蛋糕等许多食品的生产制作过程中需要添加良好乳化性能的乳化剂,使水相和油相均匀成乳液,并保持稳定的状态,防止在短时间内发生沉淀。
耿浩[22]研究了热处理浓缩乳清蛋白聚合物和分离乳清蛋白聚合物的乳化性和乳化稳定性,结果发现热处理浓缩乳清蛋白聚合物和分离乳清蛋白聚合物比未处理乳清蛋白的乳化性低,乳化稳定性高,85 ℃处理浓缩乳清蛋白聚合物和分离乳清蛋白聚合物的乳化性和乳化稳定性比90 ℃处理高。Jacob等[161]研究了两种酸性肽酶制剂(Maxipro AFP和蛋白酶AP-30L)对乳清蛋白乳化性的影响。结果发现乳清蛋白水解产物的乳化性增强,但两种肽酶制剂水解产物之间未发现乳化特性的差异。Moussier等[162]研究了溶剂和加工方式对乳清蛋白乳化特性的影响,将乳清蛋白溶解在纯净水或渗透液中,然后对其进行热处理、机械处理和动态高压处理(16、100、350 MPa),结果发现,热处理和350 MPa的动态高压使乳化性能发生了显著的变化,但是机械处理仅引起了很小的变化。
7 结 语
随着社会经济的快速发展,人们的生活水平和消费水平得到显著提高,对于食品的种类和质量有了新的要求。乳清蛋白作为一种优质蛋白,可通过对其加工改性有针对性地提高某些功能性质,但由于单一技术对乳清蛋白的改性效果有限,应用仍然受到限制,研究乳清蛋白新产品和新工艺刻不容缓。综合现阶段的研究进展,可以将两项甚至多项技术结合处理乳清蛋白,物理方法、酶法及化学方法等多项技术复合改性不仅可以使蛋白获得更好的功能性质,还能改变传统乳清蛋白产品的加工套路,为研发优质化、个性化食品提供新思路。未来可以集合加强人体营养摄入、维护肠道菌群健康以及调节身体机能等方面的需要研发新产品,生产消费者真正需要的健康食品。
