莲子酸枣仁酵素的功能研究
2022-01-04刘潇萌朱德强祝文兴刘新利黄谊东张国栋黄武军
刘潇萌,朱德强,祝文兴,王 婷,刘新利*,黄谊东,张国栋,黄武军,李 欣
1.齐鲁工业大学(山东省科学院)生物工程学院,济南 250353 2.江西仁仁健康产业有限公司,樟树 331200 3.江西农业工程职业学院,樟树 331200 4.仁和集团(发展)有限公司,樟树 331200
在中国经典医书中,《神农本草经》记载“补中益肝,坚筋骨,助阴气,皆酸枣仁之功也”。《本草纲目》记载“枣仁:熟用疗胆虚不得眠,烦渴虚汗之症;生用疗胆热好眠,皆足厥阴少阳药也”[1]。而现代综合性研究与分析实验表明,酸枣仁具有有效的镇静和催眠作用,并有一定的血压、血脂调节活性,是适合缓解治疗失眠、神经衰弱的优良中药原料[1-2]。
酵素是以动物、植物、菌类等为原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分的产品[3]。随着社会高速发展,生活节奏逐步加快,亚健康人群日益增多,养生的理念也越发受到大众关注[4],基于药食同源类的酵素也开始广泛应用于生活的各个方面。近年来,酵素已是我国健康产业甚至全社会的焦点,备受行业从业者和普通百姓的追捧。酵素影响力提升的同时,功效评价亟待科学认定和深入研究[5-6]。
研究以莲子酸枣仁酵素为研究对象,从成分组成、动物实验、肠道菌群组学分析等方面,研究其改善睡眠相关功能,以期为莲子酸枣仁酵素的功能评价提供理论依据;同时为酵素产品的发展和革新提供参考。
1 实验材料与方法
1.1 实验材料
莲子酸枣仁提取液和莲子酸枣仁酵素由江西仁仁健康产业有限公司提供,莲子酸枣仁提取液未经发酵,其主要配料为莲子、酸枣仁、龙眼肉、百合、茯苓、肉桂、人参、诺丽果浆。1,1-二苯基-2-三硝基苯肼(DPPH)购自上海阿拉丁生化科技有限公司;福林酚试剂、没食子酸、芦丁购自上海生工生物工程有限公司;安神补脑液购自济南漱玉大药房,产自广州白云山药业;马来酸曲美布汀溶液片和硫酸阿托品片购自济南长清区人民医院,产自天津田边制药有限公司和杭州民生药业有限公司;乐力益生菌调理冻干粉购自京东网上商城,产自维奥健康科技(成都)有限公司;其他生化试剂均购自国药集团化学试剂有限公司。
1.2 多酚、黄酮、总酸含量的测定
多酚测定按照GB/T 8313-2008《茶叶中茶多酚的检测》测定;总黄酮的测定参照SNT 4592-2016《出口食品中黄酮的测定》;总酸测定(以柠檬酸计)按照GB/T 12456-2008《食品中总酸的测定》测定。
1.3 有机酸的测定
采用带有示差检测器的岛津高效液相色谱仪(LC-20AT,日本岛津);色谱柱Bio-Rad AminexHPX-87H(美国伯乐);流动相为0.5 mmol/L H2SO4溶液,流速0.6 mL/min,柱温65 ℃。酵素样品经离心(12 000 r,2 min),取上清过0.22 mm无机滤膜。
1.4 氨基酸种类及含量测定
采用氨基酸分析仪(HITACHI L-8900,日本日立),样品离心(8 000 r,5 min),取上清;酵素用双蒸水稀释后按1:1体积比加入去沉淀处理液,混匀后过0.22 mm滤膜。
1.5 抗氧化能力测定
准确称量4 mg DPPH用无水乙醇溶解定容至100 mL容量瓶中,摇匀即得到DPPH工作液。在10 mL比色管中依次加入4.0 mL DPPH工作液和稀释后待测液,再加入无水乙醇至刻度,混匀后立即用测定517 nm波长处吸光度(A),记为Ai;在室温避光保存30 min后再次测定吸光值,记为Aj;对照实验为只加DPPH的乙醇溶液,其吸光值为Ac。按下列公式计算自由基清除率:K=[1-(Ai-Aj)/Ac]×100%。
1.6 睡眠实验
实验选用雄性昆明鼠(体重18~22 g),购自斯贝福(北京)生物技术有限公司。小鼠随机分组,每组10只;按表1分组灌胃培养,灌胃频率一天两次,每次一半剂量。安神补脑液灌胃前用无菌水稀释十倍。
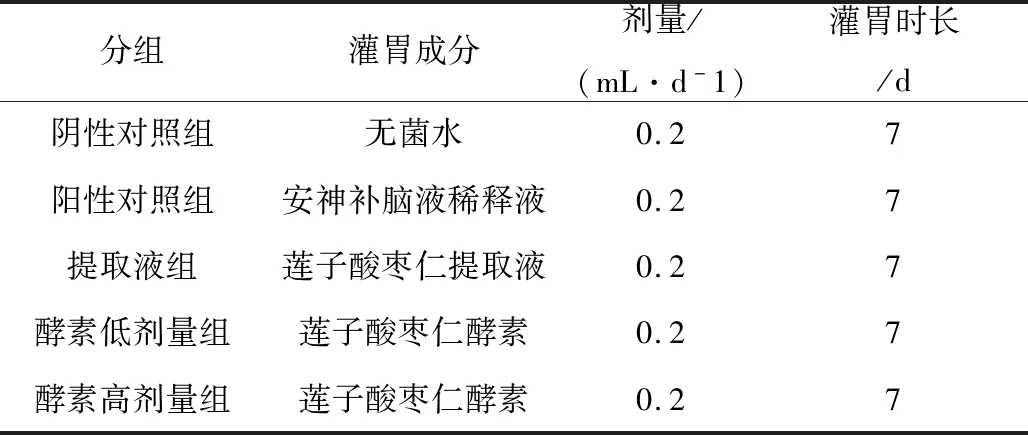
表1 睡眠实验分组和剂量
1.6.1 直接睡眠实验
各组小鼠以预设剂量分别一次性灌胃。睡眠以翻正反射消失为指标。当小鼠置于背卧位时,如超过60 s不能翻正,即认为翻正反射消失,进入睡眠。翻正反射恢复即为动物觉醒,翻正反射消失至恢复这段时间为动物睡眠时间,记录1 h内各组入睡动物数及睡眠时间。
1.6.2 戊巴比妥钠阈下剂量催眠实验
各组小鼠末次灌胃30 min后,按戊巴比妥钠最大阈下催眠剂量(30 mg/kg)·BW(80%~90%小鼠翻正反射不消失的剂量)对小鼠腹腔注射,记录30 min内入睡动物数量(翻正反射消失达60 s以上)。
1.6.3 巴比妥钠睡眠潜伏期实验
各组小鼠末次灌胃30 min后,按(250 mg/kg)·BW剂量腹腔注射巴比妥钠,从注射开始到翻正反射消失所用时间为睡眠潜伏期,记录各组小鼠睡眠潜伏期。
1.6.4 延长戊巴比妥钠睡眠时间实验
各组小鼠末次灌胃30 min后,按(50 mg/kg)·BW腹腔注射戊巴比妥钠,以翻正反射消失和翻正反射恢复为指标,两者之间这段时间为睡眠时间。
1.7 肠道蠕动能力测定
实验选用C57BL/6J雄性7~8周小鼠(体重18~22 g),购自斯贝福(北京)生物技术有限公司。小鼠随机分组,每组10只;经适应性培养1周后,按表2分组灌胃培养。其中灌胃所用马来酸曲美布汀溶液为现用现配,取一片溶解到250 mL水中,搅拌彻底溶解。
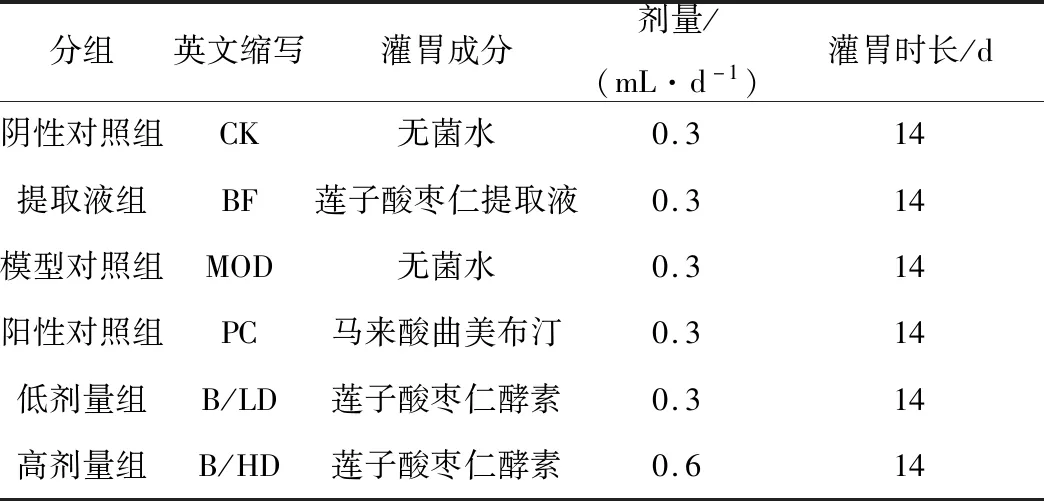
表2 肠道蠕动能力测定分组和剂量
按照表2所示的分组和剂量,连续灌胃14 d后,各组小鼠禁食不禁水12 h。除阴性对照组外,分别给予硫酸阿托品0.1 mL腹腔注射抑制小肠蠕动。30 min后,所有组给予灌胃墨汁0.2 mL。25 min后脱颈椎处死动物,打开腹腔分离肠系膜,剪取上端至幽门,下端至回盲部的肠管,将小肠拉成直线,测量肠管长度为“小肠总长度”,从幽门至墨汁前沿为“墨汁推进长度”,计算墨汁推进率:墨汁推进率=墨汁推进长度/小肠总长度×100%。
1.8 肠道菌群的影响和调节实验
实验选用C57BL/6J雄性7~8周小鼠(体重18~22 g),购自斯贝福(北京)生物技术有限公司。小鼠随机分组,每组10只;适应性培养1周,按表3分组灌胃培养。建模组采用含2.5% DSS的饮水替代正常饮水,获得炎症性肠炎IBD模型小鼠。乐力益生菌每包用室温无菌水100 mL溶解,现用现配。
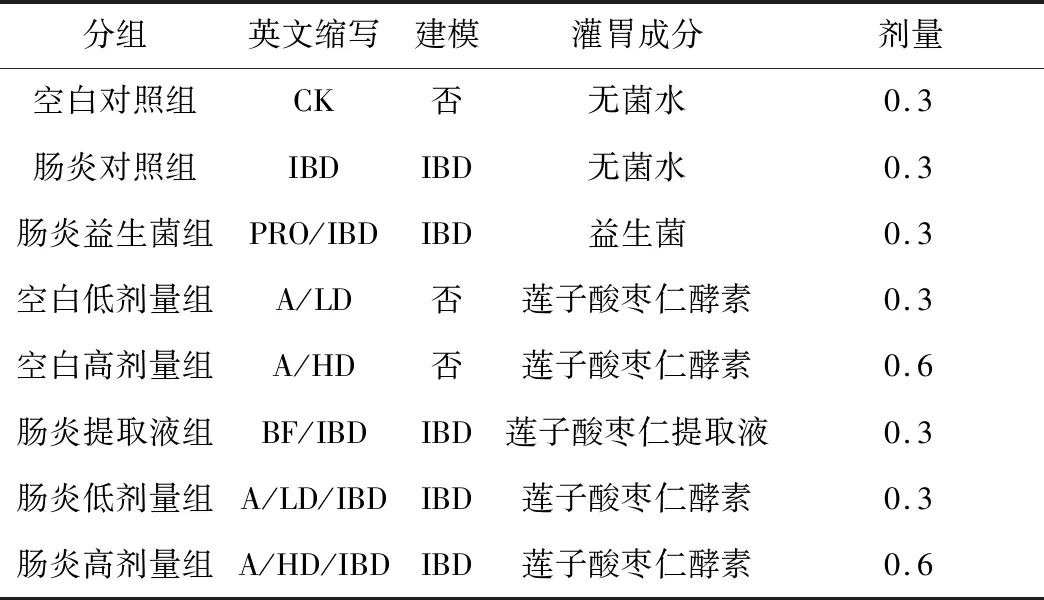
表3 肠道菌群实验分组与剂量 mL/d
连续灌胃28 d后颈椎脱臼法处死小鼠,取盲肠内容物液氮速冷,干冰环境送样,菌群测序分析由上海派森诺生物公司完成。
2 实验结果
2.1 多酚、黄酮、总酸含量
为避免酵素样品中的不溶性固形物对实验结果造成干扰,测试样品均离心(10 000 r,1 min)取上清。含量达到281.56 mg/L的多酚类物质(如表4所示)赋予莲子酸枣仁酵素较强的抗氧化能力,能够清除体内自由基;经滴定后,总酸含量达到11.99 g/kg,可知该酵素的酸度较大,从侧面说明发酵程度较深。
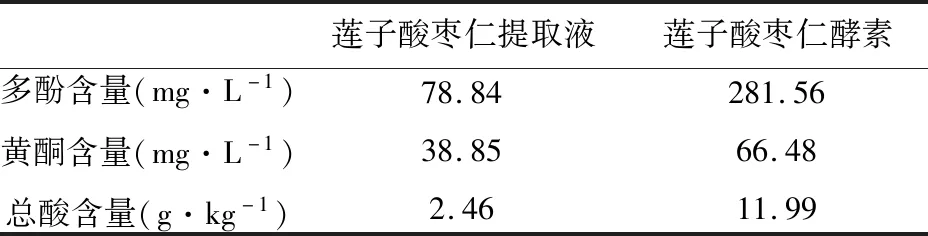
表4 莲子酸枣仁酵素的多酚、黄酮和总酸含量
2.2 有机酸、低级醇、单糖和二糖含量
经液相色谱检测(如表5所示)可知莲子酸枣仁酵素中乙酸含量高达10.05 g/kg,预示醋酸菌在发酵体系中发挥较大作用。未检测到对人体健康不利的甲醇,也无乙醇检出,说明酿酒酵母等产乙醇的微生物不在发酵体系中,可避免饮用该酵素后出现酒后驾车的风险;同样未检测到葡萄糖,说明发酵进行较为充分,这一结论与滴定总酸的数值较高是一致的,同时契合“低糖低脂”的健康饮食理念。
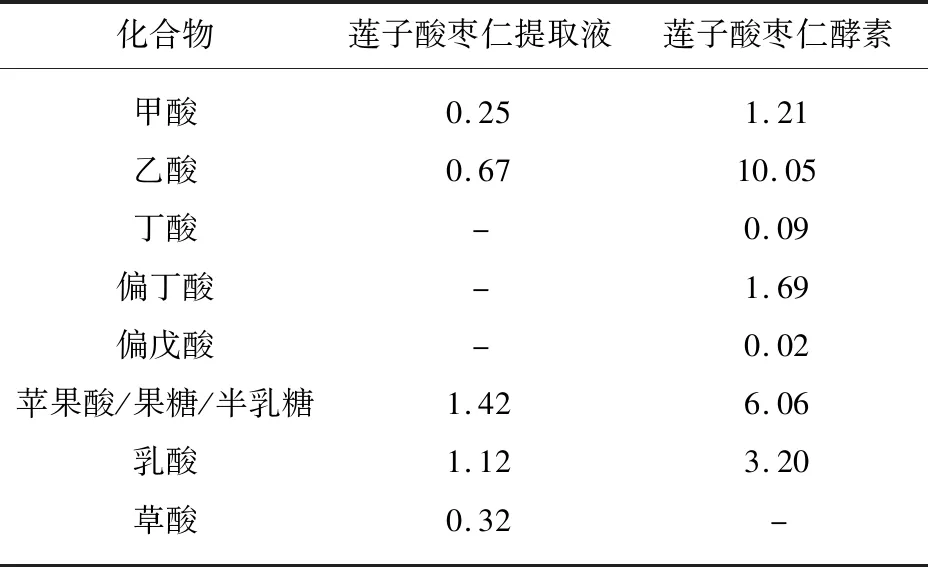
表5 莲子酸枣仁酵素中有机酸、单糖和二糖含量 mg/L
2.3 氨基酸的种类及含量测定
莲子酸枣仁酵素中经氨基酸自动分析仪共检测到14种氨基酸,总量达到49.9 mg/L,种类丰富的氨基酸为该酵素提供了营养支持。其中,含量最高的氨基酸是酪氨酸,含量达到20.12 mg/L。
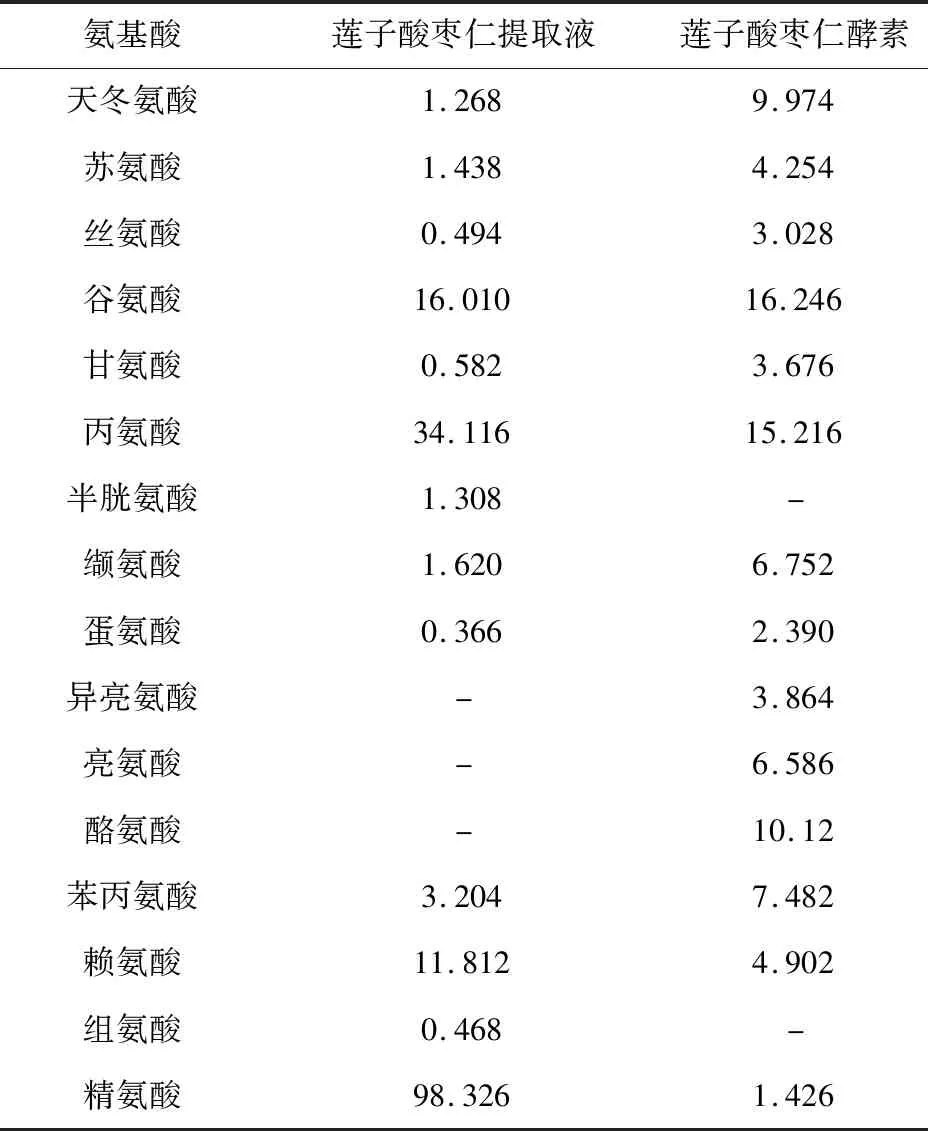
表6 莲子酸枣仁酵素中氨基酸种类及含量 mg/L
2.4 抗氧化能力
拟合公式为:
y=-77.942x3+58.846x2+98.454x+16.856
解方程可知IC50=60.738/200
由IC50数值可知,该酵素具有较强的抗氧化能力,当莲子酸枣仁酵素按照60.738/200(酵素/稀释后终体积)后,其氧自由基清除能力仍可达50%。
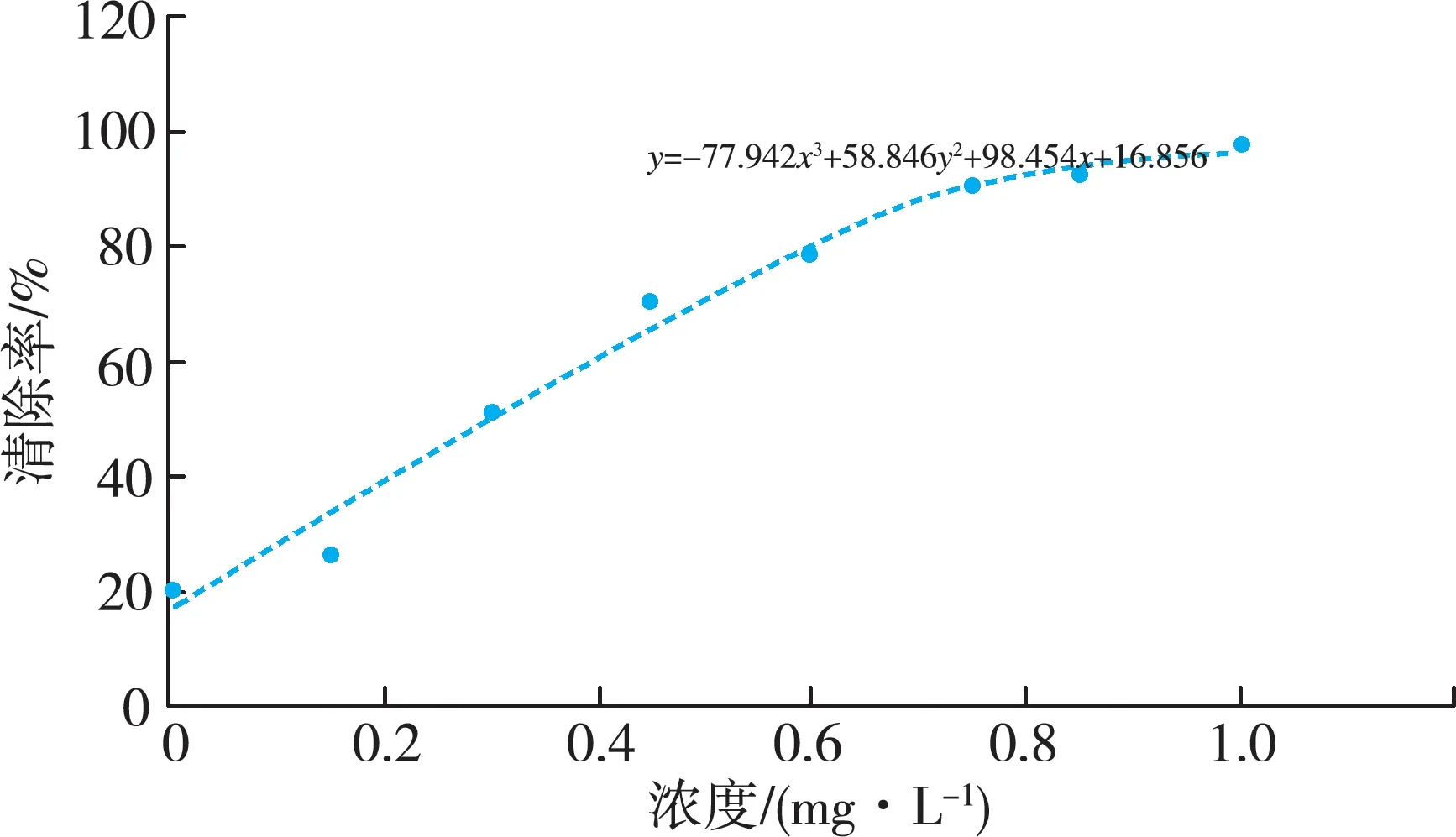
图1 莲子酸枣仁酵素DPPH法测定自由基清除能力
2.5 睡眠相关实验
在直接睡眠实验中所有分组均未发现直接睡眠的小鼠,可知阳性对照药物和高低剂量酵素对小鼠都没有直接催眠作用,满足进行后续睡眠相关实验的基础性条件。
在戊巴比妥钠阈下剂量催眠实验中,相比阴性对照组,阳性对照药物与酵素大幅提高小鼠睡眠率(如表7所示,睡眠率从20%提高至50%~60%);但阳性对照组虽比酵素组表现出更大的睡眠率,但统计学差异并不显著。在腹腔注射巴比妥钠后,酵素组(高低剂量)相比空白对照组的睡眠潜伏期同样缩短(高低剂量组分别缩短20.77%和22.05%),但效果不及阳性对照组。未经发酵的莲子酸枣仁提取液同样表现出促进睡眠作用,然而其促进作用明显弱于发酵组。然而,高剂量组的睡眠潜伏期反而长于低剂量组,推测是高剂量酵素对小鼠的酸刺激较大,抵消了酵素本身的助眠效应。在延长戊巴比妥钠睡眠时间实验中,阳性对照药物组和高剂量莲子酸枣仁酵素组均对小鼠睡眠时间有超过100%的延长作用(p<0.01);低剂量酵素对睡眠时间具有显著的延长作用(延长66.85%,p<0.05)。显然,低剂量酵素在此项测试中的效果不如高剂量组优异。推测小鼠在度过灌胃后的刺激阶段后,在入睡阶段中酵素发挥了较好作用,且与剂量呈正相关趋势。
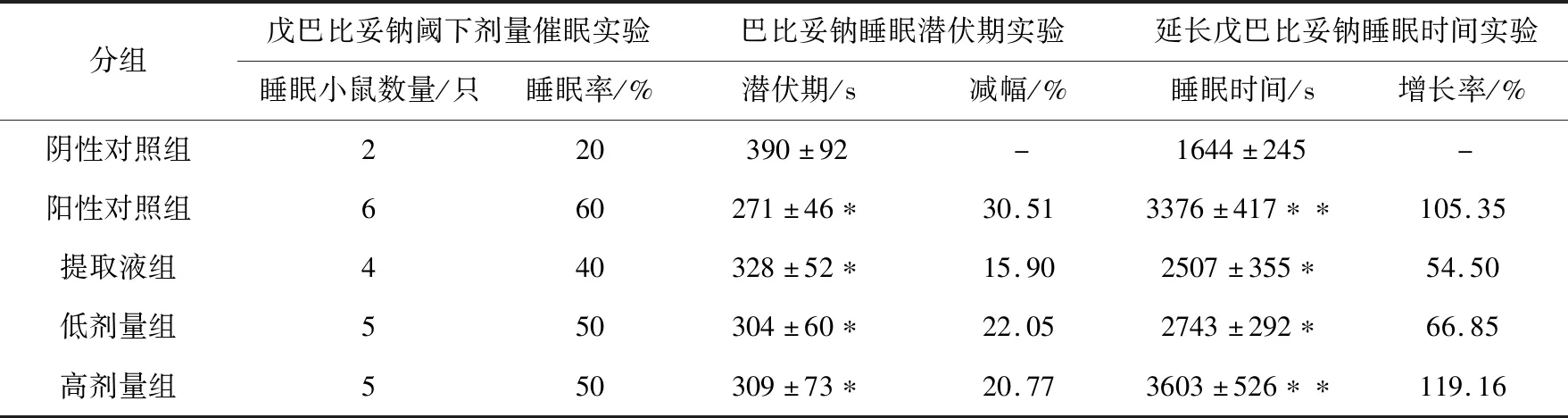
表7 睡眠相关实验
通过三项动物睡眠实验可知,莲子酸枣仁酵素对于小鼠起到了显著的助眠作用;尤其是低剂量组即表现出良好效果,兼具较好的依从性,因而具有更好的实用潜力[7]。
2.6 肠道蠕动能力动物实验
测量肠管长度为“小肠总长度”,从幽门至墨汁前沿为“墨汁推进长度”,计算墨汁推进率。如图2所示,经注射硫酸阿托品后,模型对照组(MOD)相比阴性对照组(CK)小肠蠕动受到显著抑制,说明模型构架成功;灌胃马来酸曲美布汀和低剂量酵素组小鼠小肠蠕动则表现出与空白对照组(CK)近似的墨汁推进率;高剂量组(A/HD)表现出超过空白组的蠕动性(高出47%),并且具有统计学显著性意义。空白对照组CK与阳性对照组、莲子酸枣仁提取液组(未发酵)、莲子酸枣仁酵素低剂量组和高剂量组的墨汁推进率没有显著性差异,说明经过硫酸阿托品抑制小肠蠕动后,阳性对照马来酸曲美布汀片、莲子酸枣仁酵素恢复了小鼠小肠蠕动,因此表现出与空白对照组小肠推进率一致。
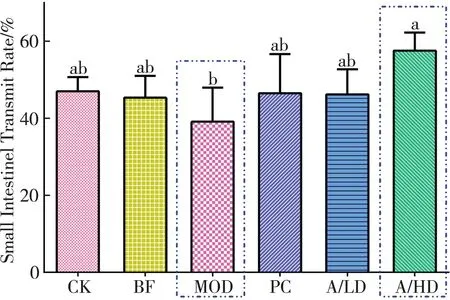
注:CK:阴性对照组;BF:提取液组;MOD:模型对照组;PC:阳性对照组;A/LD:低剂量组;A/HD:高剂量组图2 肠道蠕动能力变化
便秘是常见疾病,但其危害却长期被低估[8],同时也是失眠的重要诱因之一,严重影响患者的睡眠质量[9]。目前常采用容积性、润滑性、渗透性和刺激性泻药等药物治疗来治疗便秘[10],现在一些药物虽然也可以改善便秘[11-15]。如何借助药食同源食品原料通过改善肠道蠕动能力并改善睡眠的研究已陆续开展[16-17],本文的结果说明莲子酸枣仁酵素的通便润肠效果,尤其是在高剂量下比马来酸曲美布汀片的效果好,预示该领域仍有较大的发展和研究潜力。
2.7 肠道菌群的影响和调节作用评价
2.7.1 分类组成分析
经过测序鉴定及分析,C57BL/6J小鼠肠道内共鉴定出10个门,18个纲,22个目,36个科,46个属,14个种。门纲目完全鉴定,而科属种则只有部分能够鉴定出来。其中,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、疣微菌门(Verrucomicrobia)和放线菌门(Actinobacteria)为优势菌门。相对含量分别为61%、26%、2%、3%和4%左右。其它门的相对含量极低。脱硫弧菌属(Desulfovibrio)、艾克曼菌属(Akkermansia)、葡萄球菌属(Staphylococcus)、颤螺旋菌属(Oscillospira)、拟杆菌属(Bacteroides)、棒状杆菌属(Corynebacterium)、胃球菌属(Ruminococcus)和杆菌属(Odoribacter)等为优势菌属(大部分菌属未鉴定)。
对门和属水平的菌群结构进行统计分析,我们将各实验组之间具有统计学显著性差异,且相对含量大于0.1%的门属等进行计算分析做图。从图3可以看出,实验组高剂量酵素组(A/HD)显著降低厚壁菌门的相对含量,与对照组比较大约降低27%左右;与对照组比较IBD组、A/LD/IBD组和A/HD/IBD组则显著提高拟杆菌门的含量,分别提高约60%、60.1%和52%,而其它实验组对拟杆菌门则没有显著性差异;IBD组、A/HD组和A/HD/IBD组则显著提高了放线菌门的含量,分别提高约40%、120%和120%。莲子酸枣仁酵素对疣微菌门含量没有产生显著的影响,IBD肠炎组和PRO/IBD益生菌肠炎组则大幅提高了疣微菌门的相对含量,分别提高86.6%和86.5%。此外,莲子酸枣仁酵素还显著提高短柄杆菌属、臭杆菌属、粘皮菌属、拟杆菌属、副杆菌属等菌属的含量;显著降低粪球菌属的含量。
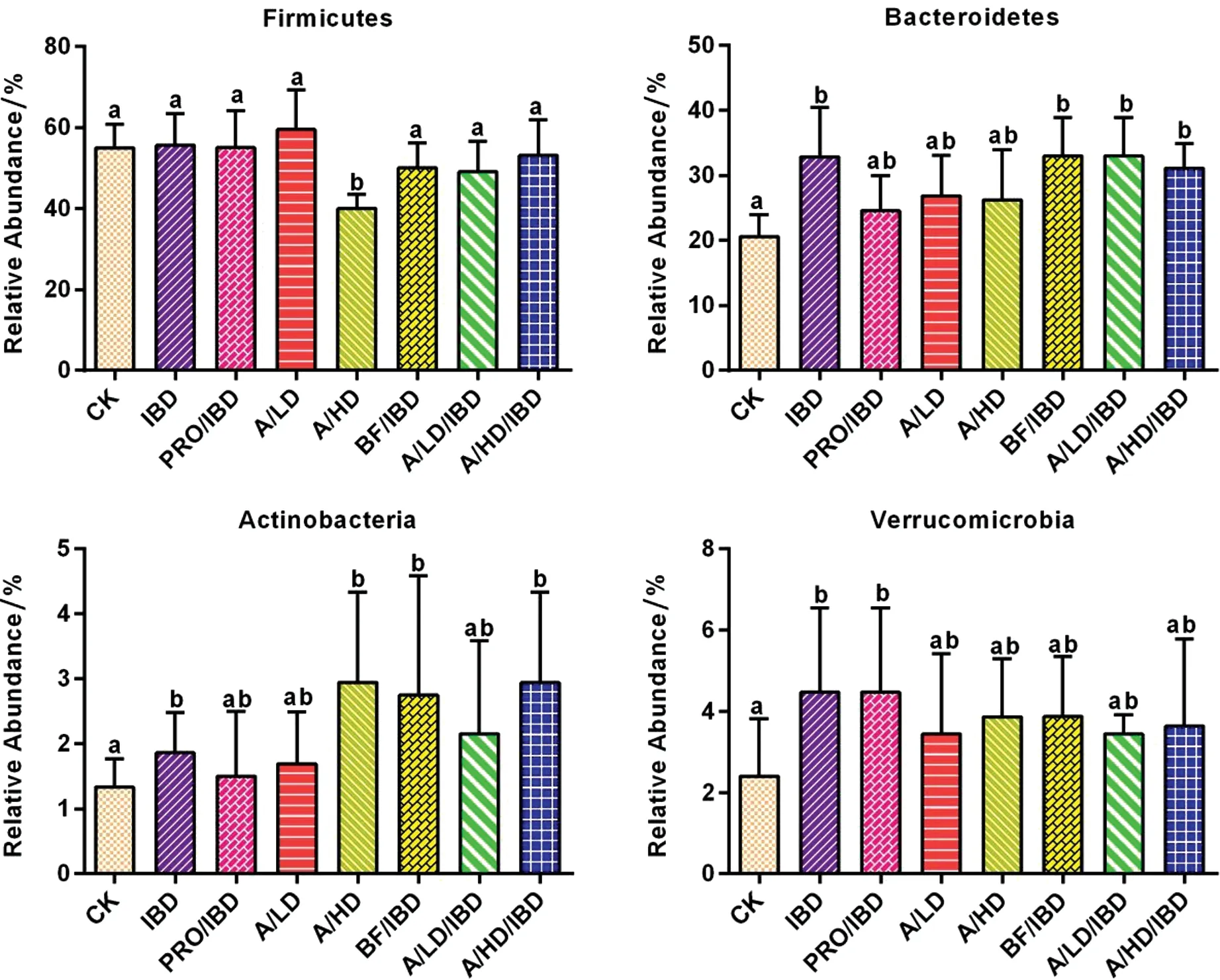
注:CK:空白对照组;IBD:肠炎对照组;PRO/IBD:肠炎益生菌对照组;A/LD:空白低剂量组;A/HD:空白高剂量组;BF/IBD:肠炎提取液组;A/LD/IBD:肠炎低剂量组;A/HD/IBD:肠炎高剂量组图3 莲子酸枣仁酵素对小鼠体内优势菌门的影响
由此可知酵素对健康小鼠、对IBD小鼠对不同菌属表现出不同的影响。首先,莲子酸枣仁酵素增加艾克曼菌属的含量。艾克曼菌属是近年来比较公认的具有抗肿瘤活性的菌属,该菌属的提高有益于宿主健康[18]。无论是益生菌还是酵素均大幅提高葡萄球菌属的含量,大约提高585%~1 576%。在该属下具有多种益生菌[19]。高低剂量的莲子酸枣仁酵素对正常小鼠和肠炎模型小鼠都显著增加双歧杆菌属的含量(增幅61%~96%)。值得一提的是,双歧杆菌属中含有各种益生菌,该属含量的提高意味着该酵素可能会显著大幅提高益生菌双歧杆菌的含量,利于宿主健康。
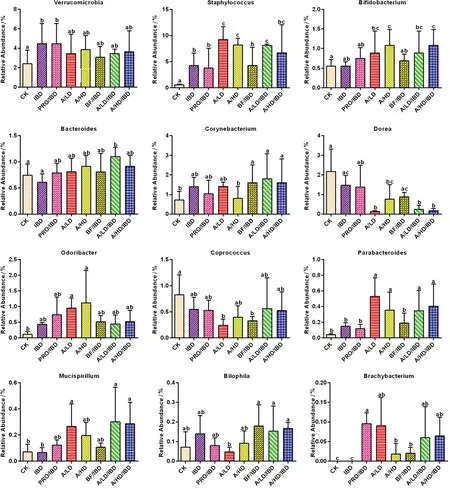
注:CK:空白对照组;IBD:肠炎对照组;PRO/IBD:肠炎益生菌对照组;A/LD:空白低剂量组;A/HD:空白高剂量组;BF/IBD:肠炎提取液组;A/LD/IBD:肠炎低剂量组;A/HD/IBD:肠炎高剂量组图4 莲子酸枣仁酵素对小鼠体内菌属的显著性影响
2.7.2 莲子酸枣仁酵素对小鼠肠道菌群多样性分析
由图5可以看出,相比于对照组,酵素对小鼠肠道菌群Alpha多样性指数Chao1、Shannon、ACE和Simpson均没有显著性的影响,说明酵素不影响肠道菌群的Alpha多样性。同样的,无论是Unweighted UniFrac PCoA分析还是Weighted UniFrac PCoA分析,各实验组均没有表现出差异性,酵素对小鼠肠道菌群的beta多样性也没有明显的影响。因此可知,莲子酸枣仁酵素虽改变肠道菌群结构,但对肠道菌群多样性没有产生显著的影响。
既往研究发现睡眠障碍患者的肠道菌群发生改变,而肠道菌群改变也会影响睡眠[20]。失眠患者中伴随胃肠道功能异常的比例最大,睡眠不足可能导致生理应激,破坏肠道微生物稳态,扰乱肠道微生物群,从而造成代谢功能紊乱,引发一系列慢性炎症过程[21-22]。通过本实验中对莲子酸枣仁酵素对肠道菌群影响的评价,表明莲子酸枣仁酵素可以降低厚壁菌门的相对含量,提高拟杆菌门的含量,放线菌门的含量,增加艾克曼菌属微生物的含量,显著提高葡萄球菌属和双歧杆菌属微生物的含量,同时显著降低粪球菌的含量。
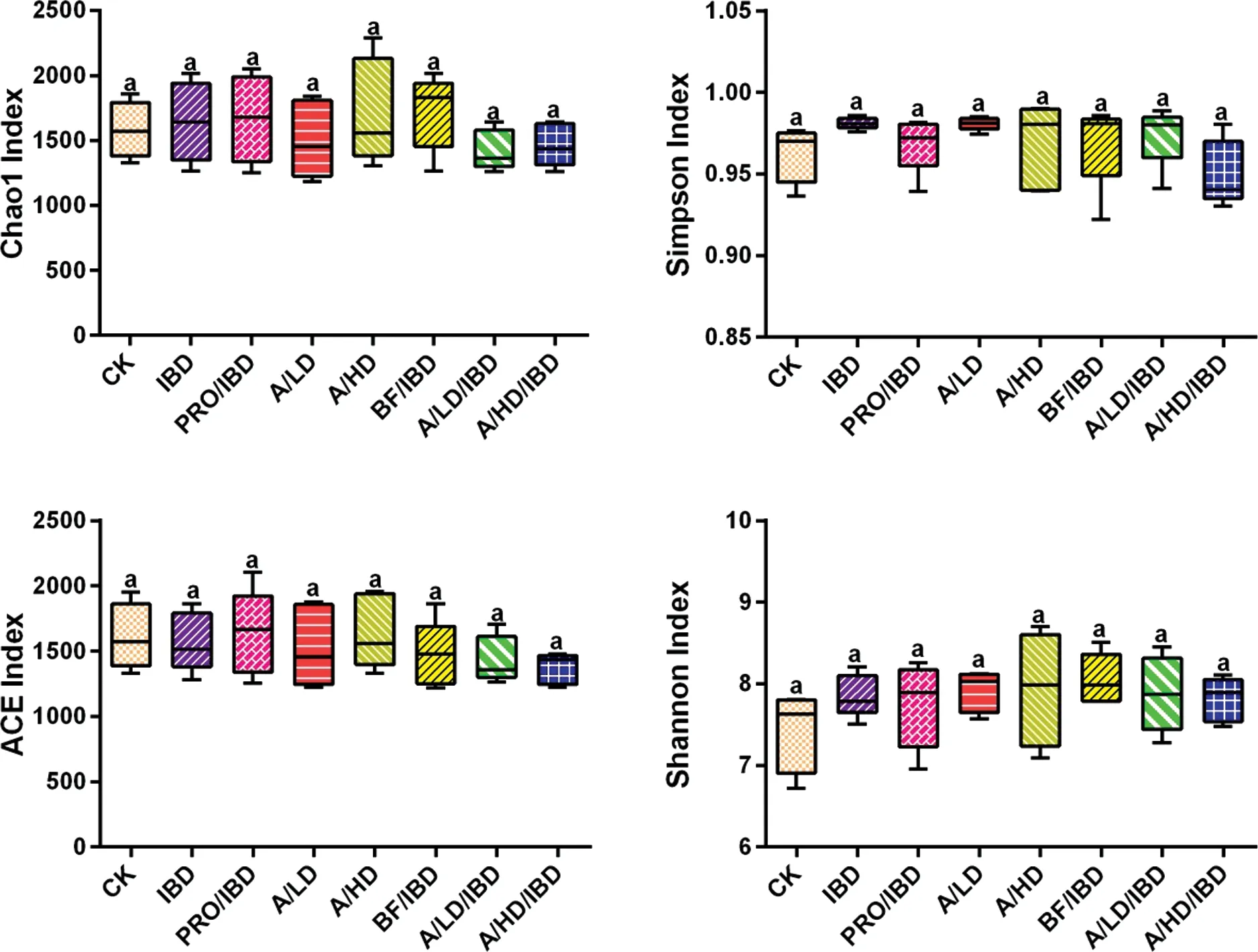
注:CK:空白对照组;IBD:肠炎对照组;PRO/IBD:肠炎益生菌对照组;A/LD:空白低剂量组;A/HD:空白高剂量组;BF/IBD:肠炎提取液组;A/LD/IBD:肠炎低剂量组;A/HD/IBD:肠炎高剂量组图5 莲子酸枣仁酵素中有机酸、单糖和二糖含量
结果表明莲子酸枣仁酵素能提高肠道中有益菌的含量,降低肠道中有害菌的含量,具有很好的菌群调节作用;结合莲子酸枣仁酵素对小鼠睡眠的促进作用,莲子酸枣仁酵素对小鼠肠道菌群尤其是有益菌群的比例促进作用对于助眠功效具有正向协同作用。
3 实验结论
通过从莲子酸枣仁酵素的成分组成,动物实验,生化实验,肠道菌群组学分析等方面进行研究,并对改善睡眠相关功能进行活性评价。莲子酸枣仁酵素含有丰富的多酚和氨基酸物质,并有较强的抗氧化能力;同时对小鼠的睡眠有较好的改善作用,提高睡眠率,延长睡眠时间;解剖与肠道动力学实验显示,在莲子酸枣仁酵素干预下,便秘小鼠的小肠运动产生明显的蠕动促进作用,提高小肠推进率,恢复小鼠小肠的蠕动能力,具有较强的通便润肠功能;此外,通过对莲子酸枣仁酵素干预下的小鼠肠道菌群分析,发现该酵素能提高肠道中有益菌的含量,降低肠道中有害菌的含量,具有良好的菌群调节作用。综合实验数据,莲子酸枣仁酵素的具有明显的助眠功效,并且该功效与促进肠道蠕动和改善肠道菌群结构具有协同效应。
