Antagomir-320对胫骨骨折小鼠围术期神经认知障碍的影响
2021-12-31周加慧宋作艳谢春晖郭雨薇牟传琳毕燕琳
周加慧,宋作艳,谢春晖,陶 和,郭雨薇,牟传琳,符 丽,林 旭,王 彬,毕燕琳*
0 引言
围术期神经认知障碍(Perioperative neruocognitive disorders,PND)是指麻醉手术后患者出现持续存在的记忆力、抽象思维和定向力障碍[1],同时伴有社会活动能力变化的一种并发症。明确其发病机制,可为有效预防PND的发生提供帮助。近年来有研究提出,microRNA在衰老与神经退行性疾病的发生中有着重要的调节作用[2]。有研究通过全基因组测序在晚发型阿尔茨海默病家族中也发现miRNA-320这一外显变异基因[3],并且在朊病毒感染所诱导的神经退行性疾病小鼠海马组织中发现miRNA-320异常表达[4]。而PND 在分子水平上与阿尔茨海默病同为神经退行性疾病[5],推测miRNA-320可能也是PND发病过程中的分子生物学基础之一。但目前关于miRNA-320与PND状态的直接研究甚少。Antagomir是一种新型的人工化学合成物质,根据miRNA的特异性核苷酸序列设计而成,可针对性地改变小鼠内源性miRNA的表达[6]。本研究通过胫骨骨折内固定手术方法建立小鼠PND模型,检测应用Antagomir-320后小鼠认知功能发生的改变及海马组织miRNA-320和相关蛋白IGF-1、APP表达变化,为治疗及预防患者PND提供新思路。
1 材料与方法
1.1 实验动物及分组 清洁级C57/BL小鼠120只,12~14周龄,体重20~30 g,购于济南朋悦实验动物研究公司,许可证号:[SCXK(鲁)20140007],实验开始前适应饲养环境1周,饲养于12 h黑白昼夜交替的恒定室温及湿度的环境中,适应性饲养1周后用于实验。采用随机数字表法将其分为4组(n=30):对照组(C组)、麻醉手术组(AS组)、生理盐水+麻醉手术组(NS组)、Antagomir-320+麻醉手术组(AT组)。小鼠术前连续6 d均在同一时间段行Morris水迷宫训练,并在术前1 d进行旷场实验,分别于术后1、3、7 d行旷场实验并在行水迷宫测试结束后处死各组小鼠。
1.2 PND模型建立 参考文献[7]行小鼠麻醉下单侧下肢胫骨骨折切开复位髓内针固定手术。将小鼠置于2 L/min的纯氧携带5%异氟醚的小动物麻醉箱内5 min进行麻醉诱导,将失去行动力的小鼠从麻醉箱内取出,2.1%±0.5%异氟醚吸入以面罩方式维持麻醉状态,分离胫骨平台附近附着的筋膜与肌肉组织,充分暴露小鼠胫骨粗隆,将修剪后的0.38 mm针头插入胫骨骨髓腔内,使用手术刀与外科钳于胫骨下1/3处人为造成骨折后,缝合伤口,消毒后局部涂抹复方利多卡因软膏镇痛。手术时间控制在15 min以内。苏醒后放回笼内继续饲养。
1.3 海马微量注射 在胫骨骨折内固定手术模型建立前,按照50 mg/kg的剂量腹膜内给予1%戊巴比妥钠麻醉,在保证麻醉效果完善的前提下,固定小鼠头部于立体定位仪平台上,将小鼠头部正中备皮消毒,给予利多卡因局部皮下注射,暴露颅骨,手术刀片剥离局部脑膜,定位零点于前囟,于鼠脑左右两侧旁开1.8 mm、沿矢状轴向背侧旁开2.5 mm、深度2.3 mm,海马组织即定位于此并做好标记。按照海马深度将微量注射器针尖置于海马内,以0.2 μl/min速率将2 μl生理盐水、Antagomir-320(0.5 nmol/μl)缓慢注入海马内,结束后将针留置5 min后,匀速缓慢拔出以防止药物溢出。
1.4 Morris水迷宫 于术前 6 d开始每天于固定时间点进行Morris水迷宫训练,剔除有明显运动障碍的小鼠。测试采用圆形水池,直径 120 cm;圆柱形平台直径10 cm,高30 cm,隐匿平台可放置于某一固定位置,于水面下0.5 cm。维持水温恒定于(24±2)℃。术前1~5 d每天追踪小鼠进行路径采集。于第6天即术前1 d,撤除平台,将小鼠随机选择某一落水点置入水池中,小鼠首次到达原平台所在位置的时间则为术前逃避潜伏期。术后1、3、7 d 时采用相同的方法测定认知功能。选用逃避潜伏期和靶象限停留时间百分比作为反映学习和记忆能力的指标。
1.5 旷场试验 旷场试验检测箱为白色正方体检测箱,大小为 50 cm×50 cm×40 cm,箱内有标记线划分为不同区域,放置在安静环境中。将小鼠轻柔抓取,从旷场检测箱一角缓慢放入,小鼠可以在箱内自由运动,通过摄像头记录小鼠在检测箱内的运动路径,记录时间为 5 min。每个区域的小鼠测试结束后,将小鼠再次放回饲养笼内,对检测箱侧壁及底部使用75%酒精擦拭消毒,并充分晾干后进行下一轮测试。检测期间保持安静,减少外界环境对小鼠的任何刺激,选取小鼠自发运动的路径为反映活动能力的指标。
1.6 Western blot检测海马IGF-1、APP 术后1、3、7 d水迷宫测试结束后,随机取5只小鼠断头处死,迅速切开颅顶皮肤,剥离顶骨、枕骨,取出小鼠脑组织置于冰台上操作。根据解剖图谱所示,取出小鼠海马,放入冻存管保存在液氮中备用。处死后分离海马组织,-80 ℃冰箱保存。取海马组织加入RIPA裂解缓冲液和蛋白酶抑制剂PMSF(碧云天生物试剂研究所),于冰面进行充分的研磨、裂解、离心,取上清液加入适量蛋白质上样缓冲液(5×)(碧云天生物试剂研究所)100 ℃加热5 min,使用12%的聚丙烯凝胶(碧云天生物试剂研究所)电泳分离蛋白。转移到PVDF膜(北京索莱宝科技有限公司)上,使用5%脱脂奶粉(北京索莱宝科技有限公司)在室温摇床封闭3 h,使用TBST冲洗后,分别加入内参抗体β-actin(稀释1∶5 000,北京博奥森生物技术有限公司),APP一抗(稀释1∶1 000,Abcam公司,英国),IGF-1一抗(稀释1∶5 000,Abcam公司,英国),置于4 ℃低温摇床下孵育过夜。TBST洗脱后加入二抗(稀释度1∶6 000,北京中杉金桥科技公司)与膜在室温摇床孵育2 h。使用ECL(碧云天生物试剂研究所)显示结合蛋白,用生物成像系统进行分析。
1.7 qRT-PCR检测海马IGF-1 mRNA和miRNA-320表达 术后1、3、7 d水迷宫测试结束后,随机取5只小鼠断头处死,迅速切开颅顶皮肤,剥离顶骨、枕骨,取出小鼠脑组织置于冰台上操作。根据解剖图谱所示,提取出小鼠海马,将海马组织置于RNA保存液(碧云天生物试剂研究所)中,4 ℃冰箱过夜,第2天弃去RNA保存液,将海马组织放入-80 ℃冰箱保存。用超纯RNA提取试剂盒(天根生化有限公司)提取海马组织总RNA以及miRNA。使用miRcute增强型miRNA cDNA第一链合成试剂盒和FastKing cDNA第一链合成试剂盒(天根生化有限公司)将相应RNA反转录成cDNA。使用SuperReal 荧光定量预混试剂盒及miRcute 增强型miRNA荧光定量检测试剂盒(天根生化有限公司)实时荧光定量PCR系统检测得到的cDNA。GAPDH和U6作为内部对照。引物序列:IGF-1上游:5′-ATGTTATCCGAAATAAGCTG-3′下游:5′-CTCTGCAAACCTCCATGCCG-3′;GAPDH上游:5′-CTGCAATCCGAAAGAAGCTG-3′下游;5′-ATC TTCA AACCTCCATGATG-3′;miRNA-320引物5′-ACACTCCAGCTGGGAAAAGCTGGGTTGAGA-3′。U6引物;5′-CTCGCTTCGGCAGCACA-3′。结果显示,在β-微管蛋白及U6正常化后,测2-ΔΔCt的表达水平。扩增后立即测定溶出曲线,呈单峰,显示出良好的产物特异性。
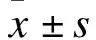
2 结果
2.1 Morris 水迷宫实验 与C组相比,AS组、NS组、AT组在术后1、3、7 d逃避潜伏期延长、靶象限停留时间百分比降低(P<0.05);与NS组相比,AT组术后3、7 d 潜伏期缩短、靶象限停留时间百分比增加(P<0.05),而术后1 d与AS组比较,差异无统计学意义(P>0.05);AS与NS组相比,术后1、3、7 d逃避潜伏期和靶象限停留时间百分比差异无统计学意义(P>0.05)。见表1。

表1 各组小鼠各时点逃避潜伏期(s)与靶象限停留时间百分比的比较(%)
2.2 旷场实验 术前各组小鼠的运动总路程差异无统计学意义;与C组相比,在术后1、3、7 d,各组小鼠运动总路程差异亦无统计学意义(P>0.05),见表2。

表2 术后各时间点各组小鼠运动总路程的比较(cm)
2.3 小鼠术后海马组织各时点IGF-1和APP的表达 与C组相比,AT组术后1 d IGF-1蛋白表达降低,术后3、7 d IGF-1蛋白表达升高;AS组与NS组海马IGF-1略降低,但差异无统计学意义(P>0.05);与NS组相比,AT组术后1 d 表达降低,术后3、7 d表达升高(P<0.05)。与C组相比,AS组、NS组术后1、3、7 d以及AT组术后1、3 d APP蛋白表达均增加(P<0.05),AT组术后7 d表达差异无统计学意义(P>0.05);与NS组相比,AT组术后3、7 d表达降低(P<0.05),术后1 d差异无统计学意义(P>0.05)。NS组与AS组相比,术后1、3、7 d海马IGF-1和APP的表达差异均无统计学意义(P>0.05)。见图1。
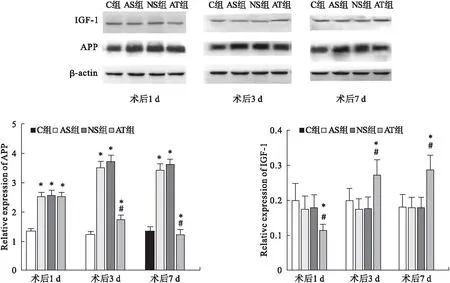
图1 各组小鼠术后各时点海马IGF-1和APP蛋白表达水平
2.4 小鼠术后海马组织各时点IGF-1 mRNA和miRNA-320的表达 与C组相比,AS组、NS组术后1、3、7 d以及AT组术后1 d IGF-1mRNA表达均降低,AT组术后3 d和7 d表达升高(P<0.05);与NS组相比,AT组术后1、3、7 d表达升高(P<0.05);NS组与AS组相比,术后1、3、7 d差异均无统计学意义(P>0.05)。与C组相比,AS组、NS组术后1、3 d miRNA-320表达升高(P<0.05),术后7 d变化无统计学意义(P>0.05),AT组术后1 d表达升高,术后3 d和7 d表达降低(P<0.05);与NS相比,AT组在术后1、3、7 d表达均降低(P<0.05);NS组与AS组相比,术后1、3、7 d差异均无统计学意义(P>0.05)。见表3。

表3 各组小鼠术后各时点海马IGF-1 mRNA和miRNA-320的表达水平比较(n=5)
3 讨论
微小核糖核酸(microRNA)是一类长度约20~30个核苷酸组成的高度保守的内源性非编码单链小分子RNA,通过与下游靶蛋白的3′-UTR结合,可降解mRNA或者阻止蛋白的翻译而在转录后水平发挥负向调节作用[8-9]。PND发病机制尚未明确,包括神经炎症、β淀粉样蛋白沉积、tau磷酸化、胆碱能受损、突触功能受损、缺乏神经营养支持等。通常PND与精神神经疾病密切相关,如与抑郁症和阿尔茨海默病等有着共通的分子途经[5],而近年来越来越多的证据表明,失调的microRNA也参与了认知功能障碍相关的神经系统疾病的发生与发展,例如miRNA-320[4]、miRNA-572[10]、miRNA-126[11]、miRNA-31[12]、miRNA-34[13]等,而且miRNA作为具有生物活性的小分子物质,能够自由穿过血-脑屏障,可能为中枢炎症状态和外周炎症状态的交流提供了信息传递的物质基础[14]。随着对microRNA生物学领域的扩展,microRNA在发育和疾病中的作用认知逐渐加深,使microRNA成为众多疾病非常有吸引力的新型治疗方法[15]。在该研究中,通过使用Antagomir-320作用于PND小鼠,可以看出miRNA-320与PND可能存在的关联性,从而为PND治疗提供新的方向。Zovoilis等[16]发现,相较于局部给药,相同剂量的Antagomir全身给药稀释性降低该低聚物的活性浓度,因此,本实验采用微量泵海马局部注射以保证其作用的确切性,全身给药的作用效应仍需进一步验证。
海马是参与认知功能的重要脑区,与空间学习能力、记忆能力密切相关[17]。使用相对成熟的胫骨骨折内固定术建立实验动物的PND模型[7],通过经典研究认知功能的Morris水迷宫实验检测小鼠认知功能,选取小鼠的逃避潜伏期及靶象限停留时间百分比作为反映学习能力与空间记忆能力的指标,旷场实验测试能排除胫骨骨折手术对小鼠活动能力产生影响,也是评价小鼠自主行为及探究行为的常用方法。有研究表明,异氟醚麻醉也是引起认知障碍的因素之一[18],但本实验异氟醚暴露时间较短,因此,主要探究手术因素刺激所造成的PND。本研究结果显示,相较于正常小鼠,手术组与麻醉手术组的小鼠逃避潜伏期延长,靶象限停留时间百分比降低,提示该实验模型建立成功,此外,手术组与麻醉手术组小鼠海马组织的miRNA-320在术后1、3 d表达明显升高。并且海马注射这项操作对PND无明显影响。
Liang 等[19]研究发现,通过Antagomir-320的局部脑室注射,可以改善脑缺血再灌注损伤,其可能机制是通过抑制小鼠缺血再灌注脑组织内miRNA-320的表达,进而通过IGF-1途径改善缺血再灌注损伤。IGF-1是调节神经生长的重要物质,能调节中枢神经系统发育和成熟,是细胞可塑性的有效神经内分泌调节剂[20]。研究表明,IGF-1具有神经保护功能[21],此外,有研究发现,患有PND的患者外周循环中IGF-1的水平明显低于正常组[22]。研究表明,IGF-1可以抑制APP、Aβ形成,从而促进神经元的存活[23],减缓认知障碍的发生。而能与IGF-1mRNA靶向结合的miRNA-320[19,24]可引起 IGF-1mRNA 的降解或翻译抑制,在转录后水平上负调节蛋白质表达,从而在学习与记忆方面发挥作用[25]。本实验中,与正常小鼠相比较,麻醉手术组小鼠逃避潜伏期延长、靶象限停留时间百分比降低,miRNA-320在术后1、3 d表达明显升高,IGF-1mRNA表达均降低,IGF-1蛋白有所降低但差异无统计学意义,APP蛋白表达均升高。给予Antagomir-320处理后,与麻醉手术组相比较,逃避潜伏期缩短,靶象限停留时间百分比增高,miRNA-320表达降低,IGF-1mRNA及蛋白表达升高,APP于术后3、7 d 表达明显降低。结合小鼠的行为学测试,以上结果支持Antagomir-320可能通过IGF-1通路影响了PND的发生与发展这一推测。在中枢神经系统中有丰富的microRNA表达,可参与神经元发育、神经炎症、神经传递和突触可塑等一系列生物学调节作用,而Antagomir-320仅为miRNA-320的特异性抑制剂,手术病理刺激时,脑组织中大量的microRNAs是否通过参与其他生物学调节途径,调控不同的认知相关因子,从而参与围术期神经认知障碍的发生与发展,仍需进一步探索。
综上所述,Antagomir-320可能通过下调miRNA-320,进而调节认知功能相关蛋白IGF-1、APP,改善胫骨骨折小鼠围术期神经认知功能,为PND的预防和治疗提供了新的靶点。
