LC-MS/MS法测定东北黄精灌胃后大鼠血浆中3种皂苷类化合物含量及其药代动力学研究
2021-12-30崔芙岩黄金月姜佳欣唐檬马鹰郑时嘉于纯淼王志刚杨波
崔芙岩,黄金月,姜佳欣,唐檬,马鹰,郑时嘉,于纯淼,王志刚,杨波*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.天问山农业综合开发股份有限公司,黑龙江 哈尔滨 150300)
黄精为常用中药,在我国用药历史悠久,具有多种药理作用,长期应用于治疗肺虚燥咳、体倦乏力、肾虚亏损等,也应用于治疗糖尿病、慢性肝炎、结核病等疾病[1-3]。中药黄精的化学成分较为复杂,主要化学成分有皂苷、黄酮类、多糖、氨基酸等。皂苷成分中,主要以人参皂苷Rb1、薯蓣皂苷为主,也有文献报道测定黄精中的菝葜皂苷元,皂苷类化合物具有抗菌抗炎、抗肿瘤、防治心血管疾病等药理作用[4-10]。近些年,黄精中的皂苷类成分一直是黄精药物研究的关键。经研究证明,东北黄精因种植环境的不同,与其他地区黄精相比,其化学成分及含量有所不同[11-13]。东北黄精亦是一种药食两用的中药资源,具有极高的药用价值和保健作用[14]。
本研究中,东北黄精大鼠灌胃后采取96孔板血浆处理技术[15-16],应用液质联用(MRM法)测定大鼠血浆中薯蓣皂苷、人参皂苷Rb1和菝葜皂苷元的浓度,研究人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元的药代动力学,为黄精的中医临床应用提供理论数据。
1 实验部分
1.1 仪器与试剂
安捷伦超高液相色谱仪(Agilent 1200);安捷伦三重四级杆质谱仪(Aglient 6410);96孔板处理器(美国瓦里安公司);BT-25 电子分析天平(德国 Sartourious公司);Milli-Q Gradient A10超纯水器(美国Millipore公司);人参皂苷Rb1对照品(中国食品药品鉴定研究院,20200906);薯蓣皂苷对照品(中国食品药品鉴定研究院,20200603);菝葜皂苷元对照品(中国食品药品鉴定研究院,20200618);甘草次酸对照品(中国食品药品鉴定研究院,20200523);东北黄精生药材(黑龙江省天问山农业综合开发股份有限公司,经黑龙江中医药大学孙慧峰教授鉴定为百合科植物黄精);甲醇、乙腈、甲酸(色谱纯,德国默克公司);正丁醇、乙酸乙酯(分析纯,天津富宇精细化工有限公司)。
1.2 实验动物
SD大鼠,体质量(250±20)g,雌雄各半,由黑龙江中医药大学实验动物中心提供;饲养温度为(25±2)℃,湿度为(50±2)%,采用12 h交替光照,适应性饲养两周,实验前禁食不禁水12 h。
1.3 溶液的制备
1.3.1 对照品溶液
精密称取人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元对照品各10 mg,分别置于10 mL的容量瓶中,用甲醇溶解后稀释至刻度,混匀,制成浓度为1 mg/mL的对照品溶液(储备液)。精密称取人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元储备液适量,配置成浓度为20、50、100、200、500、1 000、2 000、5 000 ng/mL的标准溶液。用大鼠空白血浆进行稀释,得到浓度分别为1、2.5、5、10、25、50、100、250 ng/mL浓度的血浆标准工作液。
1.3.2 内标溶液
精密称取10 mg甘草次酸对照品,放于10 mL容量瓶中,以甲醇溶解、稀释至刻度后混匀,制得1 mg/mL的甘草次酸储备液。称取甘草次酸储备液适量,制得200 ng/mL的甘草次酸内标溶液。
1.3.3 黄精提取液
称取黄精干燥根茎,粉碎后过4号筛,以15倍量的75%乙醇加热回流提取两次(1.5 h/次),合并两次滤液,采用0.25 μm微孔滤膜过滤,续滤液用0.9%氯化钠溶液稀释10倍,备用。
1.3.4 质控溶液
精密称取人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元储备液适量,用空白血浆进行稀释,制备浓度为5、50、200 ng/mL的人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元样品溶液。
1.4 色谱、质谱条件
1.4.1 色谱
色谱柱:安捷伦 SB-C18色谱柱(100 mm×2.1 mm,3.5 μm);流动相:A甲醇-B 0.1%甲酸溶液(70∶30)等度洗脱;柱温:30 ℃;流速:0.2 mL/min;进样量:5 μL。
1.4.2 质谱
使用电喷雾离子源,扫描方式为多级反应检测(MRM),在正离子模式下进行数据采集。正离子模式下质谱条件:毛细管电压:3.5 KV;干燥器:N2;干燥器温度:350℃;去溶剂流量:10 L/min;检测离子对:人参皂苷Rb1(m/z 1131.6→365.7),薯蓣皂苷(m/z 890.5→721.3),菝葜皂苷元(m/z 439.7→417.6),内标甘草次酸(m/z 491.5→425.3);碰撞电压:人参皂苷Rb1为65 eV,薯蓣皂苷为50 eV,菝葜皂苷元为40 eV,内标甘草次酸为50 eV。
1.5 生物样品的制备
取100 μL血浆标准工作溶液、空白血浆及质控样品,分别加入96孔板,除空白血浆外分别加入5 μL的内标工作溶液,涡旋5 min后,加入10 μL NaOH溶液(0.1 mol/L),继续涡旋1 min。混匀后加入0.5 mL正丁醇,反复振摇、混合均匀后,2 000 r/min离心10 min,-20 ℃冷冻2 h,取0.4 mL上层溶液,以氮气吹干,取100 μL流动相复溶。
1.6 动物分组及给药
SD大鼠6只,雌雄各半,作为实验组,禁食不禁水12 h,灌胃东北黄精提取液。空白组灌胃给予蒸馏水,给药前及给药后0.25、0.5、0.75、1、2、3、4、6、8、10、12、24、36、48 h,通过眼眶取0.5 mL血后放于肝素钠离心管,离心后制备血浆,药动学参数采用Winnorlin软件进行处理。
2 结果与讨论
2.1 液相色谱-质谱条件优化
优化液相色谱条件时,结合保留时间、分离度、拖尾因子等因素,对流动相和洗脱梯度进行考察。综合考虑,选择甲酸水和甲醇作为流动相,梯度为70∶30。在数据采集模式考察中,通过比较人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元和内标甘草次酸在正离子扫描模式和负离子扫描模式下的响应值,结果正离子响应值较高,所以本研究选择正离子模式采集数据。经优化,人参皂苷Rb1最佳碰撞电压为65 eV,薯蓣皂苷为50 eV,菝葜皂苷元为40 eV,甘草次酸为50 eV。通过一级质谱全扫描,薯蓣皂苷、人参皂苷Rb1、菝葜皂苷元和甘草次酸的[M+Na]+分别为m/z 890.5、1131.5、439.7和491.5。经二级质谱全扫描可发现并确定人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元和内标甘草次酸的定量离子反应对分别为m/z 1 131.6→365.7、m/z 890.5→721.3、m/z 439.7→417.6、m/z 491.5→425.3。人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元和内标甘草次酸的一、二级质谱图结果见图1。
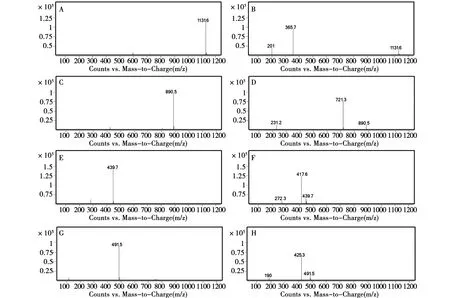
注:A.人参皂苷Rb1一级;B.人参皂苷Rb1二级;C.薯蓣皂苷一级;D.薯蓣皂苷二级;E.菝葜皂苷元一级;F.菝葜皂苷元二级;G.内标一级;H.内标二级。图1 一级、二级质谱图
2.2 专属性
考察血浆样品所需萃取溶剂时,发现正丁醇的提取效率最高,血浆生物样品所受的基质干扰效应最少,故选择正丁醇作为本次生物样品的提取溶剂。将血浆样品按“1.5”项下方式进行处理,经LC-MS/MS法检测后,色谱图结果见图2。结果表明,薯蓣皂苷、人参皂苷Rb1、菝葜皂苷元和甘草次酸的保留时间分别为3.3 min、3.5 min、4.0 min及2.8 min,无内源性成分干扰目标化合物的检测。

注:A.空白血浆(m/z 1131.6→365.7);B.样品血浆(m/z 1131.6→365.7);C.空白血浆(m/z 890.5 →721.3);D.样品血浆(m/z 890.5→721.3)E.空白血浆(m/z 439.7→417.6);F.样品血浆(m/z 439.7→417.6);G.空白血浆(m/z 491.5→425.3);H.样品血浆(m/z 491.5→425.3)。图2 大鼠血浆样品MRM扫描色谱图
2.3 线性方程、线性范围和定量限
按“1.5”项下生物样品的制备方法,分别取100 μL空白血浆,精密加入不同量的人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元和内标工作溶液5 μL,得对照品溶液(薯蓣皂苷浓度分别为20、40、80、120、160、220 ng/mL,人参皂苷Rb1浓度为5、10、20、40、100、200 ng/mL,菝葜皂苷元为10、20、40、60、100、150 ng/mL)。每种浓度平行5份样品,取以上对照品混合溶液10 μL进样,以各皂苷化合物与甘草次酸峰面积比为纵坐标,以浓度为横坐标,按“1.4”项下方法测定,利用加权(1/x)最小二乘法分别得出薯蓣皂苷、人参皂苷Rb1及菝葜皂苷元的回归方程(表1)。3种皂苷线性范围分别为5~200 ng/mL、20~220 ng/mL、10~150 ng/mL,且线性关系良好。

表1 3种皂苷的线性考察(n=5)
2.4 准确度和精密度
测定“1.3.4”项下制备的质控溶液,通过测定皂苷类化合物低、中、高浓度质控样品计算血浆样品中人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元的准确度和精密度,结果见表2。

表2 精密度和准确度考察(n=5)
2.5 提取回收率和基质效应
提取回收率是综合评价生物样品分析方法的重要指标,其反应生物样品中目标化合物的提取效率[17]。考察基质效应有柱后灌流和标准添加两种方法[18-21]。本研究采用标准添加法考察样品的基质效应。
按“1.3.4”测定5、50、200 ng/mL 3个浓度的大鼠血浆质控样品,经测定得峰面积为A1;需要加入对应浓度纯标准品溶液,经测定峰面积为A2;空白血浆样品加入对应浓度纯标准品后,经测定峰面积为A3;计算回收率和基质效应,回收率为A1与A3的比值,基质效应为A3与A2的比值,见表3。该分析方法提取回收率良好,基质干扰效应小。

表3 血浆中人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元回收率与基质效应值
2.6 稳定性
考察5、50、200 ng/mL 3个浓度的质控生物样品分别在25 ℃环境下放置4 h、冷冻放置(-20 ℃)30 d、冻融循环(3次)后的稳定性,见表4。血浆样品中人参皂苷Rb1、薯蓣皂苷及菝葜皂苷元在各放置条件下均有较好稳定性。

表4 大鼠血浆中人参皂苷Rb1、薯蓣皂苷、菝葜皂苷元稳定性
2.7 大鼠灌胃黄精提取液后3种皂苷化合物的药代动力学研究
利用所建立的液相色谱-串联质谱方法,对东北黄精提取液灌胃后大鼠血浆样品中皂苷类成分进行浓度测定。以给药时间作为横坐标,血药浓度为纵坐标,绘制3种皂苷类成分的药时曲线。应用Winnorlin软件以非房室模型进行统计学处理,并计算药代动力学参数,结果见图3。

图3 给药后血浆中人参皂苷Rb1、薯蓣皂苷和菝葜皂苷元的血药浓度-时间曲线
结果显示,人参皂苷Rb1在大鼠体内血药浓度的达峰时间tmax为(2.03±0.32)h,半衰期t1/2为(8.57±0.53)h,最大血药浓度Cmax为(90.37±21.08)ng/mL,AUC0~24为(1 095.83±87.36)(ng·h)/mL;薯蓣皂苷的达峰时间tmax为(1.91±0.54)h,半衰期t1/2为(7.34±0.68)h,最大血药浓度Cmax为(55.21±20.12)ng/mL,AUC0~24为(735.65±64.36)(ng·h)/mL;菝葜皂苷元在大鼠体内血药浓度的达峰时间tmax为(1.16±0.19)h,半衰期t1/2为(6.85±0.52)h,最大血药浓度Cmax为(136.27±39.05)ng/mL,AUC0~24为(1648.96±103.26)(ng·h)/mL。
3 结论
目前,对黄精的研究多集中在皂苷、黄酮及多糖成分的分离、鉴定和药理作用相关机制,但对黄精主成分的体内过程及药代动力学研究较少。本研究首次利用LC-MS/MS法对大鼠灌胃给予黄精提取物后血浆中3种皂苷类成分的血药浓度进行了测定。本研究应用96孔板系统制备大鼠血浆生物样品,高效进行多个样品的处理;采用专属性强、灵敏度高的MRM扫描方式,缩短了样品分析时间。同时,经过测定条件优化和方法学验证,最终利用该方法对3种皂苷成分的药代动力学进行了研究,为黄精体内有效成分的确定提供了基础数据,也为东北黄精的质量控制和资源开发提供参考。
