吴茱萸酒制前后对痛经小鼠镇痛活性的比较及药效物质基础
2021-12-24刘叶倩欧阳荣任卫琼龙红萍
刘叶倩,李 弘,龚 姗,欧阳荣,任卫琼,龙红萍
(湖南中医药大学第一附属医院,湖南 长沙 410007)
吴茱萸来源于芸香科植物吴茱萸Euodiarutaecarpa(Juss.)Benth、石虎EuodiaRutaecarpa(Juss.)Benth.var.officinalis(Dode)Huang或疏毛吴茱萸EuodiaRutaecarpa(Juss.)Benth.var.bodinieri(Dode)Huang的干燥近成熟果实,主要功效为温中散寒、降逆止痛[1]。《备急千金要方》“吴茱萸三两,以清酒三升渍一宿,煮如蚁鼻沸……治产后腹中痛疾病”,且其酒制品用于镇痛效果显著[2],但其活性成分缺乏系统的研究。
液质联用技术(Liquid chromatography-mass spectrometry,LC-MS)能快速、精确地鉴定分析所获得的质谱信息,在鉴别化合物方面具有明显的优势,是定性定量分析中药的重要手段[3-4]。故本实验以痛经小鼠为研究对象,观察吴茱萸生品和酒制品的镇痛作用,同时采用UPLC-Q-TOF-MS对吴茱萸的水提液进行系统的定性定量分析,对比酒制前后吴茱萸化学成分及含量变化,以期为吴茱萸酒制前后镇痛活性物质的研究提供实验依据。
1 材料
1.1 动物 SPF级KM小鼠70只,雌性,体质量18~20 g,购自湖南斯莱克景达实验动物有限公司,实验动物合格证号43004700051990,实验动物生产许可证号SCXK(湘)2016-0002。
1.2 试剂与药材 吴茱萸碱(批号110802-200606)、吴茱萸次碱(批号110801-201006)、芦丁(批号0080-9705)对照品(中国食品药品检定研究院);柠檬苦素(批号1180-71-8,成都瑞芬思生物科技有限公司);去氢吴茱萸碱(批号67909-49-3,河北晨光生物科技集团股份有限公司)。苯甲酸雌二醇注射液(批号B180601,宁波三生生物科技有限公司);缩宫素注射液(批号H34022979,安徽宏业药业有限公司);罗通定片(批号H14020787,山西云鹏制药有限公司);ELISA试剂盒PGE2、ET-1、NO(批号20190702,上海晶天生物科技有限公司)。吴茱萸生品(湖南)、酒制品(湖南)均购于湖南中医药大学第一附属医院,经该院张裕民主任药师鉴定为芸香科疏毛吴茱萸的干燥近成熟果实。甲醇、乙腈(质谱纯,德国Merck Millipore公司);甲酸铵(质谱纯,美国Fisher公司);蒸馏水(深圳屈臣氏蒸馏水有限公司)。
1.3 仪器 Agilent 1290UPlC-6540 Q-TOF-MS仪,配置MassHunter质谱工作站和Mass analysis质谱数据处理系统、Agilent Masshunter Qualitative Analysis工作站中的分子特征提取(MFE)功能、TCM-DATA中药成分数据库、Agilent ZORBAX EcliPse Plus C18色谱柱(3.0 mm×100 mm,1.8 μm)(美国Agilent公司);S-23高速台式离心机(湖南湘仪科教仪器有限公司);AUW120D电子分析天平(日本Shimadzu公司);MK3型酶标仪[赛默飞世尔(上海)仪器有限公司]。
2 方法
2.1 药液制备
2.1.1 水提物制备 取吴茱萸生品与酒制品各270 g于煎药器中,分别加入10倍量蒸馏水浸泡30 min,武火加热至沸腾后转文火煎煮1 h,滤过,滤渣再加入8倍量蒸馏水,重复1次,40 min后过滤,合并2次滤液,采用旋转蒸发仪减压浓缩,真空干燥,得到吴茱萸生品、酒制品干膏各74.57 g,每1 g干膏相当于3.62 g中药[5]。
2.1.2 受试药物制备 取吴茱萸生品、酒制品干膏各3.6 g,蒸馏水溶解稀释,高、低生药质量浓度均分别为0.195、0.065 g/mL,即得。取罗通定片78片,碾碎成粉末,加蒸馏水,充分混匀,配制成质量浓度为0.47 g/mL的混悬液,即得。
2.2 UPLC-Q-TOF-MS分析
2.2.1 对照品、供试品溶液制备
2.2.1.1 供试品溶液 取3 g干膏置50 mL锥形瓶中,加入30 mL 70%甲醇,超声处理30 min,冷却,70%甲醇补充至超声前质量,离心,0.22 μm微孔滤膜过滤,即得。
2.2.1.2 对照品溶液 分别精密称取5 mg芦丁、去氢吴茱萸碱、柠檬苦素、吴茱萸碱、吴茱萸次碱对照品,置于10 mL量瓶中,甲醇定容至刻度,0.22 μm微孔滤膜过滤,分别吸取0.1 mL于进样瓶中,即得。
2.2.2 分析条件
2.2.2.1 色谱 Agilent ZORBAX EcliPse Plus C18色谱柱(3.0 mm×100 mm,1.8 μm);流动相乙腈(A)-0.05 mmol/L甲酸铵(B),梯度洗脱(0~5 min,5%~15% A;5~10 min,15%~35% A;10~20 min,35%~65% A;20~30 min,65%~5% A);体积流量0.4 mL/min;温度25 ℃;进样量1 μL。
2.2.2.2 质谱 电喷雾离子化(ESI),正离子分析模式检测;采用Agilent标准调谐液ESI-l low Concentration Tuning Mix G1969-85000对进样分析前的准确质量数进行校正。一级质谱质量扫描范围m/z100~1 700;脱溶剂气体N2体积流量6.8 L/min;脱溶剂气温度325 ℃;鞘气温度350 ℃;毛细管电压4.0 kV;Fragment电压150 V。二级质谱质量扫描范围m/z50~1 000;二级Fragment电压10、20、40 V。
2.3 镇痛实验
2.3.1 分组及建模 70只小鼠按照体质量随机分为7组,每组10只,分别为正常组,模型组,吴茱萸生品低、高剂量组,吴茱萸酒制品低、高剂量组,罗通定组,除正常组外,其余各组小鼠皮下注射苯甲酸雌二醇10 d,每天1次,第1、10天注射剂量为10 mg/kg,第2~9天注射剂量为5 mg/kg。
2.3.2 给药 根据文献[6]报道,吴茱萸人日用量为10 g,换算得到小鼠剂量为1.3 g/kg,以临床用量为依据,设定吴茱萸生品、酒制品高、低生药剂量均分别为3.9、1.3 g/kg。从造模第5天开始,吴茱萸生品、酒制品高、低剂量组按照20 mL/kg灌胃体积分别予以0.195、0.065 g/mL受试药物,罗通定组等剂量灌胃0.47 mg/mL混悬液,正常组、模型组灌胃给予等体积蒸馏水,连续5 d,每天1次。
2.3.3 扭体反应考察 在末次给药前24 h注射最后1次苯甲酸雌二醇,给药后40 min按照10 U/kg剂量腹腔注射缩宫素,迅速观察小鼠第1次出现扭体反应的时间,作为扭体潜伏期,并记录30 min内扭体反应发生的次数[7]。
2.3.4 血清指标检测 实验结束后小鼠眼球取血,4 500 r/min离心10 min,取其上清液,按照说明书相关操作方法,采用酶联免疫吸附法(ELISA)检测小鼠血清的前列腺素E2(prostaglandinE2,PGE2)、内皮素-1(endothelin 1,ET-1)、一氧化氮(nitric oxide,NO)水平。
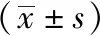
3 结果
3.1 镇痛实验
3.1.1 小鼠扭体次数比 与正常组比较,模型组小鼠扭体次数增多(P<0.01),提示模型制备成功;与模型组比较,吴茱萸酒制品高剂量组小鼠扭体次数减少(P<0.01),酒制品低剂量组、生品高低剂量组小鼠扭体次数有所降低,但差异无统计学意义(P>0.05);与同剂量生品组比较,吴茱萸酒制品高、低剂量组小鼠扭体次数减少,但差异无统计学意义(P>0.05),见图1。
注:与正常组比较,▲▲P<0.01;与模型组比较,**P<0.01。图1 吴茱萸对小鼠扭体次数的影响
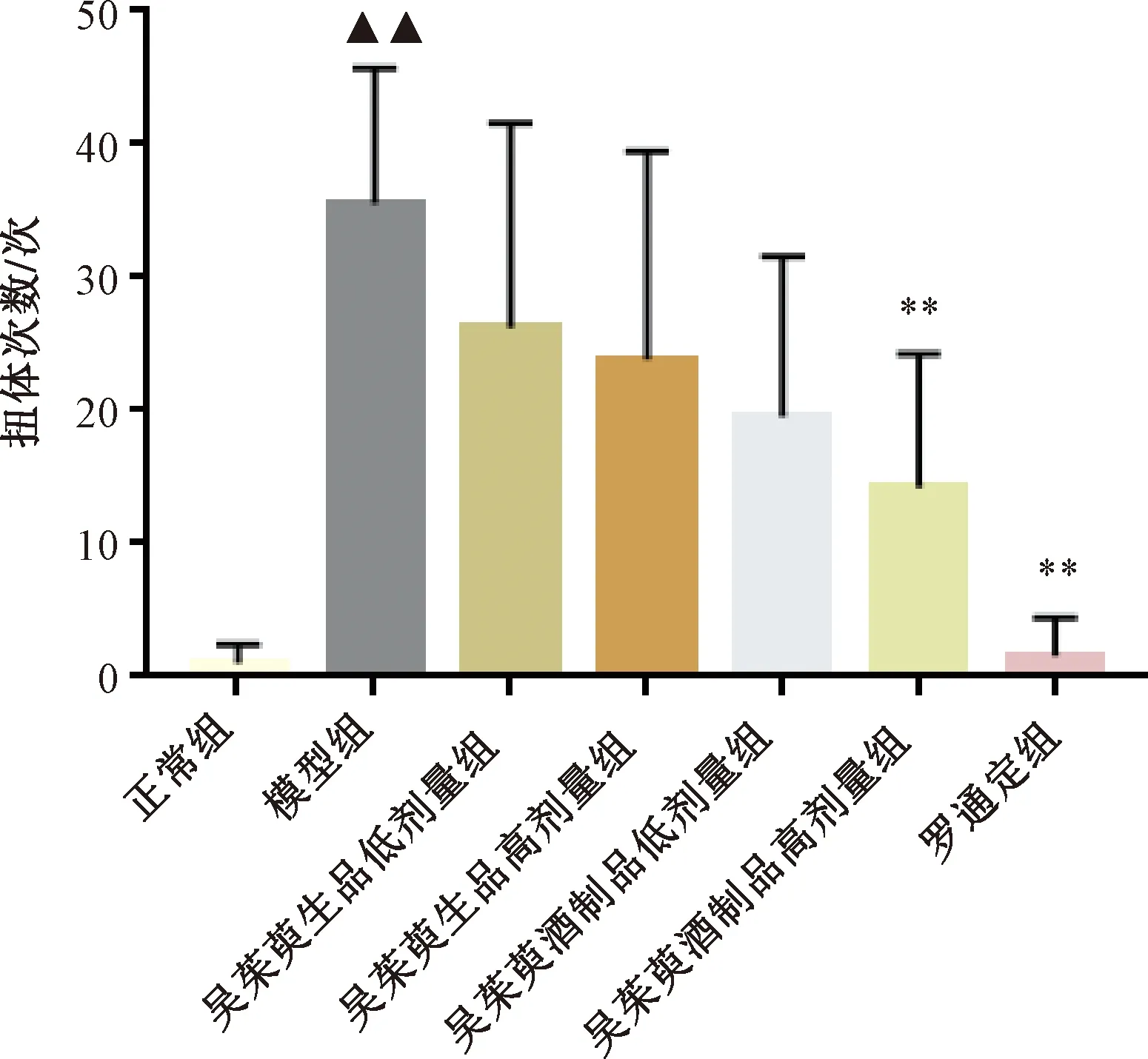
3.1.2 小鼠扭体潜伏期 与正常组比较,模型组小鼠扭体潜伏期缩短(P<0.01),提示模型制备成功;与模型组比较,吴茱萸生品、酒制品低、高剂量组小鼠扭体潜伏期延长(P<0.01);与同剂量生品组比较,吴茱萸酒制品高、低剂量组小鼠扭体潜伏期延长(P<0.05),见图2。
注:与正常组比较,▲▲P<0.01;与模型组比较,**P<0.01;与同剂量生品组比较,#P<0.05。图2 吴茱萸对小鼠扭体潜伏期的影响
3.1.3 小鼠血清PEG2、ET-1、NO水平 与正常组比较,模型组小鼠血清ET-1水平升高,PEG2、NO水平降低(P<0.01);与模型组比较,吴茱萸生品高、低剂量组小鼠血清PGE2、NO水平升高,ET-1水平降低,但差异无统计学意义(P>0.05),吴茱萸酒制品高、低剂量组小鼠血清PEG2、NO水平升高,ET-1水平降低(P<0.05,P<0.01);与同剂量生品组比较,吴茱萸酒制品高、低剂量组小鼠血清PGE2水平升高(P<0.01),NO水平有所升高,ET-1水平有所降低,但差异无统计学意义(P>0.05),见图3。

注:与正常组比较,▲▲P<0.01;与模型组比较,*P<0.05;**P<0.01;与同剂量生品组比较,##P<0.01。图3 吴茱萸对小鼠血清PGE2、ET-1、NO水平的影响
3.2 UPLC-Q-TOF-MS分析 图4~5显示,从吴茱萸生品、酒制品中鉴定出24个化合物,其中前者20个,后者24个,见表1。

表1 吴茱萸生品、酒制品所含成分质谱信息

图4 供试品正离子流色谱图
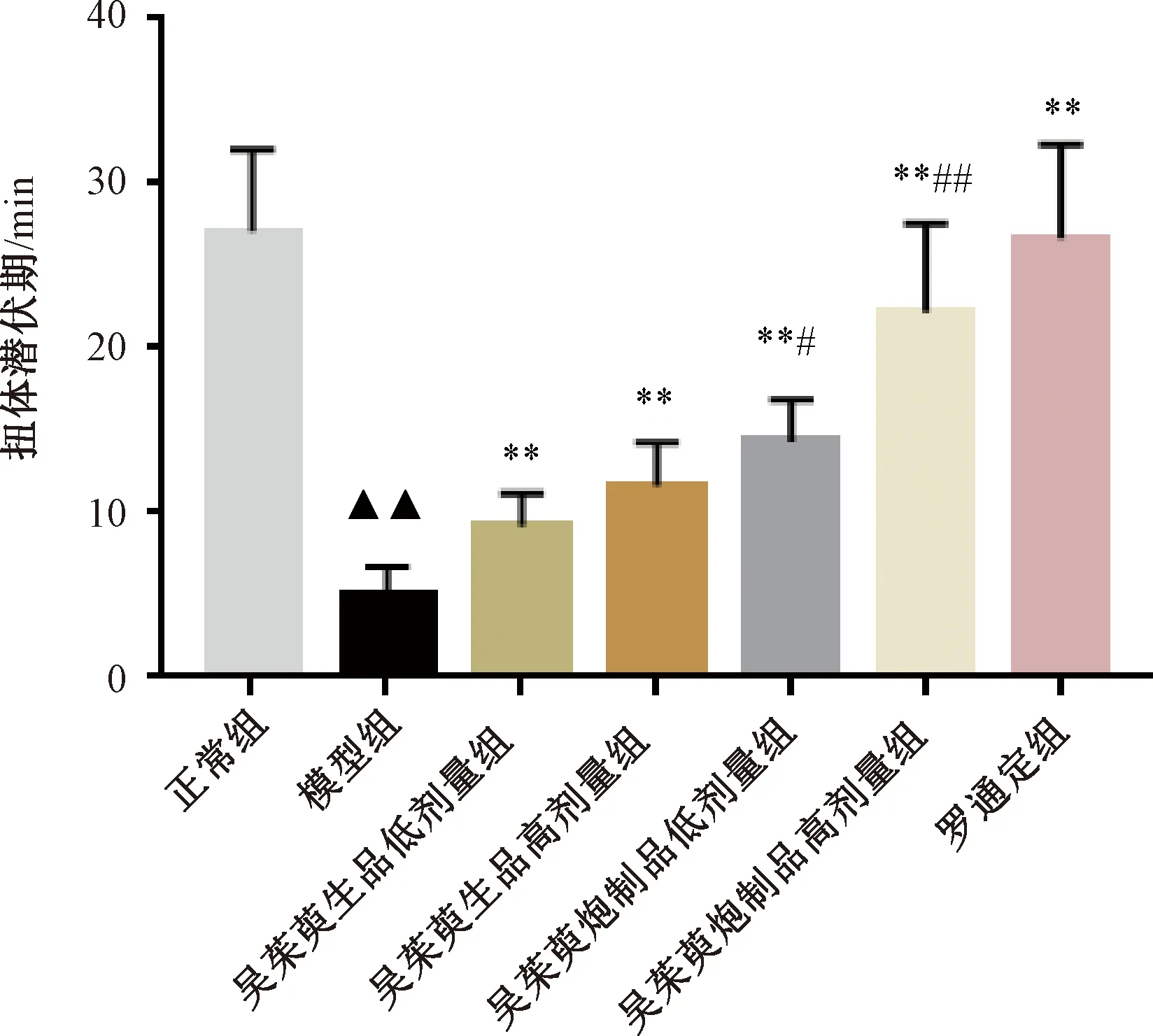
吴茱萸酒制后,其主要镇痛成分芦丁、去氢吴茱萸碱、柠檬苦素、吴茱萸碱、吴茱萸次碱含量发生明显变化,并明显高于生品,见表2。
表2 吴茱萸酒制前后主要镇痛成分含量变化
4 讨论
吴茱萸史载于《神农本草经》,列为中品,其言“主温中下气止痛”,具有散寒止痛之功[1]。吴茱萸能通过减缓缩宫素引起的子宫平滑肌收缩频率及收缩力度,起到缓解痛经的作用[8]。酒能入血分,主行药势,能增强吴茱萸温热之性、散寒止痛之功[9]。痛经患者以寒证为主,针对寒证痛经患者,温经散寒为其治疗之根本[10]。但吴茱萸酒制前后镇痛效果与有效成分之间的相关性鲜有报道。LC-MS是液相色谱和质谱技术的结合体,既有前处理简便,化合物信息丰富等优点,同时可结合质谱裂解规律,用于中药未知成分解析,是目前中药化学成分鉴定分析的重要手段[11]。因此,本实验选用痛经小鼠模型考察其镇痛作用,并运用UPLC-Q-TOF-MS技术比较吴茱萸酒制前后有效成分的变化,以期为吴茱萸酒制前后镇痛活性物质的研究提供实验依据。初步阐明吴茱萸镇痛的物质基础。

1.芦丁 2.去氢吴茱萸碱 3.柠檬苦素 4.吴茱萸碱 5.吴茱萸次碱图5 对照品正离子流色谱图
痛经的发病机理与月经期PGE2、ET-1、NO、OT的变化有关。前列腺素(prostaglandin,PG)作为重要的炎性物质,月经期间PGE2水平降低,使得子宫内膜细胞破坏,释放大量的前列腺素E2α(prostaglandin E2ɑ,PGE2ɑ),引起子宫平滑肌强烈收缩,从而导致痛经[12-14]。ET-1和NO是子宫内膜中作用相反的两种血管活性物质,ET-1水平的增高使血管强烈收缩,产生疼痛[15];NO则表现出对痛经的双向调节作用,含量升高时可抑制子宫收缩,缓解疼痛;降低可引起子宫强烈收缩,加重痛经症状[16-17]。本实验发现,痛经模型组小鼠扭体次数增加,潜伏期缩短,PGE2、NO水平降低,ET-1水平升高,提示造模成功。经吴茱萸干预后,给药组小鼠扭体次数减少、潜伏期延长,PGE2、NO水平升高,ET-1水平降低,其中酒制品高剂量组效果显著(P<0.01)。提示酒制后吴茱萸镇痛疗效增加。
借助UPLC-Q-TOF-MS技术,在吴茱萸水提物化学成分中共鉴别出24种化合物,其中吴茱萸生品20种,吴茱萸酒制品24种。吴茱萸酒制后山柰酚-3-鼠李糖基葡萄糖苷-7-葡萄糖苷、芦丁、Evollionines A、吴茱萸酰胺成分增加。其中芦丁的镇痛活性早有报道[18]。Carvalho等[19]提出芦丁可通过下调粒细胞集落刺激因子(granulocyte colony-stimulating factor,G-CSF)的表达,减轻炎症反应,起到缓解疼痛的目的。且在糖尿病大鼠中发现,芦丁可通过抑制福尔马林试验反应,逆转糖尿病大鼠的化学痛觉过敏和认知障碍[20]。已有研究报道芦丁、吴茱萸碱、柠檬苦素、吴茱萸次碱及去氢吴茱萸碱等成分具有镇痛作用[21]。本实验对吴茱萸酒制前后主要镇痛成分芦丁、去氢吴茱萸碱、柠檬苦素、吴茱萸碱以及吴茱萸次碱的含量进行了比较,发现酒制后五种镇痛成分含量均有不同程度增加,以芦丁、吴茱萸碱和柠檬苦素的含量变化最为明显,提示吴茱萸酒制后镇痛作用的增强可能与芦丁、去氢吴茱萸碱、柠檬苦素、吴茱萸碱以及吴茱萸次碱五种镇痛成分含量的增加有关。
综上,吴茱萸酒制前后镇痛活性与其有效成分及含量变化发生一定程度的改变有关,为吴茱萸酒制前后药效物质基础研究提供实验依据;但其酒制前后成分及含量变化及其原因,以及这些成分对痛经小鼠镇痛的具体作用机制有待进一步研究。
