二氢杨梅素磷脂复合物及其滴丸的制备及其体内药动学比较
2021-12-24魏永鸽黄贺梅孙永武李姝颖范明松
魏永鸽,黄贺梅,徐 凯,孙永武,李姝颖,范明松
(1.郑州铁路职业技术学院,河南 郑州 450052;2.黄河科技学院,河南 郑州 450005;3.上海雷允上药业有限公司技术中心,上海 201401)
二氢杨梅素是从蛇葡萄科葡萄属AmpelopsisMichx植物中提取分离出来的二氢黄酮醇类化合物,具有降血脂、抗炎、抗肿瘤、降血压、预防心脑血管疾病等多种药理作用[1-4],但该成分水溶性差,导致溶出受限;脂溶性较低[4],导致透膜吸收困难,故其口服生物利用度很低[5]。为了改善上述问题,已有关于二氢杨梅素制剂新技术的报道,如自微乳、脂质体、微囊等[6-8],但制备工艺复杂。
磷脂复合物是在非质子溶剂中药物分子和磷脂(或磷脂酰胆碱)通过分子间作用力结合在一起[9-10],对药物脂溶性改善作用较大,但分散性差,溶出困难[11]。滴丸是通过将基质加热熔融后加入药物进而形成均一溶液,滴入冷凝液而形成的丸剂,具有制备过程简单、工业化程度高、质量易控制等优势,可加快药物溶出,提高生物利用度[12]。本实验首先制备二氢杨梅素磷脂复合物,并考察其存在状态、溶解度等基本情况,再将其进一步制成滴丸,以期为相关制剂开发提供研究策略和参考资料。
1 材料
1.1 仪器 MSE125P-CE型电子天平(德国Sartorius公司);R2000型旋转蒸发仪(艾卡仪器设备有限公司);Agilent 1200型高效液相色谱仪(美国Agilent公司,配置DAD检测器、自动进样器);D-QCGY-12型氮吹仪(上海助乘实业有限公司);D-8型X射线粉末衍射仪(德国Bruker公司);DWJ-2000S-D型滴丸机(烟台康达尔药业有限公司);RC-6D型智能药物溶出试验仪(天津创兴电子设备制造有限公司);2401PC型可见分光光度仪(日本岛津公司)。
1.2 试剂、药物与动物 二氢杨梅素对照品(批号P20151015,质量分数为99.1%,上海爱启医药科技技术有限公司)。卵磷脂(批号181010,磷脂酰胆碱质量分数>98%,上海辅必成医药科技有限公司);PEG 6000(批号190515,国药集团化学试剂有限公司)。四氢呋喃(色谱纯,批号C10303495)、磷酸(批号P816338-1L)(上海麦克林生化科技有限公司)。SD大鼠购自河南省动物实验中心,动物生产许可证号SCXK(豫)2016-0001,实验室饲养1周,选择体质量(300±20)g者进行药动学实验。
2 方法与结果
2.1 二氢杨梅素含量测定
2.1.1 色谱条件 Waters C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈-0.1%磷酸(40∶60);体积流量1.0 mL/min;柱温25 ℃;检测波长291 nm;进样量20 μL。理论塔板数以二氢杨梅素计,不低于8 500。
2.1.2 线性关系考察 称取二氢杨梅素对照品20 mg,溶于10 mL乙腈,作为2.0 mg/mL贮备液,流动相逐步稀释成1.0、5.0、10.0,20.0、40.0、50.0 μg/mL的对照品溶液,在“2.1.1”项色谱条件下进样测定。以二氢杨梅素质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,得方程为Y=0.912 7X+2.697 8(r=0.999 9),在1.0~50.0 μg/mL范围内线性关系良好。
2.1.3 供试品溶液制备 取磷脂复合物滴丸10粒,置于100 mL量瓶中,加入约80 mL 85%乙醇超声溶解并定容至刻度,精密量取0.5 mL至10 mL量瓶中,流动相稀释定容至刻度,即得。
2.1.4 方法学考察 取50.0 μg/mL(高)、20.0 μg/mL(中)、1.0 μg/mL(低)对照品溶液,在“2.1.1”项色谱条件下进样测定6次,测得日内精密度RSD分别为0.08%、0.11%、0.14%,表明仪器精密度良好。取“2.1.3”项下供试品溶液,于0、2、4、8、12、24 h在“2.1.1”项色谱条件下进样测定,测得二氢杨梅素峰面积RSD为0.53%,表明溶液在24 h内稳定性良好。按“2.1.3”项下方法平行制备6份供试品溶液,在“2.1.1”项色谱条件下进样测定,测得二氢杨梅素峰面积RSD为1.07%,表明该方法重复性良好。取磷脂复合物滴丸10粒,置于100 mL量瓶中,平行9份,分别加入对照品12、24、36 mg各3份,按“2.1.3”项下方法制备供试品溶液,在“2.1.1”项色谱条件下进样测定,测得二氢杨梅素平均加样回收率分别为99.42%、100.17%、99.42%,RSD分别为0.98%、0.67%、1.13%。
2.2 磷脂复合物制备 按文献[7]报道的方法,称取二氢杨梅素50 mg、大豆磷脂120 mg(摩尔比1∶1),置于三角烧瓶中,加入45 mL四氢呋喃制得混悬液,45 ℃水浴磁力搅拌一定时间至溶液澄清,在45 ℃下减压旋蒸除去有机溶剂,即得,密封后置于干燥器中。平行制备3批样品,按文献[7]报道的方法,测得其平均复合率为99.47%。
2.3 磷脂复合物表征
2.3.1 紫外吸收光谱 取二氢杨梅素、磷脂复合物适量,加入甲醇溶解,再以甲醇为空白,在190~400 nm波长处进行扫描,结果见图1。由此可知,两者特征吸收峰完全一致,表明二氢杨梅素结构中的生色基团未发生变化,与文献[10]报道的磷脂复合物紫外吸收光谱与原料药相比未发生变化一致。
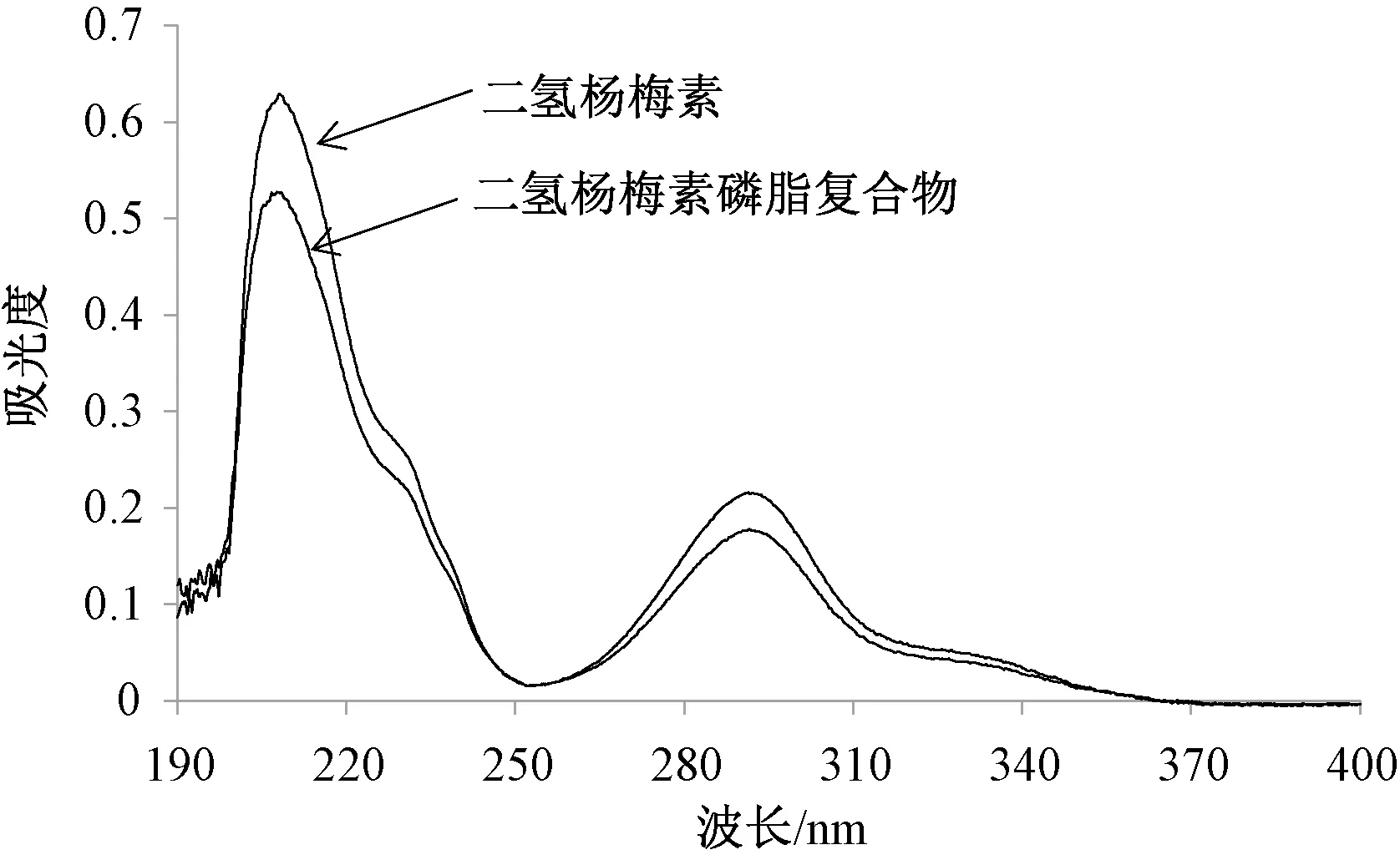
图1 各样品紫外吸收图谱Fig.1 Ultraviolet absorption spectra of various samples
2.3.2 晶型 通过X射线粉末衍射(XRPD)对二氢杨梅素、物理混合物、磷脂复合物进行扫描,采用Cu-Kα靶,扫描速度为8°/min,扫描范围(2θ)为3°~45°,结果见图2。由此可知,二氢杨梅素图谱中在9°~ 29°范围内出现多处晶型峰;物理混合物图谱中仍可明显观察到二氢杨梅素晶型峰;磷脂复合物图谱中二氢杨梅素的典型晶型峰全部消失,表明该成分以无定型状态存在。

图2 各样品XRPD图谱Fig.2 XRPD patterns for various samples
2.3.3 表观溶解度 取二氢杨梅素、物理混合物、磷脂复合物适量,加入正辛醇或蒸馏水,25 ℃、800 r/min搅拌48 h,取混悬液,8 000 r/min离心15 min,取上清液,测定表观溶解度,结果见表1。由此可知,与二氢杨梅素比较,磷脂复合物在正辛醇的表观溶解度提高1.41倍,具有显著差异(P<0.01),由微溶改善至略溶;在水中的表观溶解度提高1.59倍,也具有显著差异(P<0.01),但仍属于几乎不溶。由于磷脂复合物黏性较大,不利于药物溶出,故需要联合其他制剂技术加以改善。

表1 二氢杨梅素表观溶解度测定结果Tab.1 Results of apparent solubility determination of dihydromyricetin (μg/mL,
2.4 滴丸制备 以圆整度为指标,本实验考察了基质种类(PEG 4000、PEG 6000及两者等量混合物)、磷脂复合物与基质比例(1∶2、1∶3、1∶4、1∶5)、滴距(5、8、10 cm)、滴速(45、50、55滴/min),最终选择PEG 6000作为基质,磷脂复合物与基质比例为1∶4,滴距为8 cm,滴速为50滴/min。滴丸制备工艺为取20 g PEG 6000至烧杯中,75 ℃水浴加热熔融,边搅拌边加入5 g磷脂复合物,继续搅拌0.5 h至完全混匀,立即倒入贮液槽内(恒温75 ℃),滴头型号3.0 mm/5.0 mm,滴入具有温度梯度的二甲基硅油中(管口35 ℃,管底8 ℃),滴距为8 cm,滴速为50滴/min,即得,滤纸吸干,置于容器中。平行制备3批滴丸,按照2020年版《中国药典》要求检测,测得平均溶散时限为(9.54±0.25)min,丸重差异为(3.89±0.17)%,直径为(3.91±0.06)mm,每粒丸重为(40.10±0.23)mg。
2.5 溶出度测定 取二氢杨梅素、磷脂复合物(以二氢杨梅素计,含量为40 mg)适量,加入3 mL蒸馏水,置于截留分子量8 000~10 000 Da的透析袋中。另取17粒滴丸(以二氢杨梅素计,含量约为40 mg),置于透析袋中,同法操作[13],平行6份,在温度37 ℃、转速100 r/min、释放介质900 mL蒸馏水的条件下,于0、5、15、30、60、90、120、240、480 min各取样3 mL,并补加3 mL空白溶出介质,0.45 μm微孔滤膜过滤,测定溶出度,结果见图3。由此可知,二氢杨梅素240 min内累积溶出度为31.93%,制成磷脂复合物后提高至63.74%,再进一步制成滴丸后在30 min内基本溶出完毕,累积溶出度达95.43%。

图3 二氢杨梅素体外溶出曲线(n=6)Fig.3 In vitro dissolution curves for dihydromyricetin (n=6)
2.6 体内药动学研究
2.6.1 灌胃液制备 取二氢杨梅素、磷脂复合物、滴丸适量,0.5%CMC-Na溶液制成含二氢杨梅素15 mg/mL的混悬液,即得。
2.6.2 分组、给药及采血 18只大鼠随机分为3组,按100 mg/kg剂量分别灌胃给予“2.6.1”项下3种灌胃液,于0.25、0.5、1、1.5、2、2.5、3、4、6、8、10 h乙醚麻醉,眼眶采血各约0.3 mL,棉球止血,将血样置于离心管中(滴入2滴1%肝素),摇匀,4 000 r/min离心2 min,取上层血浆,作好标记,冷冻保存。
2.6.3 内标溶液制备及血浆样品处理 参考文献[7]报道,精密称取芹菜素对照品10.0 mg,溶于50 mL乙腈中,再用乙腈稀释至400 ng/mL,即得。取血浆样品、内标溶液各100 μL,混匀后加入0.5 mL乙酸乙酯,涡旋5 min,8 000 r/min离心10 min,取上层有机溶剂,N2吹干得残渣,100 μL乙腈复溶,转移至带有内衬管的进样瓶中。
2.6.4 方法学考察 将对照品溶液稀释至4.0、2.0、1.0、0.5、0.1、0.05 μg/mL,进样针分别吸取100 μL,N2吹干得残渣,加入空白血浆、内标溶液各100 μL,按“2.6.3”项下方法操作,在“2.1.1”项色谱条件下进样测定。以二氢杨梅素质量浓度为横坐标(X),二氢杨梅素、芹菜素峰面积比值为纵坐标(Y)进行回归,得方程为Y=0.031 8X-2.310 7(r=0.994 2),在0.05~4.0 μg/mL范围内线性关系良好。
取0.05、1.0、4.0 μg/mL血浆对照品溶液,在“2.1.1”项色谱条件下各进样测定6次,测得峰面积RSD分别为4.24%、3.69%、3.03%,表明仪器精密度良好。取磷脂复合物给药1 h后的血浆样品,室温下于0、4、8、12、18、24 h在“2.1.1”项色谱条件下进样测定,测得二氢杨梅素、芹菜素峰面积比值RSD为7.11%,表明样品在24 h内稳定性良好。再取上述3个质量浓度的血浆对照品溶液,在“2.1.1”项色谱条件下进样测定,测得平均加样回收率分别为91.68%(RSD=3.06%)、87.07%(RSD=4.13%)、94.65%(RSD=2.74%)。
2.6.5 结果分析 图4、表2显示,与二氢杨梅素比较,磷脂复合物Cmax、AUC0~t、AUC0~∞升高(P<0.05,P<0.01),但tmax无明显变化(P>0.05);与磷脂复合物比较,滴丸Cmax、AUC0~t、AUC0~∞升高(P<0.01),tmax缩短(P<0.01);磷脂复合物、滴丸分别将二氢杨梅素的口服吸收生物利用度提高至1.68、3.72倍。

表2 二氢杨梅素主要药动学参数Tab.2 Main pharmacokinetic parameters for

图4 二氢杨梅素血药浓度-时间曲线(n=6)Fig.4 Plasma concentration-time curves for dihydromyricetin (n=6)
3 讨论
目前国内尚无官方提供二氢杨梅素对照品,故课题组采用定量核磁技术对原料药含量进行了标定[14]。磷脂复合物的制备一般要求在非质子溶剂中进行,赵薪苑等[4]采用质子溶剂(甲醇)也制备了二氢杨梅素磷脂复合物,但其复合率往往会受到影响[10],而且也会影响磷脂复合物稳定性,不利于保存。
为了改善二氢杨梅素磷脂复合物的分散性,课题组进一步将其制成滴丸,发现其溶出速率及溶出度得到有效改善,tmax、Cmax、AUC0~t、AUC0~∞均有显著变化,生物利用度提高至3.72倍(磷脂复合物口服仅提高至1.68倍)。很多研究者采用固体脂质纳米粒、纳米结构脂质载体、脂质体等[15-16]技术来改善磷脂复合物溶出问题,但由于该制剂难免会接触水相,容易导致其发生解离[17],故稳定性存在一定问题。本实验将二氢杨梅素磷脂复合物制成滴丸,避免了水相的使用,可使其溶出度及生物利用度大大提高,而且操作过程简单,适合国内中药公司实际生产水平,推广意义较大。
