珍珠龙胆石斑鱼CO2麻醉无水保活效果的因素影响
2021-12-24范秀萍张家胜郭侨玉秦小明刘书成
范秀萍,张家胜,郭侨玉,杜 欢,秦小明,刘书成
珍珠龙胆石斑鱼CO2麻醉无水保活效果的因素影响
范秀萍1,2,张家胜1,郭侨玉1,杜 欢1,秦小明1,2,刘书成1,2
(1. 广东海洋大学食品科技学院 // 广东省水产品加工与安全重点实验室 // 广东省海洋食品工程技术研究中心 // 水产品深加工广东普通高等学校重点实验室,广东 湛江,524088;2. 南方海洋科学与工程广东省实验室,广东 湛江,524025)
【】研究二氧化碳(CO2)对珍珠龙胆石斑鱼(♀×♂)的麻醉效果,并探讨无水保活技术对石斑鱼运输的影响。以麻醉和复苏时间、无水保活时间和存活率为指标,探讨温度、CO2浓度、麻醉时间、保活温度对珍珠龙胆石斑鱼CO2麻醉后无水保活效果的影响;并对CO2麻醉无水保活过程中的鱼体血清生化、游离氨基酸和基本营养成分进行分析。珍珠龙胆石斑鱼(503.0±37.0)g在25 ℃海水中暂养24 h后,逐渐降温至18 ℃,在含CO2质量浓度125 mg/L(pH 5.8)的海水中麻醉5 min,转移至15 ℃、充氧保湿的无水条件下保活,11 h后的存活率达到83.3%。低温CO2麻醉与无水保活过程中鱼体代谢发生变化:谷丙转氨酶(ALT)、谷草转氨酶(AST)与尿素氮(BUN)水平均显著上升 (< 0.05),有水复苏12 h后能恢复到正常水平;出现典型的“高血糖”症状。珍珠龙胆石斑鱼经低温CO2麻醉、无水保活胁迫后主要表现出能量代谢的应激响应,以无氧呼吸为主,脂肪和糖原为主要能量物质;鲜味与苦味氨基酸含量显著下降 (< 0.05),甜味氨基酸质量分数增加43.52%。保活后鱼肉营养品质优于低温休眠有水保活模式。CO2对珍珠龙胆石斑鱼有较好的麻醉作用,CO2麻醉协同低温可用于珍珠龙胆石斑鱼无水保活运输。
CO2麻醉;珍珠龙胆石斑鱼;无水保活;血清生化;代谢;游离氨基酸
珍珠龙胆石斑鱼(♀ ×♂)是一种暖水性海洋鱼类[1],营养丰富、肉质细嫩,其鲜活产品深受消费者的青睐[2]。有水保活运输技术运载量低,同时水质恶化易引起鱼体存活能力与鱼肉品质降低,且常用的化学麻醉剂容易因残留引起食用安全问题[3]。二氧化碳(CO2)是一种安全无毒,价格低廉的麻醉剂[4]。研究发现,10 ℃温度下鲫()在700 mg/L CO2溶液中麻醉后,无水保活时间可长达15 h[5];CO2在罗非鱼()、鲤()、鳜()、鲑()等种类中均得到了较好的麻醉保活效果[6-9]。CO2进入血液,降低血pH,导致大脑中O2运输量降低,引起鱼体麻醉[10]。但CO2增加会引起水体变酸,导致鱼体呼吸困难,出现死亡,且CO2浓度随时间的延长会发生改变。低温联合低浓度的CO2处理麻醉鱼体,不仅能降低鱼体的新陈代谢,还能降低鱼体由于运输所带来的应激与损伤[11],具有较好的发展与应用前景。但CO2麻醉技术在珍珠龙胆石斑鱼中的应用尚未见相关报道。
本研究探讨CO2对珍珠龙胆石斑鱼的麻醉效果与无水保活的条件,研究CO2麻醉珍珠龙胆石斑鱼后无水保活过程中所需的适宜麻醉水温、CO2浓度、麻醉时间和无水保活温度,并对麻醉与无水保活过程中的生化指标、营养成分进行分析,以期为珍珠龙胆石斑鱼的无水保活运输提供参考。
1 材料与方法
1.1 材料与试剂
珍珠龙胆石斑鱼(♀ ×♂),广东省湛江市东海岛养殖场养殖,体质量(503.0±37.0)g。实验前停食暂养24 h,实验时挑选体质健康、无外伤的珍珠龙胆石斑鱼。
谷丙转氨酶(ALT)、谷草转氨酶(AST)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、尿素氮(BUN)、糖原检测试剂盒,南京建成生物有限公司;皮质醇:上海酶联生物科技有限公司。葡萄糖测定试剂盒:上海荣成盛生物药业有限公司。
1.2 仪器与设备
鱼类保活运输系统(定制),广州铭创生物科技有限公司;Varioskan全自动酶标仪,美国ThermoFisher公司;835-50型氨基酸分析仪,日本日立公司;HX204卤素水分测定仪,瑞士梅特勒-公司;Vap450全自动凯氏定氮仪,德国格哈特公司。
1.3 CO2麻醉无水保活实验方法
1.3.1 麻醉和复苏阶段行为特征观察 本实验中麻醉和复苏的分期标准参考Erikson等[8]的方法,并结合珍珠龙胆石斑鱼自身行为特征加以修改。将处于CO2溶液中的珍珠龙胆石斑鱼的麻醉过程分为6个时期(表1),复苏过程分为4个时期(表2)。

表1 珍珠龙胆石斑鱼麻醉程度分期及行为特征

表2 珍珠龙胆石斑鱼复苏过程分期及行为特征
1.3.2 CO2麻醉水温对珍珠龙胆石斑鱼麻醉与无水保活效果的影响 在50 L的玻璃缸中加入15 L海水,放入珍珠龙胆石斑鱼,空气泵充氧保持水体溶氧在6.0 ~ 7.5 mg/L,以2 ℃/h的速度降至实验温度(25、22、20、18、15 ℃),以0.5 L/min的流速充入CO2气体,记录水体pH值,采用化学滴定法测定水体CO2浓度、记录鱼体行为及麻醉时间。麻醉至A4期后转入相同温度海水中复苏,记录复苏时间。每组6尾鱼。
珍珠龙胆石斑鱼经25 ℃暂养24 h后,在不同温度(15、18、20、22、25 ℃)的CO2麻醉溶液中浸泡,当鱼体进入A3期后,转移至内有封口袋的保活箱中,用湿纱布包住鱼体保持湿度,充入O2,在15 ℃条件下无水保活,观察鱼体活动,以鱼体僵硬、刺激无鳃动作为死亡时间。记录不同麻醉温度浸泡后无水保活不同时间下鱼体的存活率。每组4尾鱼。
1.3.3 CO2浓度对麻醉时间和保活时间的影响 将暂养后的珍珠龙胆石斑鱼转移到18 ℃不同质量浓度的CO2麻醉溶液(30、60、75、125 mg/L)浸泡,当鱼体进入A3期后,转移至内有封口袋的保活箱中,用湿纱布包住鱼体保持湿度,充入O2,在15 ℃条件下无水保活。观察鱼活动的变化,记录麻醉时间、存活时间与存活率。每组4尾鱼。
1.3.4 CO2麻醉时间对存活率的影响 将暂养后的珍珠龙胆石斑鱼转移到相同的18 ℃、125 mg/L CO2麻醉溶液浸泡不同时间(5、10、15、20、25 min)后,转移至内有封口袋的保活箱中,用湿纱布包住鱼体保持湿度,充入O2,在15 ℃条件下无水保活。观察鱼活动变化,记录不同保活时间下的存活率。每组4尾鱼。
1.3.5 无水保活温度对存活时间与存活率的影响珍珠龙胆石斑鱼经25 ℃暂养24 h,在18 ℃、125 mg/L CO2溶液中麻醉5 min,转移到内有封口袋的保活箱中,用湿纱布包住鱼体保持湿度,充入O2,在不同温度(15、18、20、22、25 ℃)条件下无水保活。记录存活时间与存活率。每组6尾鱼。
1.4 血清生化指标的检测方法
珍珠龙胆石斑鱼经25 ℃暂养24 h后,逐渐降温至18 ℃,在充CO2(125 mg/L)海水中浸泡5 min,转移至15 ℃、充O2的无水条件下保活,10 h后取出在25 ℃新鲜海水中复苏,复苏12 h后的存活率为100%,取复苏后12 h的鱼作为复苏组。以暂养后的石斑鱼作为对照组、CO2麻醉后的鱼为麻醉组、无水保活10 h为无水保活组。使用注射器尾部静脉取血,将血液注入1.5 mL离心管中,4 ℃静置2~3 h,3 000 r/min离心10 min,取上层血清于离心管中,用于检测。取鱼背肌用于检测。每组4尾鱼。
1.5 游离氨基酸分析
采用日立835-50型高速氨基酸分析仪进行测定。测定条件:离子交换柱规格26 mm × 150 mm,交换树脂型号NO2619(52051),柱温53 ℃,泵流速0.225 mL/min,泵压力8.8 MPa,分析时间72 min,进样体积50 µL。
准确称取鱼肉样品5.00 g,加入15 mL 超纯水后均质,以10 000 r/min 离心10 min,取9 mL上清液,加入1 mL体积分数50%三氯乙酸溶液,用0.5 mol/L NaOH调pH值至2.0,经微孔(孔径0.45 μm)过滤后氨基酸自动析仪检测。
1.6 基本营养成分的测定
三种保活运输模式:CO2麻醉无水保活,采用CO2麻醉后在15 ℃下无水模拟运输;低温休眠有水保活模式[12],采用梯度降温至15 ℃,并在15 ℃下100 g/L的密度有水保活模拟运输10 h;低温有水保活运输模式,采用冰块降温至20 ℃,并在20 ℃条件下50 g/L的密度模拟运输10 h。
水分含量采用水分测定仪测定,粗蛋白质含量采用全自动凯氏定氮仪(GB5009.5-2016)测定,粗脂肪含量采用索氏抽提法(GB5009.6-2016)测定,粗灰分含量采用高温灼烧法(GB5009.4-2016)测定,糖原含量采用蒽酮-硫酸法测定。
1.7 数据处理

2 结果与分析
2.1 CO2水温对麻醉效果与无水保活的影响
通过对不同CO2浓度海水(以水体pH值表示)中珍珠龙石斑鱼的行为观察结果表明,当pH值达到6.5以下时鱼体呈现镇静状态(A2期),pH值达到6.0以下进入麻醉状态(A3期),且不会达到窒息死亡水平(A6期);表3显示,25 ℃水温中鱼体进入麻醉A4期的时间在20 min以内,22、20和15 ℃三个温度组的进入麻醉A4期的时间均在30 min以上。随着麻醉温度的降低,复苏时间延长,仅25 ℃麻醉组复苏时间在5 min内。根据10 min之内麻醉、5 min之内苏醒麻醉浓度标准要求[10],水温25 ℃可作为珍珠龙胆石斑鱼捕捞、运输等操作的有效麻醉温度。
石斑鱼在不同温度的CO2麻醉溶液中麻醉后进行无水保活,存活率随着时间的延长而降低。麻醉温度为15 ℃和18 ℃时,10 h存活率均可达到100%。因此,15 ~ 18 ℃适合作为珍珠龙胆石斑鱼的CO2麻醉温度。综合考虑CO2的麻醉效果与低温应激作用,选择18 ℃作为珍珠龙胆石斑鱼无水保活的CO2麻醉温度。

表3 不同麻醉温度下珍珠龙胆石斑鱼进入麻醉(A4期)与复苏(R4期)的时间及无水保活不同时间的存活率
注:同列标示不同字母表示差异显著(< 0.05)
Note:different letters in the column indicate significant differences among the groups of at< 0.05.
2.2 CO2浓度对无水保活时间和存活率的影响
随着CO2浓度的增加,珍珠龙胆石斑鱼麻醉时间减少。在18 ℃,75 mg/L的CO2溶液中进入麻醉A3期的时间最短(表4),为6 ~ 7 min,无水保活9 h后的存活率仍为100%;125 mg/L与75 mg/L组麻醉时间无显著差异(> 0.05),但125 mg/L组鱼体存活时间延长,10 h后存活率可达到100%。因此,综合考虑麻醉时间、CO2影响及存活时间,选择18 ℃、125 mg/L的CO2溶液进行麻醉。
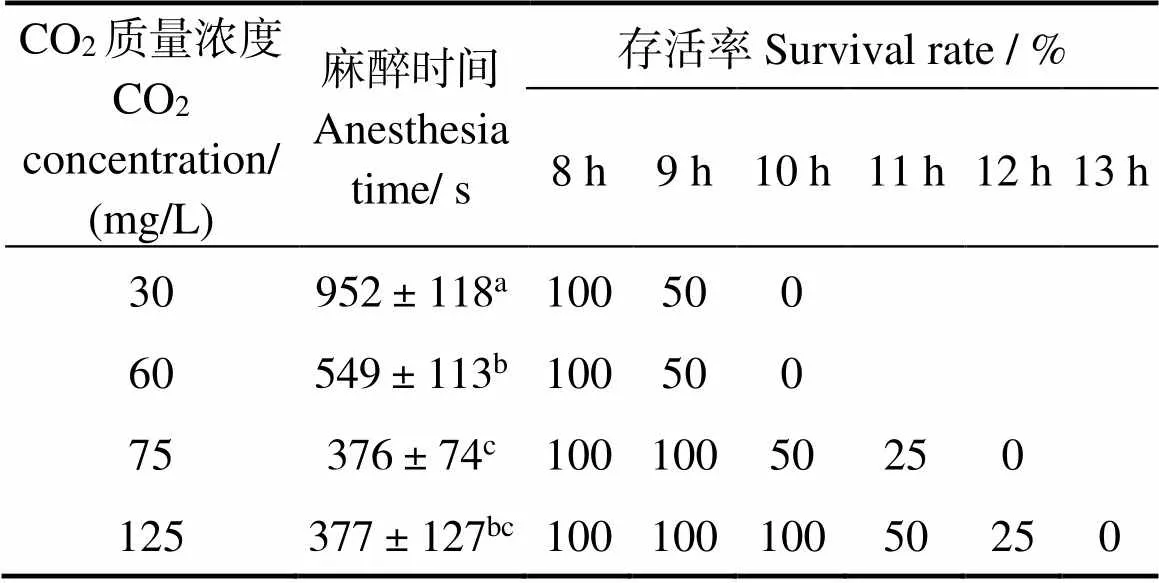
表4 不同CO2质量浓度下珍珠龙胆石斑鱼的麻醉时间和无水保活不同时间的存活率
注:同列标示不同字母表示差异显著(< 0.05)
Note:different letters in the column indicate significant differences among the groups of at< 0.05
2.3 麻醉时间对无水保活时间和存活率的影响
珍珠龙胆石斑鱼在18 ℃、125 mg/L的CO2溶液中麻醉,随着麻醉时间的延长,珍珠龙胆石斑鱼无水保活的存活率降低;麻醉5 min后,无水保活10 h鱼体存活率可达到100%(表5)。

表5 不同麻醉时间下珍珠龙胆石斑鱼的存活率
2.4 无水保活温度对保活时间和存活率的影响
珍珠龙胆石斑鱼经25 ℃暂养48 h,梯度降温至18 ℃后,再将鱼体转移至18 ℃、125 mg/L CO2溶液中麻醉5 min,转移至无水保活箱中进行无水保活。随着保活温度的上升和时间的延长,珍珠龙胆石斑鱼的存活率下降;无水保活温度为15 ℃时,11 h后鱼体存活率达到83%(表6)。
2.5 CO2麻醉无水保活过程中血清生化指标变化
石斑鱼在低温CO2麻醉、无水保活及复苏过程中鱼体代谢变化见表7。CO2麻醉引起血清转氨酶(ALT、AST)和ACP酶活性显著上升(< 0.05);尿素氮水平(BUN)增加32.65%;血糖水平增加59.47%。无水保活10 h后珍珠龙胆石斑鱼血清中血清转氨酶(ALT、AST)和碱性磷酸酶(AKP)酶活性均显著上升(< 0.05);BUN水平增加2倍;血糖水平增加2.36倍。复苏12 h后鱼体血清AKP酶活性显著下降(< 0.05);BUN恢复到对照组水平;血糖是对照组的2.66倍。血清皮质醇水平在CO2麻醉、无水保活与复苏过程中均无显著变化。

表6 不同保活温度下珍珠龙胆石斑鱼的存活率

表7 CO2麻醉无水保活过程对珍珠龙胆石斑鱼血清生化指标影响
注:标示不同字母表示同一行不同组别间差异显著(< 0.05)
Note:different letters in the line indicate significant differences among the groups at< 0.05
2.6 CO2麻醉无水保活对珍珠龙胆石斑鱼游离氨基酸的影响
暂养后的珍珠龙胆石斑鱼经CO2麻醉后、低温无水保活10 h、有水复苏12 h后肌肉中游离氨基酸的含量变化见表8。与对照组相比,CO2麻醉组与无水保活组总游离氨基酸(TAA)、必需氨基酸(EAA)、非必需氨基酸(NEAA)含量均显著增加(< 0.05),TAA分别增加87.2%和77.0%,EAA分别增加43.4%和25.7%,NEAA分别增加119.8%和115.2%。复苏组EAA减少27.8%,TAA和NEAA无显著变化(> 0.05)。
与对照组相比,CO2麻醉组与无水保活组:5种氨基酸(Gly、Lys、Ser、Thr、Ala)含量显著增加(< 0.05)。复苏组Gly含量增加145.8%;8种氨基酸(Ser、Tyr、Asp、Phe、His、Arg、Glu、Met)含量下降31% ~ 60%。
珍珠龙胆石斑鱼经CO2麻醉无水保活运输10 h后,肌肉中鲜味氨基酸(Glu、Asp)与苦味氨基酸(His、Val、Leu、Ile、Phe、Tyr)含量显著下降(< 0.05),而甜味氨基酸(Thr、Gly、Ser、Ala)含量显著增加,比保活前增加2.52倍。有水复苏12 h后,鲜味与苦味氨基酸含量分别下降36.79%和31.53%,甜味氨基酸含量增加43.52%。
2.7 CO2麻醉无水保活对珍珠龙胆石斑鱼营养成分的影响
珍珠龙胆石斑鱼经CO2麻醉无水保活运输10 h后营养成分变化见表9。肌肉水分含量有所下降,粗蛋白和粗脂肪含量分别下降0.34%和6.01%(以干质量计),肌肉中糖原下降5.67%。与低温休眠有水保活运输模式相比,CO2麻醉无水保活运输能使肌肉中糖原的降低量减少4.81%,脂肪消耗量均约为6%;但与目前市场上常用的低温有水保活运输模式相比,CO2麻醉无水保活运输能使肌肉中糖原、脂肪的降低量分别减少60.60%和32.77%(以干质量计),表明CO2麻醉可显著降低保活运输过程中能量物质(肌肉糖原和脂肪)消耗,保证运输后鱼肉品质。

表8 CO2麻醉、无水保活与复苏后的珍珠龙胆石斑鱼肌肉游离氨基酸质量分数的变化(湿基)
注:# 为必需氨基酸;上标不同字母表示同行比较差异显著(< 0.05)
Note: #,, essential amino acids,. Values within a line appended by different letters are significantly different (< 0.05)

表9 不同保活模式对珍珠龙胆石斑鱼基本营养成分质量分数的影响
注:* 与保活前或运输前相比差异显著(< 0.05)
Note: * indicate significantly difference between the before and after of keeping-alive or live transportation(< 0.05)
3 讨论
3.1 CO2对珍珠龙胆石斑鱼的麻醉效果
CO2是一种有效的渔用麻醉剂,在淡水鱼中具有较多的应用,如在鲢鱼的研究中采用了25 ℃时155 mg/L的CO2能起到较好的麻醉效果,且产生的应激程度较一次性充O2方式更低[13]。在海水鱼类中,如白线鳕()、三线矶鲈()、日本竹䇲鱼()和真鲷()等中,CO2可在10 min内诱导鱼体进入麻醉状态,在2min内恢复平衡,麻醉24 h后死亡率 < 5%[10-11,14]。在本实验中,珍珠龙胆石斑鱼在18 ℃、质量浓度125 mg/L的CO2溶液中,能完全进入麻醉状态(A4期),且在5 min内完全恢复,表现出较好的麻醉效果,说明CO2可作为麻醉剂用于鱼类的捕捞、操作与保活运输中。管维良等[13]研究发现,罗非鱼在高氧浓度的CO2水溶液中的保活时间延长60%。
与常用的化学麻醉剂相比,CO2麻醉是一种绿色安全的麻醉剂。然而当CO2浓度过高或在组织中局部累积时,就会造成鱼窒息致死[15]。且水体中溶解CO2会使水体变酸,麻醉时间过长会导致鱼体组织损伤。因此,为了降低CO2的使用浓度,常将CO2与其它方式结合使用,如CO2结合低温麻醉[13]、CO2+MS-222麻醉等。本实验中采用CO2与低温结合,在18 ℃、125 mg/L CO2溶液中麻醉后进行无水保活,与低温休眠无水保活相比,无水保活的时间延长了25%[13,16]。
水温是影响麻醉剂麻醉效果与保活运输的关键因素之一。水温升高,鱼体内新陈代谢活动增加、呼吸频率增加,麻醉剂渗透过腮丝的速率加快。因此,高温下鱼体达到各麻醉阶段的时间较短。本研究发现,在20 ~ 25 ℃水温范围,随着温度上升,CO2麻醉时间减少,复苏时间也相应缩短;而在低于20 ℃水温时,随着温度的降低,麻醉时间减少,复苏时间延长,这是因为低温同样具有镇静作用。在15 ~ 20 ℃水温范围,由于低温与CO2的共同作用,导致麻醉时间减少,这与罗非鱼[6]的CO2麻醉效果相同;同样由于低温作用使鱼体代谢能力下降,在复苏过程需要时间恢复,导致复苏时间会延长。而在高温下,由于鱼体呼吸频率增加,CO2可通过鳃的呼吸作用排出体外,可降低血液中CO2的浓度,从而使复苏时间减少。
3.2 CO2麻醉对无水保活珍珠龙胆石斑鱼应激响应的影响
麻醉剂作为一种应激源,也会引起鱼体的应激响应,皮质醇、血糖、乳酸等应激指标发生变化[17]。与其他化学麻醉剂相比,CO2引起鱼体的应激反应低[18],且应激后能迅速降至麻醉前水平[9]。研究表明,黄尾(Valenciennes)幼鱼在75 mg/L CO2水体中血糖、乳酸等应激指标无显著变化[9]。本研究发现,CO2麻醉、无水保活10 h及复苏后血清皮质醇水平均无显著变化,这与鲢[14]的研究结果一致;但血糖显著上升。表明鱼类在应对急性应激的激素和代谢反应方面存在着重要的物种特异性差异[19-20],珍珠龙胆石斑鱼应对CO2麻醉主要表现在代谢应激响应。
ALT和AST是蛋白质代谢的两种重要转氨酶,是反映细胞膜完整性的重要指标;ACP和AKP水平是反映肝细胞损伤的定量指标。鲈()在MS-222和丁香酚麻醉后ALT、AST和AKP均显著升高[20],与本研究一致。本研究中,珍珠龙胆石斑鱼在有水复苏后,ALT和AST、ACP恢复正常水平,表明CO2麻醉引起的代谢变化是可恢复的。
CO2麻醉与低温休眠无水保活胁迫下珍珠龙胆石斑鱼的BUN均显著上升,表明其肾脏功能障碍或部分受损,这与罗非鱼、鲢的研究结果一致[6, 14];有水复苏后BUN能恢复到正常水平,这表明鱼体在新鲜海水中,吸收频率能恢复正常,且鱼体血中CO2水平下降,有氧代谢恢复。
氨基酸在石斑鱼应对低温胁迫的能量代谢响应中起着重要作用[21-24]。在本研究中,石斑鱼在低温CO2麻醉与低温休眠无水保活胁迫下TFAA、EAA均显著上升,这与低温休眠应激响应一致[16]。鱼体经CO2麻醉与无水保活胁迫10 h后,能量消耗减少。其中甘氨酸(Gly)是内源性抗氧化剂还原性谷胱甘肽的组成氨基酸,CO2麻醉、无水保活与有水复苏组珍珠龙胆石斑鱼Gly含量分别增加5.5、5.5和1.5倍,表明Gly在体内抗氧化应激中发挥重要作用。Ser和Thr可提高鱼体低温下的抗冻性[23]。Lys、Ala和Ser水平的增加表明鱼体在缺氧条件下糖异生作用增强[21],合成的葡萄糖,使血糖水平上升。Arg参与动物肝脏和肌肉葡萄糖摄取和氧化以及脂肪酸氧化,Lys和Met是合成L-肉碱的底物,在鱼类中将长链脂肪酸运输到氧化点所必需的[22],有水复苏后珍珠龙胆石斑鱼恢复有氧代谢,能量动员增加,肌肉中Arg、Met和Lys水平的下降,可能与葡萄糖和脂肪酸的氧化供能有关。
3.3 CO2麻醉对无水保活珍珠龙胆石斑鱼营养品质的影响
CO2麻醉无水保活珍珠龙胆石斑鱼10 h后肌肉中营养物质的变化主要是脂肪与糖原下降,表明此过程中脂肪与糖原是主要的能量物质,与其他鱼体的应激响应一致[25-26]。但与低温休眠保活相比,CO2麻醉能降低能量物质的消耗,保证保活后的鱼肉品质,这也是CO2麻醉能延长珍珠龙胆石斑鱼无水保活时间的原因之一。在虾夷扇贝无水运输过程中,呈味化合物中Gly、Arg、Ala与Glu作为影响扇贝风味的重要化合物使得要扇贝流通过程中鲜味和甜味下降[27],在石斑鱼的保活运输后,鲜味与苦味氨基酸含量显著下降,而甜味氨基酸的含量显著增加,这表明石斑鱼保活流通过程中风味的变化是多种风味化合物共同作用的结果,有待进一步探讨。
4 结论
本研究采用绿色安全的CO2对珍珠龙胆石斑鱼进行麻醉预处理,结果表明CO2用于麻醉珍珠龙胆石斑鱼是有效可行的,CO2协同低温麻醉预处理后的珍珠龙胆石斑鱼在低温下无水保活11 h的存活率可达到83.3%,有水复苏后甜味氨基酸含量增加,保活效果优于低温休眠无水保活模式。CO2对无水保活珍珠龙胆石斑鱼的应激响应主要表现在能量代谢响应方面,且在有水复苏后鱼体代谢酶活性能恢复正常水平。
[1] RIMMER M A, GLAMUZINA B. A review of grouper (Family Serranidae: Subfamily Epinephelinae) aquaculture from a sustainability science perspective[J]. Reviews in Aquaculture, 2019, 11(1): 58-87.
[2] 张涛, 吴燕燕, 林婉玲. 石斑鱼的营养、保鲜与加工技术现状[J]. 食品工业科技, 2018, 39(8): 324-329.
[3] 刘骁, 谢晶, 黄硕琳. 鱼类保活运输的研究进展[J]. 食品与发酵工业, 2015, 41(8): 255-260.
[4] MITSUDA H, UENO S, MIZUNO H, et al. Levels of CO2in arterial blood of carp under carbon dioxide anesthesia[J]. Journal of Nutritional Science and Vitaminology, 1982, 28(1): 35-39.
[5] MITSUDA H, ISHIDA Y, YOSHIKAWA H, et al. Effects of a high concentration of CO2on electrocardiograms in the carp,[J]. Comparative Biochemistry and Physiology Part A: Physiology, 1988, 91(4): 749-757.
[6] 周翠平, 白洋, 秦小明, 等. CO2麻醉技术在罗非鱼无水保活运输中的应用研究[J]. 渔业现代化, 2014, 41(4): 21-25.
[7] YOKOYAMA Y, YOSHIKAWA H, UENO S, et al. Application of CO2-anesthesia combined with low temperature for long-term anesthesia in carp[J]. Nippon Suisan Gakkaishi, 1989, 55(7): 1203-1209.
[8] ERIKSON U, HULTMANN L, ERIK STEEN J. Live chilling of Atlantic salmon () combined with mild carbon dioxide anaesthesia: I. Establishing a method for large-scale processing of farmed fish[J]. Aquaculture, 2006, 252(2/3/4): 183-198.
[9] MORAN D M, WELLS R M G, PETHER S J. Low stress response exhibited by juvenile yellowtail kingfish (Valenciennes) exposed to hypercapnic conditions associated with transportation[J]. Aquaculture Research, 2008, 39(13): 1399-1407.
[10] OBERG E W, PEREZ K O, FUIMAN L A. Carbon dioxide is an effective anesthetic for multiple marine fish species[J]. Fisheries Research, 2015, 165: 22-27.
[11] KUGINO K, TAMARU S, HISATOMI Y, et al. Long-duration carbon dioxide anesthesia of fish using ultra fine (nano-scale) bubbles[J]. PLoS One, 2016, 11(4): e0153542.
[12] 范秀萍, 秦小明, 章超桦, 等. 温度对有水保活石斑鱼代谢与鱼肉品质的影响[J]. 农业工程学报, 2018, 34(14): 241-248.
[13] GUAN W L, ZHAO M M, LIU T T, et al. Cooling combined with hyperoxic CO2anesthesia is effective in improving the air exposure duration of tilapia[J]. Scientific Reports, 2017, 7: 14016.
[14] 胡鑫, 丁晨雨, 叶勤, 等. CO2麻醉对鲢生理生化指标及神经调控相关基因表达的影响[J]. 淡水渔业, 2020, 50(1): 9-14.
[15] TANG S, THORARENSEN H, BRAUNER C J, et al. Modeling the accumulation of CO2during high density, re-circulating transport of adult Atlantic salmon, Salmo salar, from observations aboard a sea-going commercial live-haul vessel[J]. Aquaculture, 2009, 296(1/2): 102-109.
[16] FAN X, QIN X, ZHANG C, et al. Metabolic and anti-oxidative stress responses to low temperatures during the waterless preservation of the hybrid grouper (♀ ×♂) [J]. Aquaculture, 2019, 508:10-18.
[17] PARK M O, HUR W J, IM S Y, et al. Anaesthetic efficacy and physiological responses to clove oil-anaesthetized kelp grouper[J]. Aquaculture Research, 2008, 39(8): 877-884.
[18] PIRHONEN J, SCHRECK C B. Effects of anaesthesia with MS-222, clove oil and CO2on feed intake and plasma cortisol in steelhead trout ()[J]. Aquaculture, 2003, 220(1/2/3/4): 507-514.
[19] SAMARAS A, PAPANDROULAKIS N, COSTARI M, et al. Stress and metabolic indicators in a relatively high (European sea bass,) and a low (meagre,) cortisol responsive species, in different water temperatures[J]. Aquaculture Research, 2016, 47(11): 3501-3515.
[20] WANG W H, DONG H B, SUN Y X, et al. The efficacy of eugenol and tricaine methanesulphonate as anaesthetics for juvenile Chinese sea bass () during simulated transport[J]. Journal of Applied Ichthyology, 2019, 35(2): 551-557.
[21] KARANOVA M V. Impact of seasonal temperature decrease and cold shock on the composition of free amino acids and phosphomonoethers in various organs of Amur sleeper percottus glenii (Eleotridae)[J]. Journal of Ichthyology, 2018, 58(4): 570-579.
[22] COSTAS B, CONCEIÇÃO L E C, ARAGÃO C, et al. Physiological responses of Senegalese sole (Kaup, 1858) after stress challenge: Effects on non-specific immune parameters, plasma free amino acids and energy metabolism[J]. Aquaculture, 2011, 316(1/2/3/4): 68-76.
[23] COSTAS B, ARAGÃO C, RUIZ-JARABO I, et al. Different environmental temperatures affect amino acid metabolism in the eurytherm teleost Senegalese sole (Kaup, 1858) as indicated by changes in plasma metabolites[J]. Amino Acids, 2012, 43(1): 327-335.
[24] KARANOVA M V, ANDREEV A A. Free amino acids and reducing sugars in the freshwater shrimp(Crustacea, Amphipoda) at the initial stage of preparation to winter season[J]. Journal of Evolutionary Biochemistry and Physiology, 2010, 46(4): 335-340.
[25] 王利娟, 程守坤, 张饮江, 等. 水温对加州鲈鱼保活运输的影响[J]. 渔业现代化, 2014, 41(2): 23-27; 37.
[26] LU D L, MA Q, WANG J, et al. Fasting enhances cold resistance in fish through stimulating lipid catabolism and autophagy [J]. The Journal of physiology, 2019, 597(6): 1585-603.
[27] 闫丽新, 田元勇, 姜明慧, 等.无水运输—湿藏销售中虾夷扇贝活力和呈味特性变化[J]. 水产科学: 1-16[2021-06-08]. https://doi.org/10.16378/j.cnki.1003- 1111. 20207
Effect of CO2Anesthesia on Water-free Live-transport of the Grouper (♀×)
FAN Xiu-ping1,2, ZHANG Jia-sheng1, GUO Qiao-yu1, DU Huan1, QIN Xiao-ming1,2, LIU Shu-cheng1,2
(1.,//////,524088,;2.,524025,)
【】The anesthesia effect of carbon dioxide (CO2) on water-free transport of grouper (♀×♂).【】The effects of temperature, CO2concentration, anesthesia time and keeping-alive temperature on the water-free live transport alive without water after CO2anesthesia were investigated by the indexes of anesthesia time, recovery time, the live time without water and survival rate of grouper. Fish serum biochemical, free amino acids and basic nutrients during keeping-alive without water after CO2anesthesia were also analyzed.【】After the groupers were acclimated in 25 ℃ fresh marine water for 24 h , gradient cooled to 18 ℃, transferred to 18 ℃, 125 mg/L CO2solution (pH 5.8) for 5 min, then preserved at 15 ℃ without water. The survival rate reached 83.3% after 11 h. The metabolism of grouper changed during low temperature CO2anesthesia and live preservation. Enzyme activities of glutamic-pyruvic transaminase (AST), glutamic-oxalacetic transaminase (ALT) and urea nitrogen (BUN) content were increased significantly (< 0.05), then returned to normal level after recovery in fresh seawater. However, the animals showed a typical "hyperglycemia" symptom during anesthesia, low-temperature preservation and recovery. After CO2anesthesia, combined with low-temperature and water-free survival stress, grouper showed the stress response of energy metabolism, mainly anaerobic respiration. Moreover, fats and glycogen were used as the main energy substances. The umami and bitter amino acid contents decreased significantly (< 0.05), and the sweet amino acid content increased by 43.52%. The nutritional quality of fish is better than that by keeping with water after low-temperature hibernation. 【】 CO2has a good anesthetic effect on grouper (×♂). CO2anesthesia and keeping alive under low-temperature technology, can be used for the water-free transportation of grouper.
carbon dioxide anesthesia;×; keep-alive without water; serum biochemistry; metabolism; free amino acid
S981.1
A
1673-9159(2021)06-0073-09
10.3969/j.issn.1673-9159.2021.06.009
范秀萍,张家胜,郭侨玉,等. 珍珠龙胆石斑鱼CO2麻醉无水保活效果的因素影响[J]. 广东海洋大学学报,2021,41(6):73-81.
2021-05-07
“十三五”国家重点研发计划重点专项项目(2019YFD0901601);南方海洋科学与工程广东省实验室(湛江)资助项目(ZJW-2019-06);广东海洋大学科研启动经费资助项目(060302042101);广东海洋大学创新团队项目(CXTD2021006);广东省大学生创新创业训练计划项目(S201910566059)。
范秀萍(1979―),女,博士,副教授,研究方向为水产品保活流通与加工。E-mail:fanxp08@163.com
(责任编辑:刘朏)
