Notch通路调控KLF4在糖尿病肾病进展中的作用#
2021-12-22王晓梅姚敏修小斐王雅琪陈婷婷高峰
王晓梅 姚敏 修小斐 王雅琪 陈婷婷 高峰△
(1. 河北医科大学第三医院病理科,河北 石家庄 050051;2. 河北医科大学生物化学研究室,河北 石家庄 050017)
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病的常见并发症,是引起终末期肾功能衰竭的主要原因之一。探讨其发病机制、寻求有效的防治措施对广大糖尿病肾病患者具有重要意义。Notch通路在糖尿病肾病足细胞损伤中的作用机制已被证实[1]。Notch受体在γ-分泌酶的介导下释放Notch胞内域(Notch intracellular domain,NICD)发挥生物学作用。Krüppel样因子4(Krüppel-like factor 4,KLF4)是KLFs家族成员之一,是一种真核锌指蛋白转录因子,通过激活或抑制其目的基因的转录,参与调节细胞的多种生物过程[2,3]。近年来,KLF4在蛋白尿性肾小球疾病中的作用也逐渐被关注,但Notch通路在糖尿病肾病进展过程中是否存在对KLF4表达的调控,还未被证实。
本研究在糖尿病小鼠肾组织中检测Notch通路和KLF4的表达情况,并通过抑制Notch通路观察对KLF4及足细胞特异蛋白Nephrin表达的影响,进而探讨糖尿病肾病损伤机制,为DN的防治提供依据。
1 材料与方法
1.1 材料
8周龄雄性作为糖尿病模型的db/db小鼠和对照组的db/m小鼠均购自南京大学模型动物研究所。γ-分泌酶抑制剂DAPT 购自Sigma公司。兔抗Notch1和NICD1多克隆抗体购自Cell signaling公司。兔抗KLF4多克隆抗体购自Proteintech公司。兔抗Nephrin多克隆抗体购自Abcam公司。小鼠抗β-actin多克隆抗体购自Santa Cruz公司。组织RNA提取试剂盒购自Promega公司。Real-time PCR试剂盒购自Takara公司。
1.2 动物模型与分组
选取db/db小鼠作为糖尿病小鼠模型,将糖尿病小鼠分为两组(n=6),分别为db/db组和db/db+DAPT组。db/db+DAPT组小鼠于第9 w开始每日腹腔注射一次溶于二甲基亚砜(Dimethyl sulfoxide,DMSO)的DAPT10 mg•kg-1,db/db组小鼠每日腹腔注射一次等体积的DMSO,连续给药8 w。另选8周龄雄性db/m小鼠作为对照(n=6)。于第16 w每组取6只小鼠代谢笼收集24 h尿,股动脉取血,用于生化指标检测,取左肾组织4%中性甲醛固定用于免疫组化检测,取右肾脏皮质放入液氮中,-80°C保存,用于Western blot和Real-time PCR检测。
1.3 免疫组化检测Nephrin蛋白表达
将石蜡切片脱蜡至水,3%H2O2甲醇溶液阻断内源性过氧化物酶,微波热处理修复抗原,正常小牛血清封闭非特异性抗原,然后分别加入Nephrin(1:50)抗体,4°C孵育过夜。分别加入生物素化二抗和链霉菌抗生物素蛋白-过氧化物酶在37°C孵育30 min。滴加二氨基联苯胺(Diaminobenzidine,DAB)显色液,用苏木精复染后,将切片脱水并封固。磷酸盐缓冲液(Phosphate buffer saline,PBS)代替一抗,做阴性对照。
1.4 Western blot检测Notch1、NICD1、KLF4、Nephrin蛋白表达
采用RIPA裂解液含1×PBS,1%乙基苯基聚乙二醇(Nonidet P 40,NP-40),0.5%去氧胆酸钠,0.1%十二烷基硫代硫酸钠(Sodium dodecyl sulfate,SDS),用前加苯甲基磺酰氟(Phenylmethylsulfonyl fluoride,PMSF)0.1g•L-1)提取肾组织蛋白,用考马斯亮蓝法测定蛋白浓度,每孔加100 μg总蛋白,经10%SDS-PAGE凝胶电泳后电转移至PVDF膜;5%脱脂奶粉37°C封闭1 h,分别加入兔抗Notch1(1:200)、NICD1(1:500)、KLF4(1:500)、Nephrin(1:500)多克隆抗体和小鼠抗β-actin(1:1000)多克隆抗体4°C过夜。辣根过氧化物酶标记二抗室温孵育2 h;滴加ECL发光试剂后进行拍照。用美国UVP公司LabWorks 4.5软件对条带进行定量分析,目的蛋白与β-actin光密度值表示其相对表达量。
1.5 Real-time PCR检测Notch1、KLF4、Nephrin mRNA表达
应用组织RNA提取试剂盒提取组织总RNA,反转录反应体系总体积为20 μL,按照反转录说明书合成cDNA。
引物分别为:Notch1(118 bp),上游5’- GTG GAT GAC CTA GGC AAG TCG-3’,下游:5’-GTC TCC TCC TTG TTG TTC TGC A-3’;KLF4(243 bp),上游5’-TTC CAA CTC GCT AAC CCA CC-3’,下游5’-TTG ATG TCC GCC AGG TTG AA-3’;Nephrin(190 bp),上游5’-GCT CAG GGA AGA CAG CAA CA-3’,下游5’-GAT AGA GCC CAG AAG CCT CG-3’;18S(151 bp),上游5’-GTA ACC CGT TGA ACC CCA TT-3’,下游5’-CCA TCC AAT CGG TAG TAG CG-3’;所有引物均由北京奥科公司合成。Real-time PCR反应体系总体积为50 μL,扩增条件为94°C预变性2 min,94°C变性25 s,60°C退火30 s,40个循环结束。由PCR反应曲线得到Ct值,18S mRNA作为内参,用2△△Ct法分析基因的相对表达。
1.6 统计学处理
采用SPSS 17.0软件进行统计学处理分析,数据用均数±标准差(SSD)表示,进行方差分析,P<0.05为差异有显著性意义。
2 结果
2.1 生化指标
与db/m组小鼠相比,db/db组小鼠血糖、尿蛋白和尿素氮明显升高(P<0.01);在db/db组小鼠给予DAPT后,尿蛋白和尿素氮明显下降(P<0.01),但血糖在db/db组和db/db+DAPT组无明显差异(P>0.05),见表1。
表1 小鼠血糖、尿蛋白、尿素氮比较(±SD,n=6)
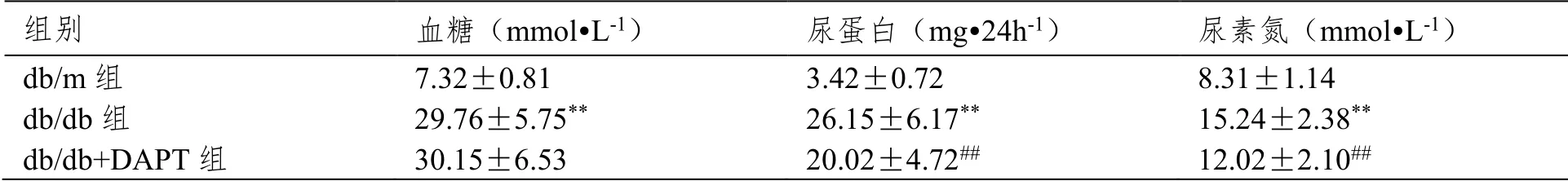
表1 小鼠血糖、尿蛋白、尿素氮比较(±SD,n=6)
注:与db/m组比较,**P<0.01;与db/db组比较,##P<0.01。
组别 血糖(mmol•L-1) 尿蛋白(mg•24h-1) 尿素氮(mmol•L-1) db/m组 7.32±0.81 3.42±0.72 8.31±1.14 db/db组 29.76±5.75** 26.15±6.17** 15.24±2.38** db/db+DAPT组 30.15±6.53 20.02±4.72## 12.02±2.10##
2.2 抑制Notch通路对KLF4和Nephrin蛋白表达的影响
免疫组化显示Nephrin在肾组织肾小球细胞浆表达,db/db组小鼠Nephrin表达强度低于db/m组小鼠,DAPT能增加糖尿病小鼠Nephrin蛋白的表达,见图1。Western blot检测显示db/db组与db/m组小鼠肾组织相比Notch1和NICD1蛋白表达增加(P<0.01),应用DAPT不能抑制糖尿病小鼠Notch1蛋白表达的增高(P>0.05),但可抑制NICD1蛋白表达(P<0.01);糖尿病小鼠肾组织KLF4和Nephrin蛋白表达与db/m组相比明显降低,在给予DAPT抑制Notch通路活化后,KLF4和Nephrin蛋白表达有所增加(P<0.05或P<0.01),见图2、表2。
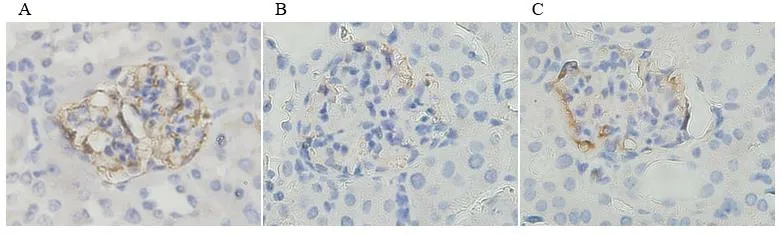
图1 免疫组化检测Nephrin蛋白表达(×400)
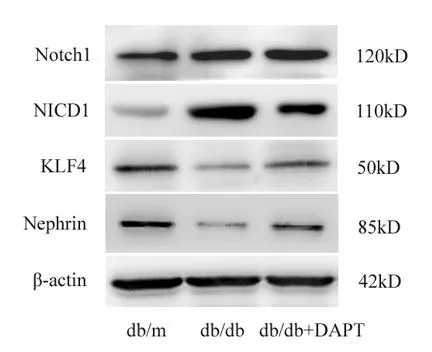
图2 Western blot检测Notch1、NICD1、KLF4和Nephrin蛋白表达
表2 Western blot检测Notch1、NICD1、KLF4和Nephrin蛋白表达(±SD,n=6)

表2 Western blot检测Notch1、NICD1、KLF4和Nephrin蛋白表达(±SD,n=6)
注:与db/m组比较,**P<0.01;与db/db组比较,#P<0.05,##P<0.01。
组别 Notch1 NICD1 KLF4 Nephrin db/m组 0.43±0.03 0.12±0.00 0.23±0.02 0.23±0.03 db/db组 0.65±0.08** 0.92±0.19** 0.09±0.00** 0.08±0.00** db/db+DAPT组 0.69±0.09 0.60±0.11## 0.15±0.00# 0.13±0.01#
2.3 抑制Notch通路对KLF4和Nephrin mRNA表达的影响
Real-time PCR检测显示Notch1 mRNA在db/db组小鼠肾组织高于db/m组(P<0.01),在db/db组和db/db+DAPT组Notch1 mRNA表达无明显差异(P>0.05);KLF4和Nephrin mRNA在db/db组比db/m组明显降低,给予DAPT后KLF4和Nephrin mRNA表达增加(P<0.01),见表3。
表3 Real-time PCR检测Notch1、KLF4和Nephrin mRNA表达(±SD,n=6)
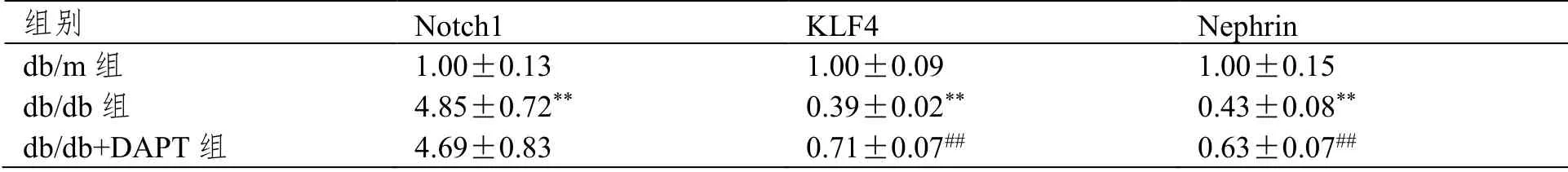
表3 Real-time PCR检测Notch1、KLF4和Nephrin mRNA表达(±SD,n=6)
注:与db/m组比较,**P<0.01;与db/db组比较,##P<0.01。
组别 Notch1 KLF4 Nephrin db/m组 1.00±0.13 1.00±0.09 1.00±0.15 db/db组 4.85±0.72** 0.39±0.02** 0.43±0.08** db/db+DAPT组 4.69±0.83 0.71±0.07## 0.63±0.07##
3 讨论
足细胞的正常结构和功能是维持肾小球蛋白质滤过屏障完整性的重要组成部分。Nephrin属于1型跨膜蛋白,它通过nephrin-nephrin或nephrin-Neph-1相互作用,起到桥接相邻足突的作用,是裂孔(Slit diaphragm,SD)蛋白复合体的中心分子。DN发生时,细胞骨架发生改变,SD蛋白复合体结构破坏,Nephrin表达降低[4]。本研究结果也证实在糖尿病小鼠肾组织Nephrin蛋白及mRNA表达降低。
Notch通路是一种在进化相对保守的广泛存在于细胞间的信号传导通路[5]。Notch信号由受体与配体相互作用而激活,配体诱导Notch受体发生构象改变,先在细胞外金属蛋白酶的作用下发生水解,随后又在γ-分泌酶的介导下释放NICD[6]。DAPT作为γ-分泌酶抑制剂只影响NICD1的生成,而对糖尿病小鼠Notch1蛋白及mRNA表达的升高无影响。NICD是Notch通路的活化形式,其进入细胞核,影响细胞分化、增殖和凋亡。在糖尿病小鼠模型及高糖培养的足细胞中Notch通路存在活化,造成Nephrin表达减少,蛋白尿增加,细胞外基质生成增多。KLF4是KLFs家族成员之一。Hayashi等[7]研究发现,在阿霉素(Adriamycin,ADM)诱导的肾病小鼠中,KLF4在肾小球足细胞中的表达显著降低,并且蛋白尿水平显著升高,当在肾病小鼠足细胞中增加KLF4的表达可以降低蛋白尿。在糖尿病小鼠肾组织KLF4的表达明显下调,伴随着Nephrin表达下降,蛋白尿增加。
已有研究证实,Notch通路抑制KLF4表达促进肝组织纤维化,运用DAPT抑制Notch通路活化后KLF4蛋白表达增加[8]。在人膀胱癌细胞中抑制Notch1表达后,KLF4表达也增加,癌细胞生长和增殖被抑制,促进肿瘤细胞阻滞于G0/G1期,细胞凋亡增加[9]。Notch通路通过调节KLF4表达促进肿瘤细胞转分化,同时KLF4的缺失可改变肿瘤血管的表型,增加肿瘤转移的几率[10]。本实验发现在在糖尿病小鼠肾组织Notch1和NICD1表达增加,存在Notch通路的激活。应用DAPT抑制Notch通路激活后,能缓解糖尿病小鼠肾组织KLF4表达的降低,进而增加Nephrin表达,改善肾脏功能,减轻蛋白尿和尿素氮。结果提示在糖尿病小鼠肾组织中,Notch通路可调控KLF4和Nephrin表达,参与糖尿病肾病进展过程。已有研究发现,Notch通路和KLF4在肾脏发育过程中共同参与调节特定节段肾单位和单个细胞的分化[11]。 在糖尿病肾病足细胞损伤过程中,Notch通路和KLF4可能协同调控足细胞固有蛋白表达。
