马铃薯品种‘并薯6号’遗传转化体系的建立
2021-12-21宋倩娜霍利光王慧杰冯瑞云
宋倩娜,梅 超,霍利光,王慧杰,冯瑞云
(山西农业大学农学院/作物遗传与分子改良山西省重点实验室,山西 太原 030031)
马铃薯(Solanum tuberosum L.)为茄科茄属一年生同源四倍体草本植株,是中国继小麦、玉米和水稻后的第四大粮食作物[1]。马铃薯营养丰富、适应性强、产量高、生育期短、经济效益高等特点使其成为重要的粮食作物,也是工业加工各种产品的原料[2]。近年来,随着粮食问题日益地严峻,马铃薯产业成为了中国粮食安全战略中不可或缺的一部分。马铃薯的产量、品质是影响中国马铃薯产业的最根本问题,只有积极的开展种质资源创新和新品种选育才能逐步解决这些问题[3]。目前马铃薯品种改良的主要手段包括传统育种和植物基因工程育种。
马铃薯基因型复杂、自交衰退性等特点导致传统育种周期长和效率低[4]。而植物基因工程育种手段则可以大大的缩短育种周期、提高育种效率[5,6]。农杆菌介导的遗传转化是植物基因工程育种中的必要环节。近几年来,人们利用此方法将外源优良基因转入到马铃薯内进行抗性及品质的改良并取得了一定的进展[7]。但是,根癌农杆菌介导的马铃薯遗传转化受到各种因素的影响,如基因型[8-10]、外植体类型[11,12]、培养基成分和培养条件[13]、农杆菌类型及浓度、农杆菌与外植体的共培养时间及农杆菌侵染时间[14]等。虽然许多马铃薯品种的遗传转化体系已经建立,但是这些体系是相对独立的,不同的体系适合不同的品种。
马铃薯‘并薯6 号’是由山西农业大学农学院(山西省农业科学院作物科学研究所)选育而成的品种,其具有生长势强、抗病性强、抗旱性强、产量高等优点,但是也存在芽眼较深等缺点。因此,‘并薯6 号’的改良对山西省马铃薯产业发展具有重要的意义。本研究以‘并薯6 号’为研究材料,通过对遗传转化和再生过程中的外植体培养、植物激素的种类及配比、抑菌剂的种类及浓度和筛选剂的浓度进行研究,建立‘并薯6 号’的农杆菌介导的遗传转化及再生体系,为马铃薯基因功能的验证和品质改良提供一定的理论基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料
试验以马铃薯品种‘并薯6 号’的无菌试管苗为材料。无菌试管苗由本研究单位提供,由本课题组植物组织培养间培养并保存。
1.1.2 农杆菌菌株及植物表达载体
农杆菌类型为根癌农杆菌(Agrobacterium tumefaciens),菌株为GV3101。农杆菌中含有的植物表达载体为基因过表达载体pMDC85,此载体上携带有潮霉素抗性基因Hyg(图1),并由本课题组保存。

图1 pMDC85载体图Figure 1 pMDC85 vector
1.1.3 培养基及其成分
目前,关于马铃薯愈伤组织诱导及再生所用的激素主要包括生长素类(IAA、NAA 和2,4-D)、细胞分裂素类(6-BA 和 ZT)以及 GA3等[15,16]。以已发表的研究报道为基础,设计了以下的试验。本试验所用的基本培养基为MS(Murashige & Skoog Medium),各种培养基的命名以及包含的成分见表1。

表1 培养基成分Table 1 Medium components
1.2 试验方法及培养条件
1.2.1 无菌试管苗的扩繁
剪取带有一个或者两个腋芽的‘并薯6 号’的茎段作为外植体,将其形态学下端插入到MS 固体培养基(4.43 g/L MS 粉末、30 g/L 蔗糖和 7 g/L 琼脂,pH 5.8),每个350 mL 培养瓶中插入的茎段数为8 个。将培养瓶置于组织培养间内进行培养,培养条件为光照强度2 000 lx,温度(25 ± 2)℃,光照周期为16 h/8 h(光照/黑暗)。待苗龄为4 周后,按照上述相同的方法和培养条件继续进行扩繁培养。
1.2.2 农杆菌菌液的制备
挑取含有pMDC85 质粒的GV3101 农杆菌单菌落,接种于含有50 g/L 卡那霉素和50 g/L 利福平的LB 液体培养基中(10 g/L 胰蛋白胨、5 g/L 酵母提取物和5 g/L 氯化钠,pH 7.4),置于摇床内,28℃,220 r/min,黑暗条件下过夜培养至生长对数期。将培养好的农杆菌菌液于3 000 r/min 离心10 min,弃掉上清液。用MS 液体培养基(4.43 g/L MS 粉末和30 g/L 蔗糖,pH 5.8)重悬农杆菌沉淀物,并稀释至浓度为OD600=0.6,用于后续外植体的浸染。
1.2.3 外植体的预培养
以生长周期约为4周的无菌苗为对象,剪取不带有腋芽的、长度约为1 cm的茎段为外植体,置于预培养培养基上进行预培养(表1)。培养条件与上述相同,预培养时间设置为0,1,2,3和4 d。每组预培养试验的茎段数为20个/培养皿,3次重复。
1.2.4 外植体的浸染及共培养
收集预培养处理后的茎段外植体,将其置于提前准备好的农杆菌菌液中浸泡10 min,在此期间轻柔的摇晃混匀几次,使外植体与农杆菌菌液充分接触。浸染结束后,将外植体转移至多层无菌滤纸上,吸干多余农杆菌菌液。将外植体以平铺方式接种到共培养培养基上进行共培养(表1),黑暗条件下,28℃共培养2 d。
1.2.5 外植体愈伤组织诱导培养基的筛选
将共培养后的外植体茎段转移到不同的愈伤组织诱导培养基上。以MS 培养基为基础培养基,激素组合有6-BA、NAA、2,4-D、KT 和GA3。将不同的激素种类及配比进行组合,共设计了4 种培养基,分别为CIM1、CIM2、CIM3 和CIM4(表2)。每组试验的茎段数为20 个/培养皿,3 次重复。培养条件同上述的试管苗扩繁,4 周之后统计愈伤组织形成率。愈伤组织形成率(%)=(愈伤组织形成数/外植体总数)×100。确定愈伤组织诱导的最佳培养基配方以CIM 命名。

表2 5种激素配比对愈伤组织诱导影响的试验(mg/L)Table 2 Tests on ratios of five phytohormones for callus induction
1.2.6 愈伤组织分化培养基的筛选
将上述不同愈伤组织诱导培养基中的茎段再次分别转移到愈伤组织分化培养基上。以MS 培养基为基础培养基,激素组合有6-BA、ZT 和GA3。将不同的激素种类及配比进行组合,共设计了2 种培养基,分别为SIM1 和SIM2(表3)。每组试验的茎段数为20 个/培养皿,3 次重复。培养条件同上述的试管苗扩繁,6 周之后统计出芽率。出芽率(%)=(再生芽数/愈伤组织总数)×100。确定愈伤组织分化的最佳培养基配方以SIM命名。

表3 3种激素配比对愈伤组织分化出芽影响的试验(mg/L)Table 3 Tests on ratios of three phytohormones for shoot induction
1.2.7 愈伤组织诱导和芽分化抗生素的筛选
将共培养2 d 后的外植体茎段置于愈伤组织诱导培养基上,待愈伤组织形成后转移至含有不同浓度潮霉素(0,5,10,15,30 和40 mg/L)的SIM1 培养基上诱导愈伤组织,每两周更换一次培养基直至出芽,每组试验的茎段数为20 个/培养皿,3 次重复。培养条件同上述的试管苗扩繁,统计出苗率。出苗率(%)=(再生植株数/愈伤组织总数)×100。
1.2.8 生根培养时抗生素浓度的筛选
将未转化的含有腋芽的马铃薯外植体扦插到含有不同浓度潮霉素(0,5,10,15,30 和40 mg/L)的RIM 培养基中进行生根处理,每个培养瓶中放入10 株,3 次重复。培养条件同上述的试管苗扩繁,大约3 周之后统计生根率。生根率(%)=(生根外植体数/外植体总数)×100。
1.2.9 最佳抑菌抗生素种类及浓度的筛选
将共培养2 d 后的外植体茎段置于含有不同抗生素种类及浓度的CIM3 培养基上进行愈伤组织的诱导。抗生素的种类包括头孢霉素(Cefotaxime,Cef)和特美汀(Timentin, TMT),浓度分别为0,100,200和300 mg/L。每组试验的茎段数为20个/培养皿,3 次重复。培养条件同上述的试管苗扩繁,15 d后统计观察抑菌情况及愈伤组织生长状态。
1.2.10 转化再生植株的PCR检测
采用CTAB 法提取再生马铃薯植株叶片的基因组DNA。以载体上的序列及基因组上的序列为基 础 设 计 引 物 序 列 F: 5′-AGGTGGCTCCTACAAATGCCACT-3′;R:5′-GTGTCACTGATGAGAAGCCAAAATGACCTTTC-3′,PCR 扩 增 产 物 的 大小为1 000 bp。PCR 扩增的反应程序为:95℃预变性3 min;95℃变性30 s,60℃退火30 s;72℃延伸30 s,35 个循环;72℃延伸 10 min。PCR 产物用1.2%琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 最佳预培养时间的确定
为了探究‘并薯6 号’的最佳预培养时间,共设置了5 个预培养的时间梯度,分别为0,1,2,3 和 4 d。用 OD 值为 0.6 的农杆菌菌液浸染 10 min,共培养2 d 后置于愈伤组织诱导培养基上,培养5周后观察愈伤组织的生长状态,并统计愈伤组织形成率。然后将上述的愈伤组织转移到愈伤组织分化培养基上,大约7 周后统计出苗率及转化频率。结果表明,不同预培养时间对外植体形成愈伤组织存在一定的差异。未经过预培养的外植体易发生白化或褐化最后死亡的现象,很难形成愈伤组织。经过预培养后的外植体都可以形成愈伤组织。其中预培养2 d 外植体的愈伤组织形成率、出苗率及转化频率均最高,预培养3 和2 d 外植体的愈伤组织形成率和出苗率差异不大,转化频率次之。而预培养1 和4 d 外植体的愈伤组织形成率、出苗率及转化频率较低(表4)。因此,最佳的预培养时间为2 d。
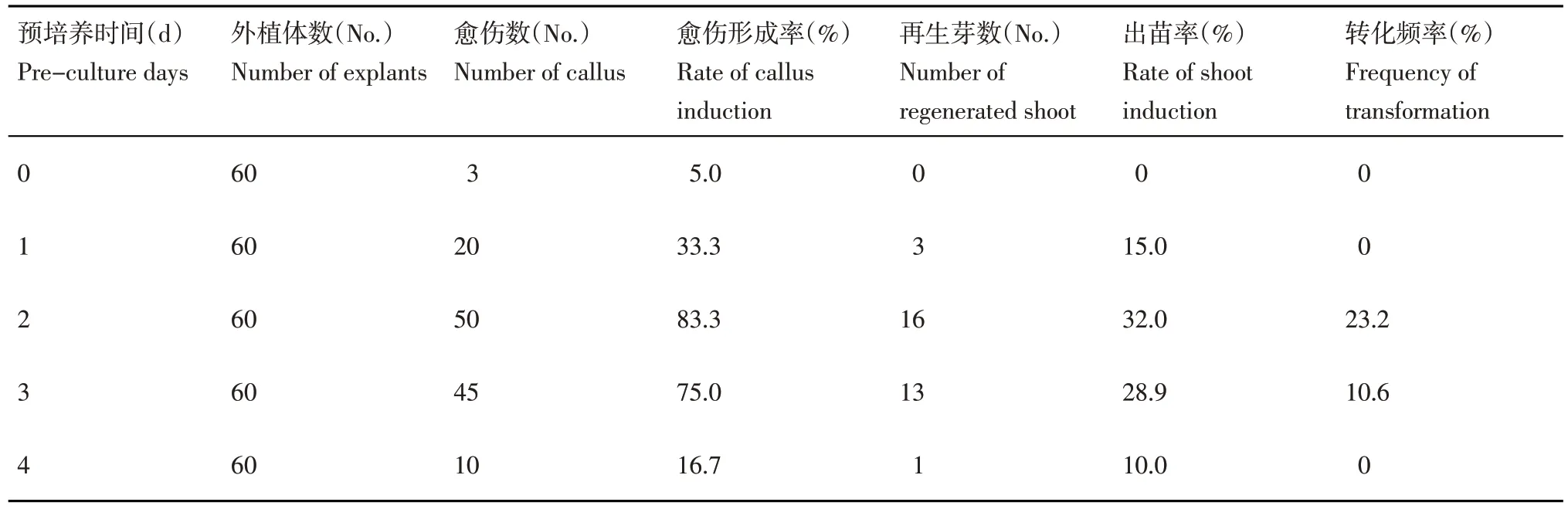
表4 预培养时间对愈伤组织形成和分化的影响Table 4 Effects of pre-culture time on callus induction and differentiation
2.2 不同激素种类及配比对外植体愈伤组织形成的影响
将外植体预培养2 d 后,用OD 值为0.6 的农杆菌菌液浸染10 min,共培养2 d 后置于愈伤组织诱导培养基CIM1、CIM2、CIM3 和CIM4 上,培养5 周后,观察愈伤组织的状态并统计愈伤组织形成率(表5)。结果表明,CIM3 的愈伤组织形成率最高,外植体伤口处膨大形成白色的愈伤组织,且形态较紧密;外植体表面几乎没有白色须状物和毛状根。CIM4 的愈伤组织形成率次之,多数外植体伤口处膨大形成白色的愈伤组织,外植体表面几乎没有白色须状物和毛状根。CIM1 和CIM2的愈伤组织形成率较低。CIM1 的一些外植体伤口处膨大形成愈伤组织,且表面白色须状物和毛状根较多。CIM2 的外植体伤口处膨大,且表面的白色须状物较多(图2)。

表5 不同激素种类及配比对茎段愈伤组织诱导的影响Table 5 Effects of different hormones and ratios on callus induction

图2 在不同类型培养基上外植体愈伤组织诱导及分化的过程Figure 2 Callus induction and differentiation processes of explants on different media
2.3 不同激素种类及配比对愈伤组织分化的影响
将上述处于 CIM1、CIM2、CIM3 和 CIM4 培养基上的愈伤组织分别平移于愈伤组织分化培养基SIM1 和SMI2 上,愈伤组织的体积逐渐的增大。培养3 周后,愈伤组织的底部可见绿色芽点的分化。待培养时间达到7 周后,在愈伤组织的芽点处分化出带有叶子的芽并从底部延伸出来。不同激素种类及配比对愈伤组织的分化具有一定的影响(表6)。与SIM2培养基相比较,SIM1培养基诱导愈伤组织分化的效果最佳,分化出的苗较粗壮,长势良好,且有些外植体上有多个芽的分化。其中CIM3+SIM1的愈伤组织分化的效率最高(图2)。

表6 不同激素种类及配比对茎段愈伤组织分化出苗的影响Table 6 Effects of different hormones and ratios on callus differentiation and shoot induction
2.4 不同潮霉素浓度对植株再生的影响
利用上述筛选出来的最佳愈伤组织诱导及分化的最佳培养基组合CIM3 + SIM1,对芽分化阶段的最佳抗生素浓度进行筛选。将预培养2 d 的外植体经过农杆菌浸染及共培养后置于愈伤组织诱导培养基CIM3 上,生长约5 周后,诱导形成愈伤组织。将形成的愈伤组织转移到含有不同潮霉素浓度的SIM1 培养基上,诱导芽的分化,每两周换一次培养基。大约培养7 周后,统计再生芽的数目并计算出苗率及转化频率(表7)。当潮霉素的浓度为0 和5 mg/L 时,愈伤组织生长正常,对芽的分化也没有太大的影响,无法起到筛选的作用。当潮霉素的浓度为10 mg/L 时,部分愈伤组织的生长受到抑制,出芽也明显受到抑制(图3),潮霉素起到了一定的筛选作用,因此转化频率较高。当潮霉素的浓度达到15 和30 mg/L 时,经过一段时间的培养后,大部分的愈伤组织生长受到抑制并逐渐褐化,出苗率很低且再生苗长势较弱甚至畸形,高浓度的潮霉素对外植体起到了毒害作用。当潮霉素的浓度达到40 mg/L 时,愈伤组织几乎全部趋于死亡,无法得到再生芽。由此可知,当潮霉素的浓度为10 mg/L 时,即能保证产生抗性芽,又能保证出苗率及转化频率,是最佳的植株再生筛选的抗生素浓度。

图3 不同潮霉素浓度下再生植株的生长状态Figure 3 Growth status of regenerated shoots under different hygromycin B concentrations

表7 不同潮霉素浓度对再生的影响Table 7 Effects of different hygromycin B concentrations on regeneration
2.5 不同潮霉素浓度对再生苗生根的影响
为了确定最适的再生苗生根的潮霉素浓度,将野生型的含有腋芽的马铃薯茎段扦插到含有不同潮霉素浓度的RIM培养基中进行培养,大约8周后统计生根率(表8)。当潮霉素的浓度为0和5 mg/L时,马铃薯植株都可以生根。当潮霉素的浓度高于或等于10 mg/L 时,马铃薯植株都无法生根,并最后趋于死亡(图4)。因此,当潮霉素的浓度为10 mg/L 时,未转化的再生苗无法生根而死亡,转化的再生苗具有一定的抗性可以正常的生根而生长。所以,10 mg/L 的潮霉素为再生苗生根的最佳筛选浓度。

图4 不同潮霉素浓度下再生植株的生根状态Figure 4 Growth status of rooting of regenerated shoots under different hygromycin B concentrations

表8 不同潮霉素浓度对再生苗生根的影响Table 8 Effects of different hygromycin B concentrations on rooting of regenerated shoots
2.6 不同抑菌剂的种类及浓度对转化的影响
当农杆菌菌液浸染外植体后,后续的试验需要进行抑菌处理。适宜的抑菌剂浓度不仅可以抑制农杆菌的生长,同时也不会毒害植株。将共培养2 d 后的茎段置于愈伤组织诱导培养基上,培养2周后观察抑菌情况和愈伤组织生长情况(表9)。当选用的抑菌剂为头孢霉素时,不论其浓度为100、200 或300 mg/L 都无法抑制农杆菌的生长,外植体也无法正常的进行愈伤组织的诱导。当选用的抑菌剂为100 mg/L特美汀时,无法有效的抑制农杆菌的生长;当特美汀的浓度达到200 mg/L 时,可以有效的抑制农杆菌的生长,并且可以正常的进行愈伤组织诱导及芽的分化;当特美汀的浓度为300 mg/L 时,可以有效的抑制农杆菌的生长,但是抑菌剂浓度过高对愈伤组织诱导及芽的分化有一定的影响(图5)。因此,选用200 mg/L 的特美汀为最佳的遗传转化的抑菌剂浓度。
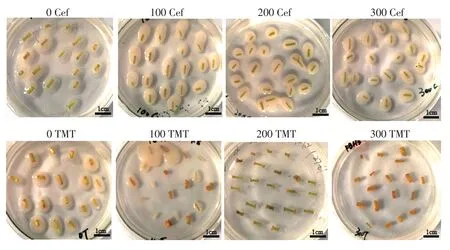
图5 不同抑菌抗生素种类和浓度下愈伤组织的生长状态Figure 5 Growth status of callus under different antibiotics and concentrations
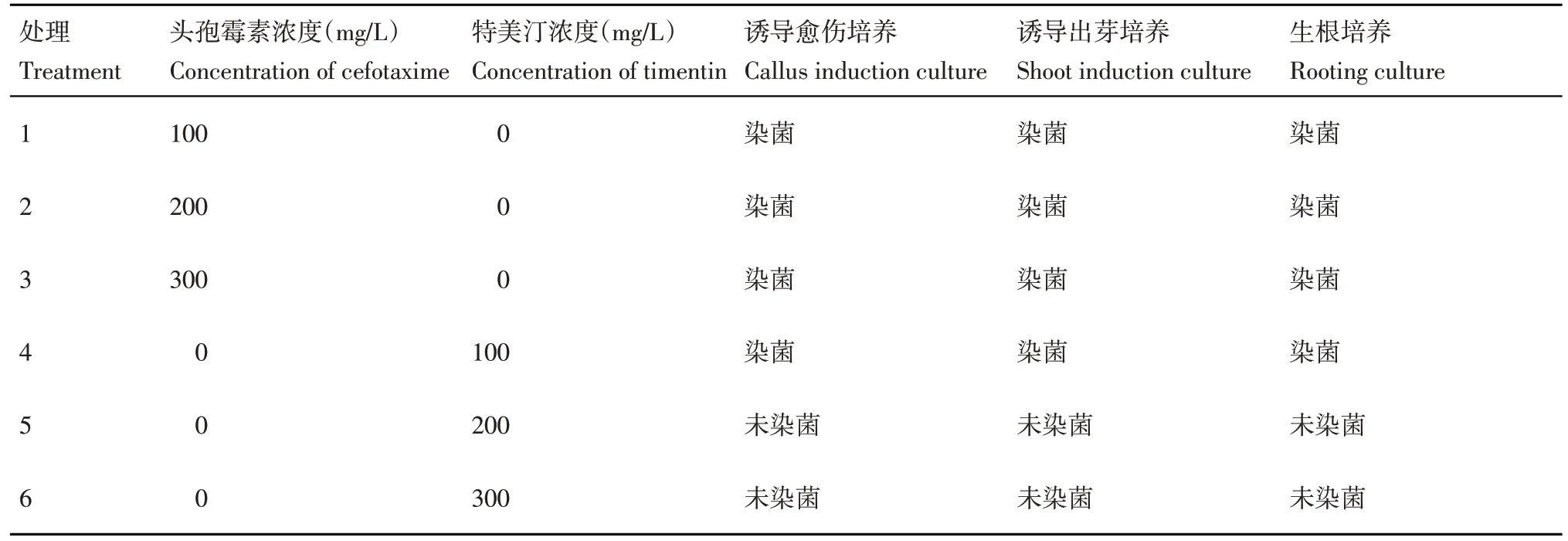
表9 不同抑菌抗生素种类及浓度的抑菌试验Table 9 Results of antimicrobial tests for different antibiotics and concentrations
2.7 再生植株的阳性检测
通过上述对预培养时间、愈伤组织诱导及分化阶段不同激素组合的筛选,确定了再生率较高的培养基类型。根据上述试验得到的最适条件进行新的遗传转化,最终共得到了58 株再生马铃薯植株。将获得的再生植株转移到生根培养基上进行筛选后得到了22 株抗性植株。提取再生抗性植株的叶片基因组DNA,经过PCR 扩增后,共有6株植株的基因组DNA 可以扩增出1 000 bp 的条带,与阳性对照扩增条带大小一致。因此,马铃薯‘并薯6号’的遗传转化效率约为27.3%(图6)。

图6 再生植株的PCR阳性检测Figure 6 Positive detection of regenerated plants by PCR
3 讨 论
外植体经过预培养后通过调整其生理状态,减轻胁迫伤害,促进细胞分裂,使细胞处于易转化状态,有利于整合外源基因组,从而可以提高遗传转化的效率[16]。熊伟等[17]和叶明旺等[18]以马铃薯品种‘PB04’和二倍体马铃薯为材料,预培养2 d 后的外植体抗性愈伤组织诱导率最高。张西英等[19]研究表明,预培养2 d 的马铃薯外植体分化率和转化率最高。因此,预培养对外植体的再生及遗传转化具有一定的影响。本研究结果表明,未经过预培养的外植体易发生白化或褐化最后死亡的现象,很难形成愈伤组织。预培养2 d 外植体的愈伤组织形成率和出苗率最高,预培养3 和2 d 外植体的愈伤组织形成率和出苗率差异不大,而预培养1 和4 d 外植体的愈伤组织形成率和出苗率较低。因此,本试验中,马铃薯外植体的最佳预培养时间为2 d。未经过预培养的外植体浸染农杆菌后容易死亡,预培养时间过长导致外植体伤口处的愈伤组织已经形成,影响农杆菌的浸染,进而影响遗传转化的效率[19]。
马铃薯的组织再生受到外植体类型及基因型的影响,不同的外植体类型及基因型所需的最适再生体系是不同的。罗源[20]研究结果表明,以‘克新13号’‘克新12号’‘东农303’和‘早大白’的茎段作为外植体,最适的愈伤组织诱导培养基为MS+30 g/L 蔗糖+8 g/L 琼脂+2 mg/L 6-BA+1 mg/L 2,4-D 和 MS + 30 g/L 蔗 糖 + 8 g/L 琼 脂 + 2 mg/L 6-BA+0.5 mg/L 2,4-D;最适愈伤组织分化培养基为MS+6-BA 4.0 mg/L+NAA 0.1 mg/L+GA31.0 mg/L,MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+GA31.0 mg/L,MS+6-BA 2.0 mg/L+NAA 0.1 mg/L+GA31.5 mg/L和MS+6-BA 2.0 mg/L+NAA 0.5 mg/L+GA31.0 mg/L。邱礽等[21]研究结果表明,以‘夏坡蒂’和‘费乌瑞它’的茎段作为外植体,最适的愈伤组织诱导培养基分别为MS + 6-BA 2.0 mg/L + NAA 0.5 mg/L + GA30.5 mg/L 和MS+ZT 2.0 mg/L+0.1 mg/L NAA+GA30.5 mg/L;不定芽诱导最佳培养基分别为MS+ZT 2.0 mg/L + 0.1 mg/L NAA + GA35 mg/L 和MS +6-BA 2.0 mg/L+ZT 2.0 mg/L+GA35 mg/L。张之为等[22]研究结果表明,以‘底西瑞’‘费乌瑞它’‘紫花白‘’夏坡蒂‘’大西洋’和‘虎头’6 个品种的叶片为外植体,6-BA 和GA3对马铃薯叶片愈伤组织生长量和不定芽分化率有影响。李晶[23]研究结果表明,以马铃薯‘东农303’的茎段和薯块为外植体,茎段最佳愈伤组织诱导培养基为MS+0.1 mg/L 2,4-D+1 mg/L BA,薯块最佳愈伤组织诱导及分化培养基均为MS+2 mg/L ZT+1 mg/L IAA。以茎段作为外植体时,相同浓度下,2,4-D 诱导愈伤组织的能力优于NAA[24]。在愈伤组织分化过程中,6-BA 起到主要作用,但其浓度过高则会影响芽的分化[25]。GA3对马铃薯幼苗的分化和伸长具有明显的促进作用[26]。另外,在培养基中加入ZT 对‘东农303’茎段的芽诱导具有很好的效果[27]。在本研究中,利用植物激素6-BA、NAA、2,4-D、KT 和GA3对‘并薯6号’愈伤组织诱导研究发现,利用2,4-D 有利于愈伤组织的诱导,利用ZT 有利于丛生芽的分化。当生长素与细胞分裂素的浓度及比例适合时,愈伤组织的诱导率和分化率较高。
在农杆菌介导的植物遗传转化的各个阶段中,需要向培养基中添加各类抗生素,但是添加的抗生素往往会影响外植体愈伤组织的诱导和分化,因此抗生素的种类及浓度是植物遗传转化过程中的重要环节。抑制农杆菌生长的抗生素一般都是头孢霉素(Cef)和羧苄青霉素(Carb)。但是由于马铃薯对Carb 毒害的忍受力较弱,所以在马铃薯遗传转化过程中最常使用的是Cef[28]。在本研究中使用的抑菌剂为Cef 和特美汀(TMT),通过研究发现,同样浓度下,TMT 的抑菌效果优于Cef,并且较低浓度的TMT 就可以达到较好的抑菌效果。抑菌剂不仅可以抑制农杆菌的生长,同样也会影响植物的正常生长和分化。选择合适种类的抑菌剂及其浓度在达到抑菌效果的同时又对植物再生影响较小,从而也可以提高植物的遗传转化效率。
农杆菌介导的植物遗传转化是一个复杂的过程。由于不同植物的基因型存在显著差异,因此不同植物对遗传转化过程中的各种因素的敏感度也不同,遗传转化的效率存在很大的差异[29]。虽然农杆菌介导的马铃薯愈伤再生转化体系已经比较成熟,并且在马铃薯分子育种中也得到了一定应用。但是对于不同基因型马铃薯遗传转化效率问题仍存在很大差异。在马铃薯育种过程中,马铃薯基因型复杂性及自交不亲和性等问题限制了杂交育种的进程。因此通过将优异外源基因导入到马铃薯中来实现品种改良是一种很好的选择,而不同基因型马铃薯遗传转化再生体系的建立是非常必要的[30]。本研究通过对马铃薯品种‘并薯6号’愈伤再生转化体系建立各个阶段的影响因素进行研究,初步建立该马铃薯品种的农杆菌介导的遗传转化体系,为马铃薯基因功能验证、分子育种和品质改良奠定了基础。
