纳米氧化亚铜的水热法制备及其可见光催化性能
2021-12-17张茂林成蕊
张茂林,成蕊
(1.蚌埠学院 材料与化学工程学院,安徽 蚌埠 233030;2.绿色和精准合成化学及应用教育部重点实验室,安徽 淮北 235000)
0 引言
近年来,氧化亚铜(Cu2O)因其独特的光电学性能、无毒、制备成本较低等优点,被认为是一种极具开发前景的绿色环保材料,在催化剂、太阳能电池、传感器、磁储存、锂离子电池以及涂料等领域有着广泛的应用.众所周知,Cu2O是一种重要的窄带隙p型半导体材料,其带隙能为2.0~2.2 ev,可以被可见光激发,在可见光区的吸收系数较高,能量转化率理论上可达12%.因此,Cu2O在可见光催化降解有机污染物、光解水产氢、CO催化氧化等领域存在较大的应用前景[1-10].
目前,有关文献已经报道不同形貌结构的Cu2O微纳米材料的制备与合成,如薄膜、低维纳米结构以及三维多面体实心结构、中空、多孔结构的Cu2O均可以制备得到.主要的制备方法有:固相法、液相还原法、水热法、电化学法、化学沉淀法以及气相沉积法等.蔡毅等[11]使用硫酸铜作为铜源,分别用山梨醇和木糖醇作为还原剂,在碱性条件下通过水热法成功制备出八面体结构的Cu2O微晶;宁甲甲等[12]使用硫酸铜作铜源,用柠檬酸钠作为还原剂和表面活性剂,通过水热法成功制备出六角星型Cu2O微米晶;万文亮等[13]以硫酸铜、氢氧化钠和葡萄糖为原料,采用液相还原两步法制备出不同形貌的Cu2O;莫若飞[14]通过水热法,采用油酸作为包覆剂、乙二胺四乙酸二钠作为配位剂,在水-乙醇碱性溶液中用葡萄糖还原醋酸铜制备出多孔腔骰子形和六足形Cu2O微米晶;潘冠福[15]采用化学气相沉积方法制备出薄膜状的高纯度Cu2O.在众多制备方法中,水热法具有独特优点:在相对较低的温度下,能够以单一步骤完成产物的形成与晶化,制备过程简单,成本相对较低,且能方便控制产物成分配比等,使水热法成为无机纳米材料合成的常用方法之一.
本研究以CuSO4·5H2O为铜源,Na2S·9H2O和NaOH为共沉淀剂,一锅混合后,首先让Cu2+共沉淀生成中间产物,随后通过水热条件下中间产物内部的氧化还原反应,定量地生成Cu2O产物.该水热一锅法具有制备过程简单,条件易控制,反应定量,无副反应,产物纯度高等优点.
1 实验部分
1.1 仪器与试剂
JFL-50ml微型磁力搅拌高温高压反应釜,DHG-9070型电热恒温鼓风箱,DZF-6020型电热型真空干燥箱,FA2004型电子分析天平,TG16K-II型离心高速机.Smartlab SE型X射线衍射仪,JSM-6610型扫描电子显微镜,JEM-2100型透射电子显微镜等;国药集团化学试剂有限公司的五水合硫酸铜(CuSO4·5H2O),九水合硫化钠(Na2S·9H2O),氢氧化钠(NaOH).
1.2 制备方法
将五水合硫酸铜溶于蒸馏水中配制一定浓度的硫酸铜溶液,按1:16的摩尔比将九水合硫化钠和氢氧化钠溶于蒸馏水中配制一定浓度的硫化钠和氢氧化钠混合溶液.按照硫酸铜、硫化钠和氢氧化钠的摩尔比为8:1:16,将硫化钠、氢氧化钠混合溶液逐滴加入均匀搅拌的硫酸铜溶液中,发生如式(1)共沉淀反应,生成中间产物前驱体CuS·7Cu(OH)2.随后将反应混合物转移至对位聚苯材质的水热反应釜内胆中,密封水热反应釜并放入加热设备中,在水热条件下,CuS·7Cu(OH)2内部发生氧化还原反应,Cu2+被S2-还原成Cu+,合成出Cu2O,如式(2)所示.反应结束后,自然冷却,离心分离,用蒸馏水洗涤产物2次,再用无水乙醇洗涤产物1次,在85℃下真空干燥1 h,得到纳米氧化亚铜.

2 结果与讨论
2.1 水热反应温度的影响
将含有0.4 mol/L铜离子的反应混合原料在不同温度下水热反应4 h,对所制得的产物进行X-衍射分析,其结果如图1所示.从图1可以看出,在220~250℃下水热反应4 h,所得产物的特征衍射峰与立方Cu2O(PDF#65-3288)的标准谱图相一致,表明产物为立方晶型的氧化亚铜,其2θ值为36.50°、42.40°、61.52°和73.70°的衍射峰分别归因于氧化亚铜的(111)、(200)、(220)和(311)晶面衍射.同时,衍射图谱中没有出现其它杂质峰,说明产物是纯氧化亚铜.利用谢乐公式进行计算,在220℃、230℃、240℃、250℃温度水热下制备的氧化亚铜的平均晶粒尺寸分别约为43 nm、49 nm、56 nm和67 nm,表明随着水热反应温度的增加,产物的平均晶粒尺寸逐渐增大.

图1 不同水热反应温度所制备产物的XRD图
2.2 水热反应时间的影响
将含有0.4 mol·L-1铜离子的反应混合原料在250℃下水热反应2~6 h,并对所制得的产物进行X-衍射分析,其结果如图2所示.从图2可以看出,250℃下水热反应2~6 h,所得产物都是纯净的立方相氧化亚铜.利用谢乐公式进行计算,结果表明水热反应时间为2 h、4 h、6 h,所得氧化亚铜的平均晶粒尺寸分别约为65 nm、67 nm和71 nm,说明随着水热反应时间的延长,产物的平均晶粒尺寸逐渐增大.所以,通过控制水热反应的时间,将能得到不同晶粒尺寸大小的氧化亚铜产品.

图2 不同水热反应时间所制备产物的XRD图
2.3 反应物浓度的影响
分别将含有0.08 mol·L-1、0.16 mol·L-1、0.4 mol·L-1、0.8 mol·L-1铜离子的反应混合原料在250℃下水热反应4 h,并对所制得的样品进行X-衍射分析,其结果如图3所示.从图3可以看出,尽管反应物浓度不同时,所得产物都是纯净立方相氧化亚铜,但其特征衍射峰的宽化程度不一样.利用谢乐公式进行计算,反应原料中铜离子浓度分别为0.08 mol·L-1、0.16 mol·L-1、0.4 mol·L-1、0.8 mol·L-1时产物氧化亚铜的平均晶粒尺寸分别约为70 nm、69 nm、67 nm和65 nm,表明随着反应物浓度的增加,产物的平均晶粒尺寸稍稍减小.这可能是由于CuS和Cu(OH)2都具有比较小的溶解度,在0.08~0.8 mol·L-1铜离子实验浓度范围内,溶质的过饱和度都很大,原料浓度对晶核形成速度的影响要大于对晶体成长速度的影响.更大的原料浓度有利于形成更多更小的晶核,产生沉淀颗粒更小的共沉淀前驱物,导致产物氧化亚铜的平均晶粒尺寸随反应物浓度的增加而减小.
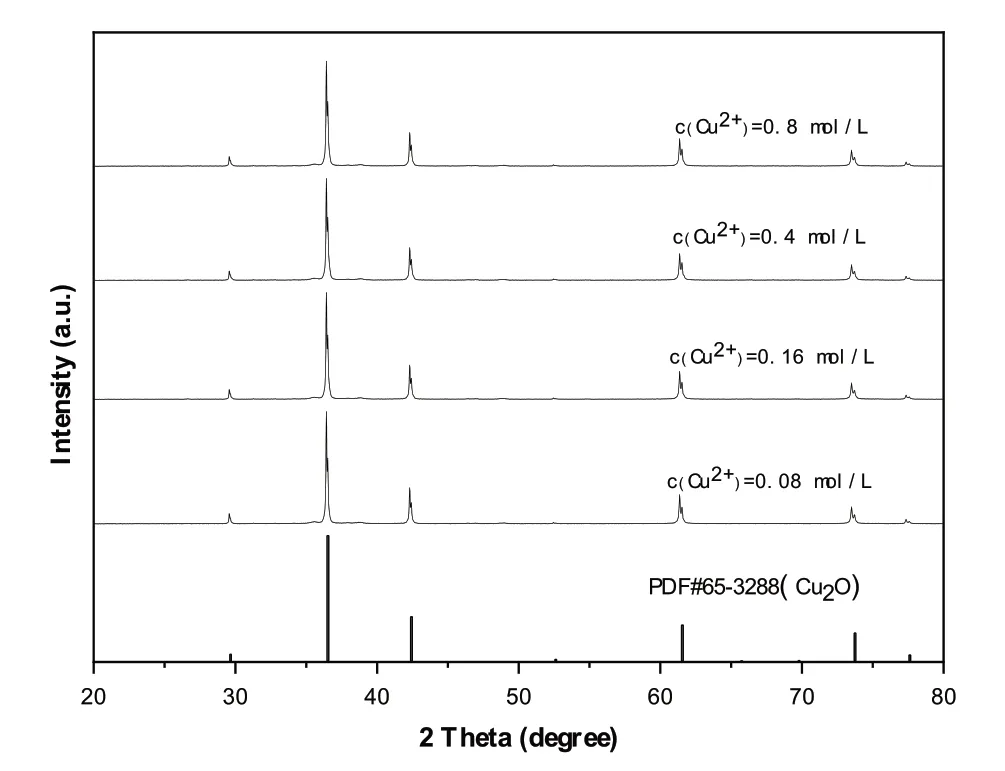
图3 不同反应物浓度所制备产物的XRD图
2.4 形貌分析
为观测样品的表面形貌和颗粒大小分布,将含有0.4 mol·L-1铜离子的反应混合原料在250℃下水热反应4 h制得的样品进行SEM和TEM分析,结果见图4.从样品的SEM和TEM图像可以看出,样品的颗粒形态为近似立方形,颗粒直径约为80~90 nm,颗粒大小分布较为均匀,但存在一定程度的聚合.

图4 氧化亚铜的SEM图像(a)和TEM图像(b)
2.5 光催化活性和稳定性
将甲基橙(MO)作为模拟有机污染物,以带有420 nm滤光片的300 W氙灯作为可见光光源,通过光照下甲基橙的降解效率来评价催化剂样品的光催化活性.具体光催化降解实验过程:在50 mL、20 mg·L-1MO溶液中加入50 mg所制备的样品,在暗处超声分散30 min以达到吸附-解吸平衡.将达到吸附-解吸平衡后的反应液进行光催化反应,且每隔30 min取反应液3 mL,经过离心、针头过滤得清液,在462 nm波长下测量其吸光度A,并与光照反应前过滤清液的吸光度A0进行比较,以此比较MO溶液降解前浓度(c0)和降解后浓度(c)的变化,c/c0=A/A0.作为对比,同时进行没有光催化剂存在下的光解实验.选用含有0.4 mol·L-1铜离子的反应混合原料在250℃下水热反应4 h制得的样品进行光催化降解实验和光解实验,实验结果如图5a所示.从图5a可以看出,没有光催化剂Cu2O存在时,可见光(λ>420 nm)几乎不能光解MO.但在光催化剂Cu2O存在下,随着光照时间的延长,MO的降解率逐渐加大,表明制备的Cu2O具有较好的可见光催化活性,光照2 h,MO的降解率约为83%.
为评价所制备样品的稳定性,对上述光催化实验样品重复进行光催化降解实验6次,其实验结果如图5b所示.从图5b可以看出,6次循环实验后,样品Cu2O的光催化效率降低大约2.1%,表明所制备的Cu2O具有较好的稳定性,没有明显失活.

图5 样品的光催化活性(a)和光催化循环实验(b)
3 结论
通过碱性条件下的共沉淀反应,获得中间产物前驱体Cu8(OH)14S纳米复合物,利用水热条件下中间产物内部的氧化还原反应,无需还原剂的另外加入,简单方便且定量地制备出纯净的纳米Cu2O.实验结果表明,反应物浓度、水热反应时间、水热反应温度等实验条件对产物Cu2O的晶粒尺寸有一定的影响.原料中铜离子浓度增加,产物的晶粒尺寸稍稍减小;水热反应时间延长,产物的晶粒尺寸逐渐减小;而水热反应温度的增加,产物的晶粒尺寸逐渐增大.此外,可见光照射下的光催化降解甲基橙实验和光催化循环实验表明,所制备的纳米Cu2O光催化剂表现出较好的光催化效率,且稳定性良好.
