中华绒螯蟹过氧化物还原酶基因克隆及其在鳗弧菌感染下的表达分析
2021-12-15李辉冯伟唐永凯苏胜彦王美垚李建林
李辉 冯伟 唐永凯 苏胜彦 王美垚 李建林

摘要:【目的】克隆中華绒螯蟹(Eriocheir sinensis)过氧化物还原酶基因(EsPrx)的开放阅读框(ORF),并分析EsPrx基因的组织表达特征及细菌感染下的表达情况,为中华绒螯蟹的先天免疫和抗病机制研究提供参考依据。【方法】通过RT-PCR结合转录组序列比对克隆出EsPrx基因,利用DNAStar、ClustalW、ExPASy、TMHMM Server v.2.0、SignalP 5.0及NetPhos 3.1 Server等在线软件进行生物信息学分析,并以实时荧光定量PCR检测EsPrx基因的组织表达特征及鳗弧菌(Vibrio anguillarum)感染下的表达情况。【结果】EsPrx基因ORF为597 bp,共编码198个氨基酸残基,含有Prx特有的2个结构域(FYPLDFTFVCPTEI和GEVCPA)。EsPrx蛋白分子式为C994H1544N258O293S8,分子量为22.05 kD,理论等电点(pI)为5.67,无跨膜域和信号肽,属于非分泌性蛋白。EsPrx氨基酸序列与扁额青蟹(Eurypanopeus depressus)、拟穴青蟹(Scylla paramamosain)和三疣梭子蟹(Portunus trituberculatus)的Prx氨基酸序列高度同源,对应的相似性分别89%、89%和88%;基于Prx氨基酸序列相似性构建的系统发育进化树也显示,EsPrx氨基酸序列先与拟穴青蟹、扁额青蟹及南美白对虾(Penaeus vannamei)的Prx氨基酸序列聚在一起,再与其他动物的2-Cys Prx氨基酸序列聚类,证实EsPrx基因属于未分化的Prx基因,即Prx1/2基因。EsPrx基因在中华绒螯蟹各组织中广泛表达,以肝胰腺的相对表达量最高,极显著高于在其他组织中的相对表达量(P<0.01);EsPrx基因表达在鳗弧菌感染不同时间段存在明显差异,感染6~24 h其相对表达量显著升高(P<0.05),而后迅速降至正常水平。【结论】EsPrx基因为甲壳动物未分化的Prx1/2基因,在中华绒螯蟹肝胰腺中高表达,并参与鳗弧菌感染的抗氧化应激反应,即在抗逆过程中发挥重要作用。
关键词: 中华绒螯蟹;过氧化物还原酶;基因克隆;鳗弧菌感染;组织表达特征
中图分类号: S966.16 文献标志码: A 文章编号:2095-1191(2021)08-2267-09
Cloning of peroxiredoxin gene(EsPrx) in Eriocheir sinensis and its expression analysis under Vibrio anguillarum infection
LI Hui1,2, FENG Wei2,3, TANG Yong-kai1,2,3*, SU Sheng-yan1,2,3,
WANG Mei-yao2,3, LI Jian-lin2
(1National Demonstration Center for Experimental Fisheries Science Education(Shanghai Ocean University), Shanghai 201306, China; 2Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences/Key Laboratory of Freshwater Aquatic Germplasm Resources, Ministry of Agriculture and Rural Affairs, Wuxi, Jiangsu 214081,
China; 3Wuxi Fisheries College, Nanjing Agricultural University, Wuxi, Jiangsu 214081, China)
Abstract:【Objective】Cloned the open reading frame(ORF) of peroxiredoxin gene(EsPrx) of Eriocheir sinensis, and analyzed the tissue expression characteristics of EsPrx gene and its expression under bacterial infection, which provi-ded reference for the study of innate immunity and disease resistance mechanism of E. sinensis. 【Method】The EsPrx gene was cloned by combining RT-PCR with transcriptome sequence alignment analysis. Bioinformatics analysis was performed using online software such as DNAStar, ClustalW, ExPASy, TMHMM Server v.2.0, SignalP 5.0, and NetPhos 3.1 Server. The tissue expression characteristics of the EsPrx gene and its expression in the presence of Vibrio anguillarum infection were detected by real-time fluorescence quantitative PCR. 【Result】The ORF of EsPrx gene was 597 bp, enco-ding a total of 198 amino acid residues, and it contained two domains specific to Prx (FYPLDFTFVCPTEI and GEVCPA). The molecular formula of EsPrx protein was C994H1544N258O293S8, with a molecular weight of 22.05 kDa and a theoretical isoelectric point(pI) of 5.67. Without transmembrane domain and signal peptide, it was a non-secretory protein. The amino acid sequence of EsPrx was highly homologous with the Prx amino acid sequence of Eurypanopeus depressus, Scylla paramamosain and Portunustri tuberculatus, with the corresponding similarities of 89%, 89% and 88%, respectively. The phylogenetic tree constructed based on the similarity of Prx amino acid sequence showed that the amino acid sequence of EsPrx was first clustered with the Prx amino acid sequence of S. paramamosain, E. depressus and Penaeus vannamei, and then clustered with the 2-Cys Prx amino acid sequence of other animals, confirming that the EsPrx gene belonged to the undifferentiated Prx gene, namely, Prx1/2 gene. The EsPrx gene was widely expressed in various tissues of E. sinensis, and the relative expression level of EsPrx gene in hepatopancreas was the highest, which was extremely significantly higher than that in other tissues(P<0.01). The expression of EsPrx gene was greatly different at different time points of Vibrio anguillarum infection, and its relative expression was significantly increased 6-24 h after infection(P<0.05), and then rapidly decreased to normal level. 【Conclusion】EsPrx gene is an undifferentiated Prx1/2 gene of crustacean, which is highly expressed in hepatopancreas of E. sinensis, and participates in the anti-oxidative stress response of V.anguillarum infection, that is, plays an important role in the resistance process.
Key words: Eriocheir sinensis; peroxiredoxin; gene cloning; Vibrio anguillarum infection;tissue expression chara-cters
Foundation item:The Fundamental Research Funds for The Central Public Welfare Research Institutes(2020TD36); Jiangsu Agricultural Major New Variety Creation Project(PZCZ201749); Jiangsu Modern Agricultural Industrial Techno-logy System Construction Special Project(JATS〔2019〕385); Fishery Technology Major Project of Jiangsu(D2018-4)
0 引言
【研究意义】过氧化物还原酶(Peroxiredoxin,Prx)是抗氧化酶家族的成员之一,最初发现于酿酒酵母中,被命名为巯基特异性抗氧化酶(Thiol-specific antioxidant enzyme,TSA)。随后发现Prx既存在于动物中,又存在于植物中,在抗氧化和清除体内过多活性氧(Reactive oxygen species,ROS)等方面发挥重要作用(Wood et al.,2003;章波等,2004;Kang et al.,2005)。在正常情况下,ROS和抗氧化酶呈动态平衡状态,当体内ROS的产生超出其清除能力时即出现氧化应激状态(张星莹等,2019)。无脊椎动物的氧化还原平衡是疾病与生理学变化相互作用的结果,是先天免疫不可或缺的一部分(Aispuro-Hernandez et al.,2008)。在外界生物和非生物的胁迫下,将诱导机体体内产生和积累大量ROS,而抗氧化酶表达的增加能抵御ROS造成的危害。因此,阐明Prx基因参与细菌感染调控的分子机制对保障养殖业的健康发展具有重要意义。【前人研究进展】在哺乳动物中,已鉴定出6种不同的Prx亚型,分别为Prx1、Prx2、Prx3、Prx4、Prx5和Prx6(章波等,2004)。此外,在发状念珠藻(岳思君等,2016)、小麦(赵明明,2017)、异育银鲫(税典章等,2018)、田鼠巴贝斯虫(彭梦华,2019)、冰岛硫化叶菌(钟晴,2019)及栉孔扇贝(Cheng et al.,2020)等物种上也有发现。与哺乳动物略有不同,甲壳动物的Prx亚型分为Prx1/2、Prx3、Prx4、Prx5和Prx6。Tu等(2018)首次对拟穴青蟹(Scylla paramamosain)Prx基因进行系统分析,结果表明,拟穴青蟹Prx1/2符合典型的2-Cys Prx结构特征,在系统进化树中先与其他甲壳动物聚为一个支,再与Prx1~Prx4聚集。因此,甲壳动物中的Prx1/2基因被推测为Prx1和Prx2的祖先基因,即未分化的Prx基因。针对甲壳动物Prx基因的相关研究,Mu等(2008)以鳗弧菌(Vibrio anguillarum)人工感染中华绒螯蟹(Eriocheir sinensis),结果发现EsPrx6基因的相对表达量在感染3~12 h内持续下降,感染后12 h达最低水平,显著低于对照组,但感染24 h后开始上升,表明EsPrx6基因参与中华绒鳌蟹鳗弧菌感染的免疫应答过程;Duan等(2013)对脊尾白虾(Exopa-laemon carinicauda)进行人工感染鳗弧菌和白斑综合症病毒(White spot syndrome virus,WSSV),结果发现血细胞和肝胰腺中EcPrx5基因的表达在感染早期上调,而后逐渐下降,表明EcPrx5基因可能参与对鳗弧菌和WSSV感染的免疫应答;谢亚凯(2016)在日本囊对虾(Penaeus japonicus)中发现由鳗弧菌感染引起的H2O2可诱导Prx6基因表达上调,Prx6基因通过发挥谷胱甘肽过氧化物酶活性而调节对虾体内H2O2水平,维持对虾体内的氧化还原稳态,防止H2O2持续积累;卜瑞倩(2018)从斑节对虾(P. monodon)中克隆出PmPrx1、PmPrx5和PmPrxn基因,在非生物环境条件下进行毒性胁迫,发现PmPrx1、PmPrx5和PmPrxn基因表现出不同的表达谱,说明这3种基因均参与氧化应激反应。【本研究切入点】近年来,中华绒螯蟹市场需求量日益增加,养殖密度和规模不断扩大,随之而来的是养殖水体环境日益恶化及病害频发(黄晓东等,2019;臧亚南等,2019),尤其是以弧菌感染为主的细菌性疾病,导致黑鳃、水肿及烂肢等症状,給中华绒螯蟹产业带来极大经济损失(房海,2008;郑世雄,2013)。Prx在氧化应激应答过程中发挥重要功能作用,但至今鲜见有关中华绒螯蟹Prx基因(EsPrx)的研究报道。【拟解决的关键问题】利用RT-PCR克隆EsPrx基因的完整开放阅读框(ORF),系统分析其生物信息学,并采用实时荧光定量PCR检测EsPrx基因的组织表达特征及细菌感染下的表达情况,旨在为中华绒螯蟹的先天免疫和抗病机制研究提供参考依据。
1 材料与方法
1. 1 试验材料
供试中华绒螯蟹取自中国水产科学研究院淡水渔业中心阳澄湖虾蟹绿色养殖基地,规格为78±5 g/只,暂养于实验室1周。暂养水温(27±1)℃,于每日下午17:00时投喂河蟹配合饲料。采集肝胰腺、鳃、肠道、血细胞、心脏、肌肉和眼柄等组织于液氮迅速冷冻后,置于-80 ℃保存备用。在鳗弧菌感染试验中,将中华绒螯蟹随机分成对照组和感染组,每组30只。对照组每只注射40.0 μL PBS缓冲液;感染组每只注射40.0 μL鳗弧菌悬液,菌液浓度为1.0×107 CFU/mL,并分别于感染后0、6、12、24、48和72 h时采集中华绒螯蟹的肝胰腺组织。HiScript II Q RT SuperMix for qPCR(+gDNA wiper)、ChamQ SYBR? qPCR Master Mix及FastPure Tissue Total RNA Isolation Kit购自南京诺唯赞生物科技股份有限公司,大肠杆菌DH5α感受态细胞、琼脂糖、pMD19-T载体、DNA Marker和连接酶等购自宝生物工程(大连)有限公司,DNA凝胶回收试剂盒购自上海博彩生物科技有限公司,鳗弧菌菌种购自中国海洋微生物菌种保藏管理中心。
1. 2 RNA提取及cDNA合成
使用FastPure Tissue Total RNA Isolation Kit试剂盒提取中华绒螯蟹肝胰腺组织总RNA,提取的总RNA以1.0%琼脂糖凝胶电泳检测其完整性,紫外分光光度计测定其浓度和纯度;再以HiScript II Q RT SuperMix for qPCR(+gDNA wiper)试剂盒反转录合成cDNA,cDNA样品-20 ℃保存备用。
1. 3 EsPrx基因克隆
将中华绒螯蟹转录组序列输入NCBI数据库进行比对分析,从中筛选出EsPrx基因片段,采用Primer 5.0设计引物(表1),并委托天霖生物科技(上海)有限公司合成。以中华绒螯蟹肝胰腺cDNA为模板,使用特异性引物X1-F、X1-R、Prx1-F和AP引物进行PCR扩增。PCR反应体系20.0 μL:2×Easy Taq PCR SuperMix 10.0 μL,cDNA模板2.0 μL,上、下游引物(10 μmol/L)各0.8 μL,灭菌蒸馏水6.4 μL。扩增程序:94 ℃预变性3 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 60 s,进行30个循环;72 ℃延伸10 min。PCR扩增产物经1.0%琼脂糖凝胶电泳后进行切胶回收,并连接至pMD19-T载体上,再转化DH5α感受态细胞,挑选单克隆送至苏州金唯智生物科技有限公司测序。
1. 4 生物信息学分析
采用Vector NTI Suite对测序结果进行序列拼接;利用DNAStar获取EsPrx基因开放阅读框(ORF),并预测其推导氨基酸序列;通过BLAST(http://blast.ncbi.nlm.nih.gov/)进行同源比对分析;使用ClustalW对EsPrx氨基酸序列和其他物种的Prx氨基酸序列进行多序列对比,同时以MEGA-X构建系统发育进化树;利用ExPASy(http://www.expasy.org/proteomics)分析EsPrx蛋白理化性质,运用TMHMM Server v.2.0(http://www. cbs.dtu.dk/services/TMHMM/)进行跨膜结构域预测,使用PSORTⅡServer(https://www.genscript. com/psort.html)预测蛋白亚細胞定位,采用SWISS-MODEL(https://swissmodel.expasy.org/)预测蛋白二级结构,运用SignalP 5.0(http://www.cbs.dtu.dk/services/SignalP/)进行信号肽分析,并以NetPhos 3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测其磷酸化位点。
1. 5 EsPrx基因组织表达分析
以β-actin为内参基因,无菌水为阴性对照。实时荧光定量PCR反应体系20.0 μL:2×ChamQ Universal SYBR qPCR Master Mix 10.0 μL,5倍稀释的cDNA模板2.0 μL,10 μmol/L的上、下游引物(qPrx1-F和qPrx1-R)各1.0 μL,灭菌蒸馏水6.0 μL。扩增程序:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,进行40个循环;熔解段为95 ℃ 15 s,60 ℃ 30 s,95 ℃ 15 s。每个样品设3个重复,采用2-ΔΔCt法换算EsPrx基因相对表达量,并以SPSS 22.0和GraphPad Prism 8进行统计分析及制图。
2 结果与分析
2. 1 EsPrx基因序列分析结果
通过PCR扩增及转录组序列比对,得知EsPrx基因全长1599 bp,其中,5'端非编码区(5'-UTR)为46 bp,ORF为597 bp,3'端非编码区(3'-UTR)为956 bp。3'-UTR包括1个终止密码子(TGA)及典型的加尾信号(AATAAA)和poly(A)尾巴(图1)。EsPrx基因共编码198个氨基酸残基,含有Prx特有的2个结构域(FYPLDFTFVCPTEI和GEVCPA)。
2. 2 EsPrx蛋白理化性质预测分析结果
EsPrx蛋白分子式为C994H1544 N258O293S8,原子总数为3097,分子量为22.05 kD,理论等电点(pI)为5.67。在EsPrx蛋白氨基酸序列中,氨基酸丰度依次为亮氨酸(Leu,占8.6%)、甘氨酸(Gly,占7.6%)、赖氨酸(Lys,占7.6%)、丙氨酸(Ala,占7.1%)、天冬氨酸(Asp,占7.1%)、苯丙氨酸(Phe,占7.1%)、缬氨酸(Val,占6.6%)、谷氨酸(Glu,占6.1%)、丝氨酸(Ser,占6.1%)、苏氨酸(Thr,占6.1%)、异亮氨酸(Ile,占5.6%)、脯氨酸(Pro,占5.1%)、精氨酸(Arg,占4.0%)、天冬酰胺(Asn,占3.5%)、谷氨酰胺(Gln,占3.0%)、络氨酸(Tyr,占2.5%)、半胱氨酸(Cys,占2.0%)、蛋氨酸(Met,占2.0%)、组氨酸(His,占1.5%)和色氨酸(Trp,占1.0%)。EsPrx蛋白亲/疏水性预测结果显示,多肽链的第41位氨基酸分值最高(1.889),第63位氨基酸分值最低(-2.178),总平均亲水性为 -0.193,即为亲水性蛋白。EsPrx蛋白不稳定指数为30.34,表明该蛋白性质稳定。NetPhos 3.1 Server预测结果显示,EsPrx蛋白的丝氨酸(Ser)、苏氨酸(Thr)、酪氨酸(Tyr)磷酸化位点数分别为7、9和1个。
2. 3 EsPrx蛋白信号肽、跨膜结构域及亚细胞定位预测结果
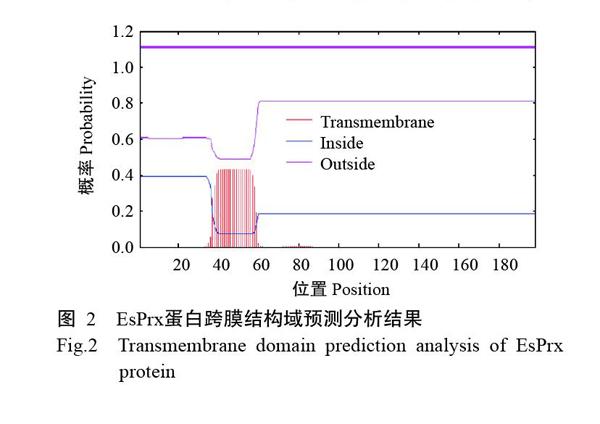
SignalP 5.0预测结果显示,EsPrx蛋白无信号肽。SWISS-MODEL预测结果表明,EsPrx蛋白二级结构中含有78个无规则卷曲(占39.39%)、62个α-螺旋(占31.31%)、42条延伸链(占21.21%)及16个β-折叠(占8.08%)。EsPrx蛋白不含跨膜结构域,第1~198位氨基酸均位于细胞膜表面(图2);PSORTⅡServer亚细胞定位预测结果表明,EsPrx蛋白定位于细胞质的概率为52.2%,定位于线粒体的概率为26.1%,而其他细胞器的定位概率相对较低。由此推测EsPrx蛋白属于非分泌性蛋白。
2. 4 EsPrx基因同源比对及系统进化分析结果
从NCBI下载已公布的Prx氨基酸序列,利用BLAST对EsPrx氨基酸序列与各参考Prx氨基酸序列进行同源比对分析,结果(图3)发现EsPrx氨基酸序列与扁额青蟹(Eurypanopeus depressus)、拟穴青蟹和三疣梭子蟹(Portunus trituberculatus)的Prx氨基酸序列高度同源,对应的相似性分别89%、89%和88%。基于Prx氨基酸序列相似性,对中华绒螯蟹、拟穴青蟹、扁额青蟹、南美白对虾(P. vannamei)、牛(Bos taurus)、褐家鼠(Rattus norvegicus)和斑马鱼(Danio rerio)等13个物种的18种Prx氨基酸序列构建系统发育进化树,结果(图4)显示,EsPrx氨基酸序列先与拟穴青蟹、扁额青蟹及南美白对虾的Prx氨基酸序列聚在一起,再与其他动物的2-Cys Prx氨基酸序列聚类。
2. 5 EsPrx基因在中华绒螯蟹组织中的表达特征
以β-actin为内参基因,同时以血细胞的EsPrx基因相对表达量为基准,进行实时荧光定量PCR检测,结果表明,在中华绒螯蟹肝胰腺、血细胞、鳃、肌肉、眼柄、心脏和肠道等组织中均能检测到EsPrx基因,即EsPrx基因广泛表达(图5)。在中华绒螯蟹各组织中,以肝胰腺的EsPrx基因相对表达量最高,为血细胞的3.66倍;鳃组织的EsPrx基因相对表达量次之,为血细胞的2.27倍;其他组织中的相对表达量则极显著低于肝胰腺和鳃组织(P<0.01,下同),尤其是在肠道和心脏的相对表达量较低,约为血细胞的25%。
2. 6 EsPrx基因在鳗弧菌感染下的表达情况
以鳗弧菌感染中华绒螯蟹后,利用实时荧光定量PCR测定EsPrx基因在中华绒螯蟹肝胰腺中的表达情况,结果表明,以感染0 h肝胰腺中的EsPrx基因相对表达量为基准,感染6 h的EsPrx基因相对表达量显著升高(P<0.05,下同),感染12 h的EsPrx基因相对表达量持续升高,至感染24 h其相对表达量达最高值,与对照组的差异极显著;随后急速下降,降至正常水平以下,感染48 h时与对照组的差异显著,但感染72 h后又恢复至正常水平(图6)。对照组中各时间点的EsPrx基因相对表达量略有起伏,但差异不显著(P>0.05)。
3 讨论
Prx进化相对保守,广泛存在于原核生物和真核生物中(Hofmann et al.,2002),能调节细胞和组织中ROS的平衡,既能有效保护生物不受氧化应激的侵害,又能准确控制正常生理代谢中的过氧化物浓度(Wood et al.,2003)。至今,已在多种甲壳动物中研究发现Prx基因,但大部分只发现某一亚型,如三疣梭子蟹(Chen et al.,2011)、脊尾白虾(Duan et al.,2013)及日本沼虾(Macrobrachium nipponense)(孙盛明等,2014)等。本研究结果表明,EsPrx氨基酸序列的N端和C端均含有1个保守的半胱氨酸残基,且与其他虾蟹类的Prx氨基酸序列高度相似,即属于未分化的Prx1/2。基于Prx氨基酸序列相似性构建的系统发育进化樹也显示,EsPrx氨基酸序列先与拟穴青蟹、扁额青蟹及南美白对虾的Prx氨基酸序列聚在一起,再与其他动物的2-Cys Prx氨基酸序列聚类,进一步证实EsPrx基因属于未分化的Prx基因,即Prx1/2基因。
大量研究表明,Prx基因在生物体内的各种组织中均有表达,说明Prx具有广泛的抗氧化作用(Gross et al.,2001;卜瑞倩,2018);但Prx基因在不同组织中的表达水平存在差异,且一般在免疫组织中高表达,即Prx基因具有组织偏好性。Mu等(2008)研究证实,Prx6基因在中华绒螯蟹的肝胰腺、心脏、性腺、血细胞、肌肉和鳃组织中均有表达,但以肝胰腺中的表达量最高。Chen等(2011)研究发现,Prx基因在三疣梭子蟹的肌肉、肝胰腺、心脏、胃、肠道、鳃、卵巢和血细胞中均有表达,尤其以在肝胰腺和鳃组织中的表达量较高。孙盛明等(2014)研究表明,Prx基因在日本沼虾的肝胰腺、卵巢、肌肉、心脏、鳃和肠道中均有表达,且以在肝胰腺中的表达量最高。本研究通过实时荧光定量PCR检测到EsPrx基因在所检测组织中均有表达,但不同组织中的相对表达量存在明显差异,其中以肝胰腺中的相对表达量最高,极显著高于在其他组织中的相对表达量,与在三疣梭子蟹(Chen et al.,2011)和日本沼虾(孙盛明等,2014)中的研究结果类似,同时说明肝胰腺在中华绒螯蟹体内发挥着重要的免疫作用。
甲壳动物的肝胰腺在体液免疫和基础代谢中发挥着重要作用,其功能与哺乳动物的肝脏和胰脏相似(Roszer,2014),大多数免疫相关基因在肝胰腺中均呈高水平表达(Gross et al.,2001)。大量研究表明,当生物机体受应激时,Prx作为维持机体氧化平衡的重要生物酶,其表达发生明显变化(Fujii and Ikeda,2002;章波等,2004)。经人工感染WSSV后,中国明对虾(Fenneropenaeus chinensis)Prx4基因在血细胞和肝胰腺中的表达显著上调(Zhang et al.,2014);在鳗弧菌侵染后,脊尾白虾EcPrx5基因在血细胞和肝胰腺中的表达水平也显著增加,且显示出不同的表达谱(Duan et al.,2013);在镉刺激条件下,拟穴青蟹Prx基因相对表达量在刺激6 h后迅速升高,但在刺激12 h后随即恢复正常水平(Tu et al.,2018)。在本研究中,EsPrx基因表达在鳗弧菌刺激下的不同时间段存在明显差异,在感染6~24 h其相对表达量显著升高,而后迅速降至正常水平,表明EsPrx基因在鳗弧菌感染过程中发挥了重要作用,与Zhang等(2014)、Tu等(2018)的研究结论一致,即在外界因子刺激下Prx基因的表达水平先上升后降低。可见,Prx对外部环境刺激敏感,能及时清除机体损伤产生的有害物质,促使机体尽快恢复至正常生理状态(朱江艳,2013)。
4 结论
EsPrx基因为甲壳动物未分化的Prx1/2基因,在中华绒螯蟹肝胰腺中高表达,并参与鳗弧菌感染的抗氧化应激反应,即在抗逆过程中发挥重要作用。
参考文献:
卜瑞倩. 2018. 斑节对虾三种过氧化物还原酶在应激条件下的表达与功能分析[D]. 上海:上海海洋大学. [Bu R Q. 2018. Three peroxiredoxins from Penaeus monodon:Identification,characterization,functional analysis under biotic and abiotic stresses[D]. Shanghai:Shanghai Ocean University.]
房海. 2008. 中华绒鳌蟹细菌感染症及其病原学研究[D]. 杨凌:西北农林科技大学. [Fang H. 2008. Studies on the bacterial infection and its pathogen of crab(Eriocheir sinensis L.)[D]. Yangling:Northwest A & F University.]
黃晓东,周慧华,安健,杨先乐,曹海鹏. 2019. 中华绒螯蟹致病性弗氏柠檬酸杆菌的分离鉴定及其药敏特性[J]. 南方农业学报,50(7):1613-1619. [Huang X D,Zhou H H,An J,Yang X L,Cao H P. 2019. Isolation,identification and antibiotic susceptibility of pathogenic Citrobacter freundii from Eriocheir sinensis[J]. Journal of Southern Agriculture,50(7):1613-1619.] doi:10.3969/j.issn.2095-1191.2019.07.00.
彭梦华. 2019. 田鼠巴贝斯虫过氧化物氧化还原酶Prx1氨基酸突变对其功能的影响[D]. 上海:上海师范大学. [Peng M H. 2019. Effects of amino acid mutation of peroxiredoxin Prx1 on the function of Babesia vole[D]. Shanghai:Shanghai Normal University.] doi:10.7666/d.Y3542 924.
税典章,陈胜峰,吴萍,叶元土,陈佳,张晶晶. 2018. 异育银鲫过氧化物还原酶基因的克隆及其表达分析[J]. 四川动物,37(1):35-44. [Shui D Z,Chen S F,Wu P,Ye Y T,Chen J,Zhang J J. 2018. cDNA cloning,characterization and expression analysis of peroxiredoxin gene in Carassius auratus gibelio[J]. Sichuan Journal of Zoology,37(1):35-44.] doi:10.11984/j.issn.1000-7083.20170233.
孙盛明,戈贤平,傅洪拓,朱健,张世勇. 2014. 日本沼虾过氧化物还原酶基因的克隆及其表达分析[J]. 中国水产科学,21(3):474-483. [Sun S M,Ge X P,Fu H T,Zhu J,Zhang S Y. 2014. Molecular cloning and gene expression of peroxiredoxin (Prx) in oriental river pawn (Macrobrachium nipponense) in response to environmental hypoxia and reoxygenation[J]. Journal of Fishery Sciences of China,21(3):474-483.] doi:10.3724/SP.J.1118.2014. 00474.
谢亚凯. 2016. 两种过氧化物还原酶在日本囊对虾先天免疫中的功能研究[D]. 济南:山东大学. [Xie Y K. 2016.The function analysis of two peroxiredoxin subfamilies in innate immunity of kuruma shrimp Marsupenaeus japonicas[D]. Jinan:Shandong University.] doi:10.7666/d.Y3036402.
岳思君,周娟,郑蕊,范红丽,苏建宇. 2016. 发状念珠藻过氧化物还原酶NfPrx基因的克隆与表达分析[J]. 植物生理学报,52(8):1287-1294. [Yue S J,Zhou J,Zheng R,Fan H L,Su J Y. 2016. Cloning and expression analysis of NfPrx gene from Nostoc flagelliforme[J]. Plant Physio-logy Journal,52(8):1287-1294. doi:10.13592/j.cnki.ppj. 2016. 0241.
臧亚南,张晓,黄鹏丹,Kassimu Hashim Ame,沈怀舜. 2019. 中华绒螯蟹羧酸酯酶基因克隆及其在农药胁迫下的表达变化[J]. 南方农业学报,50(5):1093-1103. [Zang Y N,Zhang X,Huang P D,Kassimu H A,Shen H S. 2019. Cloning of carboxylesterase gene in Eriocheir sinensis and its expression variation under pesticide stress[J]. Journal of Southern Agriculture,50(5):1093-1103.] doi:10. 3969/j.issn.2095-1191.2019.05.25.
張星莹,李甜甜,杨春娜,李连芹. 2019. 过氧化物还原酶在生殖与妊娠并发症中作用机制的研究进展[J]. 山东医药,59(1):94-97. [Zhang X Y,Li T T,Yang C N,Li L Q. 2019. Research progress on the mechanism of peroxide reductase in reproductive and pregnancy complications[J]. Shandong Medical Journal,59(1):94-97.] doi:10. 3969/j.issn.1002-266X. 2019.01.028.
章波,向渝梅,白云. 2004. 抗氧化蛋白Peroxiredoxin家族研究进展[J]. 生理科学进展,35(4):352-355. [Zhang B,Xiang Y M,Bai Y. 2004. Progress in the study of anti-oxi-dant peroxiredoxin family[J]. Progress in Physiological Sciences,35(4):352-355.]
赵明明. 2017. 小麦叶绿体过氧化物氧还酶基因TaBAS1的功能研究[D]. 济南:山东大学 [Zhao M M. 2017. The func-tional analysis of wheat chloroplast peroxiredoxin gene TaBAS1[D]. Jinan:Shandong University.]
郑世雄. 2013. 池塘养殖中华绒螯蟹细菌性疾病的病原鉴定及流行病学调查[D]. 合肥:安徽农业大学. [Zheng S X. 2013. Identification of pathogens and epidemiological survey of bacteriosis of farmed Eriocheir sinensis in ponds[D]. Hefei:Anhui Agricultural University.]
钟晴. 2019. 冰岛硫化叶菌REY15A中过氧化物还原酶的性质鉴定和初步遗传分析[D]. 济南: 山东大学. [Zhong Q. 2019. Biochemical characterization and preliminary genetic analysis of peroxiredoxins of Sulfolobus islandicus REY15A[D]. Jinan:Shandong University.]
朱江艳. 2013. 高温胁迫下刺参消化道菌群变化及Prxs基因表达分析[D]. 厦门:集美大学. [Zhu J Y. 2013. Variation of microflora in the digestive tract and Prxs gene expression analysis of Apostichopus japonicas under high-temperature stress[D]. Xiamen:Jimei University.]
Aispuro-Hernandez E,Garcia-Orozco K D,Muhlia-Almazan A,del-Toro-Sanchez L,Robles-Sanchez R M,Hernandez J,Gonzalez-Aguilar G,Yepiz-Plascencia G,Sotelo-Mundo R R. 2008. Shrimp thioredoxin is a potent antioxidant protein[J]. Comparative Biochemistry and Physiology. Part C:Toxicology & Pharmacology,148(1):94-99. doi:10. 1016/j.cbpc. 2008.03.013.
Chen P,Li J T,Gao B Q,Liu P,Wang Q Y,Li J. 2011. cDNA cloning and characterization of peroxiredoxin gene from the swimming crab Portunus trituberculatus[J]. Aquaculture,322-323:10-15. doi:10.1016/j.aquaculture.2011. 09.009.
Cheng D W,Zhang H K,Liu H X,Zhang X X,KarSoon T,Li S K,Ma H Y,Zheng H P. 2020. Identification and molecular characterization of peroxiredoxin 6 from noble scallop Chlamys nobilis revealing its potent immune response and antioxidant property[J]. Fish & Shellfish Immunology,100(15):368-377. doi:10.1016/j.fsi.2020.03. 021.
Duan Y F,Liu P,Li J T,Li J,Gao B Q,Chen P. 2013. cDNA cloning,characterization and expression analysis of pero-xiredoxin 5 gene in the ridgetail white prawn Exopalaemon carinicauda[J]. Molecular Biology Reports,40:6569-6577. doi:10.1007/s11033-013-2702-4.
Fujii J,Ikeda Y. 2002. Advances in our understanding of pero-xiredoxin,a multifunctional,mammalian redox protein[J]. Redox Report,7(3):123-130. doi:10.1179/13510 0002125000352.
Gross P S,Bartlett T C,Browdy C L,Chapman R W,Warr G W. 2001. Immune gene discovery by expressed sequence tag analysis of hemocytes and hepatopancreas in the Pacific white shrimp,Litopenaeus vannamei,and the Atlantic white shrimp,L. setiferus[J]. Developmental & Comparative Immunology,25(7):565-577. doi:10.1016/s0145- 305x(01)00018-0.
Hofmann B,Hecht H J,Flohé L. 2002. Peroxiredoxins[J]. Biological Chemistry,383(3-4):347-364. doi:10.1515/BC. 2002.040.
Kang S W,Rhee S G,Chang T S,Jeong W J,Choi M H. 2005. 2-Cys peroxiredoxin function in intracellular signal transduction:Therapeutic implications[J]. Trends in Molecular Medicine,11(12):571-578. doi:10.1016/j.molmed.2005.10.006.
Mu C K,Zhao J M,Wang L L,Song L S,Zhang H,Li C H,Qiu L M,Gai Y C. 2008. Molecular cloning and characterization of peroxiredoxin 6 from Chinese mitten crab Eriocheir sinensis[J]. Fish & Shellfish Immunology,26(6):821-827. doi:10.1016/j.fsi.2008.10.006.
Roszer T. 2014. The invertebrate midintestinal gland(“hepatopancreas”) is an evolutionary forerunner in the integration of immunity and metabolism[J]. Cell and Tissue Research,358:685-695. doi:10.1007/s00441-014-1985-7.
Tu D D,Zhou Y L,Gu W B,Zhu Q H,Xu B P,Zhou Z K,Liu Z P,Wang C,Chen Y Y,Shu M A. 2018. Identification and characterization of six peroxiredoxin transcripts from mud crab Scylla paramamosain:The first evidence of peroxiredoxin gene family in crustacean and their expression profiles under biotic and abiotic stresses[J]. Molecular Immunology,93:223-235. doi:10.1016/j.molimm. 2017.11.029.
Wood Z A,Schr?der E,Robin H J,Poole L B. 2003. Structure,mechanism and regulation of peroxiredoxins[J]. Trends in Biochemical Sciences,28(1):32-40. doi:10. 1016/s0968-0004(02)00003-8.
Zhang Q L,Huang J,Li F H,Liu S,Liu Q H,Wei J K,Liang G F,Xiang J H. 2014. Molecular characterization,immune response against white spot syndrome virus infection of peroxiredoxin 4 in Fenneropenaeus chinensis and its antioxidant activity[J]. Fish & Shellfish Immunology,37(1):38-45. doi:10.1016/j.fsi.2013.12.026.
(責任编辑 兰宗宝)
收稿日期:2020-08-25
基金项目:中央级公益性科研院所基本科研业务费专项(2020TD36);江苏省农业重大新品种创制项目(PZCZ201749);江苏省现代农业产业技术体系建设专项(JATS〔2019〕385);江苏省渔业技术类重大项目(D2018-4)
通讯作者:唐永凯(1978-),https://orcid.org/0000-0002-5643-2844,博士,研究员,主要从事河蟹遗传育种研究工作,E-mail:tangyk@ffrc.cn
第一作者:李辉(1995-),https://orcid.org/0000-0003-2207-9090,研究方向为河蟹遗传育种,E-mail:1147067174@qq.com
