川芎嗪通过调控组蛋白乙酰化修饰上调SERCA2a对心力衰竭小鼠模型的防治机制研究
2021-12-14张文华
杨 英, 张文华,丁 铭, 吴 翔
(1.陕西省第四人民医院重症医学科 ,西安 710043; 2.西安交通大学医学院基础医学院,西安 710012)
心力衰竭(heart failure, HF)是以系统性灌注为特征的临床综合征,由于心脏功能受损,其不足以满足人体的代谢需求,全球估计患病率>3 770 万[1]。尽管实质性疗效与基于证据的疗法相关,例如血管紧张素转化酶抑制剂(angiotensin converting enzyme inhibitor,ACEI)、血管紧张素受体阻滞剂(angiotensin receptor blocker,ARB)、醛固酮拮抗剂和β-肾上腺素能受体阻滞剂(β-受体阻滞剂),但不良的临床结果仍然是主要公众健康问题,并且该综合征的患病率在全球范围内继续扩大[2]。因此,急需开发针对新靶标或基于新机制的新型治疗药物。
心肌肌浆网Ca2+-ATPase 2a(sarcoplasmic reticulum Ca2+-ATPase,SERCA2a)调节细胞内钙的处理,在心脏收缩和舒张中起关键作用[3]。在压力超负荷引起的心力衰竭的动物模型中,SERCA2a mRNA和蛋白的表达水平显著降低[4-5]。因此,通过基因修饰增加SERCA2a 的表达或活性被认为是解决心力衰竭的一种革命性方法[6-7]。研究表明,通过腺病毒基因转移SERCA2a 在肌细胞中的过度表达导致收缩力增加和瞬时钙的更快松弛,进而改善压力超负荷引起的心力衰竭动物的心肌功能[8]。最近,在压力超负荷引起的心力衰竭小鼠模型中,发现组蛋白表观遗传修饰可调节SERCA2a[9],这表明SERCA2a 的表观遗传调控可能代表预防心力衰竭的新机制。
川芎嗪(ligustrazine,LGSZ)已被证明对人类的病理和生理过程,尤其是心血管疾病具有多重影响[10-11],其注射液临床防治心力衰竭疗效确切,但是,LGSZ预防心力衰竭的表观遗传机制仍不清楚,推测LGSZ可能通过调节SERCA2a参与心衰防治。为验证上述结果,本研究建立心衰小鼠动物模型,探讨LGSZ 对SERCA2a 表达的影响及其可能的机制,具体报道如下。
1 材料和方法
1.1 实验动物 成年雄性小鼠C57BL/6(8~10周大)购自实验动物中心。动物饲养和实验过程遵循中国医学科学院动物伦理委员会相关规定。将小鼠饲养在单独通风的笼子中(25℃,湿度55~65%),光照/黑暗周期为12h,自由饮食。将动物随机分为四组,即假手术组(SHAM)、TAC 组、TAC + LGSZ 组和SHAM + LGSZ 组,每组10 只小鼠。TAC + LGSZ 和SHAM + LGSZ 组的小鼠在手术后每天一次通过腹膜内注射用单剂量(50 mg / kg /天)的LGSZ(阿拉丁,中国)治疗,持续12 周。
1.2 仪器与试剂 超声为加拿大Visual Sonics 公司的Vevo 2100 超声高分辨率成像系统,图像拍照采集采用日本尼康DS-Fi3 显微镜相机,英国Syngene公司的G-BOX 成像系统UK。
RNA 提取试剂盒(Bioteck,中国),蛋白质提取试剂盒(Key-GEN Bio-TECH,中国),oligo dTadaptor 引物和AMV 逆转录酶试剂盒(TaKaRa,日本),SYBR Green Real Master Mix 试剂盒(Tiangen,中国),SERCA2a(Abcam,美国)和GAPDH(Arigo,台湾),ChIP 分析试剂盒,GATA4 及Mef2c(Abcam,美国),甲醛(SigmaAldrich,美国),HDAC1 活性测定试剂盒(BioVision,美国)。
1.3 方法
1.3.1 微创主动脉缩窄术(transverse aortic constriction,TAC): 使用微创TAC 方法造模[12]。通过吸入1.5%~2.5%的异氟烷麻醉小鼠,并在整个过程中使用加热垫保持体温在36~37℃之间。在胸骨上切迹的水平切出一个长度为7~10 mm 的水平皮肤切口。然后,甲状腺缩回并且胸骨暴露。在胸骨上切下5mm 的纵向切口,缩回胸腺,以便在低倍放大下观察主动脉弓。在弯曲的27 号针头的引导下,将6-0 丝线缝合穿过无名氏动脉和左颈总动脉起点之间的主动脉弓。将另一个27 号针头放置在主动脉弓旁边,并将缝合线整齐地绑在针头和主动脉周围。结扎后,取下针头。用4-0 尼龙缝合线缝合皮肤,让小鼠在加热垫上干净的笼子中完全康复。丁丙诺啡每天一次皮下给药,持续3 天,用于术后镇痛。观察动物的术后健康状况和手术部位,并每天记录两次,共7 天,直到缝线被移除,然后每天给药一次,持续3 个月。
1.3.2 超声心动图:使用Vevo 2100 高分辨率成像系统进行超声心动图研究。所有测量均由同一人执行。用1.0%~1.5%的异氟烷麻醉小鼠,然后将它们放在加热垫上。用脱毛膏去除心前区的毛发。拍摄B 模式图像以测量心室和主动脉结构,拍摄M 模式图像以测量心室功能。拍摄P 模式图像以测量血流速度。分析所有数据以评估TAC 效果。手术后3 天,经胸多普勒超声心动图检查TAC 效果。手术后12周经胸腔超声心动图检查后,用异氟烷处死小鼠并收集心脏。
1.3.3 苏木素-伊红(Hematoxylin eosin,HE)染色:心脏组织用4g/dl 多聚甲醛固定,用乙醇脱水,包埋在石蜡中,切成5mm 切片,然后用苏木素-伊红染色。于400 倍放大下拍摄四组小鼠的心室切片照片(尼康,日本)。
1.3.4 实时定量聚合酶链式反应(quantitative polymerase chain reaction,qPCR):使用Bioteck RNA提取试剂盒提取总RNA。使用oligo dT-adaptor 引物和AMV 逆转录酶试剂盒从500~1 000 ng RNA中逆转录cDNA。使用SYBR Green RealMaster-Mix 试剂盒进行RT-PCR 分析,检测cDNA。量化SERCA2a 的mRNA 表达水平,并以GAPDH标准化样品中的RNA 水平。SERCA2a 的为5’-T CGACCAGTCAATTCTTACAGG-3’ 和5’-CAGGG ACAGGGTCAGTATGC-3’,GAPDH的引物序列为5’-AAGAAGGTGGTGAAGCAGGCATC-3’ 和5’-CGGCATCGAAGGTGGAAGAGTG-3’。
1.3.5 蛋白质印迹分析:使用Key-GEN Bio-TECH蛋白质提取试剂盒,从心脏组织中提取总蛋白质,然后使用BCA 分析法(BioTeke Biotechnology,中国)进行定量。在12g/dl SDS-PAGE 凝胶上分离总蛋白(每泳道50μg)并转移到PDVF 膜上。使用SERCA2a 和GAPDH 特异性一抗,通过蛋白质印迹分析与PDVF 膜结合的蛋白质。使用G-BOX 成像系统分析和定量条带强度。
1.3.6 染色质免疫沉淀(chromatin immunoprecipitation assay,ChIP)测定:使用ChIP 分析试剂盒进行ChIP 实验。心脏组织均质化后,将1g/dl 甲醛添加到样品中,以使蛋白质与DNA 交联。然后,使用超声波(Bioruptor UCD-200)将交联DNA 片段化成小片段(500~1 000 bp)。使用特异乙酰化组蛋白3(AcH3),H3 中的赖氨酸4(lysine 4 of hisAcH3K4),H3 中的赖氨酸9(AcH3K9),组蛋白去乙酰化酶1(histone deacetylases 1,HDAC1),GATA4 和Mef2c 的单克隆抗体沉淀蛋白质-DNA 复合物。抗RNA 聚合酶抗体用作阳性对照,抗小鼠IgG 用作阴性对照。去除交联的蛋白质-DNA 复合物,并提取DNA。设计特定的qPCR 引物来确定Atp2a2 近端启动子区域附近的AcH3,AcH3K4 和AcH3K9 的水平。用于扩增SERCA2a 启动子的qPCR 引物序列如下:5’-AGC CAAG GACACCAGTGC-3’ 和5’-GGGATAGAGCG CG GAGTT-3’。
1.3.7 HDAC1 活性测定:使用HDAC1 活性测定试剂盒确定HDAC1 活性。简而言之,在蛋白质提取和蛋白质浓度测量之后,向每个500μl 反应中添加6μl HDAC1 抗体或对照抗体,并将该反应在4℃下孵育过夜。将蛋白质-A / G(25μl)添加到每个反应中,在4℃孵育1h。然后将每个反应在4℃下以14 000×g 离心10s,并弃去上清液。随后将包含HDAC 分析缓冲液和HDAC1 底物的反应化合物添加到每个反应中,并在37℃下孵育2h,向每个试管中加入20μl 显影剂,并在37℃下孵育30min。按照说明稀释AFC(7-氨基-4-三氟甲基香豆素)标准品,对于每份100μl 的反应,读取Ex / Em = 380nm/500 nm 的荧光(SYNERGY / H1 微板读数器,BioTek)。绘制AFC 标准曲线,并将样品读数应用于AFC 标准曲线,以获得样品孔中B pmol的AFC。样本HDAC1 活性的计算如下:HDAC1活性= 2×B / TS(pmol / min / mg = mU),其中B =标准曲线中的AFC 量,T =反应时间= 120min,S =蛋白量。
1.4 统计学分析 使用SPSS 22.0 进行统计学分析,定量数据显示为均值±标准差(±s)。通过twoway 或 three-way ANOVA 和事后Bonferroni-Dunn检验进行比较,P<0.05 为差异具有统计学意义。
2 结果
2.1 小鼠TAC 术后评估 见图1。超声心动图显示,TAC 干预前后无名和左颈动脉之间的横向收缩部位主动脉直径(图1A)。TAC 小鼠主动脉解剖图显示主动脉狭窄(图1B)。TAC 组和LGSZ + TAC组主动脉横径和血流量比较(图1D,1C),差异均无统计学意义(t=0.413,0.186,P=0.127,0.216)。
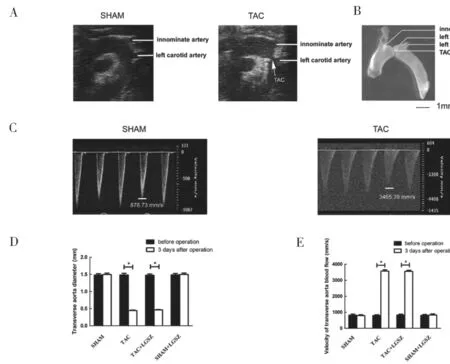
图1 小鼠TAC 术后评估
2.2 手术前后超声心动图参数比较 见表1,表2。术前和术后12 周采用无创超声心动图测量来评估心脏壁厚度的变化。与手术前相比,术后12周时TAC 组心脏左心室前壁舒张末期厚度(left ventricular anterior wall diameter,LVAWd)和舒张末期左室后壁厚度(left ventricular posterior wall diameter,LVPWd)的厚度增加,差异有统计学意义(P<0.05),但其他组手术前后比较,差异无统计学意义(P>0.05)。TAC+LGSZ 组手术前后LVAWd,LVPWd,射血分数(ejection fraction,EF)及缩短分数(fractional shortening,FS)比较,差异均无统计学意义(均P>0.05)。
表1 手术前后超声心动图参数比较(±s)
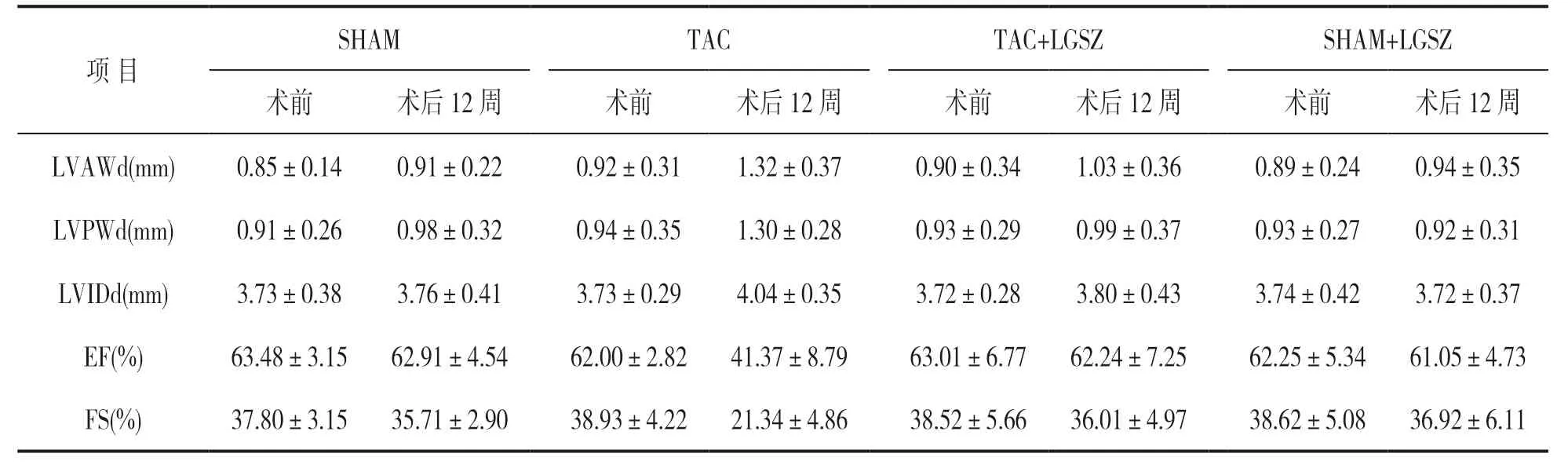
表1 手术前后超声心动图参数比较(±s)
项 目SHAM TAC TAC+LGSZ SHAM+LGSZ术前 术后12 周 术前 术后12 周 术前 术后12 周 术前 术后12 周LVAWd(mm) 0.85±0.14 0.91±0.22 0.92±0.31 1.32±0.37 0.90±0.34 1.03±0.36 0.89±0.24 0.94±0.35 LVPWd(mm) 0.91±0.26 0.98±0.32 0.94±0.35 1.30±0.28 0.93±0.29 0.99±0.37 0.93±0.27 0.92±0.31 LVIDd(mm) 3.73±0.38 3.76±0.41 3.73±0.29 4.04±0.35 3.72±0.28 3.80±0.43 3.74±0.42 3.72±0.37 EF(%) 63.48±3.15 62.91±4.54 62.00±2.82 41.37±8.79 63.01±6.77 62.24±7.25 62.25±5.34 61.05±4.73 FS(%) 37.80±3.15 35.71±2.90 38.93±4.22 21.34±4.86 38.52±5.66 36.01±4.97 38.62±5.08 36.92±6.11
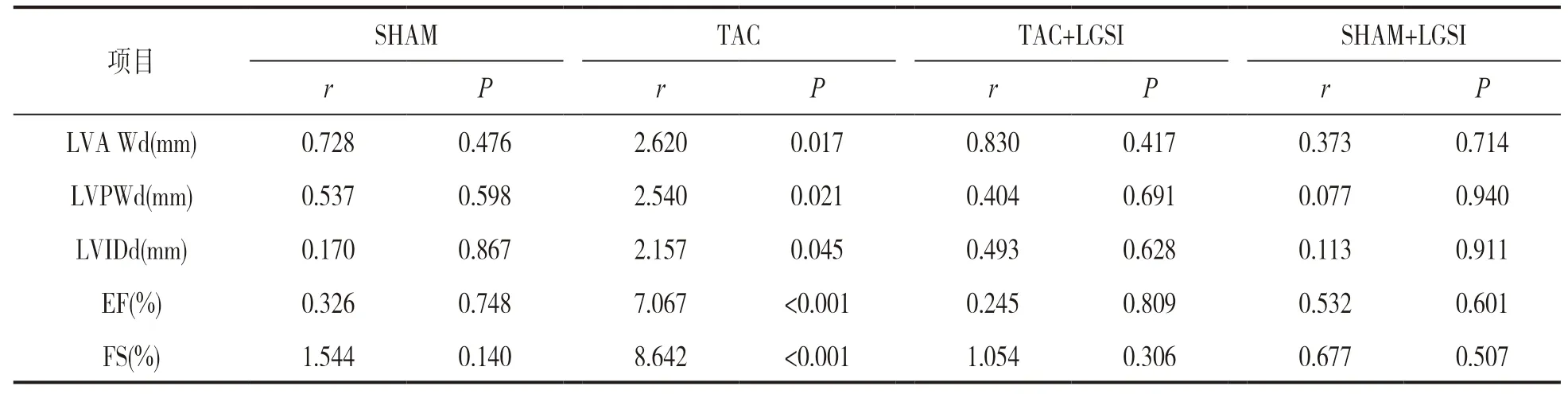
表2 手术前后超声心动图参数统计学分析
2.3 SERCA2a mRNA 和SERCA2a蛋白检测结果 见图2。qPCR 和蛋白质印迹分析结果显示,TAC+LGSZ 组SERCA2a mRNA 和SERCA2a 蛋 白表达显著高于TAC 组,差异有统计学意义(t=4.817,3.913,均P<0.05)。
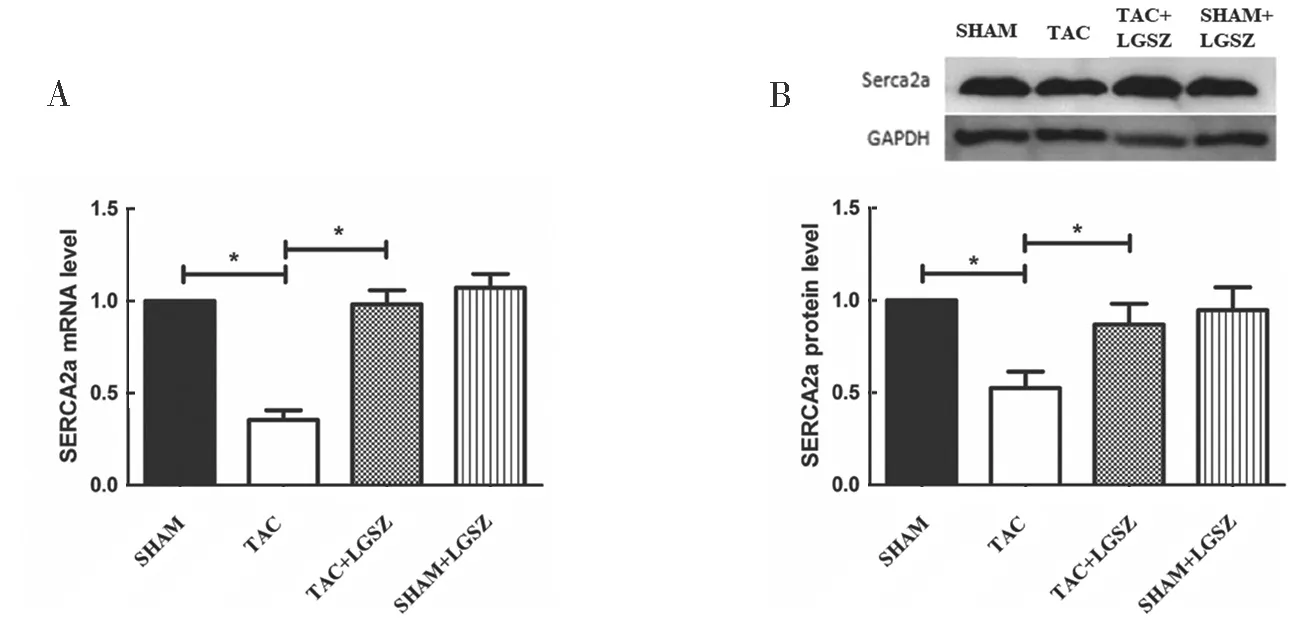
图2 SERCA2a mRNA 和SERCA2a 蛋白检测结果
2.4 各组AcH3 和AcH3K9 水平比较 见图3。TAC 组SERCA2a 的启动子元件附近的AcH3 和AcH3K9 水平低于SHAM 组,差异有统计学意义(t=2.437,2.918,P=0.024,0.013)。TAC+LGSZ组中总AcH3 和AcH3K9 与SHAM 组比较,差异无统计学意义(t=0.624,1.249,P=0.540,0.228)。
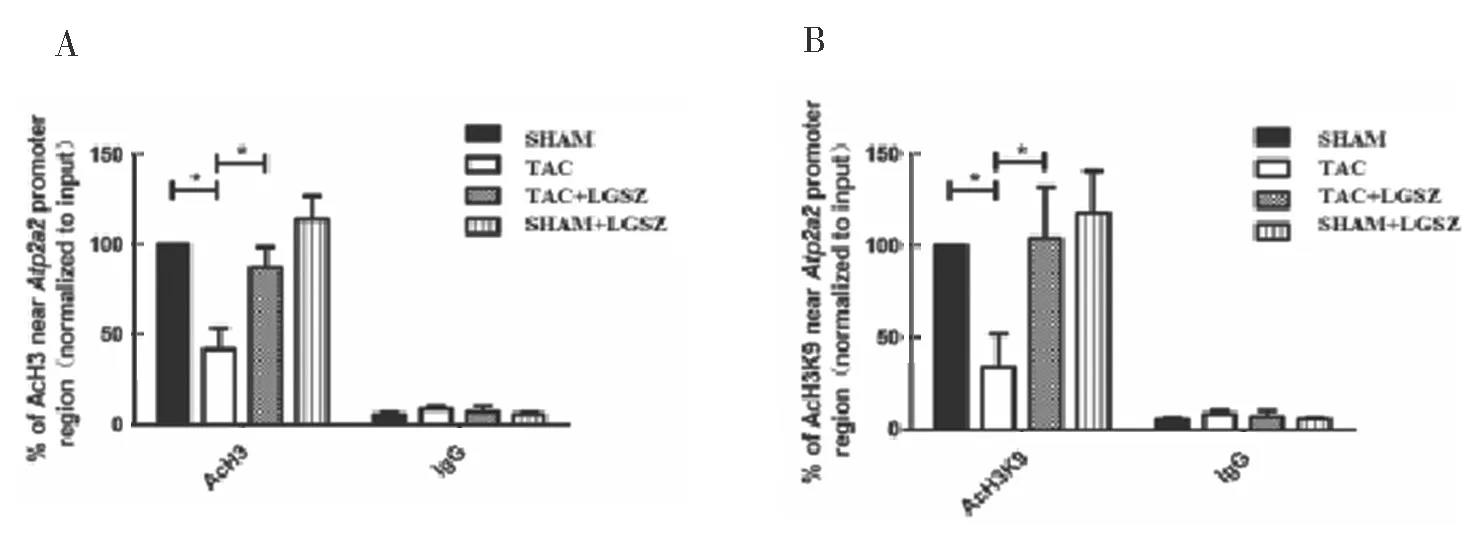
图3 各组AcH3 和AcH3K9 水平比较
2.5 各组Atp2a2 启动子附近HDAC1 酶活性和HDAC1 水平比较 见图4。TAC 组HDAC1 酶活性和HDAC1 水平均高于SHAM 组和TAC+LGSZ组,差异均有统计学意义(t=4.309,2.713,2.812,2.361,P<0.001,0.014,0.012,0.030)。
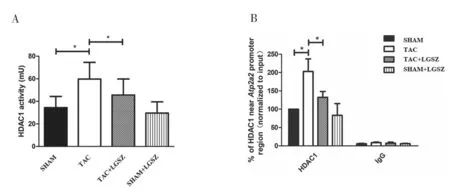
图4 各组Atp2a2 启动子附近HDAC1 酶活性和HDAC1 水平比较
2.6 各组Atp2a2 启动子区域附近GATA4 和Mef2c 水平比较 见图5。TAC 组心脏组织中,Atp2a2 启动子区域附近GATA4 和Mef2c 水平低于TAC+LGSZ 组,差异有统计学意义(t=4.816,5.007,均P<0.001)。
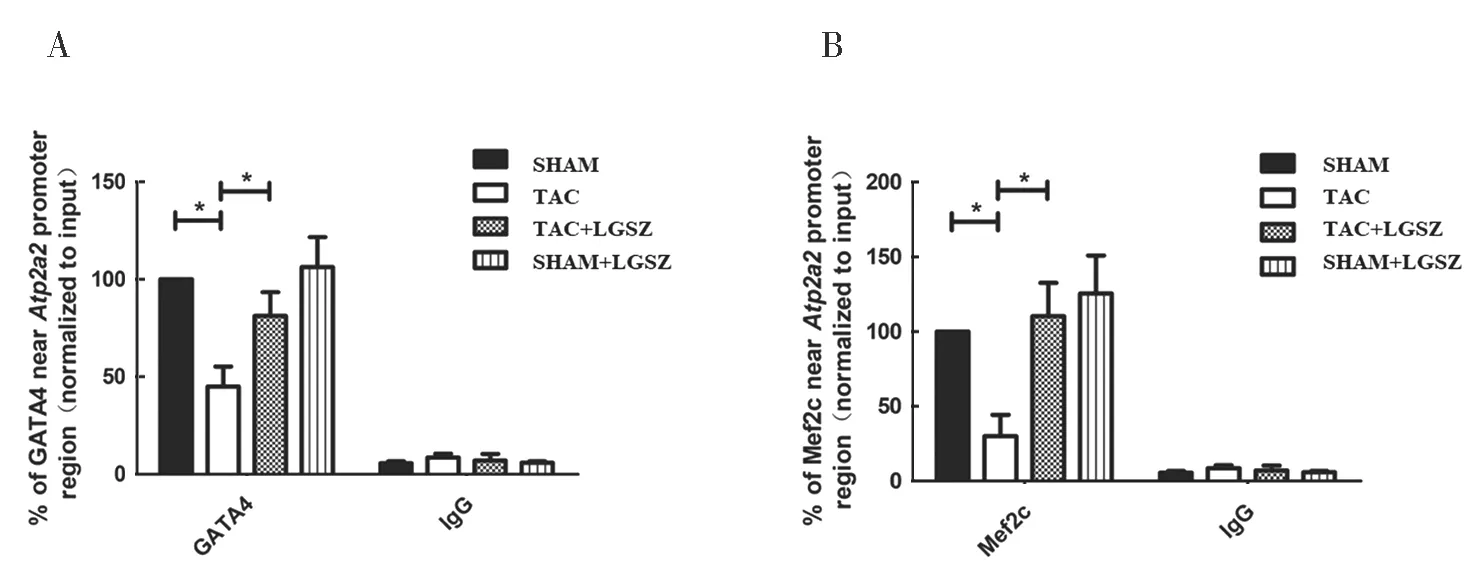
图5 Atp2a2 启动子区域附近GATA4 和Mef2c 水平
3 讨论
高血压、冠心病和糖尿病等损害或过度劳累心肌的疾病均可能导致心力衰竭。高血压是心力衰竭的最重要原因之一,压力超负荷会使心肌细胞承受较高的机械压力和神经激素,从而增加心肌质量并导致左心室肥大,进而发展为心力衰竭[13]。尽管多年来已经开发了多种抗心衰药物,但是在治疗该疾病方面疗效欠佳。近年来研究发现表观遗传调控在心力衰竭中起重要作用,但其具体机制尚不清楚[14]。心脏核心转录因子GATA4 和Mef2c 被证明在Atp2a2 转录的调控中发挥作用[15]。因此,本研究通过ChIP 测定Atp2a2 启动子附近转录因子结合水平。研究结果表明,TAC 组心脏组织中,Atp2a2 启动子区域附近的GATA4 和Mef2c 水平低于TAC+LGSZ 组,这可能是由于组蛋白的低乙酰化引起的。LGSZ 处理后,GATA4 和Mef2c 的结合显著增加,表明LGSZ 可逆转与Atp2a2 相关的组蛋白乙酰化作用。增加的HDAC1 活性和与编码SERCA2a(Atp2a2)基因的启动子结合,可导致组蛋白3 赖氨酸9 的低乙酰化和与该启动子区域结合的转录因子减少。进一步的研究表明,LGSZ 可以抑制HDAC1 的活性和与Atp2a2 近端启动子区域的结合,以挽救SERCA2a 的低表达并改善心脏功能。
SERCA2a 在调节心脏功能中起关键作用,其在心力衰竭中的低表达[16-17]。TAC 可诱发心力衰竭后SERCA2a 的蛋白和mRNA 水平降低。但是,这种下调SERCA2a 的潜在表观遗传机制仍不清楚。最近,一项研究表明,在慢性压力超负荷的条件下,组蛋白修饰在成人鼠左心室SERCA2a 启动子重编程基础[16],提示组蛋白相关的表观遗传调控SERCA2a 和表观遗传学在心力衰竭病因中的潜在作用。组蛋白表观遗传修饰包括乙酰化、甲基化、磷酸化、泛素化和SUMO 化[18-19]。乙酰化是最重要的组蛋白修饰之一,可导致染色质重塑和基因表达的激活。而且,基因近端启动子附近的乙酰化不足会导致染色质紧缩,并可能影响转录因子与近端启动子关键顺式元件的结合亲和力[20]。在本研究中,我们发现,心力衰竭后,Atp2a2 启动子区域附近的总AcH3 以及亚型AcH3K9 的结合减少,活性转录因子GATA4 和Mef2c 的结合减少。但是,这种模式在AcH3K4 亚型中未观察到,表明在心力衰竭后SERCA2a 调节过程中H3 乙酰化赖氨酸位点的选择性控制。
HDAC 可从组蛋白的ε-N-乙酰赖氨酸氨基酸中除去乙酰基,使组蛋白更紧密地包裹DNA。根据与原始酵母酶的序列同源性和域结构,HDAC 可以分为四类。HDAC1 可以增强DNA 和组蛋白之间的静电吸引力,并增加染色质的紧密度,从而导致基因表达降低。抑制I 类HDAC 可抑制压力超负荷引起的心室肥大并显著改善收缩功能[14,21],表明I 类HDAC 在心力衰竭期间起关键作用。本研究结果表明,HDAC1 的活性增加且与Atp2a2 启动子区域结合,这表明它可能是TAC 诱导的小鼠心衰期间乙酰化过低介导的SERCA2a 下调的原因。LGSZ 临床防治心力衰竭疗效确切,然而其具体机制尚不清晰,本研究发现TAC+LGSZ 组SERCA2a mRNA 和SERCA2a 蛋白表达显著高于TAC 组,提示LGSZ 可以逆转TAC 后观察到SERCA2a 的表达,同时,LGSZ 处理后乙酰化的H3 和H3K9 上调,进一步发现,LGSZ 可以抑制HDAC1 的活性和结合力。
综上,LGSZ 可以抑制HDAC1 活性,并与编码SERCA2a 基因的启动子结合,从而通过增强AcH3 和AcH3K9 与该基因近端启动子的结合而导致SERCA2a 表达增加,表明LGSZ 通过组蛋白乙酰化的修饰来上调SERCA2a 在压力超负荷引起的心力衰竭中起预防作用,可能代表了一种心力衰竭治疗的新方法。
