枸杞皂苷通过调控Suv39H1/JAK2/STAT3通路对鼻咽癌细胞增殖、侵袭和凋亡的影响
2021-12-14胡鹏刚张昌明空军军医大学第一附属医院西京医院耳鼻咽喉头颈外科西安710032
胡鹏刚,张昌明(空军军医大学第一附属医院西京医院耳鼻咽喉头颈外科,西安 710032)
鼻咽癌是临床最常见的恶性肿瘤之一,目前的治疗方法尚未明显改善鼻咽癌患者的生存率[1-2]。据报道组蛋白甲基化酶Suv39H1 作为癌基因与肿瘤转移密切相关[3-4]。有研究发现中药皂苷通过下调促癌基因表达促进鼻咽癌CNE-2 细胞的自噬和凋亡[5]。此外,研究发现在从用植物黄酮处理的癌细胞分离的组蛋白中注意到降低的组蛋白甲基转移酶EZH2表达和H3K27 的三甲基化[6]。黄芩苷通过下调Suv39H1 的表达和H3K9 甲基化水平起到抗肿瘤的作用[7]。枸杞皂苷,又名短葶山麦冬皂苷C,其富含皂苷和黄酮等有效成分,通过抑制血管生成,肿瘤增殖、黏附和侵袭,表现出抗肿瘤转移的作用[8]。因此,推测枸杞皂苷可能通过调节Suv39H1 的表达抑制鼻咽癌发展。本研究通过枸杞皂苷干预鼻咽癌CNE-2细胞观察细胞增殖、凋亡、侵袭以及Suv39H1 蛋白表达的变化,旨在为鼻咽癌治疗提供新依据。
1 材料与方法
1.1 研究对象 研究时间为2019年8月~2020年9月,人鼻咽癌细胞系(HONE1,C666-1,CNE-1和CNE-2)和人鼻咽上皮细胞(NP69)购自中国医学科学院基础医学研究所,在温度为37℃,5 %(v/v)CO2,湿润的细胞培养箱中孵育。从得到组织病理学证实的15 例患者(男性,年龄32.46 ±9.77 岁)收集鼻咽癌组织和邻近组织样品。所有患者均未接受放疗或化疗,没有其他疾病和肿瘤。所有鼻咽癌患者均签署了知情同意书。本研究经西安交通大学医学部伦理委员会批准。动物实验程序严格按照机构动物护理和使用委员会批准的方案进行。
1.2 仪器与试剂 枸杞皂苷(西安康诺化工有限公司);RPMI-1640 培养液、胎牛血清购自美国Hyclone 公司;青霉素-链霉素、0.25g/dl 胰蛋白酶/EDTA 消化液(美国Sigma 公司);转染试剂Lipofectamine®3000 购自美国Sigma 公司;JAK2,p-JAK2,STAT3,p-STAT3 及Suv39H1 等一抗及相应二抗(美国Santa Cruz 公司);RT-qPCR 试剂盒RNA 提取试剂盒,RT 反转录试剂盒,蛋白提取试剂盒,引物合成由上海生工合成;Lipofectamine®3000转染试剂购自美国Thermo 公司;CCK-8 试剂盒,Annexin V-FITC 检测试剂盒,Transwell 小室(美国Millipore 公司);高通量实时荧光定量聚合酶链式反应(PCR)仪(Roche 公司,瑞士),Western blot系统(北京六一仪器厂DYY-7C),台式低温高速离心机(日本KUBOTA 公司),细胞培养箱(上海力申科学仪器公司),流式细胞仪(美国Beckman 公司),凝胶成像分析仪(广州瑞丰实验设备有限公司)。
1.3 方法
1.3.1 细胞培养及分组:将鼻咽癌细胞CNE-2 复苏后,置于含10ml/dl 胎牛血清和1g/dl 青链霉素(100 U/ml 青霉素、100 U/ml 链霉素)的RPMI-1640 培养液于37℃,5%(v/v) CO2恒温箱中培养。当细胞汇合至70%时,用不同浓度枸杞皂苷(0,2.5,5,10,50,100 和200μmol/L)分别处理细胞24 h 检测细胞活力,筛选合适浓度;使用5,10 和50μmol/L 的枸杞皂苷分别干预细胞,在0,24,48 和72 h 时检测细胞增殖,48 h 后检测细胞凋亡率和侵袭率;将pcDNA-Suv39H1 和Suv39H1 siRNA 分别转染于细胞内,检测细胞增殖、凋亡和侵袭;转染pcDNA-Suv39H1 载体于细胞中,24 h后使用50 μmol/L 枸杞皂苷干预细胞,48 h 后检测细胞增殖、凋亡和侵袭。
1.3.2 细胞转染:Suv39H1 过表达载体(pcDNASuv39H1)和针对Suv39H1 的siRNA(Suv39H1 siRNA)均获自上海生工公司(中国上海)。转染前,使用1g/dl 胰蛋白酶处理消化细胞。在血液计数室中计数后,将细胞接种到六孔培养板上24 h,然后以40%~60%汇合率转染。所有转染均使用Lipofectamine®3000 根据制造商的说明进行。转染后48 h,收获细胞并进行下一步分析。
1.3.3 实时荧光定量-PCR:检测组蛋白甲基转移 酶Suv39H1 的mRNA水平,按照TRIZOL 试剂盒说明书提取各组细胞总RNA,并用紫外分光光度计检测RNA 的纯度和浓度。随后,使用Takara 反转录试剂盒反转录各组检测基因,并使用SYBR Green PCR Master Mix 扩增反转录后的产物,以β-actin 作为内参基因。Suv39H1 上游引物:5’-GGTGGTGGGGAAGAAGCTGG-3’;下游引物:5’-TCCCACCTCTCCACGAAGTT-3’。β-actin 上游引物:5’-TACAACCTCCTTGCAGCTCC-3’;下游引物:5’-GGATCTTCATGAGGTAGTCAGTC-3’。采 用Applied Biosystems 7900HT qPCR 系统按照以下参数进行qPCR:95℃预变性2 min,94℃变性15 s,55℃退火25 s,在72℃延伸15 s,进行35 个循环。PCR 产物经1g/dl 琼脂糖凝胶电泳检测,依据2-ΔΔCt法计算各样本mRNA 的相对表达量。
1.3.4 Western blot 检测法:检测Suv39H1 和JAK2/ STAT3 通路蛋白JAK2,p-JAK2,STAT3 和p-STAT3的表达。将各组细胞按照每孔1×105的密度接种于6 孔板,24 h 后采用蛋白质定量(bicinchoninic acid,BCA)法进行蛋白定量,各取30μl 样品进行十二烷基硫酸钠聚炳烯酰胺凝胶电泳(SDSPAGE),再将蛋白转移至膜上,5g/dl 脱脂奶粉室温封闭1 h,加入I 抗,4℃孵育过夜。加入II 抗(1∶ 1 000,ab150077)37℃ 孵育45 min,用ECL 液显影,使用化学发光试剂盒在化学发光系统检测,随后结果采用Image-Pro Plus 6 软件(Media Cybernetics)分析,以待测蛋白与内参照GAPDH 的灰度值比值作为蛋白的相对表达量。
1.3.5 CCK-8 实验检测细胞活力:将各组细胞按照每孔1×105的密度接种于96 孔板中,用含10ml/dl胎牛血清的RPMI-1640 培养液制成单细胞悬液,置于37℃、5%(v/v)CO2的条件下培养。每组设5个复孔,加入20 μl CCK-8 溶液。培养24 h,于酶标仪450 nm 处检测吸光度(A)值。取5 孔A值的平均数,按照下列公式计算细胞相对活力:细胞相对活力(%)=处理组A/对照组A×100%。
1.3.6 流式细胞术检测细胞凋亡:根据制造商说明使用双染凋亡试剂盒Annexin-V FITC/PI处理细胞,于1 h 内,在流式细胞仪上使用Beckman CXP 软件检测细胞凋亡情况。
1.3.7 Transwell 实验检测细胞侵袭能力:在Transwell 上室加入300 μl 预温的无血清RPMI-1640 培养液,使用无血清培养液将待测细胞制成浓度为1×106/ml 的单细胞悬液,取细胞悬液100~200 μl加入Transwell 上室中,并于下室中加入500 μl 含10ml/dl 胎牛血清的RPMI-1640 培养液,在37℃环境下培养细胞12~24 h,使用0.5g/dl 的结晶紫对上室底部细胞进行染色,用棉签除去上室内侧细胞,显微镜下观察细胞形态并统计细胞数量。
1.4 统计学分析 数据均采用SPSS 20.0 统计软件进行统计学分析,呈正态分布的计量资料以均数±标准差(±s)表示。采用ANOVA 方差分析、Dunnett-t法比较总体和总体中两样本均数之间的差异。以P<0. 05 为差异有统计学意义。
2 结果
2.1 观察枸杞皂苷对鼻咽癌CNE-2 细胞生物学行为的影响 与0 μmol/L 枸杞皂苷干预组比较,不同浓度枸杞皂苷干预剂量依赖性降低CNE-2 细胞活力(P<0.01),见表1。与对照组比较,5,10 和50 μmol/L枸杞皂苷干预组CNE-2 细胞增殖力呈剂量依赖性显著降低,ANOVA 比较差异有统计学意义(P<0.01),见表2。与对照组相比,5,10 和50 μmol/L 枸杞皂苷干预组CNE-2细胞凋亡率呈剂量依赖性增加至(15.70±1.18)%(F=5.232,P=0.026 1),细胞侵袭数剂量依赖性减少至(32.66±2.51)%(F=4.807,P=0.031 5),ANOVA 比较差异均具有统计学意义,见图1。
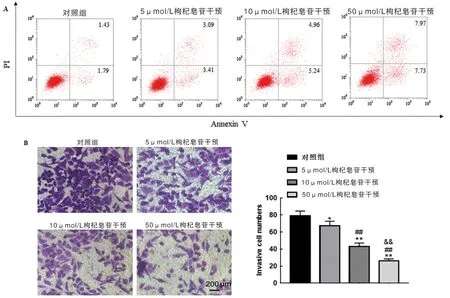
图1 枸杞皂苷对鼻咽癌CNE-2 细胞凋亡和侵袭的影响
表1 不同浓度枸杞皂苷干预后CNE-2 细胞活力(n=3,±s)
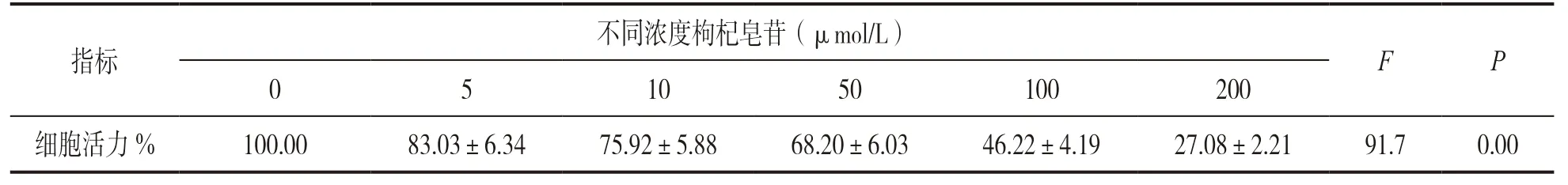
表1 不同浓度枸杞皂苷干预后CNE-2 细胞活力(n=3,±s)
指标不同浓度枸杞皂苷(μmol/L)F P 0 5 10 50 100 200细胞活力% 100.00 83.03±6.34 75.92±5.88 68.20±6.03 46.22±4.19 27.08±2.21 91.7 0.00
表2 不同浓度枸杞皂苷干预CNE-2 细胞后的细胞增殖力比较(n=3,±s)
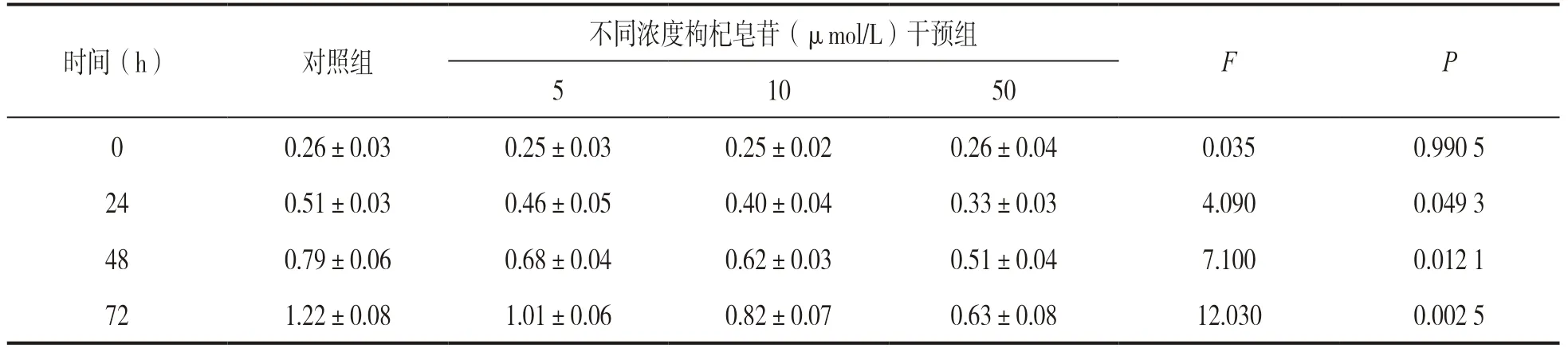
表2 不同浓度枸杞皂苷干预CNE-2 细胞后的细胞增殖力比较(n=3,±s)
时间(h) 对照组不同浓度枸杞皂苷(μmol/L)干预组F P 5 10 50 0 0.26±0.03 0.25±0.03 0.25±0.02 0.26±0.04 0.035 0.990 5 24 0.51±0.03 0.46±0.05 0.40±0.04 0.33±0.03 4.090 0.049 3 48 0.79±0.06 0.68±0.04 0.62±0.03 0.51±0.04 7.100 0.012 1 72 1.22±0.08 1.01±0.06 0.82±0.07 0.63±0.08 12.030 0.002 5
2.2 不同剂量枸杞皂苷对鼻咽癌CNE-2 细胞中Suv39H1 表达的影响 见图2。与对照组相比,枸杞皂苷干预组CNE-2 细胞中Suv39H1 的mRNA(F=25.75,P= 0.000 2)和蛋白(F=14.64,P= 0.001 3)表达均随着枸杞皂苷浓度增加而减少,ANOVA 比较差异具有统计学意义。
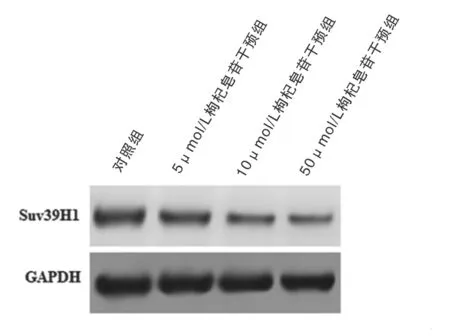
图2 Western blot 检测CNE-2 细胞中Suv39H1 蛋白表达
2.3 组蛋白甲基化酶Suv39H1 在鼻咽癌中高表达 本实验通过Western blot 测定15 对鼻咽癌患者肿瘤组织和相邻非肿瘤组织中Suv39H1 的表达水平。结果显示,与正常组织(normal)相比,Suv39H1 在鼻咽癌组织中高表达,unpaired-t检验比较差异具有统计学意义(P<0.01),见图3A。与正常鼻咽上皮细胞(NP69)相比,Suv39H1 在鼻咽癌细胞系(HONE1,C666-1,CNE-1 和CNE-2)中高表达,Dunnett-t检验,差异具有统计学意义(P<0.01),见图3B。
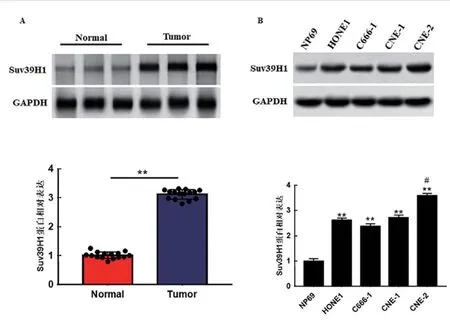
图3 组蛋白甲基化酶Suv39H1 在鼻咽癌细胞和 组织中的表达
2.4 组蛋白甲基化酶Suv39H1 对CNE-2 细胞增殖、侵袭和凋亡的影响 见表3。本实验测得转染pcDNA-Suv39H1 过表达效率为pcDNA-3.1 组的3.16±0.22 倍,转染Suv39H1 siRNA干扰效率为NC siRNA 组 的0.33±0.06 倍(Dunnett-t检验,P<0.01)。与pcDNA-3.1 组比较,pcDNASuv39H1 组CNE-2 细胞增殖力以及细胞侵袭数(图4B)明显增加,细胞凋亡率显著降低(图4A),Dunnett-t检验比较差异具有统计学意义;与对照组及NC siRNA 组比较,Suv39H1 siRNA 组CNE-2细胞在450 nm 处吸光度值以及细胞侵袭数(图4B)显著降低,细胞凋亡率明显增加(图4A),Dunnett-t检验比较差异具有统计学意义。
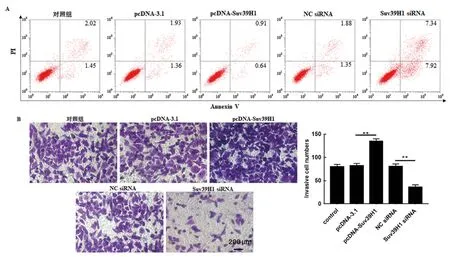
图4 转染pcDNA-Suv39H1 和Suv39H1 siRNA对CNE-2 细胞侵袭和凋亡的影响
表3 转染pcDNA-Suv39H1 和Suv39H1 siRNA 后CNE-2 细胞增殖力比较(n=3,±s)
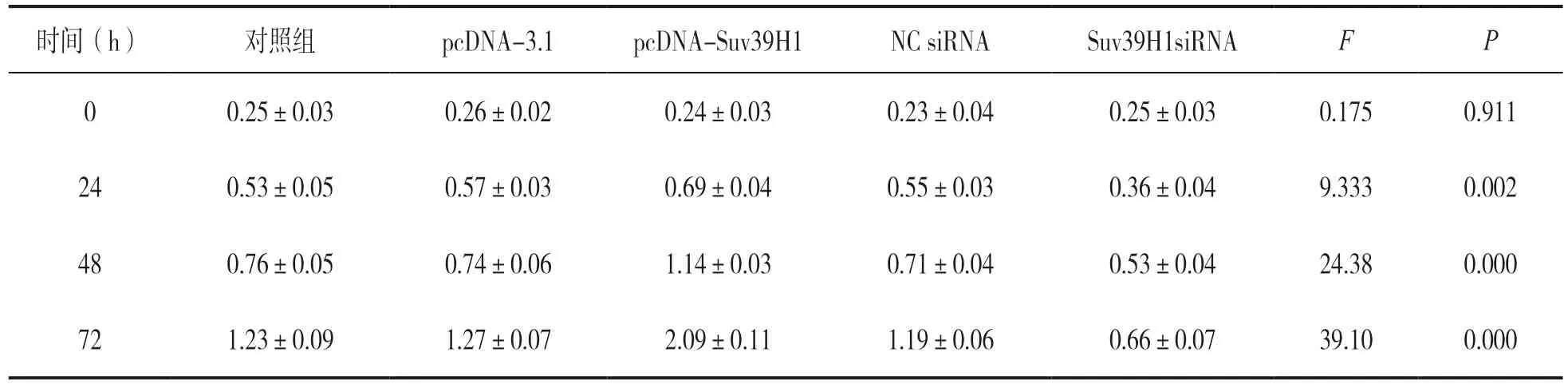
表3 转染pcDNA-Suv39H1 和Suv39H1 siRNA 后CNE-2 细胞增殖力比较(n=3,±s)
时间(h) 对照组 pcDNA-3.1 pcDNA-Suv39H1 NC siRNA Suv39H1siRNA F P 0 0.25±0.03 0.26±0.02 0.24±0.03 0.23±0.04 0.25±0.03 0.175 0.911 24 0.53±0.05 0.57±0.03 0.69±0.04 0.55±0.03 0.36±0.04 9.333 0.002 48 0.76±0.05 0.74±0.06 1.14±0.03 0.71±0.04 0.53±0.04 24.38 0.000 72 1.23±0.09 1.27±0.07 2.09±0.11 1.19±0.06 0.66±0.07 39.10 0.000
2.5 枸杞皂苷干预通过Suv39H1 对CNE-2 细胞增殖、侵袭和凋亡的影响 见表4。与50 μmol/L 枸杞皂苷干预+pcDNA-3.1 组相比,50 μmol/L 枸杞皂苷干预+pcDNA-Suv39H1 组CNE-2 细胞吸光度显著降低(Dunnett-t检验,P<0.01)。与50 μmol/L枸杞皂苷干预+pcDNA-3.1 组比较,50 μmol/L 枸杞皂苷干预+pcDNA-Suv39H1 组CNE-2 细胞凋亡率明显降低,细胞侵袭数显著增加,Dunnett-t检验差异具有统计学意义(P<0.01),见图5。
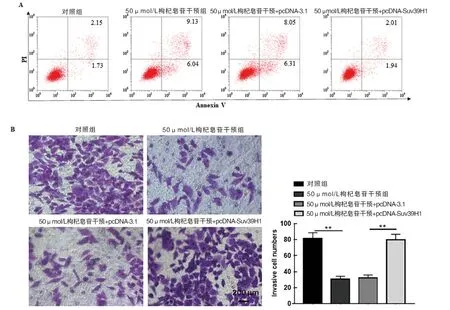
图5 枸杞皂苷通过下调Suv39H1 抑制鼻咽癌细胞的增殖和侵袭并促进细胞凋亡
表4 枸杞皂苷干预转染pcDNA-Suv39H1 的CNE-2 细胞增殖力比较(n=3,±s)
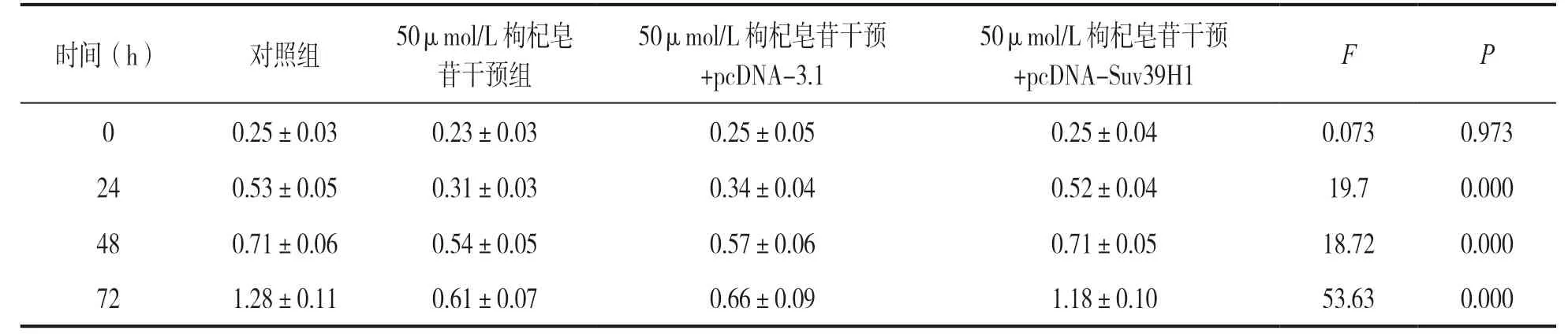
表4 枸杞皂苷干预转染pcDNA-Suv39H1 的CNE-2 细胞增殖力比较(n=3,±s)
时间(h) 对照组 50μmol/L 枸杞皂苷干预组50μmol/L 枸杞皂苷干预+pcDNA-3.1 50μmol/L 枸杞皂苷干预+pcDNA-Suv39H1 F P 0 0.25±0.03 0.23±0.03 0.25±0.05 0.25±0.04 0.073 0.973 24 0.53±0.05 0.31±0.03 0.34±0.04 0.52±0.04 19.7 0.000 48 0.71±0.06 0.54±0.05 0.57±0.06 0.71±0.05 18.72 0.000 72 1.28±0.11 0.61±0.07 0.66±0.09 1.18±0.10 53.63 0.000
2.6 枸杞皂苷干预对JAK2/STAT3 通路相关蛋白表达的影响 见图6。与对照组相比,枸杞皂苷干预组JAK2/STAT3 通路蛋白p-JAK2 和p-STAT3 的表达均被显著抑制,Dunnett-t检验差异具有统计学意义(P<0.01)。与枸杞皂苷干预+pcDNA-3.1 组相比,枸杞皂苷干预+pcDNA-Suv39H1 组p-JAK2和p-STAT3 的蛋白表达明显增强,Dunnett-t检验比较差异具有统计学意义(P<0. 01)。
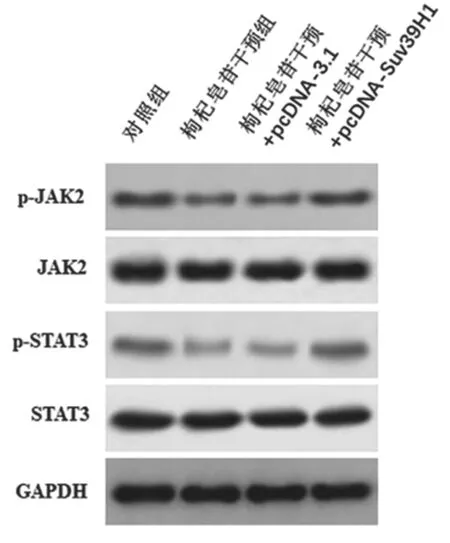
图6 枸杞皂苷干预细胞后JAK2/STAT3 通路相关蛋白表达
3 讨论
鼻咽癌是遗传因素、病毒感染和环境因素共同作用的结果,放疗是主要治疗手段,但30%以上的晚期鼻咽癌患者仍治疗失败[9]。所以致力于开发治疗鼻咽癌更有效更安全的药物是十分必要的。本研究探讨了枸杞皂苷对鼻咽癌细胞增殖、侵袭和凋亡的影响,并探究通过下调Suv39H1 表达发挥对肿瘤细胞增殖和侵袭的抑制作用,进而改善鼻咽癌治疗进展。
传统中药的开发已成为新药研发的途径之一,许多中药及其活性成分可诱导肿瘤细胞发生凋亡。WANG 等[10]研究表明人参皂苷Rg3 可能通过调节MMP-2,MMP-9 和EMT 相关基因的表达抑制鼻咽癌细胞的迁移和侵袭。枸杞皂苷作为癌症治疗的热点药物具有抑制肿瘤增殖抗肿瘤转移的作用。HE等[11]报道枸杞皂苷通过调节脂肪细胞与乳腺癌细胞之间的相互作用抑制乳腺癌转移。此外,1,5,10,30 和50 μmol/L 枸杞皂苷以非肌肉肌球蛋白IIA(NMIIA)作为靶标,通过剂量依赖性下调其表达预防肺癌转移[12]。本研究表明枸杞皂苷干预对鼻咽癌CNE-2 细胞有明显的增殖抑制作用,呈剂量依赖性(5,10,50,100 和200μmol/L)抑制CNE-2 细胞增殖和侵袭,促进细胞凋亡。
越来越多的研究表明,基因突变及表观遗传学改变是肿瘤发病的重要机制。其中,组蛋白修饰的异常可使表观遗传学调控失衡,导致疾病的发生发展[13]。表观遗传的改变是可逆的,这就为疾病的治疗提供了靶点。组蛋白H3K9 特异性甲基化酶Suv39H1 可催化组蛋白H3K9 三甲基化,参与异染色质形成,是表观遗传学及染色体研究领域的重要发现[14]。目前认为Suv39H1 不仅与染色体的分离和稳定性有关,也能影响肿瘤抑制蛋白Rb,导致肿瘤发生[15]。RODRIGUES 等[16]研究表明Suv39H1 和H3K9me3 水平升高的患者,宫颈癌复发率明显增高。Suv39H1 在前列腺癌中表达升高,并促进前列腺癌细胞的迁移[17]。本研究表明枸杞皂苷能够通过下调Suv39H1 表达抑制鼻咽癌细胞的增殖和侵袭。提示Suv39H1 在鼻咽癌的发生过程中可能起到了促进的作用。
JAKs 家族JAK 是一类重要的酪氨酸激酶,下游信号是STAT,是信号转导和转录激活因子,也是一类具有信号转导功能和转录活化功能的细胞脂蛋白[18]。研究显示,多种人类肿瘤中有该家族成员的异常激活,尤其是STAT1,STAT3 和STAT5[19]。其中STAT3 可通过自身活化的增强以及下游基因表达的变化来抑制凋亡,促进细胞增殖,参与肿瘤的发生发展[20]。据报道当JAK2/STAT3 途径持续激活,可导致鼻咽癌细胞异常增殖和恶性转化,可能与鼻咽癌发生发展的机制相关联[21]。此外,有研究报道在骨髓增殖性肿瘤中上调Suv39H1 的表达,JAK2的表达显著增加[4]。黄芪甲苷通过JAK2/STAT3 途径被证明是气道慢性炎症性肺病和血管生成的重要调节剂[22]。本研究表明,当枸杞皂苷干预鼻咽癌CNE-2 细胞后,JAK2/STAT3 通路蛋白的表达水平显著降低,而Suv39H1 过表达能够逆转该结果。
综上所述,本研究表明枸杞皂苷能够抑制Suv39H1 表达和JAK2/STAT3 信号通路以缓解体外鼻咽癌细胞的增殖和侵袭,有望成为治疗鼻咽癌新的靶向药物。本研究还未对组蛋白甲基化酶Suv39H1 催化组蛋白H3K9 三甲基化的下游靶基因做深入研究,接下来将以表观遗传学组蛋白修饰作为后续研究重点。
