基于UPLC指纹图谱和一测多评法的虎杖药材质量评价
2021-12-10梁慧潘晓君杨文惠吕渭升罗宇琴吴佳璇魏梅程学仁兰小勇李振雨
梁慧 潘晓君 杨文惠 吕渭升 罗宇琴 吴佳璇 魏梅 程学仁 兰小勇 李振雨


摘 要 目的:建立虎杖藥材的超高效液相色谱(UPLC)指纹图谱,并测定药材中4种活性成分的含量,为虎杖药材的质量评价提供依据。方法:以色谱柱为Waters BEH C18(100 mm×2.1 mm,1.7 μm)、流动相为乙腈-0.2%甲酸溶液(梯度洗脱)、流速为0.4 mL/min、柱温为40 ℃、检测波长为290 nm、进样量为1 μL的色谱条件建立虎杖药材的UPLC指纹图谱,并采用相似度计算、聚类分析和正交偏最小二乘法判别分析方法对指纹图谱进行评价。以虎杖苷为内参物,测定白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素的相对校正因子,建立一测多评法;再利用相对校正因子计算15批虎杖药材中上述4种成分的含量,并将一测多评法与外标法的结果进行比较。结果:建立了15批虎杖药材的UPLC指纹图谱,确定了12个共有峰,指认出了其中5个成分,分别为虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素和大黄素甲醚。15批虎杖药材指纹图谱的相似度为0.865~0.976;聚类分析将15批药材分为4类,并呈现一定的产地规律性;正交偏最小二乘法判别分析共确定了7个差异性标志物,差异显著性排序为峰7>大黄素-8-O-β-D-葡萄糖苷>白藜芦醇>峰8>虎杖苷>峰1>峰10。采用一测多评法测得的15批虎杖药材中白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素的含量与外标法测得的含量的相对平均偏差均小于5.0%,说明两种方法无明显差异。结论:UPLC指纹图谱结合一测多评法可便捷、可靠地对虎杖药材进行质量评价;安徽和重庆所产虎杖药材的质量较优。
关键词 虎杖;超高效液相色谱法;指纹图谱;一测多评法;含量测定;质量评价;产地
ABSTRACT OBJECTIVE: To establish the UPLC fingerprint of Polygonum cuspidatum, and to determine the contents of four active ingredients and to provide reference for the quality evaluation of P. cuspidatum. METHODS: The determination was performed on Waters BEH C18 column (100 mm×2.1 mm, 1.7 μm) with mobile phase consisted of acetonitrile-0.2% formic acid (gradient elution) at flow rate of 0.4 mL/min. The column temperature was 40 ℃, and detection wavelength was 290 nm. The sample size was 1 μL. The fingerprints were evaluated by similarity calculation, cluster analysis and orthogonal partial least square discriminant analysis (OPLS-DA). Using polydatin as internal standard, relative calibration factors of resveratrol, emodin-8-O- β-D-glucoside and emodin were determined to develop a method of QAMS. The contents of 4 above components in 15 batches of P. cuspidatum were calculated by relative calibration factors. The results of QAMS were compared with those of external standard. RESULTS: UPLC fingerprints of 15 batches of P. cuspidatum were established, and 12 common peaks were confirmed. Five components were identified, i.e. polydatin, resveratrol, emodin-8-O-β-D-glucoside, emodin, emodin methyl ether. The fingerprint similarity of 15 batches of P. cuspidatum was in the range of 0.865-0.976. According to cluster analysis, 15 batches of P. cuspidatum were classified into 4 categories, showing certain regularity of origin. Seven markers were identified by OPLS-DA method. The order of difference significance was peak 7>emodin-8-O-β-D-glucoside>resveratrol>peak 8>polydatin>peak 1>peak 10. The relative deviation among the contents of resveratrol, emodin-8-O-β-D-glucoside and emodin in 15 batches of P. cuspidatum determined by QAMS and external standard method was less than 5.0%, indicating that there was no significant difference between the two methods. CONCLUSIONS: UPLC fingerprint combined with QAMS method is convenient and reliable for the quality evaluation of P. cuspidatum; the quality of P. cuspidatum produced in Chongqing and Anhui province is better.
KEYWORDS Polygonum cuspidatum; UPLC; Fingerprint; QAMS; Content determination; Quality evaluation; Producing area
虎杖,始载于《名医别录》,别名花斑竹、大虫杖、苦杖、斑杖等[1]。2020年版《中国药典》(一部)规定,虎杖为蓼科植物虎杖Polygonum cuspidatum Sieb. et Zucc.的干燥根茎和根,其味微苦、性微寒,临床常用于治疗湿热黄疸、风湿痹痛等病症[2]。虎杖以往主产于我国江南各省[1],但目前我国虎杖产量最大的3个产区分别为湖北省十堰市、重庆市(主要为黔江区和石柱县)和福建省三明市,这3个产区的虎杖总产量占全国总产量的85%以上[3]。
化学成分研究显示,虎杖中主要含有以大黄素、大黄酚为代表的蒽醌类化合物和以虎杖苷、白藜芦醇为代表的二苯乙烯类化合物,从而使该药材具有抗炎、抗病毒、调节血脂和扩张血管等多种药理作用[4]。 虎杖含有多种有效化学成分,但2020年版《中国药典》(一部)仅以大黄素和虎杖苷作为药材质量控制的指标成分,难以全面反映该药材质量。近年来,指纹图谱结合化学计量学方法为中药材的整体质量控制提供了一种新的思路[5-6]。目前有关虎杖指纹图谱及其中一种或数种成分含量测定的研究较多[7-10],但大都采用高效液相色谱法(HPLC),分析时间较长。超高效液相色谱(UPLC)技术具有分离度好、灵敏度高、分析速度快等优点,将UPLC指纹图谱结合一测多评法用于虎杖药材的质量评价鲜有报道。基于此,本研究采用UPLC法建立虎杖指纹图谱,再结合一测多评法测定虎杖药材中虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素4种有效成分的含量,并利用相似度评价和化学计量学分析方法进行综合评价,旨在为虎杖药材的整体质量评价提供参考。
1 材料
1.1 主要仪器
本研究所用的主要仪器有H-Class型UPLC仪(美国Waters公司)、Vanquish型UPLC仪(美国Thermo Fisher Scientific公司)、1290 Infinity型UPLC仪(美国Agilent公司)、ME204E型分析天平(瑞士Mettler Toledo公司,精度为0.1 mg)、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)、Milli-Q Direct型超纯水系统(美国Merck公司)。
1.2 主要试剂
本研究所用的主要试剂有购自成都普菲德生物技术有限公司的大黄素-8-O-β-D-葡萄糖苷对照品(批号JOT-10422,纯度98.85%)和购自中国食品药品检定研究院的虎杖苷对照品(批号111575-201603,纯度87.3%)、大黄素对照品(批号110756-201913,纯度96.0%)、白藜芦醇对照品(批号111533-201703,纯度99.4%)、大黄素甲醚对照品(批号110758-201817,纯度99.2%);乙腈(德国Merck公司)、甲酸(天津市科密欧化学试剂有限公司)为色谱纯,水为超纯水,其余试剂均为分析纯。
1.3 藥材
15批来自不同种植基地的虎杖药材(表1)均经广东一方制药有限公司魏梅主任中药师鉴定为蓼科植物虎杖P. cuspidatum Sieb. et Zucc.的干燥根和根茎。
2 方法与结果
2.1 色谱条件
色谱柱为Waters BEH C18(100 mm×2.1 mm,1.7 μm),流动相为乙腈(A)-0.2%甲酸溶液(B),梯度洗脱(0~7 min,12%A→20%A;7~10 min,20%A→28%A;10~12 min,28%A;12~15 min,28%A→30%A;15~16 min,30%A→80%A;16~20 min,80%A),流速为0.4 mL/min,柱温为40 ℃,检测波长为290 nm,进样量为1 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液的制备 分别取虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素和大黄素甲醚对照品适量,精密称定,加甲醇制成每1 mL各含50 μg的混合对照品溶液,即得。
2.2.2 供试品溶液的制备 取虎杖药材粉末(过三号筛,下同)约0.1 g,精密称定,精密加入稀乙醇(取乙醇529 mL,加水稀释至1 000 mL,即得)25 mL,称定质量,超声(功率250 W,频率40 kHz)处理30 min;冷却至室温,再次称定质量,用稀乙醇补足减失的质量;摇匀,取上清液,滤过,取续滤液,即得。
2.3 指纹图谱方法学考察
2.3.1 精密度考察 取供试品溶液(编号S1)适量,按“2.1”项下色谱条件连续进样测定6次。以虎杖苷色谱峰为参照峰(S),计算各共有峰与参照峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间的RSD为0.03%~0.13%(n=6),相对峰面积的RSD为0.16%~0.48%(n=6),表明该方法精密度良好。
2.3.2 稳定性考察 取供试品溶液(编号S1)适量,分别于制备后在室温下放置2、4、8、10、12、24 h时按“2.1”项下色谱条件进样测定。以虎杖苷色谱峰为参照峰(S),计算各共有峰与参照峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间的RSD为0.04%~0.15%(n=6),相对峰面积的RSD为0.32%~0.51%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.3.3 重复性考察 取同一批虎杖药材粉末(编号S1)约0.1 g,平行6份,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定。以虎杖苷色谱峰为参照峰(S),计算各共有峰与参照峰的相对保留时间和相对峰面积。结果,各共有峰相对保留时间的RSD为 0.25%~0.44%(n=6),相对峰面积的RSD为1.16%~2.08%(n=6),表明该方法重复性良好。
2.4 虎杖药材指纹图谱的建立和色谱峰的指认
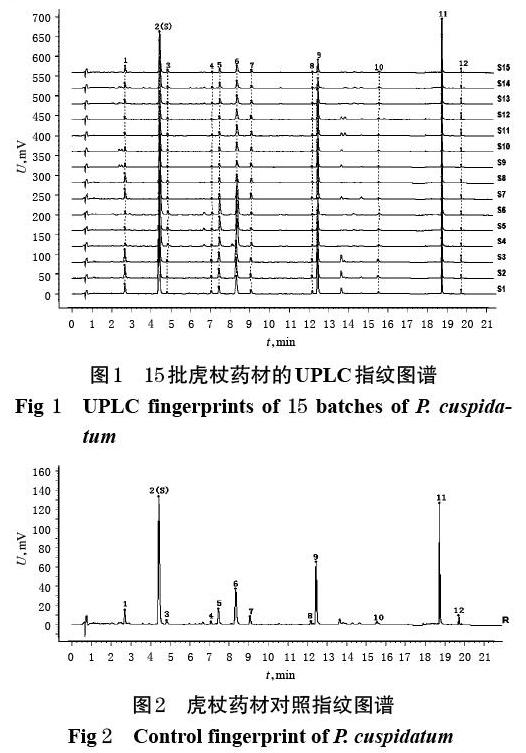
取15批虎杖药材粉末各适量,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录色谱图。采用《中药色谱指纹图谱相似度评价系统(2012版)》对15批虎杖药材的UPLC指纹图谱进行共有峰标识,以S1号样品的指纹图谱作为参照图谱进行全谱峰匹配,共标识出12个共有峰,如图1所示;以平均数法生成对照指纹图谱(R),如图2所示。通过与对照品的保留时间以及紫外-可见3D光谱进行比对,指认了其中5个成分,其中峰2为虎杖苷、峰6为白藜芦醇、峰9为大黄素-8-O-β-D-葡萄糖苷、峰11为大黄素、峰12为大黄素甲醚,如图3所示。
2.5 相似度评价
采用《中药色谱指纹图谱相似度评价系统(2012版)》计算15批虎杖药材的指纹图谱与对照指纹图谱的相似度,结果如表2所示。
由表2可知,15批虎杖样品药材指纹图谱与对照指纹图谱的相似度为0.865~0.976;来自安徽安庆(编号S4~S6)、重庆石柱(编号S1~S3)的样品指纹图谱与对照指纹图谱的相似度较低,而来自江西(编号S7~S12)和浙江(编号S13~S15)的样品指纹图谱与对照指纹图谱的相似度较高,说明安徽、重庆的虎杖药材质量与江西、浙江的虎杖药材存在较大的差异;江西和浙江两产地之间的样品指纹图谱相似度虽然也有一定的差异,但与安徽、重庆产样品相比,差异较小。
2.6 指纹图谱的化学计量学分析
化学计量学已广泛应用于中药材产地、基原、炮制和真伪鉴别等方面[11],分为有、无监督两种统计方法。其一般先进行无监督的系统聚类分析和主成分分析,观察样本之间是否有分类趋势,再采用偏最小二乘判别分析或者正交偏最小二乘判别分析(OPLS-DA)进行有监督的模式识别,以显示样本间差异主要由哪些变量引起,并寻找差异性标志物[6]。
2.6.1 聚类分析 以12个共有峰的“峰面积/称样量”为变量,以夹角余弦为距离,采用SPSS 25.0统计软件对15批不同产地虎杖药材进行系统聚类,结果如图4所示。由图4可知,当判别条件距离为5时,15批虎杖药材被大致分为4类,其中编号S7~S12的样品聚为Ⅰ类,编号S1~S3的样品聚为Ⅱ类,编号S13~S15的样品聚为Ⅲ类,编号S4~S6的样品聚为Ⅳ类。该结果呈现一定的产地规律性:编号S7~S12的虎杖药材来自江西,编号S1~S3的虎杖药材来自重庆,编号S13~S15的虎杖药材来自浙江,编号S4~S6的虎杖药材来自安徽,说明不同产地的虎杖药材具有一定的差异性,这与相似度评价结果基本一致。
2.6.2 OPLS-DA 根据聚类分析结果,进一步运用SIMCA 14.1统计软件对15批虎杖药材进行OPLS-DA,其得分图如图5所示。由图5可知,15批虎杖药材按不同产地分为4组,即重庆产样品(S1~S3)、安徽产样品(S4~S6)、江西产样品(S7~S12)、浙江产样品(S13~S15)各聚为一类,且4组样品聚类良好、分离明显。本研究建立的模型參数R2X(cum)为0.852,R2Y(cum)为0.908,Q2(cum)为0.808,三者数值均趋近于1,表明该分组模型具有较强的解释和预测能力[12]。运用统计推断方法分析该模型[13],将模型随机排列200次做置换检验,结果如图6所示。由图6可知,R2和Q2截距值分别为0.122和-0.793,置换检验模型右上方的真实R2和Q2值均大于样本随机排列后得到的R2和Q2值,说明建立的OPLS-DA模型没有出现过拟合现象[13],可以用于不同产地虎杖药材的模式识别。采用变量投影重要性(VIP)法,以VIP>1为标准,共筛选出7个差异性标志物,按影响大小排序依次为峰7>峰9(大黄素-8-O-β-D-葡萄糖苷)>峰6(白藜芦醇)>峰8>峰2(虎杖苷)>峰1>峰10,结果如图7所示。
2.7 含量测定
2.7.1 线性关系考察 取虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素对照品各适量,精密称定,加甲醇制成每1 mL含虎杖苷189.00 μg、白藜芦醇255.10 μg、大黄素-8-O-β-D-葡萄糖苷168.54 μg、大黄素162.79 μg的混合对照品贮备液。取上述混合对照品贮备液适量,加甲醇依次稀释2、5、10、50倍,得到每1 mL含虎杖苷94.50、37.80、18.90、3.78 μg,含白藜芦醇127.55、51.02、25.51、5.10 μg,含大黄素-8-O-β-D-葡萄糖苷84.27、33.71、16.85、3.37 μg,含大黄素81.40、32.56、16.28、3.26 μg的系列混合对照品溶液。取上述混合对照品贮备液和系列混合对照品溶液各1 μL,按“2.1”项下色谱条件进样测定,记录峰面积。以峰面积(y)为纵坐标、对照品质量浓度(x)为横坐标进行线性回归,结果如表3所示。
2.7.2 精密度试验 取“2.7.1”项下混合对照品溶液(每1 mL含虎杖苷37.80 μg、白藜芦醇51.02 μg、大黄素-8-O-β-D-葡萄糖苷33.71 μg和大黄素32.56 μg)适量,按“2.1”项下色谱条件连续进样测定6次,记录峰面积。结果,虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素峰面积的RSD分别为0.11%、0.13%、0.17%和0.21%(n=6),表明仪器精密度良好。
2.7.3 稳定性试验 取供试品溶液(编号S1)适量,分别于制备后在室温下放置2、4、8、10、12、24 h时按“2.1”项下色谱条件进样测定,记录峰面积。结果,虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素峰面积的RSD分别为0.22%、0.35%、0.11%和0.41%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.7.4 重复性试验 取同一批虎杖药材粉末(编号S1)约0.1 g,平行6份,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积,以外标法计算样品含量。结果,样品中虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素的平均含量分别为2.68%、0.55%、1.48%和0.55%,RSD分别为0.87%、1.15%、0.93%和1.23%(n=6),表明该方法重复性良好。
2.7.5 加样回收率试验 精密称取已知成分含量的虎杖药材粉末(编号S1)约0.05 g,共9份,每3份一组,分别按1 ∶ 0.5、1 ∶ 1、1 ∶ 1.5的质量比加入4种对照品,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,记录峰面积,计算加样回收率。结果,虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素的平均加样回收率分别为100.34%、100.54%、100.34%和99.62%,RSD分別为0.58%、0.86%、0.51%和0.90%(n=9),表明该方法准确度良好。
2.7.6 相对校正因子的计算 因为虎杖药材中虎杖苷的含量较高,且其对照品易得,故本研究以虎杖苷为内参物(S),按照下述公式计算相对校正因子:fsi=fs/fi=Cs×Ai/(Ci×AS)。式中,fsi为内参物与其他成分(i)的相对校正因子,fs为内参物的校正因子,fi为其他成分(i)的校正因子,Cs为内参物的对照品质量浓度,Ai为其他成分(i)的对照品峰面积,Ci为其他成分(i)的对照品质量浓度,As为内参物的对照品峰面积[14]。根据“2.7.1”项下线性关系考察结果,以对照品的质量浓度及其对应的峰面积计算内参物虎杖苷与白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素的相对校正因子。结果,f虎杖苷/白藜芦醇的平均值为1.647,RSD为0.7%;f虎杖苷/大黄素-8-O-β-D-葡萄糖苷的平均值为0.890,RSD为1.9%;f虎杖苷/大黄素的平均值为1.287,RSD为2.4%,表明相对校正因子的稳定性和重现性良好。
2.7.7 耐用性试验 精密吸取“2.7.1”项下混合对照品溶液(每1 mL含虎杖苷37.80 μg、白藜芦醇51.02 μg、大黄素-8-O-β-D-葡萄糖苷33.71 μg和大黄素32.56 μg)1 μL,按“2.1”项下色谱条件进样测定,记录峰面积,分别考察不同UPLC仪、色谱柱、流速和柱温对相对校正因子的影响。结果,相对校正因子的RSD均小于1.0%,表明上述不同条件对虎杖苷与白藜芦醇、大黄素-8-O-β-D-葡萄糖苷和大黄素的相对校正因子无明显影响,如表4所示。
2.7.8 色谱峰的定位 根据“2.7.7”项下耐用性试验结果,以虎杖苷色谱峰为参照峰,计算白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素色谱峰相对于参照峰的相对保留时间。结果发现,采用不同的UPLC仪、色谱柱、柱温和流速时,各待测成分相对保留时间的RSD均小于5.0%,说明相对保留时间稳定,可以用于待测成分色谱峰的定位。
2.7.9 样品含量测定 精密称取15批虎杖药材粉末,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样测定,以外标法计算样品中虎杖苷的含量;再分别采用外标法和一测多评法(以虎杖苷为内参物)计算虎杖药材中白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素的含量,并计算两种方法所测含量的相对平均偏差,结果如表5所示。
由表5可知,采用外标法和一测多评法测定的白藜芦醇含量的相对平均偏差为0.92%~2.56%,大黄素-8-O-β-D-葡萄糖苷含量的相对平均偏差为0~1.08%,大黄素含量的相对平均偏差为0~0.75%,均小于3.0%,说明一测多评法与外标法的测定结果无明显差异。15批虎杖药材中,安徽产药材中的虎杖苷、白藜芦醇和大黄素的平均含量较高,重庆产药材中的大黄素-8-O-β-D-葡萄糖苷的平均含量较高;而以上述4种成分的总量计,安徽产药材的总量最高,重庆产药材次之,江西产药材第三,浙江产药材最低,由此提示安徽和重庆所产虎杖药材的质量可能较优。
3 讨论
3.1 色谱条件的优化
在指纹图谱和一测多评法的构建过程中,笔者采用UPLC仪在20 min内即可实现主要色谱峰的良好分离,大大节约了分析时间。针对虎杖中的蒽醌类和二苯乙烯类成分,笔者分别选择254、290、306 nm这3个不同的检测波长对其进行考察,结果显示各色谱峰在254 nm波长处的信号较弱;虎杖苷在306 nm波长处的响应较强,但其他色谱峰的响应较弱;当选择290 nm作为检测波长时,所有色谱峰的基线平稳且干扰较小,同时能检测出更多特征成分,且各色谱峰的峰面积相差不大,因此最终选取290 nm作为本研究的检测波长。在流动相的选择方面,笔者选择乙腈-0.2%甲酸溶液、甲醇-0.2%甲酸溶液、乙腈-0.2%磷酸溶液、乙腈-0.2%乙酸溶液等4种不同的流动相系统进行试验,结果显示以乙腈-0.2%甲酸溶液为流动相进行梯度洗脱时,各色谱峰的分离度及对称因子较好;进一步通过优化乙腈-0.2%甲酸溶液的洗脱程序,可使虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素的分离度均达到1.5以上,满足一测多评法的分析要求。
3.2 指纹图谱分析
本研究建立了15批虎杖药材的UPLC指纹图谱,确定了12个共有峰,并指认了其中5个成分。15批虎杖药材的指纹图谱与对照指纹图谱的相似度为0.865~0.976。安徽和重庆所产虎杖药材的质量与江西、浙江产药材存在较大的差异;而江西和浙江两产地的药材指纹图谱相似度虽然也有一定的差异,但与安徽、重庆产药材相比差异较小。聚类分析和OPLS-DA均将15批虎杖样品药材分为4类,呈现出一定的产地规律性。通过VIP法以VIP>1为标准筛选出差异性较大的组分,分别为峰7、峰9(大黄素-8-O-β-D-葡萄糖苷)、峰6(白藜芦醇)、峰8、峰2(虎杖苷)、峰1和峰10,说明以上7个成分对虎杖药材指纹图谱的影响较大,下一步将结合质谱分析和药理研究对上述成分的谱效关系进行深入分析。
3.3 含量测定结果分析
传统的单一成分定量难以全面反映药材的质量,而多指标检测方法因对照品不易获得,导致检测成本较高。本研究利用UPLC仪的高效分离能力和高灵敏度的特点,实现了对虎杖药材中虎杖苷、白藜芦醇、大黄素-8-O-β-D-葡萄糖苷、大黄素4种成分的一测多评;而有效成分大黄素甲醚因受到色谱峰附近小杂质峰的影响,校正因子不稳定,因此未被纳入一测多评。对一测多评法与外标法进行比较后发现,两者含量测定结果的相对平均偏差在5.0%以内,说明两种方法的测定结果基本一致。一测多评法的经济性与适用性较强,结合UPLC法可大大縮短分析时间,从而为虎杖药材的质量评价及控制提供了新思路。本研究根据15批虎杖药材的含量测定结果,推测安徽、重庆所产虎杖药材的质量较优;而考虑到重庆的虎杖药材产量大,建议可选择重庆为虎杖饮片、配方颗粒及相关复方制剂的原料产地。
综上所述,本研究所建立的UPLC指纹图谱结合一测多评法可便捷、可靠地对虎杖药材进行质量评价;安徽、重庆所产虎杖药材的质量较优。这可为虎杖药材的谱效关系研究及资源合理利用提供数据支撑。
参考文献
[ 1 ] 肖培根.新编中药志:第一卷[M].北京:化学工业出版社,2002:579-582.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版. 北京:中国医药科技出版社,2020:217.
[ 3 ] 张兵,李光锐,段吉雄.十堰房县:虎杖“生威”企强民富[J].民生周刊,2021(7):62-63.
[ 4 ] 时圣明,潘明佳,王文倩,等.虎杖的化学成分及药理作用研究进展[J].药物评价研究,2016,39(2):317-321.
[ 5 ] 刘东方,赵丽娜,李银峰,等.中药指纹图谱技术的研究进展及应用[J].中草药,2016,47(22):4085-4094.
[ 6 ] 于洋,李军,李宝国.化学计量学在中药质量控制研究中的应用[J].中成药,2018,40(5):1139-1142.
[ 7 ] 刘慧文,王国凯,储宣宁,等.不同产地虎杖HPLC指纹图谱及6种成分含量测定[J].现代中药研究与实践,2018,32(3):13-17.
[ 8 ] 张清峰,付莹娟,陈继光,等.高效液相色谱法同时测定虎杖中五种活性成分[J].现代食品科技,2014,30(3):216-219.
[ 9 ] 范玲,严冬,李爽,等.一测多评法测定虎杖中虎杖苷、白藜芦醇、大黄素及大黄素甲醚的含量[J].中国实验方剂学杂志,2013,19(7):103-107.
[10] 邵进明,戴胜云,徐文芬,等.一测多评法同时测定虎杖中4种不同类型成分的含量[J].中国医院药学杂志,2013,33(24):2045-2049.
[11] 孙立丽,王萌,任晓亮.化学模式识别方法在中药质量控制研究中的应用进展[J].中草药,2017,48(20):4339- 4345.
[12] 黄跃前,程学仁,吴文平,等.基于指纹图谱与多元统计分析的栀子不同炮制品评价[J].广东药科大学学报,2020,36(6):765-770.
[13] 孙冬梅,罗思妮,魏梅,等.不同基原大黄指纹图谱、多成分定量结合多元统计分析的质量评价研究[J].南京中医药大学学报,2021,37(1):83-90.
[14] 黄敏烨,李振雨,童培珍,等.基于UPLC指纹图谱和一测多评法的土贝母药材质量评价[J].中国中药杂志,2020,45(14):3459-3466.
(收稿日期:2021-02-01 修回日期:2021-07-12)
(编辑:胡晓霖)
